Антраниламидное соединение, композиция для борьбы с насекомыми, композиция для борьбы с беспозвоночными вредителями, способы борьбы с насекомыми, промежуточные соединения
Иллюстрации
Показать всеОписывается антраниламидное соединение, выбранное из соединения формулы 1 или их N-оксидов
где R1 - СН3, F, Cl, Br, R2 - F, Cl, Br, I, CF3, R3 - CF3, Cl, Br, ОСН2CF3, R4a - C1-С4алкил; R4b-Н, СН3 и R5-Cl, Br, или его приемлемая для использования в сельском хозяйстве соль; композиция для борьбы с насекомыми, содержащая биологически эффективное количество соединения формулы (1) и, по меньшей мере, один дополнительный компонент, выбранный из группы, состоящей из поверхностно-активных веществ, твердых и жидких разбавителей; композиция для борьбы с беспозвоночными вредителями, содержащая биологически эффективное количество соединения формулы (1) и эффективное количество, по меньшей мере, одного дополнительного биологически активного соединения или агента. Описываются способы борьбы с насекомыми, а также промежуточные соединения: производные бензоксазинона и пиразолкарбоновой кислоты. Технический результат - используемые соединения проявляют инсектицидное действие, что позволяет применять их в сельском хозяйстве. 7 н. и 13 з.п. ф-лы, 16 табл.
Реферат
Предпосылки изобретения
Данное изобретение относится к некоторым антраниламидам, их N-оксидам, сельскохозяйственно-приемлемым солям и композициям и способам их применения для борьбы с беспозвоночными вредителями, такими как членистоногие (Arthropoda), как в сельском хозяйстве, так и в несельскохозяйственных условиях.
Борьба с беспозвоночными вредителями, такими как членистоногие, является чрезвычайно важной для достижения высокой эффективности возделывания сельскохозяйственных культур. Повреждение беспозвоночными вредителями растущих и хранящихся сельскохозяйственных культур может вызывать значительное снижение продуктивности и тем самым приводить к повышению стоимости для потребителя. Важной является также борьба с беспозвоночными вредителями в лесном хозяйстве, в возделывании тепличных культур, декоративных культур, в выращивании саженцев, в хранении пищевых и волокнистых продуктов, а также вредителями скота, домашнего хозяйства и для общественного здравоохранения и охраны здоровья животных. Многие продукты являются коммерчески доступными для этих целей, но сохраняется потребность в новых соединениях, которые являются более эффективными, менее дорогостоящими, менее токсичными, более безопасными для окружающей среды или имеющими отличающиеся механизмы действия.
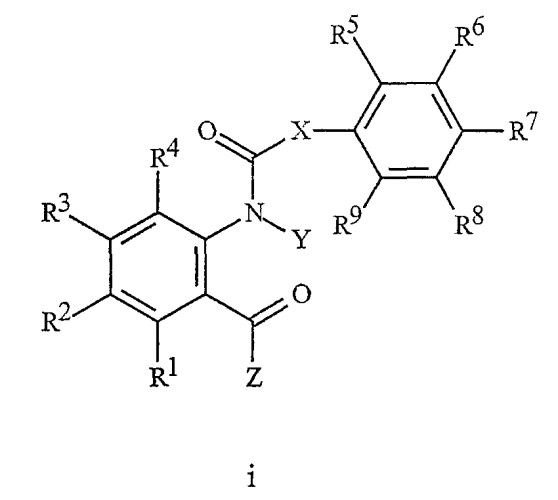
В NL 9202078 описаны производные N-ацилантраниловой кислоты формулы i в качестве инсектицидов
где
Х обозначает прямую связь;
Y обозначает Н или С1-С6алкил;
Z обозначает NH2, NH(С1-С3алкил) или N(С1-С3алкил)2; и
R1-R9 независимо обозначают Н, галоген, С1-С6алкил, фенил, гидрокси, С1-С6алкокси или С1-С7ацилокси.
Сущность изобретения
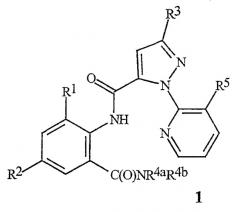
Данное изобретение относится к соединению формулы 1, его N-оксиду или сельскохозяйственно приемлемой соли этого соединения
где
R1 обозначает СН3, F, Cl или Br;
R2 обозначает F, Cl, Br, I или CF3;
R3 обозначает CF3, Cl, Br или OCH2CF3;
R4a обозначает С1-С4алкил;
R4b обозначает Н или СН3 и
R5 обозначает Cl или Br.
Данное изобретение относится также к композиции для борьбы с беспозвоночными вредителями, содержащей биологически эффективное количество соединения формулы 1 и по меньшей мере один дополнительный компонент, выбранный из группы, состоящей из поверхностно-активных веществ, твердых разбавителей и жидких разбавителей. Данное изобретение относится также к композиции, содержащей биологически эффективное количество соединения формулы 1 и эффективное количество по меньшей мере одного дополнительного биологически активного компонента или агента.
Данное изобретение относится также к способу борьбы с беспозвоночными вредителями, предусматривающему контактирование беспозвоночного вредителя или окружающей его среды с биологически эффективным количеством соединения формулы 1 (например, в виде описанной здесь композиции). Данное изобретение относится также к такому способу, в котором беспозвоночного вредителя или окружающую его среду приводят в контакт с биологически эффективным количеством соединения формулы 1 или композиции, содержащей соединение формулы 1 и биологически эффективное количество по меньшей мере одного дополнительного соединения или агента для уничтожения беспозвоночных вредителей.
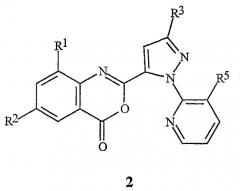
Данное изобретение относится также к соединению бензоксазинона формулы 2
где
R1 обозначает СН3, F, Cl или Br;
R2 обозначает F, Cl, Br, I или CF3;
R3 обозначает CF3, Cl, Br или OCH2CF3;
R5 обозначает Cl или Br;
которое применимо в качестве промежуточного продукта в синтезе для получения соединения формулы 1.
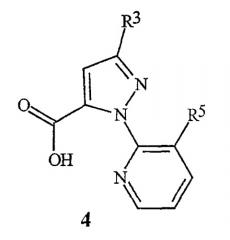
Данное изобретение относится также к соединению пиразолкарбоновой кислоты формулы 4
где
R3 обозначает CF3, Cl, Br или OCH2CF3; и
R5 обозначает Cl или Br;
которое применимо в качестве промежуточного продукта в синтезе для получения соединения формулы 1.
Подробное описание изобретения
В приведенных выше перечислениях термин «алкил», используемый отдельно или в составных словах, таких как «алкилтио» или «галогеналкил», обозначает имеющий прямую цепь или разветвленный алкил, такой как метил, этил, н-пропил, изопропил или различные изомеры бутила. Специалисту в данной области будет понятно, что не все содержащие азот гетероциклы могут образовывать N-оксиды, так как на азоте должна быть доступной неподеленная пара электронов для окисления до оксида; специалисту в данной области будет понятно, какие содержащие азот гетероциклы могут образовывать N-оксиды. Специалисту в данной области будет также понятно, что третичные амины могут образовывать N-оксиды. Синтетические способы для получения N-оксидов гетероциклов и третичных аминов очень хорошо известны специалисту в данной области, в том числе окисление гетероциклов и третичных аминов пероксикислотами, такими как перуксусная и м-хлорпербензойная кислота (MCPBA), пероксид водорода, алкилгидропероксиды, такие как трет-бутилгидропероксид, перборат натрия и диоксираны, такие как диметилдиоксиран. Эти способы получения N-оксидов были подробно описаны и рассмотрены в литературе, см., например: T.L. Gilchrist in Comprehensive Organic Synthesis, vol. 7, pp 748-750, S.V. Ley, Ed., Pergamon Press; M. Tisler and B. Stanovnik in Comprehensive Heterocyclic Chemistry, vol. 3, pp 18-20, A.J. Boulton and A. McKillop, Eds., Pergamon Press; M.R. Grimmett and B.R.T. Keene in Advances in Heterocyclic Chemistry, vol. 43, pp 149-161, A.R. Katritzky, Ed., Academic Press; M. Tisler and B. Stanovnik in Advances in Heterocyclic Chemistry, vol. 9, pp 285-291, A.R. Katritzky and A.J. Boulton, Eds., Academic Press; and G.W.H. Cheeseman and E.S.G. Werstiuk in Advances in Heterocyclic Cheniistly, vol. 22, pp 390-392, A.R. Katritzky and A.J. Boulton, Eds., Academic Press.
Соединения данного изобретения могут существовать в виде одного или нескольких стереоизомеров. Различные стереоизомеры включают в себя энантиомеры, диастереомеры, атропизомеры и геометрические изомеры. Специалисту в данной области будет понятно, что один стереомер может быть более активным и/или может проявить лучшее действие при обогащении им смеси относительно другого стереоизомера (других стереоизомеров) или при отделении от другого стереоизомера (других стереоизомеров). Кроме того, специалисту в данной области известно, как отделять, обогащать и/или селективно получать указанные стереоизомеры. Таким образом, данное изобретение включает в себя соединения, выбранные из соединений формулы 1, их N-оксидов и сельскохозяйственно приемлемых солей. Соединения данного изобретения могут находиться в виде смеси стереоизомеров, в виде индивидуальных стереоизомеров или в виде оптически активной формы.
Соли соединений данного изобретения включают в себя кислотно-аддитивные соли (соли присоединения) с неорганическими или органическими кислотами, такими как бромистоводородная, хлористоводородная, азотная, фосфорная, серная, уксусная, масляная, фумаровая, молочная, малеиновая, малоновая, щавелевая, пропионовая, салициловая, винная, 4-толуолсульфоновая или валериановая кислоты.
Предпочтительными соединениями по стоимости, легкости синтеза и/или биологической эффективности являются:
Предпочтительные соединения 1: соединения формулы 1, где R4а обозначает С1-С4алкил, а R4b обозначает Н; или R4а обозначает СН3 и R4b обозначает СН3.
Предпочтительные соединения 2: предпочтительные соединения 1, где R5 обозначает Cl.
Предпочтительные соединения 3: предпочтительные соединения 2, где R4b обозначает СН3, СН2СН3, СН(СН3)2 или С(СН3)3.
Предпочтительные соединения 4: предпочтительные соединения 3, где R2 обозначает Cl или Br.
Предпочтительные соединения 5: предпочтительные соединения 4, где R1 обозначает СН3.
Предпочтительные соединения 6: предпочтительные соединения 4, где R1 обозначает Cl.
Предпочтительные соединения 7: соединения формулы 1, где R1 обозначает СН3, Cl или Br; R2 обозначает F, Cl, Br, I или CF3; R3 обозначает СН3, Cl или Br; R4а обозначает С1-С4алкил; R4b обозначает Н и R5 обозначает Cl или Br.
Особенно предпочтительным является соединение формулы 1, выбранное из группы, состоящей из:
соединения формулы 1, где R1 обозначает СН3, R2 обозначает Br, R3 обозначает CF3, R4а обозначает CH(CH3)2, R4b обозначает Н и R5 обозначает Cl;
соединения формулы 1, где R1 обозначает СН3, R2 обозначает Br, R3 обозначает CF3, R4а обозначает CH3, R4b обозначает Н и R5 обозначает Cl;
соединения формулы 1, где R1 обозначает СН3, R2 обозначает Br, R3 обозначает Br, R4а обозначает CH(СН3)2, R4b обозначает Н и R5 обозначает Cl;
соединения формулы 1, где R1 обозначает СН3, R2 обозначает Br, R3 обозначает Br, R4а обозначает СН3, R4b обозначает Н и R5 обозначает Cl;
соединения формулы 1, где R1 обозначает СН3, R2 обозначает Br, R3 обозначает Cl, R4а обозначает CH(СН3)2, R4b обозначает Н и R5 обозначает Cl;
соединения формулы 1, где R1 обозначает СН3, R2 обозначает Br, R3 обозначает Cl, R4а обозначает СН3, R4b обозначает Н и R5 обозначает Cl;
соединения формулы 1, где R1 обозначает СН3, R2 обозначает Cl, R3 обозначает СН3, R4а обозначает CH(СН3)2, R4b обозначает Н и R5 обозначает Cl;
соединения формулы 1, где R1 обозначает СН3, R2 обозначает Cl, R3 обозначает СН3, R4а обозначает СН3, R4b обозначает Н и R5 обозначает Cl;
соединения формулы 1, где R1 обозначает СН3, R2 обозначает Cl, R3 обозначает Br, R4а обозначает CH(СН3)2, R4b обозначает Н и R5 обозначает Cl;
соединения формулы 1, где R1 обозначает СН3, R2 обозначает Cl, R3 обозначает Br, R4а обозначает СН3, R4b обозначает Н и R5 обозначает Cl;
соединения формулы 1, где R1 обозначает СН3, R2 обозначает Cl, R3 обозначает Cl, R4а обозначает CH(СН3)2, R4b обозначает Н и R5 обозначает Cl;
соединения формулы 1, где R1 обозначает СН3, R2 обозначает Cl, R3 обозначает Cl, R4а обозначает СН3, R4b обозначает Н и R5 обозначает Cl;
соединения формулы 1, где R1 обозначает СН3, R2 обозначает Cl, R3 обозначает OCH2CF3, R4а обозначает CH(СН3)2, R4b обозначает Н и R5 обозначает Cl;
соединения формулы 1, где R1 обозначает СН3, R2 обозначает Cl, R3 обозначает OCH2CF3, R4а обозначает СН3, R4b обозначает Н и R5 обозначает Cl;
соединения формулы 1, где R1 обозначает Cl, R2 обозначает Cl, R3 обозначает Br, R4а обозначает СН3, R4b обозначает Н и R5 обозначает Cl;
соединения формулы 1, где R1 обозначает СН3, R2 обозначает Cl, R3 обозначает OCH2CF3, R4а обозначает СН3, R4b обозначает Н и R5 обозначает Cl.
Предпочтительные композиции данного изобретения являются композициями, которые содержат приведенные выше предпочтительные соединения. Предпочтительные способы применения являются способами с использованием приведенных выше предпочтительных соединений.
Предпочтительными являются соединения формул 1, 2 и 4, в которых R1 обозначает СН3, Cl или Br; R2 обозначает F, Cl, Br, I или СН3; R3 обозначает СН3, Cl или Br; R4а обозначает С1-С4алкил; R4b обозначает Н и R5 обозначает Cl или Br.
Соединения формулы 1 могут быть получены с использованием одного или нескольких из следующих способов и вариантов, показанных на схемах 1-11. Определения R1, R2, R3, R4а, R4b и R5 в соединениях формул 1-24 ниже являются такими же, какие определены выше в разделе Сущность изобретения, если нет других указаний.
Соединения формулы 1 могут быть получены реакцией бензоксазинонов формулы 2 с С1-С4алкиламинами, как представлено в общем виде на схеме 1.
Схема 1
Эта реакция может протекать в неразбавленном виде или в различных подходящих растворителях, в том числе тетрагидрофуране, диэтиловом эфире, дихлорметане или хлороформе, с оптимальными температурами в диапазоне от комнатной температуры до температуры дефлегмации (кипения с обратным холодильником) растворителя. Общая реакция бензоксазинонов с аминами для получения антраниламидов хорошо описана в химической литературе. В отношении обзора см. Jakobsen et al., Bioorganic and Medicinal Chemistry 2000, 8, 2095-2103 и цитируемые в этом обзоре ссылки. См. также G.M. Coppola, J. Heterocyclic Chemistry 1999, 36, 563-588.
Бензоксазиноны формулы 2 могут быть получены различными способами. Два способа, которые являются особенно применимыми, подробно описаны на схемах 2-3. На схеме 2 бензоксазинон формулы 2 получают непосредственно связыванием пиразолкарбоновой кислоты формулы 4 с антраниловой кислотой формулы 3.
Схема 2
Она включает в себя последовательное добавление метансульфонилхлорида в присутствии третичного амина, такого как триэтиламин или пиридин, к пиразолкарбоновой кислоте формулы 4 с последующим добавлением антраниловой кислоты формулы 3, с последующим вторым добавлением третичного амина и метансульфонилхлорида. Этот способ обычно дает хорошие выходы бензоксазинона и иллюстрируется более подробно в примере 1.
Схема 3 отображает альтернативное получение бензоксазинонов формулы 2 с использованием связывания хлорангидрида кислоты формулы 6 с ангидридом изатиновой кислоты формулы 5 для получения непосредственно бензоксазинона формулы 2.
Схема 3
Для этой реакции применимы такие растворители, как пиридин или смесь пиридин/ацетонитрил. Хлорангидриды кислот формулы 6 могут быть получены из соответствующих кислот формулы 4 известными способами, такими как хлорирование тионилхлоридом или оксалилхлоридом.
Антраниловые кислоты формулы 3 могут быть получены различными известными способами. Многие из этих соединений являются известными. Как показано на схеме 4, антраниловые кислоты, содержащие в качестве заместителя R2 хлор, бром или иод, могут быть получены прямым галогенированием незамещенной антраниловой кислоты формулы 7 N-хлорсукцинимидом (NCS), N-бромсукцинимидом (NBS) или N-иодсукцинимидом (NIS) соответственно в растворителях, таких как N,N-диметилформамид (ДМФ), с получением соответствующей замещенной кислоты формулы 3.
Схема 4
Получение ангидридов изатиновой кислоты формулы 5 может быть выполнено из изатинов формулы 9, как представлено в общем виде на схеме 5.
Схема 5
Изатины формулы 9 могут быть получены из производных анилина формулы 8 согласно описанным в литературе методикам, таким как F.D. Popp, Adv. Heterocycl. Chem. 1975, 18, 1-58 и J.F.M. Da Silva et al., Journal of the Brazilian Society 2001, 12(3), 273-324. Окисление изатина 9 пероксидом водорода обычно дает хорошие выходы соответствующего ангидрида изатиновой кислоты 5 (G. Reissenweber and D. Mangold, Angew. Chem. Int. ed. Engl. 1980, 19, 222-223). ангидриды изатиновой кислоты могут быть также получены из антраниловых кислот 3 посредством многочисленных известных методик, в том числе реакции 3 с фосгеном или эквивалентом фосгена.
Пиразолкарбоновые кислоты формулы 4 могут быть получены по способу, представленному в общем виде на схеме 6.
Схема 6
Реакция пиразола 10 с 2,3-дигалогенпиридином формулы 11 дает хорошие выходы 1-пиридилпиразола 12 с хорошей специфичностью в отношении желаемой региохимии. Металлирование 12 диизопропиламидом лития (LDA) с последующим гашением соли лития диоксидом углерода дает пиразолкарбоновую кислоту формулы 4. Дополнительные детали методик для этого способа приведены в примерах 1, 3 и 5.
Исходные пиразолы 10, где R3 представляет собой СН3, Cl или Br, являются известными соединениями. Пиразол 10, в котором R3 является СН3, является коммерчески доступным. Пиразолы 10, в которых R3 является Cl или Br, могут быть получены в соответствии с описанными в литературе методиками (H. Reimlinger and A. Van Overstraeten, Chem. Ber. 1966, 99(10), 3350-7). Применимый альтернативный способ получения 10, в котором R3 представляет собой Cl или Br, изображен на схеме 7.
Схема 7
Металлирование сульфамоилпиразола 13 н-бутиллитием с последующим прямым галогенированием этого аниона либо гексахлорэтаном (если R3 является Cl), либо 1,2-дибромтетрахлорэтаном (если R3 является Br) дает галогенированные производные 14. Удаление сульфамоильной группы трифторуксусной кислотой (ТФУ) при комнатной температуре протекает без затруднений и с хорошим выходом с образованием пиразолов 10, где R3 представляет собой Cl или Br соответственно. Дополнительные экспериментальные подробности для этого способа описаны в примерах 3 и 5.
В качестве альтернативы способу, иллюстрированному на схеме 6, пиразолкарбоновые кислоты формулы 4, где R3 обозначает CF3, могут быть также получены способом, представленным в общем виде на схеме 8.
Схема 8
Реакция соединения формулы 15, где R6 обозначает С1-С4алкил, с подходящим основанием в подходящем органическом растворителе дает циклизированный продукт формулы 16 после нейтрализации кислотой, такой как уксусная кислота. Подходящим основанием может быть, например, но без ограничения, гидрид натрия, трет-бутоксид натрия, димсил натрия (диметилсульфоксид натрия) (CH3S(O)CH2 -Na+), карбонаты или гидроксиды щелочных металлов (таких как литий, натрий или калий), фториды или гидроксиды тетраалкил(например, метил, этил или бутил)аммония или 2-трет-бутиламино-2-диэтиламино-1,3-диметилпергидро-1,3,2-диазафосфонин. Подходящим органическим растворителем может быть, например, но без ограничения, ацетон, ацетонитрил, тетрагидрофуран, дихлорметан, диметилсульфоксид или N,N-диметилформамид. Реакцию циклизации обычно проводят в диапазоне температур от приблизительно 0 до 120°С. Влияния растворителя, основания, температуры и времени добавления являются взаимозависимыми, и выбор условий реакции является важным для минимизации образования побочных продуктов. Предпочтительным основанием является тетрабутиламмонийфторид.
Дегидратация соединения формулы 16 с получением соединения формулы 17 с последующим превращением функциональной группы эфира карбоновой кислоты в функциональную группу карбоновой кислоты дает соединение формулы 4. Дегидратацию выполняют обработкой каталитическим количеством подходящей кислоты. Этой каталитической кислотой может быть, например, но без ограничения, серная кислота. Реакцию обычно проводят с использованием органического растворителя. Как должно быть понятно специалисту в данной области, реакции дегидратации могут проводиться в широком разнообразии растворителей в диапазоне температур обычно между приблизительно 0 и 200°С, более предпочтительно между приблизительно 0 и 100°С. Для дегидратации в способе схемы 8 предпочтительными являются растворитель, содержащий уксусную кислоту, и температуры около 65°С. Соединения эфиров карбоновых кислот могут быть превращены в соединения карбоновых кислот многочисленными способами, в том числе нуклеофильным расщеплением при безводных условиях или гидролитическими способами, включающими в себя применение либо кислот, либо оснований (см. T.W. Greene and P.G.M. Wuts, Protective Groups in Organic Synthesis, 2nd ed., John Wiley & Sons, Inc., New York, 1991, pp. 224-269 в отношении обзора способов). Для способа схемы 8 предпочтительными являются катализируемые основанием гидролитические способы. Подходящие основания включают в себя гидроксиды щелочных металлов (таких как литий, натрий или калий). Например, эфир может быть растворен в смеси воды и спирта, такого как этанол. После обработки гидроксидом натрия или гидроксидом калия эфир омыляется с образованием натриевой или калиевой соли карбоновой кислоты. Подкисление сильной кислотой, такой как хлористоводородная кислота или серная кислота, дает карбоновую кислоту формулы 4. Эта карбоновая кислота может быть выделена способами, известными специалистам в данной области, в том числе кристаллизацией, экстракцией и дистилляцией.
Соединения формулы 15 могут быть получены по способу, представленному в общем виде на схеме 9.
Схема 9
где R3 обозначает CF3 и R6 обозначает С1-С4алкил.
Обработка соединения гидразина формулы 18 кетоном формулы 19 в растворителе, таком как вода, метанол или уксусная кислота, дает гидразон формулы 20. Специалисту в данной области должно быть понятно, что эта реакция может требовать катализа выбранной кислотой и может также требовать повышенных температур в зависимости от характера молекулярного замещения гидразона формулы 20. Реакция гидразона формулы 20 с соединением формулы 21 в подходящем органическом растворителе, таком как, например, но без ограничения, дихлорметан или тетрагидрофуран, в присутствии акцептора кислоты, такого как триэтиламин, дает соединение формулы 15. Эту реакцию обычно проводят при температуре между приблизительно 0 и 100°С. Дополнительные экспериментальные подробности для способа схемы 9 иллюстрируются в примере 7. Соединения гидразина формулы 18 могут быть получены стандартными способами, такими как контактирование соответствующего галогенсодержащего соединения формулы 11 с гидразином.
В качестве альтернативы способу, иллюстрированному на схеме 6, пиразолкарбоновые кислоты формулы 4, в которых R3 представляет собой Cl или Br, могут быть также получены по способу, представленному в общем виде на схеме 10.
Схема 10
где R6 представляет С1-С4алкил.
Окисление соединения формулы 22, необязательно в присутствии кислоты, с получением соединения формулы 17 с последующим превращением функциональной группы эфира карбоновой кислоты в группу карбоновой кислоты обеспечивает соединение формулы 4. Окислительным агентом может быть пероксид водорода, органические пероксиды, персульфат калия, персульфат натрия, персульфат аммония, моноперсульфат калия (например, Oxone®) или перманганат калия. Для получения полного превращения должен использоваться по меньшей мере один эквивалент окислительного агента относительно соединения формулы 22, предпочтительно между приблизительно одним и двумя эквивалентами. Это окисление обычно проводят в присутствии растворителя. Растворителем может быть эфир, такой как тетрагидрофуран, п-диоксан и т.п., органический эфир, такой как этилацетат, диметилкарбонат и т.п., или полярный апротонный органический растворитель, такой как N,N-диметилформамид, ацетонитрил и т.п. Кислоты, пригодные для применения на стадии окисления, включают в себя неорганические кислоты, такие как серная кислота, фосфорная кислота и т.п., и органические кислоты, такие как уксусная кислота, бензойная кислота и т.п. Кислота, когда она используется, должна применяться в количестве, большем, чем 0,1 эквивалента относительно соединения формулы 22. Для получения полного превращения могут быть использованы один-пять эквивалентов кислоты. Предпочтительным окислителем является персульфат калия, и окисление предпочтительно проводят в присутствии серной кислоты. Реакция может проводиться смешиванием соединения формулы 22 в желаемом растворителе и, если используется кислота, в кислоте. Затем может быть добавлен окислитель с подходящей скоростью. Температуру реакции обычно варьируют от низкой температуры, такой как приблизительно 0°С, до точки кипения растворителя для получения приемлемой скорости реакции для завершения реакции в пределах, предпочтительно, менее 8 часов. Желаемый продукт, соединение формулы 17, может быть выделен способами, известными специалистам в данной области, в том числе кристаллизацией, экстракцией и дистилляцией. Способы, подходящие для превращения эфира формулы 17 в карбоновую кислоту формулы 4, уже описаны для схемы 8. Дополнительные экспериментальные подробности для способа схемы 10 иллюстрируются в примерах 8 и 9.
Соединения формулы 22 могут быть получены из соответствующих соединений формулы 23, как показано на схеме 11.
Схема 11
где R6 представляет С1-С4алкил.
Обработка соединения формулы 23 галогенирующим реагентом, обычно в присутствии растворителя, дает соответствующее галогенсодержащее соединение формулы 22. Галогенирующие реагенты, которые могут быть использованы, включают в себя оксигалогениды фосфора, тригалогениды фосфора, пентагалогениды фосфора, тионилхлорид, дигалогентриалкилфосфораны, дигалогендифенилфосфораны, оксалилхлорид и фосген. Предпочтительными являются оксигалогениды фосфора и пентагалогениды фосфора. Для получения полного превращения должны использоваться по меньшей мере 0,33 эквивалента оксигалогенида фосфора относительно соединения формулы 23, предпочтительно между приблизительно 0,33 и 1,2 эквивалента. Для получения полного превращения должны использоваться по меньшей мере 0,20 эквивалента пентагалогенида фосфора относительно соединения формулы 23, предпочтительно между приблизительно 0,20 и 1,0 эквивалентом. Соединения формулы 23, в которых R6 обозначает С1-С4алкил, являются предпочтительными для этой реакции. Типичные растворители для этого галогенирования включают в себя галогенированные алканы, такие как дихлорметан, хлороформ, хлорбутан и т.п., ароматические растворители, такие как бензол, ксилол, хлорбензол и т.п., эфиры, такие как тетрагидрофуран, п-диоксан, диэтиловый эфир и т.п., и полярные апротонные растворители, такие как ацетонитрил, N,N-диметилформамид и т.п. Необязательно, может быть добавлено органическое основание, такое как триэтиламин, пиридин, N,N-диметиланилин или т.п. Необязательно, может быть также добавлен катализатор, такой как N,N-диметилформамид. Предпочтительным является процесс, в котором растворителем является ацетонитрил, а основание отсутствует. Обычно ни основание, ни катализатор не требуются, когда в качестве растворителя используют ацетонитрил. Предпочтительную реакцию проводят смешиванием соединения формулы 23 в ацетонитриле. Затем добавляют галогенирующий реагент в течение удобного времени, и затем эту смесь выдерживают при желаемой температуре, пока реакция не завершится. Температура реакции обычно находится в диапазоне между 20°С и точкой кипения ацетонитрила, и время реакции обычно меньше, чем 2 часа. Затем реакционную массу нейтрализуют неорганическим основанием, таким как бикарбонат натрия, гидроксид натрия и т.п., или органическим основанием, таким как ацетат натрия. Желаемый продукт, соединение формулы 22, может быть выделен способами, известными специалистам в данной области, в том числе кристаллизацией, экстракцией и дистилляцией.
Альтернативно, соединения формулы 22, где R3 обозначает Br или Cl, могут быть получены обработкой соответствующих соединений формулы 22, где R3 обозначает отличающийся галоген (например, Cl для получения формулы 22, где R3 обозначает Br) или сульфонатную группу, такую как п-толуолсульфонат, бензолсульфонат и метансульфонат, бромидом водорода или хлоридом водорода соответственно. При помощи этого способа заместитель галоген или сульфонат R3 в исходном соединении формулы 22 заменяется Br или Cl из бромида водорода или хлорида водорода соответственно. Эту реакцию проводят в подходящем растворителе, таком как дибромметан, дихлорметан или ацетонитрил. Реакцию можно проводить примерно при атмосферном давлении или при более высоком давлении, чем атмосферное давление, в автоклаве. Когда R3 в исходном соединении формулы 22 является галогеном, таким как Cl, реакцию предпочтительно проводят таким образом, что галогенид водорода, генерируемый из этой реакции, удаляют с использованием барботера или другими подходящими средствами. Реакцию можно проводить при температуре между приблизительно 0 и 100°С, наиболее предпочтительно при температуре около температуры окружающей среды (например, при приблизительно 10-40оС) и, более предпочтительно, между приблизительно 20 и 30°С. Добавление в качестве катализатора кислоты Льюиса (такой как трибромид алюминия, для получения соединения формулы 22, где R3 является Br) может способствовать этой реакции. Продукт формулы 22 выделяют обычными способами, известными специалистам в данной области, в том числе экстракцией, дистилляцией и кристаллизацией. Дополнительные подробности для этого способа иллюстрируются в примере 10.
Исходные соединения формулы 22, где R3 обозначает Cl или Br, могут быть получены обработкой соответствующих соединений формулы 23, как уже описано. Исходные соединения формулы 22, где R3 обозначает сульфонатную группу, могут быть также получены из соответствующих соединений формулы 23 стандартными способами, такими как обработка сульфонилхлоридом (например, п-толуолсульфонилхлоридом) и основанием, таким как третичный амин (например, триэтиламин) в подходящем растворителе, таком как дихлорметан; дополнительные подробности для этого способа иллюстрируются в примере 11.
В качестве альтернативы способу, иллюстрированному на схеме 6, пиразолкарбоновые кислоты формулы 4, где R3 обозначает OCH2CF3, могут быть также получены по способу, представленному в общем виде на схеме 12.
Схема 12
где R6 обозначает С1-С4алкил и Х обозначает уходящую (отщепляемую) группу.
В этом способе вместо галогенирования, показанного на схеме 11, соединение формулы 23 окисляют до соединения формулы 17а. Условия реакции для этого окисления уже описаны для превращения соединения формулы 22 в соединение формулы 17 на схеме 10.
Затем соединение формулы 17а алкилируют с образованием соединения формулы 17b контактированием с алкилирующим агентом СН3СН2Х (24) в присутствии основания. В алкилирующем агенте 24 Х обозначает уходящую группу нуклеофильной реакции, такую как галоген (например, Br, I), OS(O)2CH3 (метансульфонат), OS(O)2CF3, OS(O)2Ph-p-CH3 (п-толуолсульфонат) и т.п.; хорошо действует метансульфонат. Эту реакцию проводят в присутствии по меньшей мере одного эквивалента основания. Подходящие основания включают в себя неорганические основания, такие как карбонаты и гидроксиды щелочных металлов (таких как литий, натрий или калий), и органические основания, такие как триэтиламин, диизопропилэтиламин и 1,8-диазабицикло[5.4.0]ундец-7-ен. Реакцию обычно проводят в растворителе, который может содержать спирты, такие как метанол и этанол, галогенированные алканы, такие как дихлорметан, ароматические растворители, такие как бензол, толуол и хлорбензол, эфиры, такие как тетрагидрофуран, и полярные апротонные растворители, такие как ацетонитрил, N,N-диметилформамид и т.п. Спирты и полярные апротонные растворители являются предпочтительными для применения с неорганическими основаниями. Предпочтительными являются карбонат калия в качестве основания и ацетонитрил в качестве растворителя. Реакцию обычно проводят при температуре между приблизительно 0 и 150°С, наиболее часто между температурой окружающей среды и 100°С. Продукт формулы 17b может быть выделен общепринятыми способами, такими как экстракция. Затем эфир формулы 17b превращают в карбоновую кислоту формулы 4 способами, уже описанными для превращения соединения формулы 17 в соединение формулы 4 на схеме 8. Дополнительные подробности для способа схемы 12 иллюстрируются в примере 12.
Соединения формулы 23 могут быть получены из соединений формулы 18, как представлено в общем виде на схеме 13.
Схема 13
где R6 обозначает С1-С4алкил.
В этом способе соединение гидразина формулы 18 контактируют с соединением формулы 25 (фумаратным эфиром или малеатным эфиром или может быть использована их смесь) в присутствии основания и растворителя. Основанием является обычно соль алкоксида металла, такая как метоксид натрия, метоксид калия, этоксид натрия, этоксид калия, трет-бутоксид калия, трет-бутоксид лития и т.п. Следует использовать больше, чем 0,5 эквивалента основания относительно соединения формулы 18, предпочтительно между 0,9 и 1,3 эквивалента. Следует использовать больше, чем 1,0 эквивалент соединения формулы 25, предпочтительно между 1,0 и 1,3 эквивалента. Могут быть использованы полярные протонные и полярные апротонные органические растворители, такие как спирты, ацетонитрил, тетрагидрофуран, N,N-диметилформамид, диметилсульфоксид и т.п. Предпочтительными растворителями являются спирты, такие как метанол и этанол. Особенно предпочтительно, чтобы спирт был тем же самым спиртом, которым разбавляют фумаратный или малеатный эфир и алкоксидное основание. Реакцию обычно проводят смешиванием соединения формулы 18 и основания в растворителе. Эта смесь может быть нагрета или охлаждена до желаемой температуры, и соединение формулы 25 добавляют в течение некоторого периода времени. Обычно температуры реакции находятся в диапазоне между 0°С и точкой кипения используемого растворителя. Реакцию можно проводить при давлении, более высоком, чем атмосферное давление, для увеличения точки кипения растворителя. Обычно предпочтительными являются температуры между приблизительно 30 и 90°С. Время добавления может быть настолько быстрым, насколько это позволяет теплопередача. Типичные периоды добавления находятся между 1 минутой и 2 часами. Оптимальные температура реакции и время добавления варьируются в зависимости от конкретных соединений формулы 18 и формулы 25. После добавления реакционная смесь может быть выдержана в течение некоторого времени при температуре реакции. В зависимости от температуры реакции требуемое время выдерживания может быть от 0 до 2 часов. Обычные периоды выдерживания равны 10-60 минутам. Затем масса реакции может быть подкислена добавлением органической кислоты, такой как уксусная кислота и т.п., или неорганической кислоты, такой как хлористоводородная кислота, серная кислота и т.п. В зависимости от условий реакции и способов выделения группа -СО2R6 на соединении формулы 23 может гидролизоваться до -СО2Н; например, такому гидролизу может способствовать присутствие воды в реакционной смеси. Если образуется карбоновая кислота (-СО2Н), она может быть превращена обратно в -СО2R6, где R6 обозначает С1-С4алкил, с использованием способов этерификации, хорошо известных в данной области. Желаемый продукт, соединение формулы 23, может быть выделен способами, известными специалистам в данной области, такими как кристаллизация, экстракция или дистилляция.
Понятно, что некоторые реагенты и условия реакции, описанные выше, для получения соединений формулы 1, могут не быть совместимыми с некоторыми функциональными группами в промежуточных продуктах. В этих случаях включение последовательностей реакций введения/снятия защиты или взаимопревращений функциональной группы в этот синтез будет способствовать получению желаемых продуктов. Применение и выбор защитных групп будут очевидными специалисту в области химического синтеза (см., например, T.W. Greene and P.G.M. Wuts, Protective Groups in Organic Synthesis, 2nd ed., John Wiley: New York, 1991). Специалисту в данной области должно быть понятно, что, в некоторых случаях, после введения конкретного реагента, как это изображено на любой отдельной схеме, может быть необходимым выполн