Азолильные производные хинолина и хиназолина, содержащая их фармацевтическая композиция, их применение и способ лечения заболеваний
Иллюстрации
Показать всеИзобретение относится к соединениям, которые обладают мощной противоопухолевой активностью и пригодны для лечения заболевания, выбранного из группы, включающей опухоли, диабетическую ретинопатию, хронический ревматизм, псориаз, атеросклероз и саркому Капоши, представленным формулой (I), или к их фармацевтически приемлемым солям или сольватам: где Х и Z представляет собой СН или N; Y представляет собой О; R1, R2 и R3, которые могут быть одинаковыми или различными и представляют собой атом водорода, C1-6 алкокси; R4 представляет собой атом водорода; R5, R6, R7 и R8, которые могут быть одинаковыми или различными, представляют собой атом водорода, атом галогена, C1-4 алкил, трифторметил; R9 и R10 представляют собой атомы водорода; и R11 представляет собой необязательно замещенный азолил. Также описаны фармацевтическая композиция, обладающая ингибирующей активностью в отношении фосфорилирования KDR и способ ингибирования ангиогенеза кровеносных сосудов-мишеней. 7 н. и 26 з.п. ф-лы, 5 табл.
Реферат
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Область изобретения
Настоящее изобретение относится к производным хинолина и производным хиназолина, которые обладают противоопухолевой активностью. Более конкретно, настоящее изобретение относится к производным хинолина и производным хиназолина, которые являются терапевтически эффективными при таких заболеваниях, как опухоль, диабетическая ретинопатия, хронический ревматизм, псориаз, атеросклероз и саркома Капоши.
Предшествующий уровень техники
WO 97/17329, выложенная заявка на патент Японии № 328782/1997 и WO 00/43366 описывают производные хинолина и производные хиназолина, которые обладают противоопухолевой активностью. Однако они не описывают соединения по настоящему изобретению.
КРАТКОЕ ИЗЛОЖЕНИЕ ИЗОБРЕТЕНИЯ
Заявители обнаружили, что группа азолил-содержащих производных хинолина и производных хиназолина обладает мощной противоопухолевой активностью.
Цель настоящего изобретения состоит в создании соединений, обладающих мощной противоопухолевой активностью.
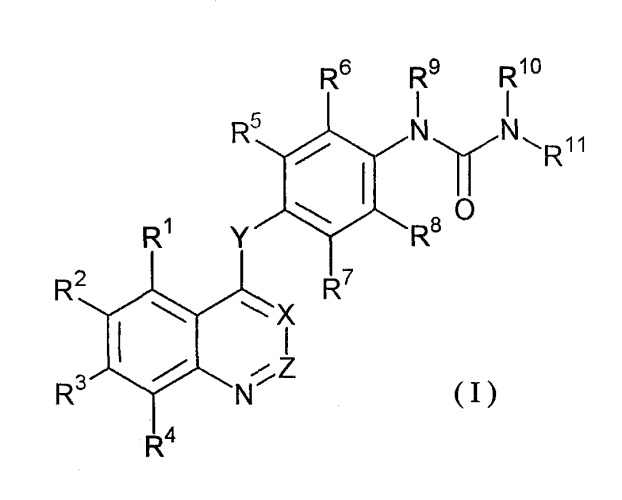
Согласно настоящему изобретению предлагается соединение, представленное формулой (I), или его фармацевтически приемлемая соль или сольват:
где
X и Z каждый независимо представляет собой СН или N;
Y представляет собой O или S;
R1, R2 и R3, которые могут быть одинаковыми или различными, и представляют собой атом водорода, С1-6 алкил, С1-6 алкокси, С2-6 алкенил, С2-6 алкинил, нитро или амино, причем С1-6 алкильные, С1-6 алкоксильные, С2-6 алкенильные и С2-6 алкинильные группы необязательно замещены атомом галогена; гидроксилом; С1-4 алкилом; С1-4 алкоксикарбонилом; аминогруппой, в которой один или два атома водорода необязательно замещены С1-4 алкилом, необязательно замещенным гидроксилом или С1-4 алкокси группой; группой R12R13N-C(=O)-O-, где R12 и R13, которые могут быть одинаковыми или различными, представляют собой атом водорода или С1-4 алкил, необязательно замещенный гидроксилом или С1-4 алкокси группой; или группой R14-(S)m-, где R14 представляет собой насыщенную или ненасыщенную карбоциклическую или гетероциклическую группу, содержащую от трех- до семи атомов в цикле, необязательно замещенную С1-4 алкилом и m равно 0 или 1;
R4 представляет собой атом водорода;
R5, R6, R7 и R8, которые могут быть одинаковыми или различными и представляют собой атом водорода, атом галогена, С1-4 алкил, С1-4 алкокси, С1-4 алкилтио, трифторметил, нитро или аминогруппу;
R9 и R10, которые могут быть одинаковыми или различными и представляют собой атом водорода, С1-6 алкил или С1-4 алкилкарбонил, и алкильная часть С1-6 алкильной или С1-4 алкилкарбонильной группы необязательно замещена атомом галогена; С1-4 алкокси; аминогруппой, необязательно замещенной С1-4 алкилом, необязательно замещенным С1-4 алкоксильной группой; или насыщенной или ненасыщенной карбоциклической или гетероциклической группой, содержащей от трех- до семи атомов в цикле; и
R11 представляет собой азолил, в котором один или несколько атомов водорода необязательно замещены атомом галогена; С1-4 алкилом;
С1-4 алкокси; С1-4 алкилтио; трифторметилом; нитро; аминогруппой, в которой один или два атома водорода необязательно замещены С1-4 алкильными(ой) группами(ой), которые могут быть одинаковыми или различными; С1-4 алкоксикарбонил С1-4 алкилом, С1-4 алкилкарбонилом или С3-5 циклическим алкилом.
Соединения по настоящему изобретению являются терапевтически эффективными при таких заболеваниях, как опухоль, диабетическая ретинопатия, хронический ревматизм, псориаз, атеросклероз и саркома Капоши.
ДЕТАЛЬНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Соединение
Используемые термины “С1-6 алкил” и “С1-6 алкокси” в качестве группы или части группы, соответственно, обозначают линейную или разветвленную алкильную или алкоксильную цепь, содержащую от 1 до 6, предпочтительно, от 1 до 4 атомов углерода.
Используемые термины “С2-6 алкенил” и “С2-6 алкинил” в качестве группы или части группы, соответственно, обозначают линейную или разветвленную алкенильную или алкинильную цепь, содержащую от 2 до 6, предпочтительно, от 1 до 4 атомов углерода.
Примеры С1-6 алкила включают метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, н-пентил и н-гексил.
Примеры С1-6 алкокси группы включают метокси, этокси, н-пропокси, изопропокси, н-бутокси, изобутокси, втор-бутокси и трет-бутокси группы.
Примеры С2-6 алкенила включают аллил, бутенил, пентенил и гексенил.
Примеры С2-6 алкинила включают 2-пропинил, бутинил, пентинил и гексинил.
Примеры С3-5 циклического алкила включают циклопропил и циклопентил.
Термин “атом галогена” обозначает атом фтора, хлора, брома или йода.
Насыщенное или ненасыщенное карбоциклическое или гетероциклическое кольцо, содержащее от трех до семи атомов в цикле, предпочтительно, представляет собой насыщенное или ненасыщенное карбоциклическое или гетероциклическое кольцо, содержащее от пяти до семи атомов в цикле, более предпочтительно, от пяти до шести атомов в цикле.
Примеры насыщенных или ненасыщенных карбоциклических или гетероциклических колец, содержащих от трех до семи атомов в цикле, включают фенил, циклогептил, циклогексил и циклопентил.
Насыщенное или ненасыщенное гетероциклическое кольцо, включающее от трех до семи атомов в цикле, содержит один или несколько гетероатомов, выбранных из атомов кислорода, азота и серы. Используемый в данном описании термин “гетероатом” обозначает атом кислорода, азота или серы. Примеры насыщенных или ненасыщенных гетероциклических групп, содержащих от трех до семи атомов в цикле, включают пиридил, пиперидино, пиперазино, морфолино, имидазолил, триазолил, тетразолил, оксазолил, тиазолил, пирролидинил и пиразолил.
Используемый в данном описании термин “азолил” обозначает пятичленную насыщенную или ненасыщенную гетероциклическую группу, содержащую в качестве атомов цикла два или более гетероатома, выбранных из группы, состоящей из атомов азота, серы и кислорода, где, по меньшей мере, один из гетероатомов представляет собой атом азота.
Предпочтительно, R1 представляет собой атом водорода.
С1-6 алкильные, С1-6 алкоксильные, С2-6 алкенильные и С2-6 алкинильные группы, которыми могут быть представлены R1, R2 и R3, необязательно являются замещенными группой R14-(S)m-.
Карбоциклическая или гетероциклическая группа, которой может быть представлена R14, предпочтительно, представляет собой насыщенную или ненасыщенную пяти- или шестичленную карбоциклическую или гетероциклическую группу. Карбоциклическая группа, более предпочтительно, представляет собой фенил. Гетероциклическая группа, более предпочтительно, представляет собой насыщенную или ненасыщенную пятичленную гетероциклическую группу, содержащую от одного до четырех атомов азота, или насыщенную или ненасыщенную шестичленную гетероциклическую группу, содержащую один или два гетероатома, выбранные из атомов азота и кислорода. Более конкретно, гетероатом, входящий в состав шестичленной гетероциклической группы, может являться атомом азота и атомом кислорода, или одним или двумя атомами азота.
Когда m равно 0 (нулю), -(S)m- представляет связь.
Замещенная С1-6 алкоксильная группа, которой могут быть представлены R1, R2 и R3, предпочтительно, представляет собой группу R31-(CH2)p-O-, где R31 представляет собой атом галогена; гидроксил; С1-4 алкоксильную группу; С1-4 алкоксикарбонил; аминогруппу, в которой один или два атома водорода необязательно замещены С1-4 алкилом, необязательно замещенным гидроксилом, или С1-4 алкоксильной группой; группу R12R13N-C(=O)-O-, где R12 и R13 являются такими, как определено в формуле (I); или группу R14-(S)m-, где R14 является таким, как определено в формуле (I), и р равно целому числу от 1 до 6, предпочтительно от 1 до 4, более предпочтительно 1 или 2.
R2 и R3, предпочтительно, представляют собой С1-4 алкокси, более предпочтительно, метокси.
Х, предпочтительно, представляет собой N или СН, и Z, предпочтительно, представляет собой СН.
Предпочтительно, по меньшей мере, один из R5, R6, R7 и R8 представляет собой атом галогена.
Предпочтительно, по меньшей мере, один из R5, R6, R7 и R8 представляет собой атом хлора или фтора.
Предпочтительно, по меньшей мере, один из R5, R6, R7 и R8 представляет собой С1-4 алкил.
Предпочтительно, по меньшей мере, один из R5, R6, R7 и R8 представляет собой С1-4 алкокси.
Предпочтительно, по меньшей мере, один из R5, R6, R7 и R8 представляет собой С1-4 алкилтио, трифторметил, нитро или аминогруппу.
Предпочтительно, R5 и R6 представляют собой атом галогена, более предпочтительно атом хлора или фтора, С1-4 алкил, С1-4 алкокси,
С1-4 алкилтио, трифторметил, нитро или аминогруппу, а R7 и R8 представляют собой атом водорода.
R9 и R10, предпочтительно, представляют собой атом водорода.
Предпочтительно, R11 представляет собой группу (i):
где Q представляет собой O, S или NH, и R22 и R23, которые могут быть одинаковыми или различными, представляют собой атом водорода; атом галогена; С1-4 алкил; С1-4 алкокси; С1-4 алкилтио; трифторметил; нитро; аминогруппу, в которой один или два атома водорода необязательно замещены С1-4 алкильной(ыми) группой(ми), которые могут быть одинаковыми или различными; С1-4 алкоксикарбонил С1-4 алкил; С1-4 алкилкарбонил или С3-5 циклический алкил.
Предпочтительно, R11 представляет собой группу(ii):
где Q представляет собой O, S или NH, и R22 и R23, которые могут быть одинаковыми или различными, представляют собой атом водорода; атом галогена; С1-4 алкил; С1-4 алкокси; С1-4 алкилтио; трифторметил; нитро; аминогруппу, в которой один или два атома водорода необязательно замещены С1-4 алкильной(ыми) группой(ми), которые могут быть одинаковыми или различными; С1-4 алкоксикарбонил С1-4 алкил; С1-4 алкилкарбонил или С3-5 циклический алкил.
Предпочтительно, R11 представляет собой группу(iii):
где Q представляет собой O, S или NH, и R22 и R23, которые могут быть одинаковыми или различными, представляют собой атом водорода; атом галогена; С1-4 алкил; С1-4 алкокси; С1-4 алкилтио; трифторметил; нитро; аминогруппу, в которой один или два атома водорода необязательно замещены С1-4 алкильной(ыми) группой(ми), которые могут быть одинаковыми или различными; С1-4 алкоксикарбонил С1-4 алкил; С1-4 алкилкарбонил или С3-5 циклический алкил.
Предпочтительно, R11 представляет собой группу(iv):
где Q представляет собой O, S или NH, и R22 представляет собой атом водорода; атом галогена; С1-4 алкил; С1-4 алкокси; С1-4 алкилтио; трифторметил; нитро; аминогруппу, в которой один или два атома водорода необязательно замещены С1-4 алкильной(ыми) группой(ми), которые могут быть одинаковыми или различными; С1-4 алкоксикарбонил С1-4 алкил; С1-4 алкилкарбонил или С3-5 циклический алкил.
В группах (i) и (ii) R23, предпочтительно, представляет собой атом водорода.
Предпочтительно, R11 представляет собой необязательно замещенный азолил, выбранный из группы, состоящей из имидазолила, оксазолила, тиазолила, пиразолила, изоксазолила, изотиазолила, 1,3,4-тиадиазолила, 1,2,4-тиадиазолила, 1,2,4-оксадиазолила и 1,3,4-оксадиазолила.
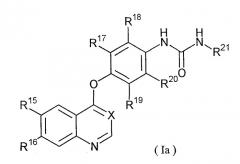
Предпочтительная группа соединений, представленных формулой (I), включает соединения, представленные формулой (Ia):
где
Х представляет собой СН или N,
R15 и R16, которые могут быть одинаковыми или различными и представляют собой С1-6 алкокси,
R17, R18, R19 и R20, которые могут быть одинаковыми или различными и представляют собой атом водорода, атом галогена, С1-4 алкил, С1-4 алкокси, С1-4 алкилтио, трифторметил, нитро или аминогруппу,
R21 представляет собой азолил, в котором один или несколько атомов водорода необязательно замещены атомом галогена; С1-4 алкилом;
С1-4 алкокси; С1-4 алкилтио; трифторметилом; нитро; аминогруппой, в которой один или два атома водорода необязательно замещены С1-4 алкильной(ыми) группой(ми), которые могут быть одинаковыми или различными; С1-4 алкоксикарбонил С1-4 алкилом; С1-4 алкилкарбонилом или С3-5 циклическим алкилом.
Предпочтительно, R15 и R16 представляет собой метокси.
Предпочтительно, по меньшей мере, один из R17, R18, R19 и R20 представляет собой атом галогена.
Предпочтительно, по меньшей мере, один из R17, R18, R19 и R20 представляет собой атом хлора или фтора.
Предпочтительно, по меньшей мере, один из R17, R18, R19 и R20 представляет собой С1-4 алкил.
Предпочтительно, по меньшей мере, один из R17, R18, R19 и R20 представляет собой С1-4 алкокси.
Предпочтительно, по меньшей мере, один из R17, R18, R19 и R20 представляет собой С1-4 алкилтио, трифторметил, нитро или аминогруппу.
Предпочтительно, R17 и R18 представляют собой атом галогена, более предпочтительно атом хлора или фтора, С1-4 алкил, С1-4 алкокси, С1-4 алкилтио, трифторметил, нитро или аминогруппу, а R19 и R20 представляют собой атом водорода.
Предпочтительно, R21 представляет собой группу (i), (ii), (iii) или (iv).
Предпочтительно, R21 представляет собой необязательно замещенный азолил, выбранный из группы, состоящей из имидазолила, оксазолила, тиазолила, пиразолила, изоксазолила, изотиазолила, 1,3,4-тиадиазолила, 1,2,4-тиадиазолила, 1,2,4-оксадиазолила и 1,3,4- оксадиазолила.
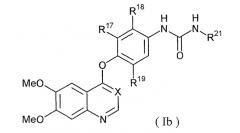
Группа более предпочтительных соединений, представленных формулой (I), включает соединения, представленные формулой (Ib):
где MeO представляет собой метокси; X представляет собой СН или N; R17, R18 и R19, которые могут быть одинаковыми или различными, представляют собой атом водорода, атом галогена, С1-4 алкил, С1-4 алкокси, С1-4 алкилтио, трифторметил, нитро или аминогруппу; и R21 представляет собой группу (i), (ii), (iii) или (iv).
В формуле (Ib), предпочтительно, R21 представляет собой группу (i), где Q представляет собой О, более предпочтительно, R22 и R23 представляют собой атом водорода, либо один из R22 и R23 представляет собой атом водорода, а другой представляет собой С1-4 алкил.
В формуле (Ib), предпочтительно, R21 представляет собой группу (iii), где Q представляет собой S, более предпочтительно, R22 и R23 представляют собой атом водорода, либо один из R22 и R23 представляет собой атом водорода, а другой представляет собой С1-4 алкил.
Конкретные примеры соединений по настоящему изобретению включают соединения, полученные в примерах 1-75.
Более предпочтительные соединения по настоящему изобретению включают следующие ниже соединения. Числовые значения в скобках показывают № примера.
(4) N-{2-хлор-4-[(6,7-диметокси-4-хинолил)окси]фенил}-N'-(5-метил-3-изоксазолил)мочевина;
(27) N-{4-[(6,7-диметокси-4-хинолил)окси]-2-фторфенил}-N'-(1,3-тиазол-2-ил)мочевина;
(28) N-{4-[(6,7-диметокси-4-хинолил)окси]-2-фторфенил}-N'-(4-метил-1,3-тиазол-2-ил)мочевина и
(38) N-{2-хлор-4-[(6,7-диметокси-4-хиназолинил)окси]фенил}-N'-(1,3-тиазол-2-ил)мочевина.
Соединения по настоящему изобретению могут образовывать фармацевтически приемлемые соли. Предпочтительные примеры таких солей включают: соли щелочных металлов или щелочноземельных металлов, такие как соли натрия, соли калия или соли кальция; соли галогеноводородных кислот, такие как соли фтористоводородной кислоты, соли хлористоводородной кислоты, соли бромистоводородной кислоты или соли йодистоводородной кислоты; соли неорганических кислот, такие как соли азотной кислоты, соли хлорной кислоты, соли серной кислоты или соли фосфорной кислоты; соли низших алкилсульфоновых кислот, такие как соли метансульфокислоты, соли трифторметансульфокислоты или соли этансульфокислоты; соли арилсульфоновых кислот, такие как соли бензолсульфокислоты или соли п-толуолсульфокислоты; соли органических кислот, такие как соли фумаровой кислоты, соли янтарной кислоты, соли лимонной кислоты, соли винной кислоты, соли щавелевой кислоты, соли малеиновой кислоты, соли уксусной кислоты, соли яблочной кислоты, соли молочной кислоты или соли аскорбиновой кислоты; соли аминокислот, такие как соли глицина, соли фенилаланина, соли глутаминовой кислоты или соли аспаргиновой кислоты.
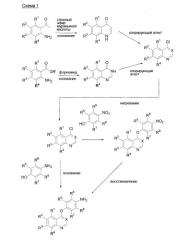
Соединения по настоящему изобретению можно получить, например, по схеме 1 и схеме 2.
где R' представляет собой С1-6 алкил или аналогичное, а R1, R2, R3, R4, R5, R6, R7, R8 и X являются такими, как определено в формуле (I).
Исходные соединения, необходимые для синтеза соединений по настоящему изобретению, имеются в продаже или их можно легко получить традиционным методом. Например, производное 4-хлорхинолина можно синтезировать обычным методом, описанным, например, в Org. Synth. Col. Vol. 3, 272 (1955), Acta Chim. Hung., 112, 241 (1983) или WO 98/47873.
Альтернативно, производное 4-хлорхиназолина можно получить сначала (1) реакцией сложного эфира бензойной кислоты с формамидом с получением производного хиназолона, и затем (2) нагреванием производного 4-хиназолона в присутствии оксихлорида фосфора, используя толуол или сульфолан в качестве растворителя. Производное хиназолона обычно синтезируют в присутствии такого растворителя, как сложный эфир бензойной кислоты, метоксид натрия, формамид, N,N-диметилформамид или метанол.
Затем, производное 4-(аминофенокси)хинолина или соответствующее производное хиназолина можно получить реакцией нитрофенола с производным 4-хлорхинолина или соответствующим производным хиназолина в присутствии или отсутствии подходящего растворителя, получая производное 4-(нитрофенокси)хинолина или соответствующее производное хиназолина, и затем перемешивая производное 4-(нитрофенокси)хинолина или соответствующее производное хиназолина в подходящем растворителе, например N,N-диметилфорамиде, в присутствии катализатора, например, гидроксида палладия на угле, палладия на угле, в атмосфере водорода. Альтернативно, производное 4-(аминофенокси)хинолина или соответствующее производное хиназолина можно получить реакцией аминофенола с производным 4-хлорхинолина или соответствующим производным хиназолина в присутствии основания, например гидрида натрия.
Альтернативно, производное 4-(аминофенокси)хиназолина можно получить, растворяя аминофенол в водном растворе гидроксида натрия и подвергая раствор двухфазной реакции с раствором производного 4-хлорхиназолина в органическом растворителе в присутствии катализатора межфазного переноса, например бромида тетра-н-бутиламмония, или в отсутствии катализатора.
где Hal представляет собой атом галогена, и R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R11 и X являются такими, как определено в формуле (I).
Заместитель в R9 можно ввести реакцией полученного таким образом производного 4-(аминофенокси)хинолина или соответствующего производного хиназолина с хлорангидридом или ангидридом кислоты в присутствии основания и затем восстановлением продукта реакции литийалюмогидридом или т.п. (стадия 1А).
Альтернативно, заместитель в R9 можно ввести реакцией производного 4-(аминофенокси)хинолина или соответствующего производного хиназолина с альдегидом или кетоном, получая соединение имина, и затем осуществляя реакцию соединения имина со смешанным цианогидридом натрия и бора или т.п. (стадия 1В).
Соединение, представленное формулой (I), можно получить реакцией производного, имеющего заместитель у R9, с производным изоцианата традиционным способом (стадия 2) и осуществляя реакцию продукта реакции с подходящим алкилирующим агентом (R10Hal) в присутствии основания, например гидрида натрия (стадия 3).
R9 и R10 также можно ввести реакцией производного мочевины, где R9 и/или R10 представляют собой атом водорода, с подходящим алкилирующим агентом (R10Hal) в присутствии основания, например гидрида натрия, аналогично стадии 3 (стадии 5 и 7).
Производное мочевины, где R9 и/или R10 представляют собой атом водорода, можно получить реакцией производного 4-(аминофенокси)хинолина или соответствующего производного хиназолина, полученного по схеме 1, с производным изоцианата традиционным способом, или добавляя трифосген к производному 4-(аминофенокси)хинолина или соответствующему производному хиназолина в присутствии основания, например триэтиламина, и затем осуществляя реакцию смеси с подходящим производным амина (R11NH2 или R10R11NH) (стадии 4 и 6).
Соединение, представленное формулой (I), где Y представляет собой S, можно получить реакцией производного аминотиофенола с производным 4-хлорхинолина или соответствующим производным хиназолина в подходящем растворителе, например, в хлорбензоле, по схеме 1, получая производное 4-(хинолилсульфанил)анилина или производное 4-(хиназолинилсульфанил)анилина и затем образуя группу мочевины по схеме 2.
Применение соединений/фармацевтических композиций
Соединения по настоящему изобретению имеют ингибирующую в отношении пролиферации опухоли активность in vivo (фармакологический тест примеры 2, 3 и 4).
Далее, соединения по настоящему изобретению ингибируют in vitro автофосфорилирование во внутриклеточном домене KDR человека, вызываемое стимуляцией NIH3T3 клеток, которые устойчиво экспрессируют KDR человека, VEGF (фактором роста сосудистого эндотелия) (фармакологический тест пример 1). Связывание VEGF с KDR, рецептором VEGF на клеточной мембране, индуцирует активирование МАРК (активированной митогеном протеинкиназы) или подобного посредством автофосфорилирования внутриклеточного домена KDR под действием тирозинкиназы (Shibuya M., Ito N., Claesson-Welsh L., in Curr. Topics Microbiol. Immunol., 237, 59-83 (1999); Abedi, H., Zachary, I., J. Biol. Chem., 272, 15442-15451 (1997)). Известно, что активирование МАРК играет важную роль в росте клеток сосудистого эндотелия при ангиогенезе (Merenmies, J. et al., Cell Growth & Differ., 83-10 (1997); и Ferrara, N., Davis-Smyth, T., Endocr. Rev., 18, 4-25 (1997)). Таким образом, соединения по настоящему изобретению имеют ингибирующую активность по отношению к ангиогенезу.
Ангиогенез на патологических участках, как известно, играет ключевую роль в таких заболеваниях, как опухоль, диабетическая ретинопатия, хронический ревматизм, псориаз, атеросклероз, саркома Капоши и метастазирование солидных опухолей (Folkman, J. Nature Med. 1: 27-31 (1995); Bicknell, R., Harris, A.L. Curr. Opin. Oncol. 8: 60-65 (1996)). Поэтому соединения по настоящему изобретению можно использовать при лечении данных заболеваний.
В соответствии с настоящим изобретением предлагается фармацевтическая композиция, включающая соединение по настоящему изобретению. Фармацевтическую композицию по настоящему изобретению можно использовать при лечении таких заболеваний, как опухоли, диабетическая ретинопатия, хронический ревматизм, псориаз, атеросклероз, саркома Капоши и метастазирование солидных опухолей.
Соединения по настоящему изобретению можно вводить человеку и другим млекопитающим орально или парентерально такими путями введения, как внутривенное введение, внутримышечное введение, подкожное введение, ректальное введение или чрескожное введение. Поэтому фармацевтические композиции, включающие в качестве активного ингредиента соединение по настоящему изобретению, составляют в подходящие лекарственные формы в соответствии с путями введения.
Конкретно, оральные препараты включают таблетки, капсулы, порошки, гранулы и сиропы, а парентеральные препараты включают инъекции, суппозитории, пластыри и мази.
Эти разнообразные препараты можно приготовить традиционными способами, например, с обычно используемыми фармацевтически приемлемыми носителями, такими как наполнители, вещества способствующие распадаемости лекарственной формы, связывающие вещества, смазывающие вещества, красители и разбавители.
Наполнители включают, например, лактозу, глюкозу, кукурузный крахмал, сорбит и кристаллическую целлюлозу; вещества способствующие распадаемости лекарственной формы включают, например, крахмал, альгинат натрия, порошок желатины, карбонат кальция, цитрат кальция и декстрин; связывающие вещества включают, например, диметилцеллюлозу, поливиниловый спирт, поливиниловый эфир, метилцеллюлозу, этилцеллюлозу, аравийскую камедь, желатин, гидроксипропилцеллюлозу и поливинилпирролидон; смазывающие вещества включают, например, тальк, стеарат магния, полиэтиленгликоль и гидрогенизированные растительные масла.
При приготовлении инъекций, если это необходимо, можно добавить, например, буферирующие вещества, регуляторы рН, стабилизаторы, агенты тоничности и консерванты.
Содержание соединения по настоящему изобретению в фармацевтической композиции по настоящему изобретению может изменяться в зависимости от лекарственной формы. Однако, как правило, содержание составляет от 0,5 до 50% массовых, предпочтительно, от 1 до 20% массовых, от общей массы композиции.
Дозу можно соответствующим образом определить, принимая во внимание, например, возраст, массу, пол, различие в заболевании и серьезность состояния индивидуальных пациентов, и препараты можно вводить, например, в количестве от 0,01 до 100 мг/кг, предпочтительно, от 0,1 до 50 мг/кг. Данную дозу вводят один раз в сутки или разделенными дозами несколько раз в сутки.
Соединение по настоящему изобретению можно вводить в комбинации с другим(и) лекарственным(и) средством(ами). В данном случае соединение по настоящему изобретению можно вводить одновременно или после или до введения других(ого) лекарственных(ого) средств(а). Например, когда заболевание представляет собой злокачественную опухоль, соединение по настоящему изобретению может действовать на клетки-мишени сосудистого эндотелия, приводя к уменьшению опухоли, после чего следует введение противоопухолевого препарата для эффективного уничтожения опухоли. Тип, интервалы введения и аналогичное для противоопухолевого препарата можно определить в зависимости, например, от типа раковой опухоли и состояния пациентов. Данный метод можно применять для заболеваний, отличных от злокачественной опухоли.
В соответствии с настоящим изобретением предлагается использование соединения по настоящему изобретению для получения лекарственного средства для лечения заболевания, выбранного из группы, включающей опухоли, диабетическую ретинопатию, хронический ревматизм, псориаз, атеросклероз и саркому Капоши.
Далее, в соответствии с настоящим изобретением предлагается способ лечения заболевания, выбранного из группы, состоящей из опухоли, диабетической ретинопатии, хронического ревматизма, псориаза, атеросклероза и саркомы Капоши, включающий стадию введения млекопитающему, например человеку, терапевтически эффективного количества соединения по настоящему изобретению, необязательно вместе с фармацевтически приемлемым носителем.
Далее в соответствии с настоящим изобретением предлагается способ ингибирования ангиогенеза кровеносных сосудов-мишеней, включающий стадию введения соединения по настоящему изобретению в контакт с клетками сосудистого эндотелия кровеносных сосудов-мишеней. Кровеносные сосуды-мишени включают кровеносные сосуды, вовлеченные в подачу питания к тканям, являющимся причиной заболевания, например тканям опухоли, ретинопатическим тканям или ревматическим тканям. Соединения по настоящему изобретению можно ввести в контакт с клетками сосудистого эндотелия, например, общим введением, например, внутривенным введением или оральным введением; местным введением, например, чрезкожным введением или внутрисуставным введением; или мишеневым введением лекарственного средства, используя носитель, например, липосому, липидную микросферу или полимерные формы лекарственного средства.
ПРИМЕРЫ
Далее настоящее изобретение иллюстрируется следующими примерами, которые не предназначены для ограничения изобретения.
Пример 1: N-{3-хлор-4-[(6,7-диметокси-4-хинолил)окси]фенил}-N'-(3-изоксазолил)мочевина
3-хлор-4-[(6,7-диметокси-4-хинолил)окси]анилин (20 мг) растворяют в хлорбензоле (2 мл) и N,N-диизопропилэтиламине (0,2 мл), получая раствор. Затем к данному раствору добавляют раствор трифосгена (18 мг) в хлорбензоле (0,5 мл) и смесь перемешивают при комнатной температуре в течение 30 мин. Затем добавляют 3-изоксазоламин (10 мг) и далее смесь перемешивают при 110°С в течение ночи. Реакционный раствор проявляют на диатомитовой земле, импрегнированной (пропитанной) насыщенным водным раствором гидрокарбоната натрия, после чего следует экстракция хлороформом. Растворитель из экстракта удаляют перегонкой. Остаток очищают ВЭЖХ с использованием для проявления смеси хлороформ/метанол, получая указанное в заголовке соединение (2 мг, выход 8%).
1H-ЯМР (CDCl3, 400 МГц): 4,06 (с, 3H), 4,07 (с, 3H), 6,35 (д, J=5,4 Гц, 1H), 6,37 (ушир., 1H), 7,23 (д, J=8,8 Гц, 1H), 7,45 (с, 1H), 7,51 (дд, J=2,4, 8,8 Гц, 1H), 7,60 (с, 1H), 7,90 (д, J=2,4 Гц, 1H), 8,29 (д, J=2,0 Гц, 1H), 8,49 (д, J=5,4 Гц, 1H)
Масс-спектрометрия (ЭРИ-МС, m/z): 441 (М++1)
Пример 2: N-{3-хлор-4-[(6,7-диметокси-4-хинолил)окси]фенил}-N'-(3-метил-5-изоксазолил)мочевина
3-Хлор-4-[(6,7-диметокси-4-хинолил)окси]анилин (20 мг) растворяют в хлорбензоле (2 мл) и N,N-диизопропилэтиламине (0,2 мл), получая раствор. Затем к данному раствору добавляют раствор трифосгена (18 мг) в хлорбензоле (0,5 мл) и смесь перемешивают при комнатной температуре в течение 30 мин. Затем добавляют 3-метил-5-изоксазоламин (12 мг) и далее смесь перемешивают при 110°С в течение ночи. Реакционный раствор проявляют на диатомитовой земле, импрегнированной насыщенным водным раствором гидрокарбоната натрия, после чего следует экстракция хлороформом. Растворитель из экстракта удаляют перегонкой. Остаток очищают ВЭЖХ с использованием для проявления смеси хлороформ/метанол, получая указанное в заголовке соединение (5 мг, выход 18%).
1H-ЯМР (CDCl3, 400 МГц): δ 2,28 (с, 3H), 4,03 (с, 3H), 4,06 (с, 3H), 6,09 (с, 1Н), 6,33 (д, J=5,4 Гц, 1Н), 7,17 (д, J=8,8 Гц, 1H), 7,38 (дд, J=2,7, 8,8 Гц, 1H), 7,43 (с, 1Н), 7,61 (с, 1H), 7,73 (д, J=2,7 Гц, 1H), 8,47 (д, J=5,4 Гц, 1H), 8,48 (ушир., 1H)
Масс-спектрометрия (ЭРИ-МС, m/z): 455 (М++1)
Пример 3: N-{4-[(6,7-диметокси-4-хинолил)окси]-3-фторфенил}-N'-(3-изоксазолил)мочевина
4-[(6,7-Диметокси-4-хинолил)окси]-3-фторанилин (800 мг) растворяют в хлороформе (20 мл) и триэтиламине (1,0 мл), получая раствор. Затем к данному раствору добавляют раствор трифосгена (378 мг) в хлороформе и смесь перемешивают при комнатной температуре в течение 10 мин. Затем добавляют 3-аминоизоксазол (252 мг) и далее смесь перемешивают при комнатной температуре в течение ночи. К реакционному раствору добавляют воду со льдом и смесь экстрагируют хлороформом. Органический слой промывают водой, насыщенным соляным раствором и затем сушат над безводным сульфатом натрия. Осушенный органический слой фильтруют и затем концентрируют. К остатку для кристаллизации добавляют эфир. Кристаллическое вещество собирают фильтрованием. Собранное кристаллическое вещество очищают хроматографией (хлороформ:ацетон=2:1). К продукту очистки добавляют 10% раствор хлористого водорода в метаноле, после чего следует концентрирование. Полученное в результате кристаллическое вещество промывают эфиром, получая 554 мг соединения, указанного в заголовке соединения.
1H-ЯМР (ДМСО-d6, 400 МГц): δ 4,05 (3H, с), 4,06 (3H, с), 6,86 (1H, д, J=1,7 Гц), 6,99 (1H, д, J=6,3 Гц), 7,36 (1H, дд, J=1,5 Гц, J=9,0 Гц), 7,55 (1H, т, J=9,0 Гц), 7,62 (1H, с), 7,78 (1H, с), 7,83 (1H, дд, J=2,4 Гц, J=12,9 Гц), 8,77 (1H, д, J=1,5 Гц), 8,85 (1H, д, J=6,6 Гц), 9,77 (1H, с), 9,96 (1H, с)
Масс-спектрометрия (ЭРИ-МС, m/z): 498 (М++1)
Пример 4: N-{2-хлор-4-[(6,7-диметокси-4-хинолил)окси]фенил}-N'-(5-метил-3-изоксазолил)мочевина
2-Хлор-4-[(6,7-диметокси-4-хинолил)окси]анилин (100 мг) растворяют в хлороформе (5 мл) и триэтиламине (0,5 мл), получая раствор. Затем к данному раствору добавляют раствор трифосгена (100 мг) в хлороформе и смесь перемешивают при комнатной температуре в течение 15 мин. Затем добавляют 3-амино-5-метилизоксазол (38 мг) и далее смесь перемешивают при комнатной температуре в течение ночи. К реакционному раствору добавляют дистиллированную воду и смесь разделяют экстракцией хлороформом. Органический слой промывают насыщенным соляным раствором и сушат над сульфатом натрия. Органический слой концентрируют при пониженном давлении и остаток очищают ВЭЖХ с использованием для проявления смеси хлороформ/ацетон, получая 78 мг указанного в заголовке соединения.
1H-ЯМР (CDCl3, 400 МГц): δ 2,42 (3H, с), 4,02 (3H, с), 4,03 (3H, с), 6,00 (1H, ушир.), 6,49 (1H, д, J=5,4 Гц), 7,11 (1H, дд, J=2,7 Гц, J=9,0 Гц), 7,23-7,27 (1H, м), 7,41 (1H, с), 7,49 (1H, с), 8,36 (1H, д, J=9,0 Гц), 8,44 (1H, ушир.с), 8,50 (1H, д, J=5,4 Гц), 9,51 (1H, ушир.с)
Масс-спектрометрия (ЭРИ-МС, m/z): 453, 455 (M+-1)
Пример 5: N-{2-хлор-4-[(6,7-диметокси-4-хинолил)окси]фенил}-N'-(3-метил-5-изоксазолил)мочевина
2-Хлор-4-[(6,7-диметокси-4-хинолил)окси]анилин (100 мг) растворяют в хлороформе (5 мл) и триэтиламине (0,5 мл), получая раствор. Затем к данному раствору добавляют раствор трифосгена (100 мг) в хлороформе и смесь перемешивают при комнатной температуре в течение 15 мин. Затем добавляют 5-амино-3-метилизоксазол (32 мг) и далее смесь перемешивают при комнатной температуре в течение ночи. К реакционному раствору добавляют дистиллированную воду и смесь разделяют экстракцией хлороформом. Органический слой промывают насыщенным соляным раствором и сушат над сульфатом натрия. Органический слой концентрируют при пониженном давлении и остаток очищают ВЭЖХ с использованием для проявления смеси хлороформ/ацетон, получая 53 мг указанного в заголовке соединения.
1H-ЯМР (CDCl3, 400 МГц): δ 8,46 (1H, д, J=5,1 Гц), 8,23 (1H, д, J=8,8 Гц), 7,70 (1H, с), 7,43 (1H, с), 7,37 (1H, с), 7,15 (1H, д, J=2,7 Гц), 7,07-7,11 (1H, м), 6,43 (1H, д, J=5,1 Гц), 5,99 (1H, с), 3,97 (6H, с), 2,22 (3H, с)
Масс-спектрометрия (ЭРИ-МС, m/z): 453 (M+-1)
Пример 6: N-{4-[(6,7-диметокси-4-хинолил)окси]-2-фторфенил}-N'-(3-метил-5-изоксазолил)мочевина
2-Фтор-4-[(6,7-диметокси-4-хинолил)окси]анилин (100 мг) растворяют в хлороформе (5 мл) и триэтиламине (0,5 мл), получая раствор. Затем к данному раствору добавляют раствор трифосгена (100 мг) в хлороформе и смесь перемешивают при комнатной температуре в течение 15 мин. Затем добавляют 5-амино-3-метилизоксазол (37 мг) и далее смесь перемешивают при комнатной температуре в течение ночи. К реакционному раствору добавляют дистиллированную воду и смесь разделяют экстракцией хлороформом. Органический слой промывают насыщенным соляным раствором и сушат над сульфатом натрия. Органический слой концентрируют при пониженном давлении и остаток очищают ВЭЖХ с использованием для проявления смеси хлороформ/ацетон, получая 53 мг указанного в заголовке соединения.
1H-ЯМР (CDCl3, 400 МГц): δ 8,50 (1H, д, J=5,4 Гц), 8,20 (1H, д, д, J=9,0 Гц, J=9,0 Гц), 7,73 (1H, с), 7,49 (1H, с), 7,42 (1H, с), 6,99-7,04 (1H, м), 6,93 (1H, дд, J=2,7 Гц, J=11,2 Гц), 6,50 (1H, д, J=5,4 Гц), 6,05 (1H, с), 4,02 (6H, с), 2,27 (3H, с)
Масс-спектрометрия (ЭРИ-МС, m/z): 437 (M+-1)
Пример 7: N-{4-[(6,7-диметокси-4-хинолил)окси]-3-фторфенил}-N'-(3-метил-5-изоксазолил)мочевина
4-[(6,7-Диметокси-4-хинолил)окси]-3-фторанилин (800 мг) растворяют в хлороформе (20 мл) и триэтиламине (1,0 мл), получая раствор. Затем к данному раствору добавляют раствор трифосгена (378 мг) в хлороформе и смесь перемешивают при комнатной температуре в течение 10 мин. Затем добавляют 5-амино-3-метилизоксазол (294 мг) и далее смесь перемешивают при комнатной температуре в т