Предшественник инсулина, способ его получения и применение
Иллюстрации
Показать всеИзобретение относится к области биотехнологии и может быть использовано в медико-биологической промышленности. Предложены новые полипептиды - предшественники инсулина или его аналогов, характеризующиеся повышенной стабильностью структуры и высоким уровнем экспрессии при получении в виде рекомбинантных форм в дрожжевых клетках. Полипептиды по изобретению отличаются от природной формы предшественника инсулина тем, что содержат укороченный С-пептид, включающий остаток ароматической аминокислоты, и имеют общую формулу: В (1-27)-X2-X3-X1-Y-A (1-21), где Х1-пептидная последовательность из 1-3 аминокислотных остатков, в которой рядом с Y расположен остаток ароматической аминокислоты; Х2-Pro или Asp; Х3-Lys; Y-Lys или Arg; A (1-21) - А-цепь инсулина человека, а В (1-27) - первые 27 аминокислотных остатков В-цепи инсулина человека. Раскрыт способ получения новых предшественников инсулина с помощью технологии рекомбинантных ДНК и последующего преобразования их в активный гормон. 5 с. и 4 з.п. ф-лы, 6 табл., 10 ил.
Реферат
Организмы дрожжей продуцируют ряд белков, которые функционируют вне клетки. Такие белки называют секретируемыми белками. Указанные секретируемые белки сначала экспрессируются внутри клетки в виде предшественника или преформы, содержащей последовательность препептида, обеспечивающего эффективное направление (транслокацию) экспрессированного продукта через мембрану эндоплазматического ретикулума (ЭР). Препептид, обычно называемый сигнальным пептидом, как правило, отщепляется от желаемого продукта в ходе транслокации. После входа в секреторный путь белок транспортируется к аппарату Гольджи. Из аппарата Гольджи белок может следовать разными путями, которые ведут в такие компартменты, как клеточная вакуоль или клеточная мембрана, или он может быть направлен из клетки для секреции во внешнюю среду (Pfeffer et al. (1987) Ann. Rev. Biochem. 56: 829-852).
Инсулин является полипептидным гормоном, секретируемым β-клетками поджелудочной железы, и состоит из двух полипептидных цепей А и В, которые связаны двумя межцепочечными дисульфидными мостиками. Кроме того, особенностью А-цепи является наличие одного внутрицепочечного дисульфидного мостика.
Гормон синтезируется в виде одноцепочечного предшественника проинсулина (препроинсулина), состоящего из препептида длиной 24 аминокислоты, за которым следует проинсулин, содержащий 86 аминокислот в следующем порядке: препептид - В-Arg Arg - С - Lys Arg - А, в котором С означает соединительный пептид из 31 аминокислоты. Arg-Arg и Lys-Агд представляют собой расщепляемые сайты для отщепления соединительного пептида от А- и В-цепей.
Для получения инсулина человека в микроорганизмах использовали три основных способа. В двух способах применяли Escherichia coli либо в случае экспрессии крупного слитого белка в цитоплазме (Frank et al. (1981) in Peptides: Proceedings of the 7th American Peptide Chemistry Symposium (Rich and Gross, eds.), Pierce Chemical Co., Rockford, IL. p.729-739), либо в случае использования сигнального пептида, чтобы обеспечить возможность секреции в периплазматическое пространство (Chan et al. (1981) PNAS 78: 5401-5404). В третьем способе использовали Saccharomyces cerevisiae, чтобы секретировать предшественник инсулина в среду (Thim et al. (1986) PNAS 83: 6766-6770). В предшествующем уровне техники сообщается об ограниченном количестве предшественников инсулина, которые экспрессируются либо в Е. coli, либо в Saccharomyces cerevisiae, смотри патент США 5962267, заявки WO 95/16708, ЕР 0055945, ЕР 0163529, ЕР 0347845 и ЕР 0741188.
Круговой дихроизм (КД) используют для того, чтобы определить стабильность белка и относительные стабильности молекул. КД, наблюдаемый ниже 240 нм, обусловлен амидным хромофором пептида, и его можно использовать для оценки вторичной структуры белка (Johnson (1988) Ann. Rev. Biophys. Chem. 17: 145-166). Спектр инсулина характеризуется минимумами при 220 и 209 нм, отрицательно-положительным переходом вблизи 203 нм и максимумом при 195 нм. При денатурации отрицательная полоса спектра КД в пределах 240-218 нм постепенно уменьшается, что согласуется с потерей упорядоченной вторичной структуры, которая сопутствует разворачиванию белка. Поэтому стабильность укладки предшественника инсулина можно количественно проанализировать, измеряя потерю вторичной структуры как функцию добавленного денатурирующего агента, например гидрохлорида гуанидина (GuHCl) (смотри, например, Расе (1975) CRC Crit. Rev. Biochem. 3: 1-43).
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Особенностью данного изобретения являются новые соединительные пептиды (С-пептиды), которые дают повышенный выход продукции и/или повышенную стабильность молекул предшественников инсулина и молекул аналогов предшественников инсулина при экспрессии в трансформированном микроорганизме, в частности, в дрожжах. Такие предшественники инсулина или аналоги предшественников инсулина затем можно превратить в инсулин или аналоги инсулина в ходе одной или нескольких подходящих, хорошо известных стадий превращения.
Соединительные пептиды согласно данному изобретению содержат, по меньшей мере, один остаток ароматической аминокислоты Phe, Trp или Tyr и, как правило, будут короче, чем природный С-пептид человека, который, включая фланкирующие сайты расщепления из двух основных аминокислот, состоят из 35 аминокислот. Таким образом, новые соединительные пептиды, как правило, будут длиной не более 15 аминокислотных остатков, и предпочтительно не более 9 аминокислотных остатков. Обычно новые соединительные пептиды будут длиной до 7 или до 5 аминокислотных остатков и предпочтительно не более 4 аминокислотных остатков в длину.
Как и в природной молекуле инсулина человека соединительный пептид будет содержать сайт расщепления на его С- и N-конце, обеспечивающий отщепление in vitro соединительного пептида от А- и В-цепей. Такими сайтами расщепления могут быть любые подходящие сайты расщепления, известные в данной области, например Met, отщепляемый бромцианом; отдельный остаток основной аминокислоты или пара остатков основных аминокислот (Lys или Arg), отщепляемые трипсином или трипсиноподобными протеазами; протеазой Acromobactor lyticus или протеазой карбоксипептидазой. Сайт расщепления, обеспечивающий отщепление соединительного пептида от А-цепи, предпочтительно представляет собой единственный остаток основной аминокислоты Lys или Arg, предпочтительно Lys.
Альтернативно отщепление соединительного пептида от В-цепи можно обеспечить посредством расщепления у природного аминокислотного остатка Lys в В-цепи, приводящего к образованию предшественника инсулина desВ30 или аналога предшественника инсулина desВ30. Требуемый аминокислотный остаток В30 затем можно добавить хорошо известными ферментативными способами in vitro.
В одном варианте соединительный пептид не будет содержать двух близлежащих остатков основных аминокислот (Lys, Arg). В указанном варианте отщепление от А-цепи можно осуществить у единственного Lys или Arg, локализованного на N-конце А-цепи, и природного Lys в положении В29 в В-цепи.
Соединительный пептид может содержать более одного остатка ароматической аминокислоты, но предпочтительно не более 5. Остатки ароматических аминокислот могут быть одинаковыми или отличаться друг от друга. Соединительный пептид предпочтительно не будет содержать более 3 остатков ароматических аминокислот и наиболее предпочтительно он будет содержать только единственный остаток ароматической аминокислоты.
В одном варианте данного изобретения один из остатков ароматических аминокислот в соединительном пептиде находится непосредственно у N-конца сайта расщепления, примыкающего к А-цепи. Кроме того, один из остатков ароматических аминокислот предпочтительно будет расположен на расстоянии менее 5 Å, по меньшей мере, от одного из остатков в положениях B11, B12 или В26 в В-цепи. В одном варианте ароматическая аминокислота, расположенная непосредственно у N-конца сайта расщепления, примыкающего к А-цепи, находится на расстоянии менее 5 Å, по меньшей мере, от одного из остатков в положениях В11, В12 или В26 в В-цепи.
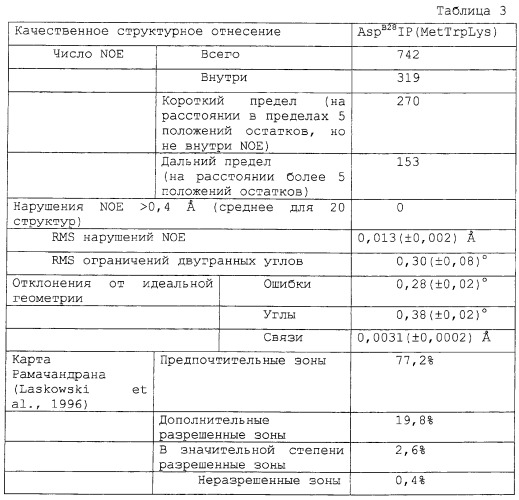
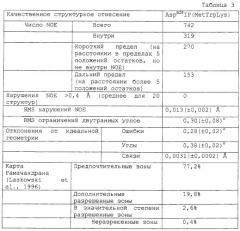
Предшественники инсулина или аналоги предшественников инсулина характеризуются наличием высокой стабильности укладки в растворе. Предшественники согласно данному изобретению будут обладать более высокой стабильностью с более высоким значением Cmid по сравнению с инсулином или аналогами инсулина, которые не содержат остатка ароматической аминокислоты в соединительном пептиде. Стабильность, таким образом, будет выше с Cmid, выше чем примерно 5,5 М GuHCl, обычно выше чем около 6,0 М GuHCl и более типично выше чем около 6,5 М GuHCl.
Соответственно, в одном аспекте данное изобретение относится к предшественникам инсулина или аналогам предшественников инсулина, содержащим соединительный пептид (С-пептид), отщепляемый от А- и В-цепей, при этом указанный соединительный пептид содержит, по меньшей мере, один остаток ароматической аминокислоты и сайт расщепления, обеспечивающий расщепление пептидной связи между А-цепью и соединительным пептидом, где один остаток ароматической аминокислоты расположен непосредственно у N-конца указанного сайта расщепления.
В другом аспекте данное изобретение относится к предшественникам инсулина или аналогам предшественников инсулина, содержащим соединительный пептид (С-пептид), отщепляемый от А- и В-цепей, при этом указанный соединительный пептид содержит до 9 аминокислотных остатков, из которых, по меньшей мере, один является остатком ароматической аминокислоты.
В еще одном аспекте данное изобретение относится к предшественнику инсулина или аналогу предшественника инсулина, содержащему соединительный пептид (С-пептид), отщепляемый от А- и В-цепей, при этом указанный соединительный пептид содержит один остаток ароматической аминокислоты, который расположен на расстоянии менее 5 Å, по меньшей мере, от одного из остатков в положениях B11, B12 или В26 в В-цепи.
В следующем аспекте данное изобретение относится к предшественникам инсулина или аналогам предшественников инсулина, содержащим соединительный пептид (С-пептид), включающий в себя, по меньшей мере, один остаток ароматической аминокислоты и отщепляемый от А- и В-цепей. Указанные предшественники инсулина или аналоги предшественников инсулина обладают повышенной стабильностью с более высоким Cmid по сравнению с предшественником инсулина или аналогами предшественника инсулина, которые не содержат остатка ароматической аминокислоты в соединительном пептиде.
Повышенную активность определяют разными способами, известными специалисту в данной области и описанными ниже. В одном варианте повышенную стабильность измеряют определением посредством КД концентрации гидрохлорида гуанидина (GuHCl), необходимой для достижения половины от максимального разворачивания молекулы предшественника инсулина (Cmid).
В следующем аспекте данное изобретение относится к предшественникам инсулина или аналогам предшественников инсулина, содержащим последовательность формулы:
В (1-27)-X2-X3-X1-Y-A (1-21),
где
X1 представляет собой пептидную последовательность из 1-15 аминокислотных остатков, содержащую один остаток ароматической аминокислоты непосредственно у N-конца Y,
Х2 представляет собой одну из аминокислот Pro, Asp, Lys или Ile в положении 28 В-цепи,
Х3 представляет собой одну из аминокислот Pro, Lys, Ala, Arg или Pro-Thr в положении 29 В-цепи, и
Y является Lys или Arg.
В одном варианте общее количество аминокислотных остатков в X1 будет составлять 1-10, 1-9, 1-8, 1-7, 1-6, 1-5 или 1-4 аминокислотных остатка в длину. В другом конкретном варианте X1 означает 1-3 аминокислотных остатка и предпочтительно 1-2 аминокислотных остатка. Аминокислотным остатком в X1 может быть любой кодируемый аминокислотный остаток, и они могут быть одинаковыми или разными, только при условии, что один является остатком ароматической аминокислоты, расположенным непосредственно у N-конца Y.
В следующем аспекте данное изобретение относится к предшественникам инсулина или аналогам предшественников инсулина, содержащим последовательность формулы:
B(1-27)-X2-X3-X1-Y-A(1-21),
где
X1 представляет собой пептидную последовательность из 1-15 аминокислотных остатков, один из которых является остатком ароматической аминокислоты, который расположен на расстоянии менее 5 Å, по меньшей мере, от одного из аминокислотных остатков в положении В11, В12 или В26 в В-цепи,
Х2 представляет собой одну из аминокислот Pro, Asp, Lys или Ile в положении 28 В-цепи,
Х3 представляет собой одну из аминокислот Pro, Lys, Ala, Arg или Pro-Thr в положении 29 В-цепи, и Y является Lys или Arg.
В одном варианте количество аминокислотных остатков в Xi составляет 1-9, 1-5 или 1-4. В другом варианте количество аминокислотных остатков составляет 1-3 или 1-2.
В другом аспекте данное изобретение относится к предшественникам инсулина или аналогам предшественников инсулина, содержащим последовательность формулы:
B(1-27)-X2-X3-X1-Y-A(1-21),
где
X1 представляет собой пептидную последовательность из 1-8 аминокислотных остатков, по меньшей мере, один из которых является остатком ароматической аминокислоты,
Х2 представляет собой одну из аминокислот Pro, Asp, Lys или Ile в положении 28 В-цепи,
Х3 представляет собой одну из аминокислот Pro, Lys, Ala, Arg или Pro-Thr в положении 29 В-цепи, и
Y является Lys или Arg.
Общее количество аминокислотных остатков в X1 будет составлять 1-7, 1-6, 1-5 или 1-4 аминокислотных остатка. В более конкретном варианте X1 означает 1-3 аминокислотных остатка и предпочтительно 1-2 аминокислотных остатка. Аминокислотным остатком в X1 может быть любой кодируемый аминокислотный остаток, и они могут быть одинаковыми или разными, только при условии, что, по меньшей мере, один аминокислотный остаток в X1 является остатком ароматической аминокислоты.
В указанной выше формуле X1 может содержать до 5 остатков ароматических аминокислот, которые могут быть одинаковыми или разными. В конкретном варианте X1 содержит до 3 остатков ароматических аминокислот, которые могут быть одинаковыми или разными, X1 предпочтительно будет содержать только один остаток ароматической аминокислоты. Остатки ароматических аминокислот представляют собой Trp, Phe или Tyr, предпочтительно Phe или Trp.
В одном варианте Х2 означает Asp, а Х3 означает Lys. Указанный вариант охватывает аналоги предшественников инсулина, содержащие Asp в положении В28 В-цепи (называемые в дальнейшем «AspB28IP»). В другом варианте X2 означает Lys, а Х3 означает Pro. В следующем варианте последовательность X1-Y выбрана из группы: (a) Met-Trp-Lys; (b) Ala-Trp-Lys; (с) Val-Trp-Lys; (d) Ile-Trp-Lys; (e) Leu-Trp-Lys; (f) Glu-Glu-Phe-Lys (SEQ ID NO:15); (g) Glu-Phe-Lys; (h) Glu-Trp-Lys; (i) Ser-Trp-Lys; (j) Thr-Trp-Lys; (k) Arg-Trp-Lys; (1) Glu-Met-Trp-Lys (SEQ ID NO:1); (m) GIn-Met-Trp-Lys (SEQ ID NO:2) и (n) Asp-Trp-Lys.
В другом варианте Х2 означает Pro, а Х3 означает Lys, и X1 означает 1-2 аминокислотных остатка, один из которых является Trp или Phe.
В другом варианте X2 означает Lys, Х3 означает Pro-Thr, и X1 имеет в своем составе до 15 аминокислотных остатков, один из которых является Thr, Туг или Phe. В указанном варианте X1 будет содержать сайт расщепления на С-конце, например, сайт расщепления из одной или двух основных аминокислот (Lys, Arg).
Данное изобретение также относится к полинуклеотидным последовательностям, которые кодируют заявленные предшественники инсулина или аналоги предшественников инсулина. В следующем аспекте данное изобретение относится к векторам, содержащим такие полинуклеотидные последовательности, и к клеткам-хозяевам, содержащим такие полинуклеотидные последовательности или векторы.
В другом аспекте изобретение относится к способу получения предшественников инсулина или аналогов предшественников инсулина в клетке-хозяине, при этом указанный способ включает в себя (i) культивирование клетки-хозяина, содержащей полинуклеотидную последовательность, кодирующую предшественники инсулина или аналоги предшественников инсулина согласно изобретению, в условиях, подходящих для экспрессии указанного предшественника или аналога предшественника; и (ii) выделение предшественника или аналога предшественника из культуральной среды.
В еще одном аспекте изобретение относится к способу получения инсулина или аналогов инсулина в клетке-хозяине, при этом указанный способ включает в себя (i) культивирование клетки-хозяина, содержащей полинуклеотидную последовательность, кодирующую предшественник инсулина или аналоги предшественника инсулина согласно изобретению; (ii) выделение предшественника или аналога предшественника из культуральной среды и (iii) превращение предшественника или аналога предшественника в инсулин или аналог инсулина путем ферментативного превращения in vitro.
В одном варианте данного изобретения клетка-хозяин представляет собой дрожжевую клетку-хозяина, а в следующем варианте дрожжевая клетка-хозяин выбирается из клеток рода Saccharomyces. В следующем варианте дрожжевая клетка-хозяин выбирается из клеток вида Saccharomyces cerevisiae.
КРАТКОЕ ОПИСАНИЕ РИСУНКОВ
На фиг.1 представлена экспрессирующая плазмида рАК721 S. cerevisiae, которая экспрессирует слитый белок лидер LA19-ЕЕАЕАЕАЕРК (SEQ ID NO:3)-IP(AlaAlaLys).
На фиг.2 представлена последовательность ДНК и рассчитанная аминокислотная последовательность кодируемого слитого белка (лидер α-фактора-ЕЕАЕАЕАРК (SEQ ID NO:4)-AspB28IP части плазмиды рАК1150, используемой в качестве матрицы в ПЦР (SEQ ID NO:5 и 6).
На фиг.3 представлена последовательность ДНК, кодирующая слитый белок лидер α-фактора-AspB28IP(GluTrpLys) с синтетическим мини-С-пептидом GluTrpLys, полученным путем рандомизированной оптимизации (SEQ ID NO:7 и 8). Мини-С-пептид (EWK) указан подчеркиванием.
На фиг.4 показана стабильность укладки аналога инсулина AspB28IP(MetTrpLys) по сравнению с AspB28IP.
На фиг.5 показаны структуры AspB28IP(MetTrpLys) в растворе в виде линий основных цепей набора из 20 конвергентных структур.
На фиг.6 показано представление AspB28IP(MetTrpLys) в виде ленты. Фигура получена с использованием MOLSCRIPT (Kraulis (1991) J. Appl. Crystallog. 24: 946-950). Аннотация к остаткам аминокислот дана следующим образом: В1-В29 (В-цепь) пронумерованы 1-29, остатки С1-С3 (соединительный пептид) пронумерованы 30-32 и остатки А1-А21 (А-цепь) пронумерованы 33-53.
Фиг.7 представляет собой идентификационный спектр ЯМР протонов для AspB28IP(MetTrpLys), записанный при 27°С при концентрации 1,0 мМ в 10%/90% D2O/H2O с 10 мМ фосфатным буфером при рН 8,0.
На фиг.8 представлена ДНК и рассчитанная последовательность аминокислот экспрессирующей кассеты, которая экспрессирует слитый белок YAP3-TA39-EEGEPK (SEQ ID NO:11)-AspB28IP с синтетическим мини-С-пептидом GluTrpLys (SEQ ID NO:9 и 10) и
На фиг.9 представлена ДНК и рассчитанная аминокислотная последовательность экспрессирующей кассеты, которая экспрессирует слитый белок YAP3-TA57-EEGEPK (SEQ ID NO:17)-AspB28IP с синтетическим мини-С-пептидом GluTrpLys (SEQ ID NO:11 и 12).
На фиг.10 представлена кривая расщепления предшественника инсулина Aspart - протеазой Achromobacter Cyticus.
ПОДРОБНОЕ ОПИСАНИЕ
Сокращения и номенклатура
Под «соединительным пептидом» или «С-пептидом» подразумевается соединительный фрагмент «С» полипептидной последовательности В-С-А одноцепочечной молекулы, подобной препроинсулину. В частности, в природной цепи инсулина С-пептид связывает положение 30 В-цепи и положение 1 А-цепи. «Мини-С-пептид» или «соединительный пептид», такой как описанные здесь пептиды, связывает В29 или В30 с А1 и отличается по последовательности и длине от природного С-пептида.
Под «IP» подразумевается одноцепочечный предшественник инсулина, в котором dеsВ30-цепь связана с А-цепью инсулина посредством соединительного пептида. Одноцепочечный предшественник инсулина будет содержать правильно расположенные дисульфидные мостики (три), как в инсулине человека.
Термины «dеsВ30» или «В(1-29)» означают В-цепь природного инсулина, в которой отсутствует остаток аминокислоты В30, «А(1-21)» означает А-цепь природного инсулина, «В(1-27)» означает природную В-цепь, в которой отсутствуют аминокислотные остатки В28, В29 и В30; «AspB28IP» означает одноцепочечный предшественник инсулина с аспарагиновой кислотой в положении 28 В-цепи и без С-пептида) (В29 связан с A1). Мини-С-пептид и его аминокислотная последовательность указаны трехбуквенным кодом аминокислот в круглых скобках после IP; таким образом, «AspB28IP(MetTrpLys)» означает одноцепочечный предшественник инсулина с аспарагиновой кислотой в положении 28 В-цепи и мини-С-пептидом с последовательностью Met-Trp-Lys, связывающим В29 с A1.
Термин «предшественник инсулина» означает одноцепочечный полипептид, который в результате одного или нескольких последовательных химических и/или ферментативных процессов можно превратить в инсулин человека.
Термин «аналог предшественника инсулина» означает молекулу предшественника инсулина, имеющую одну или несколько мутаций, замен, делеций и/или присоединений в А- и/или В-аминокислотных цепях, по сравнению с молекулой инсулина человека. Предпочтительны такие аналоги инсулина, в которых один или несколько аминокислотных остатков природного происхождения, предпочтительно один, два или три остатка, были заменены другим кодируемым аминокислотным остатком. В одном варианте данное изобретение включает в себя молекулы аналогов, в которых положение 28 В-цепи изменено по сравнению с природной молекулой инсулина человека. В указанном варианте положение 28 изменено с природного остатка Pro на один из остатков Asp, Lys или Ile. В предпочтительном варианте природный остаток Pro в положении В28 изменен на остаток Asp. В другом варианте Lys в положении В29 заменен на Pro; Asn в положении А21 также может быть изменен на Ala, Gin, Glu, Gly, His, Ile, Leu, Met, Ser, Thr, Trp, Tyr или Val, в частности на Gly, Ala, Ser или Thr и предпочтительно на Gly. Кроме того, Asn в положении В3 может быть изменен на Lys. Следующими примерами аналогов предшественников инсулина являются инсулин человека des(B30), аналоги инсулина, в которых был делегирован PheB1; аналоги инсулина, в которых А-цепь и/или В-цепь имеют N-концевое удлинение, и аналоги инсулина, в которых А-цепь и/или В-цепь имеют удлинение С-конца. Таким образом, к положению В1 могут быть добавлены один или два Arg.
Термин «непосредственно у N-конца» предназначен для иллюстрации ситуации, когда аминокислотный остаток или пептидная последовательность непосредственно связана своим С-концом с N-концом другого аминокислотного остатка или аминокислотной последовательности посредством пептидной связи.
В данном контексте термин «функциональный аналог инсулина» и тому подобное, предназначен для обозначения полипептида со сходным биологическим действием, как и у нативного белка инсулина человека.
Выражение расстояние «короче 5 Å» между двумя аминокислотными остатками означает самое короткое межатомное расстояние менее 5 Å между любым атомом в первой аминокислоте и любым атомом во второй аминокислоте. Атомные расстояния измеряют из трехмерной структуры молекулы, определенной либо посредством ЯМР (Wüthrich, К., 1986, NMR of Proteins and Nucleic Acids, Wiley, New York), либо способом рентгеновской кристаллографии (Drenth, J., 1994, Principles of Protein X-ray crystallography. Springer Verlag Berlin). Расстояние от одной аминокислоты до другой измеряют в виде самого короткого межатомного расстояния между любым атомом в первой аминокислоте и любым атомом во второй аминокислоте, если не оговорено особо.
Особенностью данного изобретения являются новые мини-С-пептиды, связывающие положение 29 В-цепи инсулина и положение 1 А-цепи инсулина, которые существенно увеличивали выход продукции в дрожжевой клетке-хозяине. Под термином «существенно увеличенная продукция», «увеличенный выход ферментации» и тому подобным понимают увеличение секретируемого количества молекулы предшественника инсулина или молекулы аналога предшественника инсулина в надосадке культуры по сравнению с выходом предшественника инсулина или аналога предшественника инсулина, не содержащего остатка ароматической аминокислоты в мини-С-пептиде. «Повышенный» выход ферментации представляет собой абсолютное количество, большее чем в контроле; предпочтительно увеличение представляет собой повышение на 50% или больше, чем уровень (AspB28 IP) в контроле; еще более предпочтительно увеличение представляет собой превышение на 100% или более по сравнению с контрольными уровнями.
Под термином «повышение стабильности» понимают, например, увеличенное значение Cmid в растворе по сравнению со значением, полученным для предшественника аналога инсулина (например. AspB28IP), не содержащего остатка ароматической аминокислоты в мини-С-пептиде. Под термином «Cmid» понимают концентрацию GuHCl, необходимую для развертывания половины популяции белков при анализе, в котором измеряется круговой дихроизм молекулы инсулина в дальнем УФ как функция возрастающих концентраций денатурирующего агента.
«РОТ» означает ген триозофосфатизомеразы Schizosaccharomyces pombe, а «TPI1» означает ген триозофосфатизомеразы S. cerevisiae.
Под «лидером» понимают аминокислотную последовательность, состоящую из препептида (сигнального пептида) и пропептида.
Подразумевается, что термин «сигнальный пептид» означает препептид, который присутствует в виде N-концевой последовательности в форме предшественника белка. Функция сигнального пептида состоит в том, чтобы обеспечить возможность для облегчения транслокации гетерологичного белка в эндоплазматический ретикулум. Сигнальный пептид обычно отщепляется в ходе этого процесса. Сигнальный пептид может быть гетерологичным или гомологичным по отношению к организму дрожжей, продуцирующему белок. Ряд сигнальных пептидов, которые можно использовать с конструкцией ДНК согласно изобретению, включает сигнальный пептид аспарагиновой протеазы 3 дрожжей (YАР3) или любой функциональный аналог (Egel-Mitani et al. (1990) YEAST 6: 127-137 и патент США 5726038) и сигнал α-фактора гена MFα1 (Thorner (1981) in The Molecular Biology of the Yeast Saccharomyces cerevisiae, Strathern et al., eds., p.143-180, Cold Spring Harbor Laboratory, NY и патент США 487000.
Термин «пропептид» означает полипептидную последовательность, функция которой состоит в обеспечении того, чтобы экспрессированный полипептид был направлен из эндоплазматического ретикулума в аппарат Гольджи и далее в секретируемую везикулу для секреции в культуральную среду (т.е. экспорта полипептида через клеточную стенку или, по меньшей мере, через клеточную мембрану в периплазматическое пространство дрожжевой клетки). Пропептидом может быть пропептид α-фактора дрожжей, смотри патенты США 4546082 и 4870008. Альтернативно, пропептидом может быть синтетический пропептид, что говорит о том, что пропептид не встречается в природе. Подходящими синтетическими пропептидами являются пропептиды, заявленные в патентах США 5395922; 5795746; 5162498 и заявке WO 98/32867. Пропептид предпочтительно будет содержать сайт процессинга эндопептидазой на С-конце, такой как последовательность Lys-Arg или любой его функциональный аналог.
Полинуклеотидную последовательность согласно изобретению можно получить синтетически стандартными принятыми способами, например, фосфоамидитным способом, описанным Beaucage et al. (1981) Tetrahedron Letters 22: 1859-1869, или способом, описанным Matthes et al. (1984) EMBO Journal 3: 801-805.
Согласно фосфоамидитному способу олигонуклеотиды синтезируют, например, в автоматическом синтезаторе ДНК, очищают, образуют дуплексы и лигируют, чтобы образовать синтетическую конструкцию ДНК. Предпочтительным в настоящее время способом получения ДНК-конструкции является полимеразная цепная реакция (ПЦР).
Полинуклеотидная последовательность согласно изобретению также может происходить из смешанной геномной, кДНК или синтетической ДНК. Например, последовательность геномной или кДНК, кодирующую лидерный пептид, можно соединить с последовательностью геномной ДНК или кДНК, кодирующей А- и В-цепи, после чего последовательность ДНК можно модифицировать в сайте встраиванием синтетических олигонуклеотидов, кодирующих желаемую аминокислотную последовательность для гомологичной рекомбинации, в соответствии с хорошо известными способами, или предпочтительно созданием желаемой последовательности с помощью ПЦР, используя подходящие олигонуклеотиды.
Изобретение включает в себя вектор, который способен к репликации в выбранном микроорганизме или клетке-хозяине и который несет полинуклеотидную последовательность, кодирующую предшественники инсулина или аналоги предшественников инсулина согласно изобретению. Рекомбинантный вектор может быть автономно реплицируюшимся вектором, т.е. вектором, который существует как внехромосомная единица, репликация которой не зависит от репликации хромосом, например, плазмидой, в не хромосомным элементом, минихромосомой или искусственной хромосомой. Вектор может содержать любые средства для обеспечения автономной репликации. В альтернативном случае вектором может быть вектор, который при введении в клетку-хозяина интегрируется в геном и реплицируется вместе с хромосомой(ами), в которую он был интегрирован. Кроме того, можно использовать отдельный вектор или плазмиду, или два или несколько векторов или плазмид, которые вместе содержат полную ДНК, которую необходимо ввести в геном клетки-хозяина, или транспозон. Векторы могут быть линейными или замкнутыми кольцевыми плазмидами, и предпочтительно будут содержать элемент(ты), который делает возможной стабильную интеграцию вектора в геном клетки-хозяина или автономную репликацию вектора в клетке независимо от генома.
В предпочтительном варианте рекомбинантный экспрессирующий вектор способен реплицироваться в организме дрожжей. Примерами последовательностей, которые дают возможность вектору реплицироваться в дрожжах, являются гены репликации 2 мкм-плазмиды дрожжей REP 1-3 и начало репликации.
Векторы согласно данному изобретению предпочтительно содержат один или несколько селектируемых маркеров, которые обеспечивают простую селекцию трансформированных клеток. Селектируемый маркер представляет собой ген, продукт которого обеспечивает биоцидную или вирусную резистентность, резистентность к тяжелым металлам, прототрофность ауксотрофам и тому подобное. Примерами бактериальных селектируемых маркеров являются гены dal Bacillus subtilis или Bacillus licheniformis, или маркеры, которые придают устойчивость к антибиотикам, такую как устойчивость к ампициллину, канамицину, хлорамфениколу или тетрациклину. Селектируемые маркеры для применения в клетке-хозяине нитчатых грибов включают amdS (ацетамидаза), argB (орнитинкарбамоилтрансфераза), pyrG (оротидин-5'-фосфатдекарбоксилаза) и trpC (антранилатсинтаза). Подходящими маркерами для дрожжевых клеток-хозяев являются ADE2, HIS3, LEU2, LYS2, МЕТ3, TRP1 и URA3. Предпочтительным селектируемым маркером для дрожжей является ген TPI Schizosaccharomyces pombe (Russell (1985) Gene 40: 125-130).
В векторе полинуклеотидная последовательность оперативно связана с подходящей последовательностью промотора. Промотор может быть любой последовательностью нуклеиновой кислоты, которая проявляет транскрипционную активность в клетке-хозяине, выбранной из мутантных, укороченных или гибридных промоторов, и может быть получен из генов, кодирующих внеклеточные или внутриклеточные полипептиды либо гомологичные, либо гетерологичные по отношению к клетке-хозяину.
Примерами подходящих промоторов для управления транскрипцией в бактериальной клетке-хозяине являются промоторы, полученные из lac-оперона Е coli, гена агаразы Streptomyces coelicolor (dagA), гена левансахаразы Bacillus subtilis (sacB), гена альфа-амилазы Bacillus licheniformis (amyL), гена мальтогенной амилазы Bacillus stearothermophilus (amyM), гена альфа-амилазы Bacillus amyloliquefaciens (amyQ) и гена пенициллиназы Bacillus licheniformis (penP). Примерами подходящих промоторов для управления транскрипцией в клетке-хозяине нитчатых грибов являются промоторы, полученные из генов амилазы Aspergillus oryzae ТАКА, аспарагиновой протеиназы Rhizomucor miehei, нейтральной альфа-амилазы Aspergillus niger и устойчивой к кислотам альфа-амилазы Aspergillus niger. В дрожжевой клетке-хозяине пригодными промоторами являются промоторы Mal, TPI, ADH или PGK Saccharomyces cerevisiae.
Полинуклеотидная конструкция согласно изобретению также, как правило, будет оперативно связана с подходящим терминатором. У дрожжей подходящим терминатором является терминатор TPI (Alber et al. (1982) J. Mol. Appl. Genet. 1: 419-434).
Способы, используемые для того, чтобы лигировать соответственно полинуклеотидную последовательность согласно изобретению, промотор и терминатор, и чтобы встроить их в подходящие дрожжевые векторы, содержащие информацию, необходимую для репликации у дрожжей, хорошо известны специалистам в данной области. Будет понятно, что вектор можно сконструировать либо путем получения сначала конструкции ДНК, содержащей полную последовательность ДНК, кодирующую предшественники инсулина или аналоги предшественников инсулина согласно изобретению, и затем встраиванием этого фрагмента в подходящий экспрессирующий вектор, или посредством последовательного встраивания фрагментов ДНК, содержащих генетическую информацию для отдельных элементов (таких как сигнал, пропептид, мини-С-пептид, А- и В-цепи) с последующим лигированием.
Данное изобретение также относится к рекомбинантным клеткам-хозяевам, содержащим полинуклеотидную последовательность, кодирующую предшественники инсулина или аналоги предшественников инсулина согласно изобретению. Вектор, содержащий такую полинуклеотидную последовательность, вводят в клетку-хозяина, так что вектор сохраняется в виде хромосомного компонента или в виде автономно реплицирующегося внехромосомного вектора, как описано ранее. Термин «клетка-хозяин» охватывает любое потомство родительской клетки, которое не идентично родительской клетке вследствие мутаций, которые происходят во время репликации. Выбор клетки-хозяина будет в большой степени зависеть от гена, кодирующего полипептид, и его источника. Клеткой-хозяином может быть одноклеточный микроорганизм, например, прокариот, или не одноклеточный микроорганизм, например, эукариот. Пригодными клетками одноклеточных являются бактериальные клетки, такие как грамположительные бактерии, включая, но не ограничивая указанным, клетку Bacillus, клетку Streptomyces, или грамотрицательные бактерии, такие как Е. coli и Pseudomonas sp. Эукариотические клетки могут быть клетками млекопитающих, насекомых, растений или грибов. В предпочтительном варианте клеткой-хозяином является дрожжевая клетка. Дрожжевым организмом, используемым в способе согласно изобретению, может быть любой подходящий организм дрожжей, который при культивировании продуцирует большие количества предшественника инсулина и аналогов предшественников инсулина согласно изобретению. Примерами подходящих организмов дрожжей являются штаммы, выбранные из видов дрожжей Saccharomyces cerevisiae, Saccharomyces kluyveri, Schizosaccharomyces pombe, Saccharomyces uvarum, Kluyveromyces lactis, Hansenula polymorpha, Pichia pastoris, Pichia methanolica, Pichia kluyveri, Yarrowia lipolytica, Candida sp., Candida utilis, Candida cacaoi, Geotrichum sp. и Geotrichum fermentans.
Трансформацию дрожжевых клеток можно, например, осуществить путем образования протопластов с последующей трансформацией по существу известным способом. Средой, используемой для культивирования клеток, может быть любая обычная среда, подходящая для роста организмов дрожжей. Секретированный предшественник инсулина или аналоги предшественника инсулина согласно изобретению, значительная часть которых будет присутствовать в среде в правильно процессированной форме, можно извлечь из среды традиционными способами, включая отделение дрожжевых клеток от среды центрифугированием, фильтрацией или улавливанием предшественника инсулина или аналога предшественника инсулина с помощью ионообменного матрикса или адсорбирующего матрикса обращенной фазы, осаждением белковых компонентов надосадка или фильтрата с помощью соли, например сульфата аммония, с последующей очисткой разными хроматографическими способами, например ионообменной хроматографией, аффинной хроматографией и тому подобного.
Предшественники инсулина или аналоги предшественников инсулина согласно изобретению могут быть экспрессированы с удлиненным аминокислотными остатками N-концом, как описано в патенте США 5395922 и Европейском патенте 765395А, оба этих патента специально включены здесь в виде ссылки. Обнаружено, что во время ферментации удлинение стабильно связано с предшественником инсулина или аналогами предшественника инсулина согласно изобретению, защищая N-конец предшественника инсулина или аналога предшественника инсулина от протеолитической активности дрожжевых протеаз, таких как DPAP. Присутствие удлинения N-конца в предшественнике инсулина или аналоге предшественника инсулина также может служить в качестве защиты N-концевой аминогруппы в ходе химической обработки белка, т.е. может служить как заместитель ВОС (трет-бутилоксикарбонила) или сходной защитной группы. N-концевое удлинение можно удалить из выделенного предшественника инсулина или аналога предшественника инсулина с помощью протеолитического фермента, который специфичен в отношении основной аминокислоты (например, Lys), так что концевое удлинение отщепляется у остатка Lys. Примерами таких протеолитических ферментов являются трипсин или протеаза Achromobacter lyticus.
После секреции в культуральную среду и выделения предшественник инсулина или аналоги предшественника инсулина согласно изобретению будут подвергнуты различным процедурам in vitro, чтобы удалить возможную последовательность удлинения N-конца и мини-С-пептид, чтобы получить инсулин или же