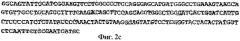Нуклеотидные последовательности, участвующие в увеличении или уменьшении скорости овуляции у млекопитающих
Иллюстрации
Показать всеИзобретение относится к нуклеотидной последовательности, участвующей в увеличении или уменьшении скорости овуляции у млекопитающих, а именно GDF-9B. Предложена мутированная молекула GDF-9B которая используется для модулирования скорости овуляции у млекопитающего женского пола. Предложены также различные способы модулирования скорости овуляции, а также композиции для осуществления таких способов. Изобретение может быть использовано для индуцирования стерильности или пониженной плодовитости млекопитающих женского пола. 12 н. и 18 з.п. ф-лы, 14 ил., 6 табл.
Реферат
Данное изобретение относится к нуклеотидным последовательностям, которые участвуют в увеличении или уменьшение скорости овуляции у млекопитающих.
В частности, изобретение, в общем, касается новых мутаций в гене, который участвует в увеличении скорости овуляции у гетерозиготных особей женского пола млекопитающих; указанные мутации вызывают стерильность гомозиготных особей женского пола млекопитающих. Знание мутантной генной последовательности можно использовать в тесте по идентификации гетерозиготных или гомозиготных млекопитающих женского и мужского пола, несущих мутантный ген. Указанные сведения о биологической функции гена и его мутациях можно также использовать для того, чтобы увеличить или уменьшить скорость овуляции у особей женского пола млекопитающих, или для того, чтобы индуцировать стерильность или пониженную плодовитость млекопитающих женского пола.
ПРЕДПОСЫЛКА ИЗОБРЕТЕНИЯ
Все ссылки, включая любые патенты или патентные заявки, цитированные в данном описании, включены здесь в виде ссылки. Не делается допущения, что любая ссылка составляет предшествующий уровень техники. При обсуждении ссылок констатируется то, о чем утверждают их авторы, и заявители сохраняют право высказать сомнение в точности и релевантности цитированных документов. Будет совершенно понятно, что хотя здесь приведены ссылки на ряд публикаций предшествующего уровня техники, данное упоминание не является признанием того, что любой из указанных документов составляет часть основных общепринятых знаний в данной области в Новой Зеландии или какой-либо другой стране.
Ген высокой плодовитости Inverdale (FecXI) является основным геном плодовитости у овец, который впервые идентифицировали в отаре Ромни (Inverdale), состоящем из потомков овцы Ромни (А281), все из которых единообразно имели высокий по численности приплод. Исследования по расщеплению генов показали, что ген несет Х-хромосома (Davis et al., 1991). Одна копия гена у гетерозиготных овец I+ увеличивает скорость овуляции примерно на одну дополнительную яйцеклетку, и численность приплода примерно на 0,6 ягнят на окот овцы. Однако гомозиготные овцы II, несущие две копии гена, имеют небольшие нефункциональные яичники и являются бесплодными (Davis et al., 1992). Исследования эмбрионов овец I+ и II показали, что развитие яичников является нормальным примерно до 100 дня эмбриональной жизни: развитие эмбриональных клеток, формирование фолликулов яичника и самые ранние стадии роста фолликулов являются нормальными. Однако у эмбрионов II после 100 дня эмбриональной жизни нарушается развитие фолликулов после первичной стадии роста, и не обнаруживаются нормальные вторичные фолликулы (Smith et al., 1997). Между тем, как ооциты у животных II увеличиваются в диаметре (>40 мкм), нет данных о пролиферации зернистых клеток, в отличие от пролиферации, которая наблюдалась бы в норме (Braw-Tal et al., 1993; McNatty et al., 1995a; Smith et al., 1997). Таким образом, наличие инфантильных нефункциональных яичников у эмбрионов, новорожденных и взрослых животных II является следствием блокирования развития фолликулов после первичной стадии роста.
Также показано, что вторая плодовитая отара Ромни (Hanna, 1995), для которой известно родство с отарой Inverdale, несет Х-сцепленную мутацию с фенотипом, подобным Inverdale. Подтверждение того, что животные Hanna несли мутацию (FecXH) в гене Inverdale, получили, когда при скрещивании барана носителя Inverdale с овцами носительницами Hanna получили гомозиготных стерильных самок (Davis et al., 1995). Указанную линию Hanna содержали в Invermay в виде отдельной группы бок о бок с исходной линией Inverdale.
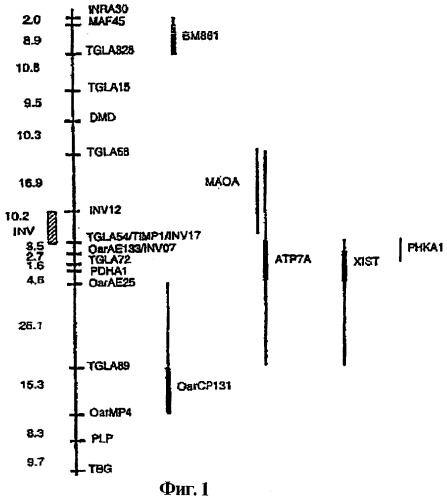
В качестве части поиска гена, ответственного за признак Inverdale, авторы изобретения сконструировали карту генетического сцепления Х-хромосомы овцы (Galloway et al., 1996), и локализовали ген Inverdale в районе 10 сМ, фланкированном минисателлитными маркерами (Galloway et al., 1999). Локализация гена в Х-хромосоме овец сузила поиск кандидатов на те гены, которые картированы в других Х-хромосомах млекопитающих, поскольку, почти без исключения, гены, присутствующие в Х-хромосоме одного млекопитающего, также присутствуют в Х-хромосомах других видов млекопитающих (Ohno, 1973).
Наследование гена Inverdale по Х-хромосоме предоставляет удобный способ получения плодовитых овец - носителей одной копии Inverdale, поскольку все дочери барана носителя Inverdale будут наследовать ген. Специалист по разведению баранов использует генетический маркер для того, чтобы идентифицировать баранов-носителей для продажи, а коммерческие специалисты по разведению покупают этих баранов, чтобы получить плодовитых овец, которых затем спаривают с конечным производителем с получением потомства для забоя. Показано, что коммерческое использование гена Inverdale является высоко прибыльным в существующей системе конечного спаривания с добавленной стоимостью, равной 1760$ на одного купленного барана Inverdale, по сравнению с обычным бараном (Amer et al., 1998). Для получения элитных баранов-производителей, несущих ген, необходимо различать не носителей (самок ++ или самцов +Y) и носителей одной копии (самок I+ или самцов IY).
Тест с генетическим маркером разработали на основе наследования фланкирующих минисателлитных маркеров вокруг гена (т.е. тест на гаплотип) (Galloway et al., 1999); он показан на фигуре 1. Однако в данном тесте можно только идентифицировать тех животных, которые унаследовали гаплотип Inverdale от известного носителя, и не является точным на 100%, так как в тесте не выявляется ген Inverdale как таковой. Гаплотип из того же самого района Х-хромосомы овцы родословной Hanna, которая несет неродственный вариант Inverdale, отличался от гаплотипа, наблюдаемого в потомстве А281.
В 1996 году показали, что фактор роста и дифференцировки 9 (GDF-9), член суперсемейства трансформирующего фактора роста бета (TGF-β), специфично экспрессируется в ооците взрослой мыши, где он необходим для фолликулогенеза (Dong et al., 1996). Матричная РНК GDF-9 синтезируется только в ооците, начиная со стадии примордиального/первичного однослойного фолликула вплоть до периода после овуляции, и самки мышей, нокаутированных по GDF-9, стерильны вследствие блокирования развития фолликулов на этой стадии первичного однослойного фолликула. Животные, гомозиготные по гену Inverdale, стерильны с фенотипом, подобным фенотипу мыши, нокаутированной по GDF-9 (McNatty et al., 1995b). Затем GDF-9 картировали на хромосоме 5 овцы, и поэтому ген не может быть ответственным за фенотип Inverdale (Sadighi et al., 1998).
Второй родственный член семейства, GDF-9B, также называемый ВМР15, идентифицировали в яичниках мыши и человека, и обнаружили, что он совместно экспрессируется с GDF-9 (Laitinen et al., 1998; Dube et al., 1998). ВМР15 картировали у мышей на Х-хромосоме, вблизи Fsc1 (Dube et al., 1998). Fsc1 (компонент фиброзной оболочки) также известен как Akap4 (белок 4 якоря киназы А), который был картирован на Х-хромосоме мыши на расстоянии 1,6 сМ от центромеры (база данных генома мыши (MGD), октябрь 1999) и в полосе р11,2 Х-хромосомы человека (Dube et al., 1998). Предварительные исследования овцы Inverdale (генотипов ++, I+ и II) с использованием молекулярного зонда, который не делает различий между генотипами, показывают, что мРНК GDF-9B экспрессируется в ооцитах первичных, но не примордиальных фолликулов, и что экспрессия указанной мРНК в яичнике ограничена ооцитами (Galloway et al., 2000).
Члены суперсемейства TGF-β имеют сходные структуры генов. Район, кодирующий GDF-9B, находится в пределах двух экзонов, разделенных интроном длиной 4,2 т.п.н (человек) и 3,5 т.п.н. (мышь) (Dube et al., 1998). У людей полноразмерная кодирующая последовательность из 1176 п.н. продуцирует препропептид из 392 аминокислот, из которых первые 17 аминокислот соответствуют секреторному сигналу. Полноразмерный препропептид человека и мыши содержит сайт процессинга для протеолитического расщепления с высвобождением зрелого активного С-концевого пептида из 125 аминокислот и N-концевого продукта пропептида (Laitinen et al., 1998; Dube et al., 1998). Последовательность интрона находится в домене пропептида, так что полный зрелый кодирующий район обнаруживается в экзоне 2.
Последовательность гена ВМР15 (GDF-9B) человека дикого типа описана в патентах США 5728679 и 5635372. Белок дикого типа описан как пригодный для лечения дефектов кости и хряща и/или других соединительных тканей, и в заживлении ран и репарации тканей.
Авторы изобретения в настоящее время идентифицировали мутантную форму гена GDF-9B овцы у овец, экспрессирующих фенотип Inverdale или Hanna, и впервые обнаружили, что данная мутантная форма GDF-9B ответственна за повышенную овуляцию, наблюдаемую у данных овец, и за стерильность, наблюдаемую у гомозиготных овец.
Данное изобретение, в общем, направлено на мутантную последовательность и соответствующий кодируемый белок.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Таким образом, в первом аспекте данное изобретение относится к выделенной мутантной молекуле нуклеиновой кислоты GDF-9B, содержащей нуклеотидную последовательность, выбранную из группы, состоящей из:
а) SEQ ID NO:1, SEQ ID NO:3, SEQ ID NO:5 или SEQ ID NO:7;
b) последовательности, способной гибридизоваться в жестких условиях с молекулой(ами) по (а);
с) последовательности, которая является функциональным вариантом или фрагментом молекулы(ул), определенной в (а);
d) последовательности, комплементарной молекуле(ам), определенной в (а), (b) или (с); и
e) антисмысловой последовательности, соответствующей любой из молекул(ы) по (а) - (d).
Молекула нуклеиновой кислоты может представлять собой молекулу РНК, кРНК, геномной ДНК или кДНК и может быть одно- или двуцепочечной. Молекула нуклеиновой кислоты также необязательно может включать одно или более синтетических неприродных или измененных нуклеотидных оснований, или их комбинацию.
Данное изобретение, кроме того, относится к способу идентификации млекопитающего, который несет мутантную молекулу нуклеиновой кислоты GDF-9B, при этом указанный способ включает следующие стадии:
(i) получение образца ткани или крови от млекопитающего;
(ii) выделение ДНК из образца;
(iii) необязательно выделение ДНК GDF-9B из ДНК, полученной на стадии (i);
(iv) необязательно исследование ДНК с помощью зонда, комплементарного мутантной ДНК GDF-9B согласно изобретению;
(v) необязательно амплификацию количества мутантной ДНК GDF-9B и
(vi) определение того, несет ли последовательность ДНК GDF-9B, полученная на стадии (ii), мутацию, связанную со стерильностью или с увеличением или снижением овуляции.
Предпочтительно стадию амплификации (v) можно выполнить любым традиционным способом, таким как полимеразная цепная реакция или лигазная цепная реакция.
Согласно еще одному аспекту данное изобретение относится к генетическому маркеру для связанной с ДНК селекции в отношении повышенной овуляции или стерильности у млекопитающего, содержащему молекулу нуклеиновой кислоты, которая специфично гибридизуется с нуклеотидной последовательностью согласно первому аспекту изобретения, или с геномной ДНК, включающей или связанной с мутантной молекулой нуклеиновой кислоты GDF-9B.
Млекопитающее может быть мужского или женского пола и может быть человеком, или домашним, проживающим вместе с человеком, зоопарковым или диким млекопитающим. Предпочтительно млекопитающее выбрано из людей, овец, крупного рогатого скота, коз, оленей, лошадей, верблюдов, опоссумов, свиней, мышей, крыс, ласок, кроликов, зайцев, хорьков, кошек и собак.
В следующем аспекте данное изобретение относится к выделенному полипептиду, кодируемому молекулой нуклеиновой кислоты, имеющей последовательность, представленную выше в (а)-(d). Предпочтительно полипептид имеет аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:2, SEQ ID NO:4, SEQ ID NO:6 и SEQ ID NO:8, или ее функциональный вариант или фрагмент.
Еще в одном аспекте изобретение относится к выделенному полипептиду, имеющему аминокислотную последовательность, включающую SEQ ID NO:10, или его функциональному варианту или фрагменту.
В дополнительном аспекте изобретение относится к выделенной молекуле нуклеиновой кислоты, имеющей нуклеотидную последовательность, включающую SEQ I NO:9, или ее функциональному фрагменту или варианту.
В еще одном аспекте изобретение относится к выделенной молекуле нуклеиновой кислоты, которая кодирует полипептид, по существу такой, как описано выше.
В следующем аспекте изобретение относится к способу модулирования скорости овуляции у млекопитающего женского пола, при этом указанный способ включает стадию введения указанному млекопитающему эффективного количества мутантного полипептида GDF-9B, полипептида GDF-9B дикого типа или функционального фрагмента или варианта каждого из них.
Изобретение также относится к способу увеличения скорости овуляции у млекопитающего женского пола, который не несет мутантной молекулы нуклеиновой кислоты GDF-9B, включающему стадию введения указанному млекопитающему эффективного количества мутантного полипептида GDF-9B или его функционального варианта или фрагмента.
Кроме того, изобретение также относится к способу увеличения скорости овуляции у стерильной особи женского пола млекопитающего, которая несет две копии мутантной молекулы нуклеиновой кислоты GDF-9B, включающему стадию введения указанному млекопитающему эффективного количества полипептида GDF-9B дикого типа.
В еще одном аспекте изобретение относится к способу увеличения или уменьшения скорости овуляции или индукции стерильности у особи женского пола млекопитающего, включающему стадию введения эффективного количества агента, выбранного из группы, состоящей из:
а) эффективно иммунизирующего количества полипептида GDF-9B дикого или мутантного типа, или его функционального фрагмента или варианта;
b) антисмысловой молекулы нуклеиновой кислоты, направленной против ДНК, кодирующей полипептид GDF-9B дикого или мутантного типа или его функциональный фрагмент или вариант;
с) лиганда, который связывается с или является антигеном к полипептиду GDF-9B дикого или мутантного типа, или его функциональному фрагменту или варианту;
чтобы таким образом ингибировать биологическую активность полипептида GDF-9B мутантного или дикого типа.
В еще одном аспекте изобретение относится к композиции, содержащей эффективное количество мутантного полипептида GDF-9B или его функционального фрагмента или варианта, вместе с фармацевтически или ветеринарно приемлемым носителем или разбавителем.
В еще одном аспекте изобретение относится к композиции, содержащей эффективное количество агента, выбранного из группы, состоящей из:
а) мутантного полипептида GDF-9B согласно изобретению;
b) полипептида GDF-9B дикого типа согласно изобретению;
с) антисмысловой молекулы нуклеиновой кислоты, направленной против полипептида GDF-9B дикого или мутантного типа согласно изобретению;
d) лиганда, который связывается с или является антигеном к полипептиду GDF-9B дикого или мутантного типа согласно изобретению;
вместе с фармацевтически или ветеринарно приемлемым носителем или разбавителем.
Согласно еще одному аспекту изобретение относится к конструкции или вектору, содержащему молекулу нуклеиновой кислоты по существу такую, как описано выше.
Данное изобретение также относится к клетке-хозяину, трансформированной вектором или конструкцией, содержащей молекулу нуклеиновой кислоты согласно изобретению.
Согласно следующему аспекту изобретение относится к выделенной молекуле нуклеиновой кислоты, содержащей нуклеотидную последовательность, выбранную из группы, состоящей из SEQ ID NO:12 или SEQ ID NO:14, или ее функционально активному фрагменту или варианту.
Изобретение также относится к выделенному полипептиду, содержащему аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:13 и SEQ ID NO:15.
В еще одном аспекте изобретение относится к выделенному функционально активному варианту полипептида, который представлен в SEQ ID NO:11.
Согласно следующему аспекту данного изобретения представлена выделенная молекула нуклеиновой кислоты, содержащая последовательность нуклеиновой кислоты, которая представлена в SEQ ID NO:16.
Данное изобретение также относится к выделенному полипептиду, содержащему аминокислотную последовательность, которая представлена в SEQ ID NO:17.
Изобретение также охватывает способ уменьшения скорости овуляции или индукции стерильности у опоссума, который включает стадию введения эффективного количества полипептида, имеющего аминокислотную последовательность, которая представлена в SEQ ID NO:17, или его функционального варианта или фрагмента.
Несмотря на то, что изобретение в общих чертах определено выше, специалистам в данной области будет понятно, что оно этим не ограничено, и что изобретение также включает предпочтительные варианты, которые приведены ниже в виде примеров.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
В частности, предпочтительные аспекты изобретения будут описаны в связи с сопровождающими чертежами, где:
На фигуре 1 показана карта генетического сцепления Х-хромосомы овцы. Генетические расстояния даны в сантиморганах (сМ) по Kosamabi. Ген Inverdale картирован в районе, указанном заштрихованным столбиком.
На фигуре 2а показана нуклеотидная последовательность экзона 2 GDF-9B овцы Inverdale. Положение замены нуклеотида Т на А в Inverdale (на расстоянии 92 нуклеотидов от сайта процессинга) указано жирным шрифтом. Триплетный кодон, затронутый данной заменой, подчеркнут. Сайт процессинга для протеолитического отщепления пропептида от зрелого фрагмента и стоп-кодон TGA обведены рамкой. Кодирующая последовательность зрелого пептида находится между двумя рамками.
На фигуре 2b показана нуклеотидная последовательность экзона 2 GDF-9B у овец Hanna. Положение замены нуклеотида C на T в Hanna (на расстоянии 67 нуклеотидов от сайта процессинга) указано жирным шрифтом. Триплетный кодон, затронутый данной заменой, подчеркнут. Сайт процессинга для протеолитического отщепления пропептида от зрелого фрагмента и стоп-кодон TGA обведены рамкой. Кодирующая последовательность зрелого пептида находится между двумя рамками.
На фигуре 2с показана нуклеотидная последовательность 394-599 п.н. фигуры 2а.
На фигуре 2d показана нуклеотидная последовательность 394-599 п.н. фигуры 2b.
На фигуре 2e показана нуклеотидная последовательность 472-486 п.н. фигуры 2а.
На фигуре 2f показана нуклеотидная последовательность 448-462 п.н. фигуры 2b.
На фигуре 3а показана выведенная аминокислотная последовательность белка GDF-9B Inverdale, кодируемого нуклеотидной последовательностью, изображенной на фигуре 2а. Зрелый GDF-9B показан обычным шрифтом, а часть пропептида показана курсивом. Аминокислота (аспарагиновая кислота, D), получаемая заменой основания в Inverdale, отмечена жирным шрифтом.
На фигуре 3b показана выведенная аминокислотная последовательность укороченного белка GDF-9B Hanna, кодируемого нуклеотидной последовательностью, изображенной на фигуре 2b. Зрелый пептид GDF-9B показан обычным шрифтом, а часть пропептида показана курсивом. Аминокислота дикого типа (глутамин, Q) превращается в стоп-кодон (END) у мутанта Hanna.
На фигуре 4 показано сравнение выведенной аминокислотной последовательности GDF-9B овцы с белком человека и мыши. Номера в скобках выше линии указывают положения аминокислот зрелого пептида. Незаштрихованный треугольник показывает положение полиморфизма по Leu, а темный треугольник показывает положение единственного интрона. Предполагаемый сайт процессинга RRAR и консервативные цистеины заштрихованы серым. Положения мутаций FecXI и FecXH в положениях аминокислот 23 и 31 указаны жирным шрифтом.
На фигуре 5 показана хроматограмма последовательности GDF-9B овец Inverdale, Hanna и дикого типа, показывающая район, где происходят мутации.
На фигуре 6 показано сопоставление мутантного района предсказанного белка FecXI с членами суперсемейства TGFβ других видов.
На фигуре 7 показана карта сцепления района Х-хромосомы овцы, содержащего ген GDF9-B.
На фигуре 8 показаны результаты анализа выявления варианта SNP у овец, несущих мутацию FecXI Inverdale, и не носителей, с использованием расщепления XbaI искусственного фрагмента ПЦР. Расщепляются ДНК носителей, содержащих аллель А. Расщепленные фрагменты не носителей ++, гетерозиготных I+ и гомозиготных II носителей показаны в сравнении с фрагментами от гетерозиготных самок (образцы А1, А2), баранов-носителей (образцы А5, А10) и баранов - не носителей (образцы А3, А4, А6, А7, А8, А11, А12 и А13).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Впервые показано, что мутации в гене GDF-9B у овец Inverdale и Hanna ответственны за повышение скорости овуляции у гетерозиготных животных и за стерильность у гомозиготных животных.
В целях описания будет вполне понятно, что слово «включающий» означает «содержащий, но не ограниченный этим», и что слово «включает» имеет соответствующее значение.
Термин «выделенный» означает в значительной степени отделенный или очищенный от загрязняющих последовательностей в клетке или организме, из которого нуклеиновая кислота происходит в естественных условиях, и включает нуклеиновые кислоты, очищенные стандартными способами очистки, а также нуклеиновые кислоты, полученные посредством рекомбинантной технологии, включая способ ПЦР, и нуклеиновые кислоты, которые были синтезированы. Предпочтительно молекулу нуклеиновой кислоты выделяют из геномной ДНК овцы, экспрессирующей фенотип Inverdale или Hanna.
Термин «модулирование овуляции» означает увеличение или уменьшение скорости овуляции по сравнению со скоростью, наблюдаемой у интактного млекопитающего.
Термин «лиганд» относится к любой молекуле, которая может связываться с другой молекулой, такой как полипептид или пептид, и следует считать, что термин включает в себя, но не ограничен этим, антитела и молекулы фагового дисплея.
Зонд и праймеры, используемые в данном способе, также составляют часть изобретения. Указанные зонды и праймеры могут содержать фрагмент молекулы нуклеиновой кислоты согласно изобретению, способной гибридизоваться в жестких условиях с последовательностью мутантного гена GDF-9B. Такие зонды и праймеры также применимы в исследовании структуры и функции мутантного гена и для получения гомологов гена не от овец, а от других млекопитающих, экспрессирующих фенотип Inverdale или Hanna.
Зонды или праймеры нуклеиновой кислоты можно получить на основе нуклеиновых кислот согласно данному изобретению. «Зонд» содержит выделенную нуклеиновую кислоту, связанную с регистрируемой меткой или репортерной молекулой. Обычные метки включают радиоактивные изотопы, лиганды, хемилюминесцентные или флуоресцентные агенты и ферменты.
«Фрагмент» нуклеиновой кислоты является частью нуклеиновой кислоты, которая короче, чем полная длина, и содержит, по меньшей мере, минимальную последовательность, способную специфически гибридизоваться с молекулой нуклеиновой кислоты согласно изобретению, или с комплементарной ей последовательностью в жестких условиях, которые определены ниже. «Фрагмент» полипептида представляет собой часть полипептида, которая короче, чем полная длина, но которая продолжает сохранять биологическую функцию либо увеличения, либо уменьшения скорости овуляции у млекопитающего, или вызывает стерильность у млекопитающего. Следовательно, фрагмент согласно изобретению обладает, по меньшей мере, одной из биологических активностей нуклеиновой кислоты или полипептида согласно изобретению.
«Праймеры» представляют собой короткие нуклеиновые кислоты, предпочтительно олигонуклеотиды ДНК длиной 15 нуклеотидов или более, которые отжигаются с комплементарной цепью ДНК-мишени путем гибридизации нуклеиновых кислот, образуя гибрид между праймером и цепью ДНК-мишени, затем удлиняются вдоль цепи ДНК-мишени полимеразой, предпочтительно ДНК-полимеразой. Пары праймеров можно использовать для амплификации последовательности нуклеиновой кислоты, например полимеразной цепной реакцией (ПЦР) или другими способами амплификации нуклеиновых кислот, хорошо известными в данной области. Пары праймеров ПЦР можно получить из последовательности нуклеиновой кислоты согласно данному изобретению, например, используя компьютерные программы, предназначенные для этой цели, такие как Primer (версия 0,5© 1991, Whitehead Institute for Biomedical Research, Cambridge, MA).
Способы получения и применения зондов и праймеров описаны, например, в Sambrook et al. Molecular Cloning: A Laboratory Manual, 2nd ed, vol.1-3, ed Sambrook et al., Cold Spring Harbour Laboratory Press, Cold Spring Harbour, NY, 1989.
Зонды и праймеры могут быть свободными в растворе или ковалентно или нековалентно связанными с твердой подложкой стандартными способами.
«Жесткие условия» для амплификации последовательности нуклеиновой кислоты-мишени (например, посредством ПЦР) с использованием конкретной пары праймеров для амплификации представляют собой условия, которые позволяют паре праймеров гибридизоваться только с последовательностью нуклеиновой кислоты-мишени, с которой связался бы праймер, имеющий соответствующую последовательность дикого типа (или ее комплемент).
На гибридизацию нуклеиновых кислот влияют такие условия, как концентрация соли, температура или органические растворители, наряду с составом оснований, длиной комплементарных цепей и количеством ошибочных спариваний нуклеотидных оснований между гибридизующимися нуклеиновыми кислотами, что будет хорошо понятно специалистам в данной области.
В том случае, когда термин «специфичный для (последовательности-мишени)» относится к зонду или праймеру, он свидетельствует о том, что зонд или праймер в жестких условиях гибридизуется только с последовательностью-мишенью в данном образце, содержащем последовательность-мишень.
В одном варианте изобретение относится к генетическому маркеру для основанной на ДНК селекции животных в отношении повышенной овуляции или стерильности у овец, коз, крупного рогатого скота, оленей, мышей, крыс или других коммерчески важных млекопитающих. Изобретение относится к приспособлениям для использования молекулы нуклеиновой кислоты, содержащей последовательность, полученную из мутантной последовательности ДНК GDF-9B или геномной ДНК, которая связана с мутантным геном GDF-9B, чтобы идентифицировать варианты последовательности у отдельных животных, которые связаны с повышенной овуляцией или стерильностью у этого животного. Хотя указанные варианты необязательно непосредственно могут вызывать характерный признак повышенной овуляции или стерильности, они будут достаточно близко связанными с ним, чтобы предсказать наличие характерного признака. Способы, посредством которых идентифицируют указанные варианты последовательности, известны в данной области и включают, но не ограничены этим, полиморфизм длин рестрикционных фрагментов (RFLP), AFLP, прямое секвенирование ДНК в мутантном гене GDF-9B или связанной с ним ДНК, или идентификацию и характеристику варьирующего количества тандемных повторов (VNTR) или полиморфизм микросателлитов (ди- или тринуклеотидные повторы), выявление и характеристику однонуклеотидного полиморфизма (SNP).
Полипептид можно получить в результате экспрессии подходящего вектора, содержащего молекулу нуклеиновой кислоты согласно изобретению или ее функциональный вариант или фрагмент, в подходящей клетке-хозяине, что должно быть понятно специалисту в данной области.
Клонирующий вектор можно выбрать в соответствии с используемым хозяином или клеткой-хозяином. Пригодные векторы, как правило, имеют следующие характеристики:
(а) способность к саморепликации;
(b) обладание единственной мишенью для любой конкретной рестрикционной эндонуклеазы; и
(с) желательно несут гены для легко селектируемых маркеров, таких как устойчивость к антибиотикам.
Два основных типа векторов, обладающих такими характеристиками, представляют собой плазмиды и бактериальные вирусы (бактериофаги или фаги). Предпочтительные в настоящее время векторы могут включать следующие векторы: pUC, pBlueScript, pGEM, PGEX, pBK-CMV, ZAP лямбда, GEM лямбда и серию pSP. Однако указанный список не следует рассматривать как ограничивающий рамки данного изобретения.
Молекулы ДНК согласно изобретению можно экспрессировать, помещая их в функциональной связи с подходящими регуляторными последовательностями в реплицирующемся экспрессирующем векторе. Регуляторные последовательности наряду с прочими могут включать точки начала репликации, промотор, энхансер и последовательности терминации транскрипции. Выбор регуляторной последовательности, которую необходимо включить в экспрессирующий вектор, зависит от типа хозяина или клетки-хозяина, предназначенного для того, чтобы использовать его для экспрессии ДНК.
Как правило, пригодными хозяевами являются прокариотические, дрожжевые клетки и клетки млекопитающих. Также в термин «хозяева» включены плазмидные векторы. Подходящие прокариотические хозяева включают E.coli, виды Bacillus и различные виды Pseudomonas. Обычно используемые промоторы, такие как промоторные системы β-лактамазы (пенициллазы) и лактозы (lac), хорошо известны в данной области. Можно использовать любую доступную промоторную систему, совместимую с выбранным хозяином. Векторы, используемые для дрожжей, также доступны и хорошо известны. Подходящим примером является 2-микронная плазмида с началом репликации.
Подобным образом векторы для применения в клетках млекопитающих также хорошо известны. Такие векторы включают хорошо известные производные SV-40, аденовируса, последовательностей ДНК, полученных из ретровируса, вирусов простого герпеса и векторы, полученные в результате комбинации плазмидной и фаговой ДНК.
В данной области известны другие эукариотические экспрессирующие векторы (например, P.J.Southern and P. Berg, J. Mol. Appl. Genet. I, 327-341 (1982); S. Subramani et al., Mol. Cell. Biol. I, 854-864 (1981); R J. Kaufmann and P.A.Sharp, «Amplification and Expression of Sequences Cotransfected with a Modular Dihydrofolate Reducase Complementary DNA Gene, J. Mol. Biol. 159, 601-621 (1982); R J. Kaufmann and P.A.Sharp, Mol. Cell. Biol. 159, 601-664 (1982); S.I.Scahill et al., «Expressions and Characterisation of the Product of a Human Immune Interferon DNA Gene in Chinese Hamster Ovary Cells,» Proc. Natl. Acad. Sci. USA. 80, 4654-4659 (1983); G. Urlaub and L.A.Chasin, Proc. Natl. Acad. Sci. USA. 77, 4216-4220, (1980).
Применимые в данном изобретении экспрессирующие векторы содержат, по меньшей мере, одну последовательность регуляции экспрессии, которая функционально связана с последовательностью ДНК или фрагментом, который необходимо экспрессировать. Регуляторная последовательность встроена в вектор для того, чтобы контролировать и регулировать экспрессию клонированной последовательности ДНК. Примерами пригодных последовательностей регуляции экспрессии является система lac, система trp, система tac, система trc, основные районы оператора и промотора фага лямбда, гликолитические промоторы кислой фосфатазы дрожжей, например, Pho5, промоторы синхронизирующих факторов альфа дрожжей и промоторы, полученные из вируса полиомы, аденовируса, ретровируса и вируса обезьян, например ранний и поздний промоторы SV40, и другие последовательности, которые контролируют экспрессию генов прокариотических и эукариотических клеток, и их вирусов, или их комбинации.
В конструкции вектора также предпочтительно иметь возможность отличать вектор, включающий чужеродную ДНК, от немодифицированных векторов посредством удобного и быстрого анализа. Репортерные системы, используемые в таких анализах, включают репортерные гены и другие детектируемые метки, которые дают измеряемые изменения цвета, устойчивость к антибиотикам и тому подобное. В одном предпочтительном векторе используют репортерный ген β-галактозидазы, и этот ген детектируется благодаря клонам, проявляющим синий фенотип на чашках с X-гал. Это облегчает селекцию. В одном варианте ген β-галактозидазы можно заменить геном, кодирующим полиэдрин; и указанный ген детектируется благодаря клонам, проявляющим белый фенотип при окрашивании с помощью X-гал. Указанная селекция на основе сине-белого окрашивания может служить в качестве маркера, применимого для детектирования рекомбинантных векторов.
После селекции векторы можно выделить из культуры, используя стандартные способы, такие как экстракция замораживанием-оттаиванием, с последующей очисткой.
Для экспрессии векторы, содержащие ДНК согласно изобретению и регуляторные сигналы, встраивают или вводят посредством трансфекции в хозяина или клетку-хозяина. Некоторые пригодные экспрессирующие клетки-хозяева включают хорошо известные прокариотические и эукариотические клетки. Некоторые подходящие прокариотические хозяева включают, например, E.coli, такие как E.coli SG-936, E.coli HB 101, E.coli W3110, E.coli X1776, E.coli X2282, E.coli DHT и E.coli MR01, Pseudomonas, Bacillus, такие как Bacillus subtilis, и Streptomyces. Подходящие эукариотические клетки включают дрожжи и другие грибы, клетки насекомых, клетки животных, такие как клетки COS и клетки CHO, клетки человека в культуре ткани.
В зависимости от используемого хозяина трансформацию выполняют согласно стандартным способам, подходящим для таких клеток. Для прокариот или других клеток, которые содержат прочные клеточные стенки, можно применять способ обработки кальцием (Cohen, S N Proceedings, National Academy of Science, USA 69 2110 (1972)). Для клеток млекопитающих, не имеющих таких клеточных стенок, предпочтителен способ осаждения фосфатом кальция Graeme and Van Der Eb, Virology 52: 546 (1978). Трансформации дрожжей осуществляют согласно способу Van Solingen et al. J. Bact. 130: 946 (1977) и Hsiao et al. Proceedings, National Academy of Science, 76: 3829 (1979).
После трансформации выбранного хозяина соответствующим вектором можно продуцировать кодируемый полипептид или пептид часто в форме слитого белка посредством культивирования клеток-хозяев. Полипептид или пептид согласно изобретению можно детектировать посредством быстрого анализа, как указано выше. Затем полипептид или пептид извлекают и очищают как это необходимо. Извлечения и очистки можно достичь, используя любой из способов, известных в данной области, например, абсорбцией на анионообменной смоле и элюированием. Указанный способ продуцирования полипептида или пептида согласно изобретению составляет следующий аспект данного изобретения.
Клетки-хозяева, трансформированные векторами согласно изобретению, также образуют следующий аспект изобретения.
Кроме того, в предпочтительных вариантах также можно использовать нуклеотиды и пептиды, обладающие значительной идентичностью с нуклеотидными и аминокислотными последовательностями согласно изобретению. В данном описании «значительная идентичность» означает, что две последовательности при оптимальном сопоставлении, таком как с помощью программ GAP или BESTFIT (нуклеотиды и пептиды), используя оценку пробелов по умолчанию, или оцениваемые с помощью компьютерного алгоритма BLASTP (пептиды) или BLASTX (нуклеотиды), проявляют идентичность, по меньшей мере, 60%, предпочтительно 75% и наиболее предпочтительно 90-95% последовательностей.
Предпочтительно положения остатков, которые не являются идентичными, отличаются консервативными аминокислотными заменами. Например, замены аминокислот, имеющих сходные химические свойства, такие как заряд или полярность, не должны влиять на свойства белка. Примеры включают замены аспарагина на глутамин или аспарагиновой кислоты на глутаминовую кислоту.
Термин «вариант» в используемом здесь смысле включает молекулы нуклеиновой кислоты и полипептиды и пептиды, имеющие «значительную идентичность» с последовательностями согласно изобретению. Вариант может быть результатом модификации нативной нуклеотидной или аминокислотной последовательности такими модификациями, как инсерции, замены или делеции одного или более нуклеотидов или аминокислот, или может представлять собой вариант природного происхождения. Термин «вариант» также включает гомологичные последовательности, которые гибридизуются с последовательностями согласно изобретению в стандартных условиях гибридизации, такими как 2 × SSC при 65°С, или предпочтительно в жестких условиях гибридизации, такими как 6 × SSC при 55°С, при условии, что вариант способен модулировать скорость овуляции у млекопитающих женского пола. В тех случаях, когда желателен такой вариант, нуклеотидную последовательность нативной ДНК изменяют соответствующим образом. Указанное изменение можно осуществить посредством синтеза ДНК или посредством модификации нативной ДНК, например, сайт-специфичным или кассетным мутагенезом. Предпочтительно в тех случаях, когда необходимы модификации последовательностей частей кДНК или геномной ДНК, применяют сайт-специфичный направляемый праймером мутагенез, используя стан