Способ экспериментальной терапии энцефалопатии
Иллюстрации
Показать всеИзобретение относится к медицине, в частности к фармакологии, и может быть использовано для лечения энцефалопатии различного генеза. Для этого подкожно вводят рекомбинантный человеческий гранулоцитарный колониестимулирующий фактор. Способ обеспечивает лечебный эффект за счет увеличения количества эндогенных стволовых клеток организма и их хоминга в пораженные участки центральной нервной системы при исключении полипрагмазии. 5 табл.
Реферат
Изобретение относится к области медицины, конкретно к фармакологии, и касается способа лечения энцефалопатии.
Известен способ лечения энцефалопатии с помощью комплексной терапии официнальными препаратами: антигипоксантами, транквилизаторами, блокаторами кальциевых каналов и ноотропами [1].
Данный способ является наиболее близким к заявляемому по достигаемому результату и выбран в качестве прототипа.
Недостатком данного способа является одновременное назначение большого количества лекарственных средств с разнонаправленными механизмами действия, сопровождаемое высокой ксенобиотической нагрузкой на организм, приводящей, в свою очередь, к нарушению функционирования систем жизнеобеспечения. Вместе с тем известно, что полипрогмазия ведет к существенному усилению неблагоприятного побочного действия препаратов и снижению эффекта терапии [2]. Кроме того, несмотря на имеющийся для лечения энцефалопатии арсенал медикаментозных средств, зачастую не удается добиться не только «полного» излечения пациентов, но и достичь частичного восстановления ряда утерянных функций [1].
Задачей, решаемой данным изобретением, является повышение эффективности предлагаемого способа и снижение побочных эффектов терапии.
Поставленная задача достигается техническим решением, представляющим собой способ лечения энцефалопатии, заключающийся в подкожном введении лабораторным животным (мыши) препарата рекомбинантного человеческого гранулоцитарного колониестимулирующего фактора в дозе 125 мкг/кг 1 раз в день в течение 5 дней.
Новым в предлагаемом изобретении является использование препарата рекомбинантного человеческого гранулоцитарного колониестимулирующего фактора в дозе 125 мкг/кг 1 раз в день в течение 5 дней для эффективной терапии энцефалопатии.
Данные отличительные признаки не обнаружены в научно-медицинской и патентной литературе, и предлагаемый способ соответствует критерию изобретения «Новизна».
Авторами в проанализированной литературе способа лечения энцефалопатии с помощью гранулоцитарного колониестимулирующего фактора не найдено.
Практически все заболевания, травмы и отравления, в той или иной мере, сопровождаются нарушением энергетического обмена в организме и развитием гипоксии. При этом специфика функционирования клеточных элементов нервной ткани, заключающаяся в сочетании высокого уровня метаболической активности, сопряженной с интенсивным потреблением кислорода, и большой скоростью обновления фонда макроэргических веществ, делает центральную нервную систему наиболее уязвимой к воздействиям внешней и внутренней среды, сопровождающихся развитием гипоксии [3]. Угнетение аэробного окисления в тканях головного мозга существенно реорганизует центральную нервную систему, изменяет интегративно-пусковую деятельность нейронов и приводит к формированию качественно нового паттерна взаимодействия отдельных мозговых структур, а в случае декомпенсации механизмов адаптации запускает цепь патологических процессов, приводящих к прогрессирующим неврологическим нарушениям и расстройствам когнитивных функций - развитию энцефалопатии [1]. Кроме того, формирование новой патодинамической системы в мозговых структурах, ответственных за управление деятельностью внутренних органов и систем, зачастую способно приводить к развитию дизрегуляционной патологии висцеральных органов практически в любые сроки после воздействия [4].
Полученные в последние годы сведения о свойствах и закономерностях жизнедеятельности мультипотентных клеток-предшественников организма открыли возможность развития новой стратегии лечения многих заболеваний - с помощью стволовых клеток [5]. При этом согласно имеющимся представлениям не вызывает сомнения факт возможности мобилизации собственных механизмов «глубокого» резерва - регионарных стволовых клеток, с помощью различных цитокинов, в том числе гранулоцитарного колониестимулирующего фактора [6]. Причем наиболее эффективным режимом введения данного препарата является его подкожное введение в дозе 125 мкг/кг в течение 5 дней [7].
Однако факт применения препарата гранулоцитарного колониестимулирующего фактора при энцефалопатии с достижением нового результата: создание эффективного способа лечения энцефалопатии, для специалиста является не очевидным.
Совокупность отличительных признаков не является очевидной для специалиста и не вытекает явным образом из уровня техники в данной области, что позволяет считать предлагаемое изобретение соответствующим критерию «Изобретательский уровень».
Способ осуществляют следующим образом:
Лабораторному животному (мыши) сразу после моделирования энцефалопатии в течение 5 дней 1 раз в день подкожно вводили 125 мкг/кг препарата рекомбинантного человеческого гранулоцитарного колониестимулирующего фактора (рч Г-КСФ).
Предлагаемый способ был изучен в экспериментах на мышах линии CBA/CaLac в количестве 198 штук, массой 18-20 г. Мыши 1 категории (конвенциональные линейные мыши) получены из питомника отдела экспериментального биомедицинского моделирования НИИ фармакологии ТНЦ СО РАМН (сертификат имеется).
Оценку состояния центральной нервной системы животных производили по регистрации показателей психоневрологического статуса: условно-рефлекторной деятельности и ориентировочно-исследовательскому поведению животных в открытом поле.
Через 1 сутки после моделирования энцефалопатии у животных вырабатывался условный рефлекс пассивного избегания [8], проверка сохранности рефлекса осуществлялась на 7, 14, 21-е сут эксперимента. Регистрация показателей ориентировочно-исследовательского поведения в открытом поле производилась на 3, 7, 14-е и 21-е сут после воздействия [8, 9].
О мобилизации стволовых клеток судили по изменению содержания нейральных клеток-предшественников в паравентрикулярной области головного мозга, количество которых определяли с помощью культуральных методов, основанных на способности нейральных стволовых клеток к нейросферообразованию в специальной культуральной среде [10].
Обработку результатов проводили методом вариационной статистики с использованием t-критерия Стыодента и непараметрического U-критерия Вилкоксона - Манна-Уитни [11].
Пример 1.
Энцефалопатия моделировалось с помощью гермокамеры объемом 500 мл. Мыши помещались в гермокамеру, крышка закрывалась, и мыши оставались там до агонального судорожного припадка или остановки дыхания, определяемой визуально, в течение 10-15 секунд. После извлечения из гермокамеры и восстановления самостоятельного дыхания, через 5-10 минут, мыши вновь помещались в гермокамеру также до наступления агонального состояния (генерализованного судорожного припадка или остановки дыхания). Первой группе животных по схеме лечения способа прототипа вводили: диазепам 10 мг/кг/сутки, цитохром С 30 мг/кг/сутки, нифедипин 5 мг/кг/сутки и пирацетам по 400 мг/кг/сутки в течение 5 дней. Указанные дозы препаратов были определены в предварительных экспериментах как максимально эффективные при данной патологии. Опытным животным сразу после моделирования энцефалопатии подкожно 1 раз в день в течение 5 дней вводили 125 мкг/кг препарата рекомбинантного человеческого гранулоцитарного колониестимулирующего фактора - нейпоген («Hofiman-la Roche», Швейцария) - растворенного в 0,2 мл растворителя.
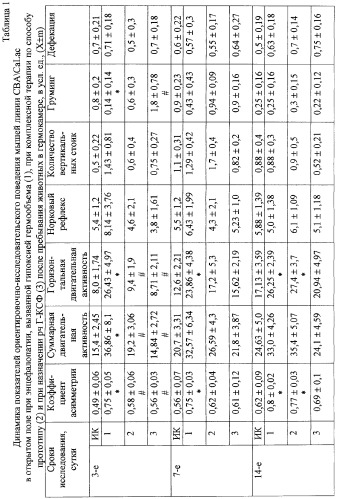
В ходе эксперимента гипоксическое воздействие приводило к формированию энцефалопатии. Так, наблюдалось статистически значимое увеличение общей двигательной активности мышей (3-е сут) в открытом поле, числа горизонтальных перемещений (3, 7, 14-е сут) и повышение коэффициента асимметрии движений (3, 7, 14, 21-е сут), а также снижение количества актов груминга на 3-е сут опыта. В то же время отмечалось резкое падение уровня воспроизведения условного рефлекса пассивного избегания на 7, 14, 21-е сут эксперимента (до 45%, 45,5% и 46,1% от контрольных значений соответственно) и спонтанная смертность животных на протяжении всего периода наблюдения, достигающая на 21-е сут 27,3%.
Лечение животных по способу-прототипу нивелировало изменения показателей психоневрологического статуса в начальные сроки эксперимента (3, 7-е сут), но не влияло на нарушения двигательной активности и воспроизведение условного рефлекса пассивного избегания в более позднем периоде (14, 21-е сут). В то же время отмечалось снижение процента гибели животных до 12,3% на 21-е сут. При этом изучение содержания нейральных клеток-предшественников в головном мозге мышей, получавших данные препараты на фоне моделирования энцефалопатии, статистически значимых изменений не выявило (табл.5).
Введение препарата гранулоцитарного колониестимулирующего фактора после моделирования энцефалопатии приводило к полной нормализации показателей психоневрологического статуса животных на протяжении всего эксперимента: снижению общей двигательной активности, числа горизонтальных перемещений, коэффициента асимметрии движений в открытом поле, повышало уровень воспроизведения условного рефлекса пассивного избегания во все сроки наблюдения до величины соответствующих значений у интактных животных и отменяло спонтанную смертность в постгипоксическом периоде (табл.1, 4).
Изучение количества нейральных клеток-предшественников в паравентрикулярной области головного мозга при введении рч Г-КСФ выявило существенное увеличение их числа на 1-е и 7-е сут после воздействия (до 267,55 и 139,5% от фона соответственно) (см. табл.5).
Пример 2.
Энцефалопатия моделировалась на мышах линии CBA/CaLac, массой 18-20 г путем однократного внутрибрюшинного введения раствора солянокислого фенилгидразина в дозе 150 мг/кг. Первой группе животных по схеме лечения способа прототипа вводили: диазепам 10 мг/кг/сутки, цитохром С 30 мг/кг/сутки, нифедипин 5 мг/кг/сутки и пирацетам по 400 мг/кг/сутки в течение 5 дней. Указанные дозы препаратов были определены в предварительных экспериментах как максимально эффективные при данной патологии. Опытным животным сразу после моделирования энцефалопатии подкожно 1 раз в день в течение 5 дней вводили 125 мкг/кг препарата рекомбинантного человеческого гранулоцитарного колониестимулирующего фактора - нейпоген («Hoffman-la Roche», Швейцария) - растворенного в 0,2 мл растворителя.
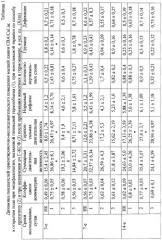
Проведенные исследования показали, что внутрибрюшинное введение гемолитического яда в дозе 150 мг/кг сопровождалось выраженными изменениями психоневрологического статуса экспериментальных животных. Так, изучение ориентировочно-исследовательского поведения в открытом поле показало рост коэффициента асимметрии движений на 3, 7, 14 и 21-е сут эксперимента, обусловленые увеличением количества горизонтальных перемещений мышей на 7, 21-е сут исследования, и падением числа обследований отверстий открытого поля на 14-е сут и уменьшением количества актов груминга на 3-е сут опыта. Кроме того, отмечалось снижение уровня воспроизведения условного рефлекса пассивного избегания на 7, 14, 21-е сут исследования (до 0% на 21-е сут) и спонтанная гибель животных после воздействия, достигающая 37,3% на 21-е сут эксперимента.
Назначение препаратов по способу-прототипу полностью отменяло появление признаков нарушения ориентировочно-исследовательского поведения животных в открытом поле, однако не оказывало существенного влияния на мнестическую функцию ЦНС. Вместе с тем лечение по способу прототипу не оказывало влияния на динамику содержания стволовых клеток в головном мозге животных. Кроме того, имела место смертность животных, составляющая к 21-м сут 21,6%.
Назначение препарата гранулоцитарного колониестимулирующего фактора после введения соляно-кислого фенилгидразина сопровождалось нивелированием нарушений психоневрологического статуса мышей. У животных, леченых Г-КСФ, не наблюдалось изменений ориентировочно-исследовательского поведения на протяжении всего эксперимента относительно интактных животных. Кроме того, имела место отмена развития амнезии и снижение летальности до 10% на 21-е сут после воздействия (табл.2, 4).
Исследование содержания стволовых клеток в паравентрикулярной области головного мозга у животных при введении рч Г-КСФ выявило существенное возрастание их числа, причем на 1-е сут число стволовых клеток в мозговой ткани животных, леченых Г-КСФ, достигало 252,7% и 430,3% от величин аналогичных параметров у интактных животных и мышей с энцефалопатией соответственно (см. табл.5).
Пример 3.
Постгеморрагическую энцефалопатию моделировали у мышей линии CBA/CaLac, массой 18-20 г., путем пункции ретроорбитального синуса и выпускания через промытую раствором гепарина пастеровскую пипетку в течение 3-х часов дробно, за 3 раза, 70% объема циркулирующей крови. Расчет необходимого для забора количества крови производят из предположения, что у грызунов объем циркулирующей крови составляет 1/13 часть от массы тела животного. Первой группе животных по схеме лечения способа прототипа вводили: диазепам 10 мг/кг/сутки, цитохром С 30 мг/кг/сутки, нифедипин 5 мг/кг/сутки и пирацетам по 400 мг/кг/сутки в течение 5 дней. Указанные дозы препаратов были определены в предварительных экспериментах как максимально эффективные при данной патологии. Опытным животным сразу после моделирования энцефалопатии подкожно 1 раз в день в течение 5 дней вводили 125 мкг/кг препарата рекомбинантного человеческого гранулоцитарного колониестимулирующего фактора - нейпоген («Hoffman-la Roche», Швейцария) - растворенного в 0,2 мл растворителя.
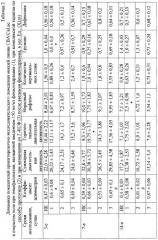
Потеря 70% объема циркулирующей крови приводила к достоверным изменениям двигательной активности животных в открытом поле и развитию выраженных нарушений мнестической функции центральной нервной системы экспериментальных животных. Имело место увеличение общей двигательной активности животных на протяжении всего эксперимента, рост коэффициента асимметрии движений на 3, 7, 14, 21-е сут исследований, за счет возрастания числа горизонтальных перемещений животных, и уменьшение количества актов груминга на 7, 14-е сут опыта. Кроме того, отмечались статистически значимое снижение уровня воспроизведения условного рефлекса пассивного избегания на 7,14, 21-е сут исследования (до 12% от контроля на 21-е сут) и спонтанная гибель животных до 20% на 21-е сут эксперимента.
Изучение психоневрологического статуса мышей при лечении их по способу прототипу показало выраженное повышение уровня воспроизведения условного рефлекса пассивного избегания, отмену гибели животных в постгеморрагическом периоде и улучшение двигательной активности животных в открытом поле. В то же время в отдаленные сроки нарушения ориентировочно-исследовательского поведения мышей, леченных по схеме способа прототипа, сохранялись (увеличение коэффициента асимметрии движений). При этом исследование содержания нейральных стволовых клеток в головном мозге животных, леченых по способу прототипу, достоверных изменений не выявило.
Введение рч Г-КСФ приводило к нормализации ориентировочно-иследовательского поведения животных, отмене возникновения нарушений мнестических функций ЦНС, а также отмене гибели животных в постгеморрагическом периоде (табл.3, 4).
Выяснение возможного механизма действия Г-КСФ показало существенное увеличение количества стволовых клеток в головном мозге на 1-е и 7-е сут эксперимента в группе мышей, леченных рч Г-КСФ, по отношению как к интактному контролю, так к группе животных с энцефалопатией (см. табл.5).
Таким образом, препарат рч Г-КСФ обладал выраженным лечебным действием в отношении энцефалопатии различного генеза, причем по ряду показателей его терапевтический эффект превосходил эффект комплексного медикаментозного лечения по способу-прототипу. При этом механизмом действия рч Г-КСФ являлась мобилизация эндогенных стволовых клеток организма и их хоминг в пораженные участки центральной нервной системы.
Предлагаемый способ соответствует критерию «Промышленно применимо»
Предлагаемый способ позволяет лечить энцефалопатию с помощью введения гранулоцитарного колониестимулирующего фактора.
Источники информации
1. Алексеева Г.В., Гурвич А.М., Семченко В.В. Постреанимационная энцефалопатия (патогенез, клиника, профилактика и лечение). - Омск; Омская областная типография, 2003. - 152 с.
2. Зборовский А.Б., Тюренков И.Н. Осложнения фармакотерапии. - М.: Медицина, 2003. - 543 с.
3. Гипоксия. Адаптация, патогенез, клиника. / Сб. Под ред. Ю.Л.Шевченко. - Санкт-Петербург, ООО «ЭЛБИ-Сб», 2000. - 384 с.
4. Дизрегуляционная патология. / Под ред. Г.Н.Крыжановского. - М.: Медицина, 2002. - 652 с.
5. Holtzer H. Cell lineages, stem cells and the quantal cell cycle concept / Stem cells and tissue homeostasis. Eds: B.I.Lord, C.S.Poten, R.J.Cole. - New York, Cambrige Unyversity Press, 1978. - P.1-28.
6. Haas R., Murea S. The role of granulocyte colony-stimulating factor in mobilization and transplantation of peripheral blood progenitor and stem cells // Mol.Ther. - 1996. - V.2. - N.I. - P.136.
7. Дыгай A.M., Жданов В.В., Масычева В.И., Минакова М.Ю., Романов В.П., Пустошилова Н.М., Симанина Е.В., Агафонов В.И., Гольдберг Е.Д. Гемостимулирующие свойства рекомбинантного колониестимулирующего фактора и глицерама в условиях цитостатической миелосупрессии // Эксперим. и клин. фармакол. - 1999. - Т.62. - №1. - С.34-37.
8. Буреш Я, Бурешова О., Хьюстон Дж. П.Методики и основные эксперименты по изучению мозга и поведения. / пер. с англ. Под ред проф. A.C.Батуева). - М.: Высшая школа, 1991. - 398 с.
9. Walsh R.N., Cummins R.A. The open-field test: a critical review. // Psychol. Bull. - 1976. V.83. - P.482-504.
10. Gritti A., Bonfanti L., Doetsch F., Caille I., Alvarez-Buylla A., Daniel A. Lim, Galli R., Jose Manuel Garcia Verdugo, Daniel G. Herrera, Vescovi A.L. Multipotent Neural Stem Cells Reside into the Rostral Extension and Olfactory Bulb of Adult Rodents // J. Neuroscience. - 2002. - V.22. - P.437-445.
11. Лакин Г.Ф. Биометрия. - М.: Высшая школа, 1973. - 215 с.
Способ терапии энцефалопатии, заключающийся во введении препарата, отличающийся тем, что в качестве препарата используют рекомбинантный человеческий гранулоцитарный колониестимулирующий фактор, который вводят подкожно.