Производные фенил-3-аминометил-хинолона-2 в качестве ингибиторов no-синтетазы, способ их получения, биологически активные соединения и фармацевтическая композиция на их основе
Иллюстрации
Показать всеИзобретение относится к новым амино- и гидрокси-производным фенил-3-аминометил-хинолона-2 общей формулы (1):
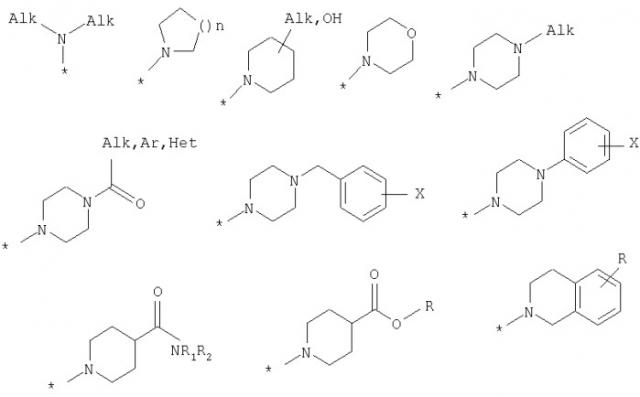
где R1, R2, R3, R4 независимо являются одинаковыми или различными, причем R1 выбран из Н, Alk, OAlk; R2 выбран из Н, Alk, OAlk, OCF3; R3 выбран из Н, Alk, OAlk, SCH3; R4 выбран из Н, Alk, OAlk; или R2, R3 выбраны из (СН2)3, ОСН2О, OCH2CH2O; R5=Н или Alk; R6, R7, R9 являются Н; R8 независимо выбран из следующих заместителей:
где n=1, 2, 3; Het представляет собой фуран; R представляет собой водород или алкил; в случае гидрокси-производных по меньшей мере один из R6, R7, R8 или R9 является ОН, при этом остальные представляют собой H. Изобретение также относится к способам получения этих соединений и к фармацевтической композиции, ингибирующей NO-синтетазу, на основе этих соединений. Технический результат - получение новых соединений и фармацевтических композиций на их основе в целях лечения болезней, связанных с гиперактивностью фагоцитирующих клеток, например ревматоидного артрита, астмы и др. 6 н. и 30 з.п. ф-лы, 1 табл.
Реферат
Изобретение относится к органической химии и медицине и предназначено для получения соединений, ингибирующих NO-синтетазу, биологически активных соединений и фармацевтических композиций на их основе.
NO-синтетаза - это фермент, осуществляющий каталитическое превращение L-аргинина в оксид азота (II) (NO). Данный процесс впервые был открыт в конце 80-х годов, и с тех пор до настоящего времени обнаруживают все новые и новые функции NO в организме. Соответственно, значимость NO-синтетазы для регулирования различных функций организма постоянно возрастает, а следовательно, возрастает и значимость различных ингибиторов и модуляторов этого фермента для лечения болезней, связанных с нарушениями этих функций. В общем случае можно сказать, что оксид азота (II) участвует:
1) в регулировании тонуса гладкой мускулатуры, что приводит к расслаблению\сокращению и, следовательно, к расширению\сжатию кровеносных сосудов (сердечно-сосудистые заболевания, а также различные нарушения функционирования половых органов) и кишечника (желудочно-кишечные заболевания);
2) в функционировании всех фагоцитирующих клеток организма, которые необходимы для борьбы организма с микробами и инородными телами. NO опосредует воспалительные процессы и необходим при формировании всех связанных с этим ответов;
3) в нейропередаче (при передаче сигнала между нейронами, в том числе и некоторых структур головного мозга). Воздействие на этот процесс приводит к возможности облегчить течение эпилептических припадков и последствия инсультов, регулировать ощущение боли, продолжительность сна и т.д.
Предлагаемые вещества, новые производные хинолона-2, а именно амино- и гидрокси-производные фенил-3-аминометил-хинолона-2, позиционируются как ингибиторы так называемой индуцибельной формы NO-синтетазы, отвечающей за генерацию NO в основном в фагоцитирующих клетках. Созданные на основе этих веществ лекарственные средства могут быть использованы для лечения болезней, таких как ревматоидный артрит, астма и им подобные. В мире существуют лекарственные средства, применяемые при этих заболеваниях, в том числе и основанные на действии ингибиторов NO-синтетазы. Однако большинство существующих ингибиторов этого фермента отличаются недостаточной селективностью по отношению к различным его изоформам, что приводит к развитию разнообразных побочных эффектов при применении лекарственных препаратов на их основе.
В настоящей заявке описаны способы синтеза заявленных структур, учитывая особенности строения конечных соединений. Структурные аналоги предложенных веществ описаны в научно-технической и патентной литературе. Например, в патенте US №5874472 боковая цепь аргинина модифицируется путем включения пяти- или шестичленного ароматического или гетероароматического циклов (тиофен, бензол, пиридин и т.д). Приведенные данные по активности в отношении NO-синтетазы, выделенной из разных источников, показывают активность на уровне Ki 0,5-50 и выше нМ. Данные по токсичности отсутствуют.
Среди других запатентованных соединений, проявляющих активность по отношению к NO-синтетазе без указания ее конкретных значений, необходимо отметить заявку JP №10-120654, в которой описаны производные 4-метил-3,4-дегидро-2-иминопиперидина.
Данные по активности, встречающиеся среди производных хинолона-2, следующие: иммуносупрессанты, противовоспалительные и противоаллергические препараты [патент US №6509352]; вещества, применяемые для лечения гипертонии, ишемии, инфаркта миокарда, стенокардии и др. [патент RU №2167874]; антиаллергические и противоастматические вещества [заявка JP №58-225065]; вещества, применяемые для лечения различных форм эпилепсии, болезни Альцгеймера, шизофрении и склероза [патенты US №№5536709, 5646132], антиконвульсанты и подобные им вещества [заявка RU №95109098]. В патентах US №№6509352 и 6605616 описаны производные хинолина, представляющие собой амиды 4-оксо-хинол-2-он-3-карбоновых кислот на ароматических аминах, содержащие обязательно при атоме азота метильный заместитель. Соединения, заявленные в настоящем изобретении, представляют собой вторичные амины, в то время как соединения, описанные в указанных патентах, являются третичными амидами. Это коренное отличие обусловливает различие методик синтеза и физико-химических свойств получаемых соединений. Кроме того, в заявленных соединениях заместителем в положении 4 хинолиного кольца является Н в отличие от аклокси-заместителя (-OR4) в этом же положении у известных соединений, описанных в вышеуказанных патентах. Известные соединения исследовались в качестве ингибиторов острого экспериментального аутоиммунного энцефаломиелита. В этих патентах отсутствуют какие-либо упоминания об активности описываемых в них соединений в качестве ингибиторов NO-синтетазы. Таким образом, можно сделать вывод о том, что предлагаемые соединения и обнаруженная высокая биологическая активность в отношении NO-синтетазы из научной технической и патентной литературы не известны.
Задачей, на решение которой направлено настоящее изобретение, является получение амино- и гидрокси-производных фенил-3-аминометил-хинолона-2, обладающих значительно более высокой активностью (IC50 1-10 нМ), а также более высокой селективностью по отношению к соответствующей изоформе фермента (NO-синтетазы), мало токсичных для организма человека при не выявленных побочных эффектах.
Исходя из вышеизложенного, в данном изобретении предлагаются новые ингибиторы аргининового сайта индуцибельной NO-синтетазы, не влияющие на ее эндотелиальную форму в физиологически допустимом диапазоне концентраций. В описании настоящей заявки представлены методика ингибирования превращения аргинина в оксид азота под действием индуцибельной формы NO-синтетазы, то есть концентрация описанных ниже ингибиторов, достаточная для эффективного ингибирования фермента в физиологических условиях, условия их введения, а также методика ингибирования избыточного превращения аргинина в оксид азота при таких состояниях, как патологически пониженное кровяное давление, септический шок или аутоиммунные нарушения, способы их введения и дозировки этих ингибиторов, достаточные для достижения терапевтического эффекта.
Поставленная задача решается тем, что предложенные амино-производные фенил-3-аминометил-хинолона-2 имеют общую формулу (I):
где:
R1, R2, R3, R4 независимо являются одинаковыми или различными, причем
R1 выбран из Н, Alk, OAlk, Cl, Br, NO2, NH2;
R2 выбран из H, Alk, OAlk, F, OCF3, ОС6Н5;
R3 выбран из Н, Alk, OAlk, SCH3;
R4 выбран из H, Alk, OAlk, Cl, Br, CH2C6H5, NO2,
или
R3, R4 выбраны из (CH2)3, ОСН2О, ОСН2СН2О;
R5=Н или Alk;
R6, R7, R9 являются Н;
R8 выбран из Н или из следующих заместителей:
Поставленная задача также решается тем, что гидрокси-производные фенил-3-аминометил-хинолона-2 имеют общую формулу (2):
где:
R1, R2, R3, R4 независимо являются одинаковыми или различными, причем
R1 выбран из Н, Alk, OAlk, Cl, Br, NO2, NH2;
R2 выбран из H, Alk, OAlk, F, OCF3, OC6H5;
R3 выбран из Н, Alk, OAlk, SCH3;
R4 выбран из H, Alk, OAlk, Cl, Br, СН2С6Н5, NO2;
или
R3, R4 выбраны из (СН2)3, ОСН2О, ОСН2CH2О;
R5=Н или Alk:
по меньшей мере, один из
R6, R7, R8 или R9 является ОН, при этом остальные представляют собой Н.
Поставленная задача решается способами получения предложенных амино- и гидрокси-производных фенил-3-аминометил-хинолона-2, имеющих вышеуказанные общие формулы, а также биологически активными соединениями и фармацевтической композицией на их основе.
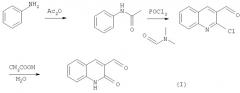
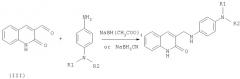
Синтез предложенных соединений, имеющих общую формулу (1), осуществляют путем взаимодействия соответствующих замещенных 2-хинолон-3-карбальдегидов с соответствующими замещенными п-фенилендиамина с последующим восстановлением образующихся оснований Шиффа. Синтез предложенных соединений, имеющих общую формулу (2), осуществляют путем взаимодействия соответствующих замещенных 2-хинолон-3-карбальдегидов с анизидинами, восстановления образующихся оснований Шиффа с образованием алкиловых эфиров в результате такого восстановления и их последующего расщепления кислотами Льюиса.
Более подробно, синтез соответствующих замещенных 2-хинолон-3-карбальдегидов проводят в несколько стадий по следующей схеме:
Сначала из анилинов (для упрощения заместители на схеме не показаны) синтезируют соответствующие замещенные ацетанилиды. Затем полученный ацетанилид добавляют к формилирующей смеси Вильсмейера, полученной в результате прикапывания POCl3 к диметилформамиду. Возможны два режима на этой стадии: с охлаждением реакционной смеси (пример 1) или с ее нагревом до 50°С (пример 3). В качестве ацетанилидов по указанной методике подходят соединения, содержащие электрондонорные заместители в бензольном кольце либо слабые электроноакцепторные заместители (выход в данном случае значительно снижается). Ход реакции в случае мета-замещенных ацетанилидов идет региоселективно с образованием практически одного изомера (7-замещенных хинолинов). Реакционную смесь выдерживают, после чего плавно поднимают температуру до 90-100°С. Время реакции колеблется от 8 до 24 часов. Выделение продуктов реакции 2-хлор-хинолин-3-карбальдегидов осуществляется путем гидролиза реакционной смеси в большом избытке мелкоизмельченного льда (на 100 мл реакционной смеси берется не менее 1 кг льда). Выпавшие при гидролизе продукты реакции используется чаще всего без дополнительной очистки, однако при необходимости их можно перекристаллизовать из ацетона, хлороформа либо из этилацетата.
Заключительной стадией синтеза замещенных 2-хинолон-3-карбальдегидов является гидролиз соответствующих 2-хлор-хинолин-3-карбальдегидов путем их кипячения в водной уксусной кислоте (порядка 80-90%) (пример 2). Время реакции колеблется от 4 до 12 часов. Продукт реакции чаще всего выкристаллизовывается по мере протекания реакции (либо при охлаждении реакционной смеси). При необходимости полученные продукты можно почистить путем перекристаллизации из уксусной кислоты или диметилформамида.
Соответствующие замещенные п-фенилендиамина получают в две стадии по следующей схеме:
В качестве исходного соединения используют 4-хлорнитробензол. На первой стадии в результате реакции нуклеофильного замещения получают соответствующие N,N-дизамещенные п-нитробензола при 80-100°С (пример 43). Реакцию чаще всего проводят с избытком соответствующего амина или в среде самого вторичного амина либо в среде диметилформамида (пример 61) или иного растворителя (ацетонитрила, диоксана и др.) в присутствии неорганического основания (поташ, сода и др.). Очистку полученного нитросоединения осуществляют перекристаллизацией или методом колоночной хроматографии на силикагеле.
На второй стадии восстанавливают полученные нитропроизводные с применением любых доступных восстанавливающих реагентов (каталитический гидрогенолиз (пример 44), восстановление гидразин-гидратом в присутствии никеля Ренея (пример 72), железом в соляной кислоте, хлоридом олова и др.). Полученный амин либо перекристаллизовывают, либо чистят путем колоночной хроматографии на силикагеле. Подобные амины чаще всего не стойкие и быстро окисляются кислородом воздуха. Поэтому необходимы тщательные условия их хранения либо использовать их в дальнейших синтезах сразу же после получения.
Целевые продукты - амино-производные фенил-3-аминометил-хинолона-2 получают по следующей схеме:
В качестве исходных соединений используют соответствующие замещенные 2-хинолон-3-карбальдегидов и п-фенилендиамина, полученные по вышеприведенным схемам (I) и (II).
Основания Шиффа и соответствующие гидроксиенамины как один из возможных интермедиатов, образующиеся в результате реакции, восстанавливают с получением целевых продуктов. Возможно промежуточное выделение оснований Шиффа. В этом случае реакцию чаще всего проводят либо в диоксане, либо в диметилформамиде при температуре порядка 100°С. Полученное основание Шиффа без дальнейшей очистки восстанавливают боргидридом натрия в спирте (метанол, этанол).
В случае синтеза без промежуточного выделения основания Шиффа реакцию проводят в инертном растворителе (ацетонитрил, дихлорэтан и др.). Первоначально в течение некоторого времени (около 1 часа) проводят реакцию между альдегидом и первичным амином при слабом нагревании. В дальнейшем в реакционную массу порциями при эффективном перемешивании добавляют триацетоксиборгидрид натрия или цианборгидрид натрия (пример 73). В случае необходимости добавляют небольшое количество уксусной кислоты. По окончании протекания реакции смесь разбавляют водным раствором соды (поташ). Органический слой отделяют, сушат. Полученные целевые продукты перекристаллизовывают либо чистят методом колоночной хроматографии на силикагеле.
Проведение синтеза с промежуточным выделением оснований Шиффа или без их выделения обусловлено только с точки зрения удобства и целесообразности. Например, если образующиеся основания Шиффа являются нестабильным, то, очевидно, их выделение нецелесообразно. С другой стороны, если для дальнейшего синтеза необходима дополнительная очистка оснований Шиффа, их выделение является желательным.
Целевые продукты - гидрокси-производные фенил-3-аминометил-хинолона-2 получают по следующей схеме:
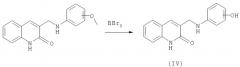
В этом случае в качестве исходных соединений используют соответствующие замещенные 2-хинолон-3-карбальдегидов, полученные по вышеприведенной схеме, и анизидины. В результате восстановления оснований Шиффа получают не целевой продукт, а соответствующие алкиловые эфиры, которые расщепляют кислотами Льюиса с получением целевого продукта, содержащего свободную гидроксильную группу в бензольном кольце. В зависимости от исходного анизидина возможно получение целевого продукта с несколькими гидроксильными группами в положениях 6, 7, 8, 9. Для синтеза можно использовать анизидины, синтезированные известными способами или выпускаемые промышленностью. В качестве кислоты Льюиса применяют трибромид бора (пример 128). Реакцию осуществляют при сильно отрицательных температурах (˜-50°С) в инертных растворителях типа хлористого метилена. По окончании реакции смесь разлагают абсолютизированным метанолом. Полученные вещества чаще всего перекристаллизовывают из подходящего растворителя.
Изобретение демонстрируется на следующих примерах.
В примерах 1-42 показано получение различных карбальдегидов в соответствии со схемой (I). Эти примеры отличаются использованием различных исходных реагентов для различных целевых продуктов, соответствующих общей формуле (1).
Пример 1.
Синтез 2-хлор-6-метилхинолин-3-карбальдегида (I).
К формилирующей смеси Вильсмейера, полученной посредством прикапывания с одновременным охлаждением 170 мл (1.75 моль) POCl3 к 60 мл (0.75 моль) диметилформамида, прибавляют небольшими порциями при одновременном интенсивном перемешивании и охлаждении 37.3 г (0.25 моль) N-пара-толилацетанилида. Реакционную смесь выдерживают при комнатной температуре в течение 1 часа и затем плавно поднимают температуру реакционной смеси до 90-100°С и выдерживают в течение 8 часов. Далее реакционную смесь охлаждают и выливают на 1,5 кг мелко размельченного льда. По окончании гидролиза (не менее 2-3 часов) образовавшуюся суспензию фильтруют, осадок промывают водой до слабокислой или нейтральной реакции (рН>5). Получают 38 г (75%) продукта (I). Аналитически чистый образец выделяют путем перекристаллизации из ацетона или хлороформа. Т.пл. 127-128°С (лит. 124-125°С, этилацетат, [9]).
H1-ЯМР спектр (δ, ДМСО-d6): 2.4 (3Н, с), 7.8 (1H, д, J=8.5 Гц), 7.9 (1Н, д, J=8.5 Гц), 8.0 (1H, д, J=3.5 Гц), 8.8 (1H, с), 10.4 (1H, с).
Пример 2.
Синтез 6-метил-2-оксо-1,2-дигидрохинолин-3-карбальдегида (II).
2-Хлор-6-метилхинолин-3-карбальдегид (38 г, 0.185 моль), полученный в примере 1, растворяют в 250 мл смеси уксусная кислота - вода (соотношение 10:1), нагревают до кипения и кипятят 3-4 часа.
По окончании реакции из кипящего раствора начинает выпадать осадок продукта (II). Реакционную смесь охлаждают, осадок фильтруют, промывают смесью спирт-вода, затем водой до удаления остатков уксусной кислоты. Выделяют 22 г (65%) продукта (II). Аналитически чистый образец получают путем перекристаллизации из диметилформамида. Т.пл. 310-312°С (лит. 275°С, уксусная кислота, [10]).
Н-ЯМР спектр (δ, ДМСО-d6): 2.2 (3Н, с), 7.2 (1H, д, J=8.5 Гц), 7.5 (1H, д, J=8.5 Гц), 7.6 (1Н, д, J=3.5 Гц), 8.5 (1Н, с), 10.1 (1Н, с), 12.0 (1H, уширенный пик).
Пример 3.
Синтез 2-хлор-8-метилхинолин-3-карбальдегида (III).
Формилирующую смесь готовят согласно примеру 1 и при температуре около 50°С прибавляют небольшими порциями 37.3 г (0.25 моль) N-орто-толилацетанилида. Полученную реакционную смесь выдерживают при указанной температуре в течение 1 часа, затем плавно поднимают температуру реакционной смеси до 90-100°С и выдерживают в течение 24 часа. Далее реакционную смесь охлаждают и выливают на 1,5 кг мелко размельченного льда. По окончании гидролиза (не менее 2-3 часов) образовавшуюся суспензию отфильтровывают, промывают водой до слабокислой или нейтральной реакции (рН>5). Выделяют 28 г (54%) продукта (III). Аналитически чистый образец получают перекристаллизацией из ацетона или хлороформа. Т.пл. 134-136°С (лит. 137-138°С, этилацетат, [9]).
H1-ЯМР спектр (δ, ДМСО-d6): 2.6 (3Н, с), 7.6 (1H, т, J=8.5 Гц), 7.9 (1Н, д, J=8.5 Гц), 8.0 (1H, д, J=8.5 Гц), 8.9 (1H, с), 10.2 (1H, с).
Пример 4.
Синтез 8-метил-2-оксо-1,2-дигидрохинолин-3-карбальдегида (IV).
Проводят по методике, приведенной в примере 2, с использованием продукта (III). Получают 26.5 г (74%) продукта (IV). Т.пл 299-300°С.
H1-ЯМР спектр (δ, ДМСО-d6): 2.4 (3Н, с); 7.1 (1H, т, J=8.5 Гц); 7.5 (1H, д, J=8.5 Гц); 7.7 (1Н, д, J=8.5 Гц); 8.5 (1Н, с); 10.1 (1Н, с); 11.0 (1H, уширенный пик).
Пример 5.
Синтез 2-хлор-7-метилхинолин-3-карбальдегида (V).
Проводят по методике, приведенной в примере 1. Получают 42 г (82%) продукта (V). Т.пл. 143-144°С (лит. 144-145°С, этилацетат, [9]).
H1-ЯМР спектр (δ, ДМСО-d6): 2.4 (3Н, с), 7.6 (1H, д, J=8.5 Гц), 7.7 (1H, д, J=3.5 Гц), 8.2 (1H, д, J=8.5 Гц), 8.9 (1H, с), 10.4 (1H, с).
Пример 6.
Синтез 7-метил-2-оксо-1,2-дигидрохинолин-3-карбальдегида (VI).
Проводят по методике, приведенной в примере 2. Получают 24.5 г (78%) целевого продукта. Т.пл. 296-297°С.
H1-ЯМР спектр (δ, ДМСО-d6): 2.2 (3Н, с); 6.9 (1H, д, J=8.5 Гц); 7.1 (1H, с); 7.7 (1H, д, J=8.5 Гц); 8.2 (1H, с); 10.1 (1H, с); 12.0 (1H, уширенный пик).
Пример 7.
Синтез 2-хлор-6-этоксихинолин-3-карбальдегида (VII).
Проводят по методике, приведенной в примере 3. Получают 36 г (60%) целевого продукта. Т.пл. 168-170°С.
H1-ЯМР спектр (δ, ДМСО-d6): 1.3 (3Н, т, J=7.5 Гц), 4.2 (2Н, q, J=7.5 Гц), 7.6 (3Н, м), 7.9 (1H, д, J=8.5 Гц), 8.8 (1Н, с), 10.4 (1H, с).
Пример 8.
Синтез 6-этокси-2-оксо-1,2-дигидрохинолин-3-карбальдегида (VIII).
Проводят по методике, приведенной в примере 2, с использованием продукта (VII). Получают 25 г (73%) продукта (VIII). Т.пл. 298-300°С (с разл.).
H1-ЯМР спектр (δ, ДМСО-d6): 1.1 (3Н, т, J=7.5 Гц); 4.0 (2Н, кв, J=7.5 Гц); 7.2 (2Н, м); 7.4 (1H, с); 8.4 (1H, с); 10.1 (1H, с); 12.0 (1H, уширенный пик).
Пример 9.
Синтез 2-хлор-5,8-диметилхинолин-3-карбальдегида (IX).
Проводят по методике, приведенной в примере 3. Получают 30 г (55%) целевого продукта. Т.пл. 184-185°С.
H1-ЯМР спектр (δ, ДМСО-d6): 2.6 (3Н, с), 2.7 (3Н, с), 7.4 (1H, д, J=8.5 Гц), 7.7 (1H, д, J=8.5 Гц), 8.8 (1Н, с), 10.4 (1Н, с).
Пример 10.
Синтез 5,8-диметил-2-оксо-1,2-дигидрохинолин-3-карбальдегида (X).
Проводят по методике, приведенной в примере 2, с использованием продукта (IX). Получают 26.5 г (74%) продукта (X). Т.пл. 297-298°С.
H1-ЯМР спектр (δ, ДМСО-d6): 2.2 (3Н, с); 2.5 (3Н, с); 6.9 (1H, д, J=8.5 Гц); 7.2 (1H, д, J=8.5 Гц); 8.5 (1H, с); 10.1 (1H, с); 11.1 (1H, уширенный пик).
Пример 11.
Синтез 2-хлор-7-метоксихинилин-3-карбальдегида (XI).
Проводят по методике, приведенной в примере 1. Выход 45 г (81%). Т.пл. 187-189°С (лит. 197-198°С, этилацетат, [9]).
H1-ЯМР спектр (δ, ДМСО-d6): 3.8 (3Н, с), 7.3 (3Н, м), 8.1 (1H, д, J=8.5 Гц), 8.8 (1H, с), 10.4 (1H, с).
Пример 12.
Синтез 7-метокси-2-оксо-1,2-дигидрохинолин-3-карбальдегида (XII).
Проводят по методике, приведенной в примере 2, с использованием продукта (XI). Получают 22 г (64%) продукта (XII). Т.пл. 286-288°С.
H1-ЯМР спектр (δ, ДМСО-d6): 3.8 (3Н, с), 6.7 (1H, д, J=3.5 Гц), 6.8 (1Н. d/d, J=8.5 Гц / 3.5 Гц), 7.8 (1Н, д, J=8.5 Гц), 8.4 (1H, с), 10.2 (1Н, с), 12.0 (1H, уширенный пик).
Пример 13.
Синтез 2-хлор-6-этилхинолин-3-карбальдегида (XIII).
Проводят по методике, приведенной в примере 1. Получают 40 г (78%) продукта (XIII). Т.пл. 95-97°С.
H1-ЯМР спектр (δ, ДМСО-d6): 1.2 (3Н, т, J=7.5 Гц); 2.9 (2Н, кв, J=7.5 Гц); 7.85 (1H, д/д, J=8.5 Гц / J=3.5 Гц); 7.95 (1H, д, J=8.5 Гц); 8.05 (1H, д, J=3.5 Гц); 8.9 (1H, с); 10.2 (1H, с).
Пример 14.
Синтез 6-этил-2-оксо-1,2-дигидрохинолин-3-карбальдегида (XIV).
Проводят по методике, приведенной в примере 2, с использованием продукта (XIII). Получают 24.5 г (78%) продукта (XIV). Т.пл. 240-241°С.
H1-ЯМР спектр (δ, ДМСО-d6): 1.2 (3Н, т, J=7.5 Гц); 2.65 (2Н, кв, J=7.5 Гц); 7.3 (1H, д, J=8.5 Гц); 7.5 (1H, д/д, J=8.5 Гц / J=3.5 Гц); 7.7 (1H, д, J=3.5 Гц); 8.3 (1H, с); 10.2 (1H. с); 12.0 (1H, уширенный пик).
Пример 15.
Синтез 2-хлор-7,8-диметилхинолин-3-карбальдегида (XV).
Проводят по методике, приведенной в примере 1. Получают 40 г (75%) продукта (XV). Т.пл. 124-126°С.
H1-ЯМР спектр (δ, ДМСО-d6): 2.4 (3Н, с), 2.6 (3Н, с), 7.5 (1Н, д, J=8.5 Гц), 8.0 (1Н, д, J=8.5 Гц), 8.8 (1Н, с), 10.4 (1Н, с).
Пример 16.
Синтез 7,8-диметил-2-оксо-1,2-дигидрохинолин-3-карбальдегида (XVI).
Проводят по методике, приведенной в примере 2, с использованием продукта (XV). Получают 26.5 г (74%) продукта (XVI). Т.пл. >330°С.
H1-ЯМР спектр (δ, ДМСО-d6): 2.4 (3Н, с); 2.6 (3Н, с); 7.2 (1Н, д, J=8.5 Гц); 7.6 (1Н, д, J=8.5 Гц); 8.3 (1Н, с), 10.3 (1Н, с); 11.6 (1Н, уширенный пик).
Пример 17.
Синтез 2-хлор-6,7-диметилхинолин-3-карбальдегида (XVII).
Проводят по методике, приведенной в примере 1. Получают 39 г (70%) продукта (XVII). Т.пл. 164-166°С.
H1-ЯМР спектр (δ, ДМСО-d6): 2.3 (3Н, с), 2.4 (3Н, с), 7.6 (1Н, с), 7.9 (1Н, с), 8.7 (1Н, с), 10.4 (1Н, с).
Пример 18.
Синтез 6,7-диметил-2-оксо-1,2-дигидрохинолин-3-карбальдегида (XVIII).
Проводят по методике, приведенной в примере 2, с использованием продукта (XVII). Получают 26.5 г (74%) продукта (XVIII). Т.пл. 236-238°С.
H1-ЯМР спектр (δ, ДМСО-d6): 2.3 (3Н, с), 2.4 (3Н, с), 7.1 (1Н, с), 7.5 (1Н, с), 8.2 (1Н, с), 10.2 (1Н, с), 12.0 (1Н, уширенный пик).
Пример 19.
Синтез 6-хлор-[1,3]диоксоло[4,5-g]хинолин-7-карбальдегида (XIX).
Проводят по методике, приведенной в примере 1. Получают 40 г (72%) продукта (XIX). Т.пл. 188-190°С.
H1-ЯМР спектр (δ, ДМСО-d6): 6.3 (2Н, с), 7.4 (1Н, с), 7.6 (1Н, с), 8.7 (1Н, с), 10.4 (1Н, с).
Пример 20.
Синтез 6-оксо-5,6-дигидро-[1,3]диоксоло[4,5-g]хинолин-7-карбальдегида (XX).
Проводят по методике, приведенной в примере 2, с использованием продукта (XIX). Получают 28 г (80%) продукта (XX). Т.пл. >300°С.
H1-ЯМР спектр (δ, ДМСО-d6): 6.1 (2Н, с), 6.6 (1Н, с), 7.6 (1Н, с), 8.6 (1H, с), 10.2 (1Н, с), 12.0 (1Н, уширенный пик).
Пример 21.
Синтез 7-хлор-2,3-дигидро-[1,4]диоксино[2,3-g]хинолин-8-карбальдегида (XXI).
Проводят по методике, приведенной в примере 1. Получают 42 г (73%) продукта (XXI). Т.пл.226-228°С.
H1-ЯМР спектр (δ, ДМСО-d6): 4.1 (4Н, с), 7.5 (1Н, с), 8.0 (1Н, с), 8.5 (1Н, с), 10.5 (1Н, с).
Пример 22.
Синтез 7-оксо-6,7-дигидро-[1,4]диоксино[2,3-g]хинолин-8-карбальдегида (XXII).
Проводят по методике, приведенной в примере 2, с использованием продукта (XXI). Получают 28 г (80%) продукта (XXII). Т.пл. >300°С.
H1-ЯМР спектр (δ, ДМСО-d6): 6.1 (2Н, с), 6.6 (1Н, с), 7.6 (1H, с), 8.6 (1Н, с), 10.2 (1Н, с), 12.0 (1Н, уширенный пик).
Пример 23.
Синтез 2-хлор-6,8-диметилхинолин-3-карбальдегида (XXIII).
Проводят по методике, приведенной в примере 3. Получают 35 г (65%) продукта (XXIII). Т.пл. 107-108°С (лит. 110-111°С, [12]).
H1-ЯМР спектр (δ, ДМСО-d6): 2.4 (3Н, с), 2.6 (3Н, с), 7.6 (1Н, с), 7.7 (1Н, с), 8.7 (1Н, с), 10.4 (1Н, с).
Пример 24.
Синтез 6,8-диметил-2-оксо-1,2-дигидрохинолин-3-карбальдегида (XXIV).
Проводят по методике, приведенной в примере 2, с использованием продукта (XXIII). Получают 24.5 г (78%) продукта (XXIV). Т.пл. 299-301°С.
H1-ЯМР спектр (δ, ДМСО-d6): 2.2 (3Н, с); 2.4 (3Н, с); 7.2 (1Н, с); 7.5 (1Н, с); 8.4 (1Н, с); 10.1 (1Н, с); 11.2 (1Н, уширенный пик).
Пример 25.
Синтез 2-хлор-7-этоксихинолин-3-карбальдегида (XXV).
Проводят по методике, приведенной в примере 3. Получают 36 г (60%) продукта (XXV). Т.пл. 166-167°С.
H1-ЯМР спектр (δ, ДМСО-d6): 1.4 (3Н, т, J=7.5 Гц); 4.25 (2Н, кв, J=7.5 Гц); 7.2 (1Н, д/д, J=8.5/3.5 Гц); 7.4 (1Н, д, J=3.5 Гц); 8.1 (1Н, д, J=8.5 Гц); 8.9 (1Н, с); 10.1 (1Н, с).
Пример 26.
Синтез 7-этокси-2-оксо-1,2-дигидрохинолин-3-карбальдегида (XXVI).
Проводят по методике, приведенной в примере 2, с использованием продукта (XXV). Получают 22 г (64%). Т.пл. 288-290°С.
H1-ЯМР спектр (δ, ДМСО-d6): 1.35 (3Н, т, J=7.5 Гц); 4.1 (2Н, кв, J=7.5 Гц); 6.8 (1Н, д, J=3.5 Гц); 6.9 (1Н, д/д, J=8.5/3.5 Гц); 7.8 (1Н, д, J=8.5 Гц); 8.2 (1Н, с); 10.1 (1Н, с); 12.0 (1Н, уширенный пик).
Пример 27.
Синтез 2-хлор-5,7-диметилхинолин-3-карбальдегида (XXVII).
Проводят по методике, приведенной в примере 1. Получают 44 г (78%) продукта (XXVII). Т.пл. 96-98°С.
H1-ЯМР спектр (δ, ДМСО-d6): 2.5 (3Н, с), 2.7 (3Н, с), 7.4 (1Н, с), 7.6 (1Н, с), 8.8 (1Н, с), 10.4 (1Н, с).
Пример 28.
Синтез 5,7-диметил-2-оксо-1,2-дигидрохинолин-3-карбальдегида (XXVIII).
Проводят по методике, приведенной в примере 2, с использованием продукта (XXVII). Получают 24.5 г (78%) продукта (XXVIII). Т.пл. 253-254°С.
H1-ЯМР спектр (δ, ДМСО-d6): 2.3 (3Н, с), 6.9 (1Н, с), 7.0 (1Н, с), 8.45 (1Н, с), 10.2 (1Н, с), 12.0 (1Н, уширенный пик).
Пример 29.
Синтез 2-хлор-хинолин-3-карбальдегида (XXIX).
Проводят по методике, приведенной в примере 1. Получают 37 г (78%) продукта (XXIX). Т.пл. 178-180°С.
H1-ЯМР спектр (δ, ДМСО-d6): 7.4 (1Н, т, J=8.5 Гц); 7.6 (1Н, д, J=8.5 Гц); 7.8 (1Н, т, J=8.5 Гц); 8.9 (1Н, с); 10.2 (1Н, с).
Пример 30.
Синтез 2-оксо-1,2-дигидрохинолин-3-карбальдегида (XXX).
Проводят по методике, приведенной в примере 2, с использованием продукта (XXIX). Получают 24.5 г (78%) продукта (XXX). Т.пл. 307-310°С.
H1-ЯМР спектр (δ, ДМСО-d6): 7.1 (1Н, т, J=8.5 Гц); 7.3 (1Н, д, J=8.5 Гц); 7.6 (1Н, т, J=8.5 Гц); 8.5 (1Н, с); 10.0 (1Н, с); 12.0 (1Н, уширенный пик).
Пример 31.
Синтез 2-хлор-6-изопропилхинолин-3-карбальдегида (XXXI).
Проводят по методике, приведенной в примере 1. Получают 40 г (68%) продукта (XXXI). Т.пл. 125-126°С.
H1-ЯМР спектр (δ, ДМСО-d6): 1.35 (6Н, д, J=7.5 Гц), 3.06 (1Н, м), 7.77 (1Н, д, J=8.5 Гц), 7.89 (1Н, д, J=8.5 Гц), 8.02 (1Н, д, J=3.5 Гц), 8.76 (1Н, с), 10.55 (1Н, с).
Пример 32.
Синтез 6-изопропил-2-оксо-1,2-дигидрохинолин-3-карбальдегида (XXXII).
Проводят по методике, приведенной в примере 2, с использованием продукта (XXXI). Получают 24.5 г (78%) продукта (XXXII). Т.пл. 221-222°С.
H1-ЯМР спектр (δ, ДМСО-d6): 1.2 (6Н, д, J=8.5 Гц); 2.95 (1Н, сеп, J=7.5 Гц); 7.2 (1Н, д, J=8.5 Гц); 7.5 (1Н, д/д, J=8.5/3.5 Гц); 7.9 (1Н, д, J=3.5 Гц); 8.4 (1Н, с); 10.2 (1Н, с); 12.0 (1Н, уширенный пик).
Пример 33.
Синтез 2-хлор-5,6,7-триметоксихинолин-3-карбальдегида (XXXIII).
Проводят по методике, приведенной в примере 1. Получают 44 г (78%) продукта (XXXIII). Т.пл. 114-116°С.
H1-ЯМР спектр (δ, ДМСО-d6): 3.9 (3Н, с); 4.0 (3Н, с); 4.1 (3Н, с); 7.3 (1Н, с); 8.75 (1Н, с); 10.3 (1Н, с).
Пример 34.
Синтез 5,6,7-триметокси-2-оксо-1,2-дигидрохинолин-3-карбальдегида (XXXIV).
Проводят по методике, приведенной в примере 2, с использованием продукта (XXXIII). Получают 24.5 г (78%) продукта (XXXIV). Т.пл. 268-270°С (с разлож.).
H1-ЯМР спектр (δ, ДМСО-d6): 3.7 (3Н, с); 3.8 (3Н, с); 3.9 (3Н, с); 6.7 (1Н, с); 8.4 (1Н, с); 10.2 (1Н, с); 12.0 (1Н, уширенный пик).
Пример 35.
Синтез 2-хлор-6-третбутилхинолин-3-карбальдегида (XXXV).
Проводят по методике, приведенной в примере 1. Получают 38 г (62%) продукта (XXXV). T.пл.101-102°C.
H1-ЯМР спектр (δ, ДМСО-d6): 1.36 (9Н, с), 7.59 (1Н, д, J=8.5 Гц), 7.92 (1Н, д, J=8.5 Гц), 8.13 (1Н, д, J=3.5 Гц), 8.95 (1Н, с), 10.55 (1Н, с).
Пример 36.
Синтез 6-третбутил-2-оксо-1,2-дигидрохинолин-3-карбальдегида (XXXVI).
Проводят по методике, приведенной в примере 2, с использованием продукта (XXXV). Получают 26.5 г (67%) целевого продукта. Т.пл. 228-230°С.
H1-ЯМР спектр (δ, ДМСО-d6): 1.25 (9Н, с); 7.2 (1Н, д, J=8.5 Гц); 7.5 (1Н, д, J=8.5 Гц); 7.95 (1Н, д, J=3.5 Гц); 8.5 (1Н, с); 10.2 (1Н, с); 12.0 (1Н, уширенный пик).
Пример 37.
Синтез 2-хлор-6-пропилхинолин-3-карбальдегида (XXXVII).
Проводят по методике, приведенной в примере 1. Получают 40 г (68%) продукта (XXXVII). Т.пл. 105-106°С.
H1-ЯМР спектр (δ, ДМСО-d6): 0.9 (3Н, т, J=7.5 Гц); 1.6 (2Н, кв, J=7.5 Гц); 2.6 (2Н, т, J=7.5 Гц); 7.4 (1Н, д, J=8.5 Гц); 7.8 (1Н, д, J=8.5 Гц); 8.2 (1Н, с); 8.8 (1Н, с); 10.3 (1Н, с).
Пример 38.
Синтез 6-пропил-2-оксо-1,2-дигидрохинолин-3-карбальдегида (XXXVIII).
Проводят по методике, приведенной в примере 2, с использованием продукта (XXXVII). Получают 25 г (68%) продукта (XXXVIII). Т.пл. 213-215°С.
H1-ЯМР спектр (δ, ДМСО-d6): 0.9 (3Н, т, J=7.5 Гц); 1.6 (2Н, кв, J=7.5 Гц); 2.5 (2Н, т, J=7.5 Гц); 7.1 (1Н, д, J=8.5 Гц); 7.5 (1Н, д, J=8.5 Гц); 7.8 (1Н, с); 8.4 (1Н, с); 10.1 (1Н, с); 12.0 (1H, уширенный пик).
Пример 39.
Синтез 2-хлор-7,8-дигидро-6Н-циклопента[g]хинолин-3-карбальдегида(IXL).
Проводят по методике, приведенной в примере 1. Получают 40 г (68%) продукта (IXL). T.пл.138-140°C.
H1-ЯМР спектр (δ, ДМСО-d6): 2.1 (2Н, м, J=7.5 Гц); 3.05 (2Н, м, J=7.5 Гц); 3.15 (2Н, м, J=7.5 Гц); 7.8 (1Н, с); 8.05 (1Н, с); 8.8 (1Н, с); 10.4 (1Н, с).
Пример 40.
Синтез 2-оксо-2,6,7,8-тетрагидро-1Н-циклопента[g]хинолин-3-карбальдегида (XL).
Проводят по методике, приведенной в примере 2, с использованием продукта (IXL). Получают 40 г (68%) продукта (XL). Т.пл. >310°С.
Н-ЯМР спектр (δ, ДМСО-d6): 2.0 (2Н, м, J=7.5 Гц); 2.9 (2Н, м, J=7.5 Гц); 3.0 (2Н, м, J=7.5 Гц); 7.1 (1Н, с); 7.6 (1Н, с); 8.2 (1H, с); 10.1 (1Н, с); 12.0 (1Н, уширенный пик).
Пример 41.
Синтез 2-хлор-6-метокси-3-карбальдегида (XLI).
Проводят по методике, приведенной в примере 3. Получают 40 г (68%) продукта (XLI).T.пл. 158-159°C.
H1-ЯМР спектр (δ, ДМСО-d6): 3.8 (3Н, с); 7.9 (1Н, д/д, J=8.5 Гц/3.5 Гц); 8.1 (1Н, д, J=8.5 Гц); 8.2 (1Н, д, J=3.5 Гц); 9.0 (1Н, с); 10.2 (1Н, с).
Пример 42.
Синтез 6-метокси-2-оксо-1,2-дигидрохинолин-3-карбальдегида (XLII).
Проводят по методике, приведенной в примере 2, с использованием продукта (XLI). Получают 25 г (68%) продукта (XLII). Т.пл. 282-284°С.
H1-ЯМР спектр (δ, ДМСО-d6): 3.7 (3Н, с); 7.5 (1Н, д/д, J=8.5 Гц / 3.5 Гц); 7.9 (1Н, д, J=8.5 Гц); 8.0 (1Н, д, J=3.5 Гц); 8.6 (1Н, с); 10.0 (1H, с); 12.0 (1Н, уширенный пик).
В примерах 43-82 показано получение различных замещенных п-фенилендиамина в соответствии со схемой (II). Эти примеры отличаются использованием различных аминов.
Пример 43.
Синтез 1-(4-нитрофенил)-пирролидина (XLIII).
Смесь 4-хлорнитробензола (16 г, 0.1 моль) и 30 мл пирролидина (25.5 г, 0.36 моль) нагревают при перемешивании с обратным холодильником при температуре порядка 80-85°С. По окончании реакции смесь разбавляют водой (200-300 мл). Образовавшийся продукт в виде густого масла затирают до затвердевания и отделяют фильтрованием. Полученный таким образом продукт очищают пропусканием через слой силикагеля (КСК, 60\100 мкм) в системе гексан-эфир. Фракции, содержащие продукт, концентрируют в вакууме. Получают 13.6 г (71%) продукта XLIII.
LC-Mass (М+Н)+: 193
Пример 44.
Синтез 4-пирролидин-1-ил-анилина (XLIV).
Полученный в предыдущем примере 1-(4-нитрофенил)-пирролидин (13.6 г, 0.07 моль) растворяют в 100 мл чистого метанола и гидрируют в присутствии палладия на активированном угле (10% мас., 1.5 гр., 1.4 ммоль) при 2-2.5 атм и температуре не более 20°С на установке Parr Instruments (USA). По окончании реакции реакционную смесь фильтруют и концентрируют при пониженном давлении. Получают 8.1 г (70%) продукта XLIV.
LC-Mass (М+Н)+: 163
Пример 45.
Синтез 1-(4-нитрофенил)-пиперидина (XLV).
Проводят по методике, приведенной в примере 43, используя вместо пирролидина пиперидин. Получают 17.6 г (85%) продукта XLV.
LC-Mass (M+H)+: 207
Пример 46.
Синтез 4-пиперидин-1-ил-анилина (XLVI).
Проводят по методике, приведенной в примере 44, с использованием продукта (XLV). Получают 12 г (80%) продукта XLVI.
LC-Mass (М+Н)+: 177.
Пример 47.
Синтез 4-метил-1-(4-нитрофенил)-пиперидина (XLVII).
Проводят по методике, приведенной в примере 43, используя вместо пирролидина 4-метилпиперидин. Получают 17.1 г (77%) продукта XLVII.
LC-Mass (M+H)+: 221.
Пример 48.
Синтез 4-(4-метилпиперидин-1-ил)-анилина (XLVIII).
Проводят по методике, приведенной в примере 44, с использованием продукта (XLVII) Получают 12 г (80%) продукта XLVIII.
LC-Mass (M+H)+: 191
Пример 49.
Синтез 3-метил-1-(4-нитрофенил)-пиперидина (IL).
Проводят по методике, приведенной в примере 43, используя вместо пирролидина 3-метилпиперидин. Получают 16.2 г (73%) продукта IL.
LC-Mass (М+Н)+: 221.
Пример 50.
Синтез 4-(3-метилпиперидин-1-ил)-анилина (L).
Проводят по методике, приведенной в примере 44, с использованием продукта (IL) Получают 10.5 г (77%) продукта L.
LC-Mass (М+Н)+: 191
Пример 51.
Синтез 3,5-диметил-1-(4-нитрофенил)-пиперидина (LI).
Проводят по методике, приведенной в примере 43, используя вместо пирролидина 3,5-диметилпиперидин. Получают 17.8 г (76%) продукта LI.
LC-Mass (М+Н)+: 235.
Пример 52.
Синтез 4-(3,5-диметилпиперидин-1-ил)-анилина (LII).
Проводят по методике, приведенной в примере 44, с использованием продукта (LI) Получают 11.2 г (72%) продукта LII.
LC-Mass (M+H)+: 205.
Пример 53.
Синтез 4-гидрокси-1-(4-нитрофенил)-пиперидина (LIII).
Проводят по методике, приведенной в примере 43, используя вместо пирролидина 4-гидроксипиперидин. Получают 16.7 г (75%) продукта LIII.
LC-Mass (М+Н)+: 223.
Пример 54.
Синтез 4-(4-гидроксипиперидин-1-ил)-анилина (LIV).
Проводят по методике, приведенной в примере 44, с использованием продукта (LIII). Получают 12.1 г (84%) продукта LIV.
LC-Mass (М+Н)+: 193.
Пример 55.
Синтез 3-гидрокси-1-(4-нитрофенил)-пиперидина (LV).
Проводят по методике, приведенной в примере 43, используя вместо пирролидина 3-гидроксипиперидин. Получают 15.2 г (69%) продукта LV.
LC-Mass (M+H)+: 223.
Пример 56.
Синтез 4-(3-гидроксипиперидин-1-ил)-анилина (LVI).
Проводят по методике, приведенной в примере 44, с использованием продукта (LV) Получают 11.2 г (79%) продукта LVI.
LC-Mass (M+H)+: 193.
Пример 57.
Синтез 1-(4-нитрофенил)-пиперидин-4-этилкарбоксилат (LVII).
Проводят по методике, приведенной в примере 43, используя вместо пирролидина этилизонипекотат. Получают 20.7 г (74%) продукта LVII.
LC-Mass (М+Н)+: 279.
Пример 58.
Синтез 4-(4-карбоэтоксипиперидин-1-ил)-анилина (LVIII).
Проводят по методике, приведенной в примере 44, с использованием продукта (LVII) Получают 15.2 г (83%) продукта LVIII.
LC-Mass (M+H)+: 249.
Пример 59.
Синтез 1-(4-нитрофенил)-пиперидин-3-этилкарбоксилат (LIX).
Проводят по методике, приведенной в примере 43, используя вместо пирролидина этилнипекотат. Получают 18.6 г (67%) продукта LIX.
LC-Mass (М+Н)+: 279.
Пример 60.
Синтез 4-(3-карбоэтоксипиперидин-1-ил)-анилина (LX).
Проводят по методике, приведенной в примере 44, с использованием продукта (LIX) Получают 13.1 г (79%) продукта LX.
LC-Mass (M+H)+: 249.
Пример 61.
Синтез 1-(4-нитрофенил)-пиперидин-4-карбамид (LXI).
Смесь 4-хлорнитробензола (16 г, 0.1 моль) и изонипекотамида (27.5 г, 0.22 моль) в 50 мл диметилформамида нагревают при перемешивании с обратным холодильником при температуре порядка 100°С. По окончании реакции смесь разбавляют водой (200-300 мл). Образовавшийся продукт в виде густого масла затирают до затвердевания и отделяют фильтрованием. Полученный таким образом продукт очищают пропусканием через слой силикагеля (КСК, 60/100 мкм) в системе гексан-этилацетат. Фракции, содержащие продукт, концентрируют в вакууме. Получают 15.8 г (63%) продукта LXI.
LC-Mass (М+Н)+: 250.
Пример 62.
Синтез 4-(4-карбамидопиперидин-1-ил)-анилина (LXII).
Проводят по методике, приведенной в примере 44, с использованием продукта (LXI). Получают 10.1 г (76%) продукта LXII.
LC-Mass (M+H)+: 220.
Пример 63.
Синтез циклогексил-метил-(4-нитрофенил)-амина (LXIII).
Проводят по методике, приведенной в примере 43, используя вместо пирролидина N-метилциклогексиламин. Получают 14.2 г (60%) продукта LXIII.
LC-Mass (М+Н)+: 235.
Пример 64.
Синтез N-циклогексил-N-метил-пара-фенилендиамина (LXIX).
Проводят по методике, приведенной в примере 44, с использованием продукта (LXIII). Получают 8.7 г (71%) продукта LXIX.
LC-Mass (М+Н)+: 205.
Пример 65.
Синтез 1-метил-4(4-нитрофенил)-пиперазина (LXV).
Проводят по методике, приведенной в примере 43, используя вместо пирролидина N-метилпиперазин. Получают 15.3 г (69%) продукта LXV.
LC-Mass (M+H)+: 222.
Пример 66.
Синтез 4-(4-метил-пиперизин-1-ил)-анилина (LXVI).
Проводят по методике, приведенной в примере 44, с использованием продукта (LXV). Получают 9.6 г (72%) продукта LXVI.
LC-Mass (М+Н)+: 192.
Пример 67.
Синтез 1-[4-(4-нитрофенил)-пиперазин-1-ил]-ацетамида (LXVII).
Проводят по методике, приведенной в примере 61, используя вместо изонипекотамида N-ацетилпиперазин. Получают 19.1 г (77%) продукта LXVII.
LC-Mass (M+H)+: 250.
Пример 68.
Синтез 1-[4-(4-аминофенил)-пиперазин-1-ил]-ацетамида (LXVIII).
Проводят по методике, приведенной в пример