2-тиозамещенные производные имидазола, их применение и фармацевтическое средство на их основе
Иллюстрации
Показать всеИзобретение относится к 2-тиозамещенным производным имидазола формулы I, их оптическим изомерам и физиологически приемлемым солям. в которой R1, R2, R3 и R4 имеют приведенные в п.1 формулы изобретения определения. Соединения обладают иммуномодулирующим и/или ингибирующим высвобождение цитокина действием и пригодны для лечения заболеваний, связанных с нарушением иммунной системы. Изобретение также относится к фармацевтическому средству, ингибирующему высвобождение цитокинов на основе соединений формулы I, и применению этих соединений для получения фармацевтического средства, ингибирующего высвобождение цитокинов для лечения заболеваний, связанных с нарушением иммунной системы. 3 н. и 10 з.п. ф-лы, 2 табл.
Реферат
Настоящее изобретение относится к 2-тиозамещенным производным имидазола с иммунномодулирующим и ингибирующим высвобождение цитокина действием, к содержащим эти соединения фармацевтическим средствам и к их применению в фармацевтической промышленности.
Фармакологически эффективные соединения имидазола, которые обладают антивоспалительным действием, уже известны.
Так, например, среди прочего, были более подробно исследованы соединения с фрагментами 4,5-ди-(гетеро)арилимидазола и описаны их различные фармацевтические действия. Также известны соединения, которые имеют замещение во 2-положении. В патенте США 4585771 раскрыты 4,5-дифенилимидазолы, которые во 2-положении замещены пирролильным, индолильным, имидазолильным или триазолильным остатком и обладают антивоспалительной и антиаллергической активностью.
Патенты США 4528298 и 4402960 описывают производные 4,5-ди(гетеро)арилимидазолов, которые во 2-положении замещены через тиогруппу, сульфинильную или сульфонильную группу фенильным, пиридильным, N-оксипиридильным, пиримидильным, тиазолильным или тиенильным остатком, и обладают антивоспалительной и антиаллергической активностью. Патенты США 4461770 и 4584310 описывают производные 4-(5-арил)-5-(4-гетероарил)имидазола, которые во 2-положении замещены через тиогруппу, сульфинильную или сульфонильную группу замещенным или незамещенным алифатическим углеводородом, и среди прочего, имеют антивоспалительное действие.
Публикация DE 19842833 относится к производным 4-гетероарил-5-фенилимидазолов, которые во 2-положении замещены фенилалкилтиогруппой. Эти соединения эффективны в качестве ингибиторов воспалений и ингибиторов высвобождения цитокина. В международных заявках WO 99/03837 и WO 93/14081 описываются 2-замещенные имидазолы, которые ингибируют синтез воспалительных цитокинов. Описанные в WO 93/14081 соединения имеют во 2-положении связанный через атом серы, содержащий фосфор заместитель или арильный или гетероарильный заместитель. Заявка WO 91/10662 описывает производные имидазола, которые ингибируют ацил-коферменты А: холестерол-О-ацилтрансферазы и связь тромбоксана ТхА2. Заявка WO 95/00501 описывает производные имидазола, которые пригодны в качестве ингибиторов циклооксигеназы. Описанные в DE 2823197 А производные имидазола имеют антивоспалительное, антиаллергическое и иммуностимулирующее действие.
Публикация J. Med. Chem. 1996, 39, 3927-37 описывает соединения с ингибирующим 5-липоксигеназу и циклооксидазу действием, причем 2-(4-метилсульфинилфенил)-4-(4-фторфенил)-5-(пирид-4-ил)имидазол обладает также и ингибирующим цитокин действием.
Было установлено, что известные соединения не стабильны, очень трудно перерабатываются или же имеют малую эффективность.
Несмотря на множество известных соединений имеется потребность в соединениях с антивоспалительным действием, которые ингибируют высвобождение цитокина.
Задача изобретения заключается в разработке подобных соединений.
Неожиданным образом было установлено, что определенные 2-замещенные производные имидазола обеспечивают стабильные, легко перерабатываемые соединения, которые имеют антивоспалительное и/или ингибирующее высвобождение цитокина действие.
Объектом настоящего изобретения являются, таким образом, 2-тиозамещенные производные имидазола формулы I
где R1 выбран из группы, включающей:
C1-С6-алкил, который необязательно замещен одной или двумя гидрокси- или С1-С4-алкоксигруппами, или неароматическим гетероциклическим остатком с 5 или 6 кольцевыми атомами и 1 или 2 гетероатомами, которые независимо друг от друга выбраны из группы, включающей N, О и S,
С2-С6-алкенил,
С3-С6-циклоалкил,
арил, который необязательно замещен одним или несколькими атомами галогена или С1-С4-алкилсульфанильной группой, амино-С1-С4-алкил, причем аминогруппа необязательно замещена одной или двумя С1-С4-алкильными группами,
аминоарил, причем аминогруппа необязательно замещена одной или двумя С1-С4-алкильными группами,
арил-С1-С4-алкил или
ароматический или неароматический гетероциклический остаток с 5 или 6 кольцевыми атомами и 1 или 2 гетероатомами, которые независимо друг от друга выбраны из группы, включающей N, О и S, который необязательно замещен 1, 2, 3 или 4 С1-С4-алкильными группами, арильной или арил-С1-С4-алкильной группой,
R2 выбран из группы, включающей:
Н;
С1-С6-алкил,
фенил-С1-С4-алкил, причем фенильная группа может иметь один или два заместителя, которые независимо друг от друга выбраны из группы, включающей С1-С4-алкил, галоген, С1-С4-алкилсульфанил, С1-С4-алкилсульфинил и С1-С4-алкилсульфонил,
С2-С6-алкенил,
С2-С6-алкенил, который замещен одним или двумя атомами галогена и/или фенильными группами, причем фенильная группа независимо может быть замещена одним или двумя С1-С4-алкилами или атомами галогена,
С2-С6-алкинил,
С2-С6-алкинил, который замещен фенильной группой, которая необязательно может быть замещена одним или двумя С1-С4-алкилами или атомами галогена,
С1-С6-алкил, который замещен неароматическим гетероциклическим остатком с 5 или 6 кольцевыми атомами и 1 или 2 гетероатомами, выбранными независимо друг от друга из группы, включающей N, О, и S, С1-С4-алкилсульфанил, С1-С4-алкилсульфинил или С1-С4-алкилсульфонил,
фенил или
означает фенил, который имеет один или два заместителя, которые независимо друг от друга выбраны из группы, включающей С1-С4-алкил, галоген, С1-С4-алкилсульфанил, С1-С4-алкилсульфинил или С1-С4-алкилсульфонил, или
R1 и R2 вместе означают группировки -СН2СН2- или -СН2СН2СН2-,
один из остатков R3 и R4 означает С1-С6-алкил или ароматический гетероциклический остаток с 5 или 6 кольцевыми атомами и 1 или 2 гетероатомами, которые независимо друг от друга выбраны из группы, включающей N, О и S, причем ароматический гетероциклический остаток может иметь 1 или 2 заместителя, которые независимо друг от друга выбраны из группы, включающей С1-С6-алкил, амино, C1-С4-алкиламино, ди-С1-С4-алкиламино, фенил-С1-С4-алкиламино и группировку R5CONR6-, где R5 означает С1-С4-алкил, фенил, может иметь один или два заместителя, которые независимо друг от друга выбраны из группы, включающей С1-С4-алкил, С1-С4-алкокси и галоген или означает С3-С6-циклоалкил и R6 означает Н, С1-С4-алкил или бензил, и
второй из остатков R3 и R4 означает С1-С6-алкил или арил, который необязательно замещен атомом галогена, причем только один из остатков R3 и R4 может означать С1-С6-алкил,
при условии, что если R1 означает арил-С1-С5-алкил или амино-С1-С6-алкил, то R2 означает алкилсульфонил- или алкилсульфинил-арил-С1-С5-алкил,
и их оптические изомеры и физиологически переносимые соли.
Предпочтительны соединения формулы I, где R1 означает С1-С6-алкил, который необязательно замещен одной или двумя гидроксигруппами или неароматическим гетероциклическим остатком, С2-С6-алкенил, С3-С6-циклоалкил, арил, который необязательно замещен одним или несколькими атомами галогена или С1-С4-алкилсульфанильной группой, амино-С1-С4-алкил, причем аминогруппа необязательно замещена одной или двумя С1-С4-алкильными группами, аминоарил, причем аминогруппа необязательно замещена одной или двумя С1-С4-алкильными группами, арил-С1-С4-алкил или ароматический или неароматический гетероциклический остаток с 5 или 6 атомами цикла и 1 или 2 гетероатомами, выбранными независимо друг от друга из группы, включающей N, О и S, который необязательно замещен 1, 2, 3 или 4 С1-С4-алкильными группами, арильной или арил-С1-С4-алкильной группой,
R2 означает Н, С1-С6-алкил, фенил-С1-С4-алкил, причем фенильная группа может иметь один или два заместителя, которые независимо друг от друга выбраны из группы, включающей С1-С4-алкил, галоген, С1-С4-алкилсульфанил, С1-С4-алкилсульфинил и С1-С4-алкилсульфонил, С2-С6-алкенил, С2-С6-алкенил, который замещен одним или двумя атомами галогена и/или фенильными группами, причем фенильная группа может быть независимо замещена одним или двумя С1-С4-алкилами или атомами галогена, С2-С6-алкинил, С2-С6-алкинил, который замещен фенильной группой, которая необязательно может быть замещена одним или двумя С1-С4-алкилами или атомами галогена, C1-С6-алкил, который замещен неароматическим гетероциклическим остатком с 5 или 6 кольцевыми атомами и 1 или 2 гетероатомами, которые независимо друг от друга выбраны из группы, включающей N, О, и S,
один из остатков R3 и R4 означает C1-С6-алкил или ароматический гетероциклический остаток с 5 или 6 кольцевыми атомами и 1 или 2 гетероатомами, которые независимо друг от друга выбраны из группы, включающей N, О и С, причем ароматический гетероциклический остаток может иметь 1 или 2 заместителя, которые независимо друг от друга выбраны из группы, включающей C1-С6-алкил, амино, С1-С4-алкиламино, ди-С1-С4-алкиламино, фенил-С1-С4-алкиламино, R5CONR6-, где R5 означает С1-С4-алкил, фенил, который может иметь один или два заместителя, которые независимо друг от друга выбраны из группы, включающей С1-С4-алкил, С1-С4-алкокси и галоген, или С3-С6-циклоалкил, и R6 означает Н, С1-С4-алкил или бензил, и второй из остатков R3 и R4 означают С1-С6-алкил или арил, который необязательно замещен атомом галогена, причем один из остатков R3 и R4 может означать С1-С6-алкил.
Если соединения по изобретению имеют центры асимметрии, то при этом подразумеваются рацематы, а также оптические изомеры (энантиомеры, диастереомеры).
Термин "алкил" (также и в соединениях с другими группами, такими, как фенилалкил, алкилсульфонил и т.п.) включает линейные и разветвленные алкильные группы предпочтительно с 1 до 6, или с 1 до 4 атомами углерода, такие, как метил, этил, н- и изо-пропил, н-, и- и трет-бутил, втор-бутил, н-пентил и н-гексил.Термин "арил" включает ароматические циклические системы, такие, как фенил или нафтил.
Термин "галоген" означает атом фтора, хлора, брома или йода, в частности атом фтора или хлора.
С3-С6-циклоалкильные группы представляют собой циклопропил, циклобутил и, в частности, циклопентил и циклогексил.
Неароматические гетероциклические остатки могут быть насыщенными или ненасыщенными. Предпочтительны пиперидинил, пиперазинил, пиранил, морфолинил или пирролидинил, причем пиперидинильный остаток может быть замещен 1, 2, 3 или 4 С1-С4-алкильными группами, в частности метильными группами.
Предпочтительными ароматическими гетероциклическими остатками являются пиридил, в частности, 3- или 4-пиридил, пиримидинил, пирролил, имидазолил, оксазолил, изоксазолил, фурил, тиенил или тиазолил, гетероциклический остаток, в частности пиридильный остаток, как указано выше, может быть замещен. Пиридильный остаток замещен, в частности, во 2-положении.
Фенил-С1-С4-алкил означает, в частности, бензил или фенилэтил.
Предпочтительны соединения формулы I, где один из остатков R3 и R4 означает С1-С4-алкил или галогензамещенный фенил и второй из остатков R3 и R4 означает С1-С4-алкил или пиридил или замещенный пиридил, однако оба остатка не могут означать С1-С4-алкил.
Далее предпочтительны соединения формулы I, где R3 означает галогензамещенный, в частности 4-замещенный фенил, и R4 означает необязательно замещенный пиридил, в частности 4-пиридил или замещенный 4-пиридил.
Согласно особенно предпочтительной форме выполнения остаток R3 в формуле I означает 4-фторфенил и R4 означает 4-пиридил или замещенный пиридил.
Если R1 означает С1-С6-алкил, который замещен неароматическим гетероциклическим остатком, он содержит предпочтительно, по меньшей мере, один атом азота, причем связь с алкильной группой осуществлена через атом азота.
Если R1 означает ароматический или неароматический гетероциклический остаток, то он связан через атом углерода с имидазольной группой.
R1 означает предпочтительно C1-С3-алкил, С3-С6-циклоалкил, в частности циклопропил, или насыщенный гетероциклический остаток с одним или двумя атомами азота, в частности пиперидинил или 2,2,6,6-тетраметилпиперидинил. В частности, предпочтителен пиперидинильный или 2,2,6,6-тетраметилпиперидинильный остаток, связанный в 4-положении с атомом азота имидазола.
R2 предпочтительно означает C1-С3-алкил (метил, этил, н-пропил или н-пропил), фенил-С1-С4-алкил, в частности бензил, который необязательно замещен, как приведено выше. Особенно предпочтительно R2 означает C1-С3-алкил или бензил, который замещен С1-С4-алкилсульфанилом, С1-С4-алкилсульфинилом или С1-С4-алкилсульфонилом, в частности, в 4-положении.
Особенно предпочтительны соединения формулы I, где R4 означает пиридил, в частности 4-пиридил, который замещен посредством амино, С1-С4-алкиламино или R5COR6-, где R5 и R6 имеют вышеприведенные значения, R1 означает С1-С3-алкил и R2 означает С1-С3-алкил.
Физиологически переносимыми солями согласно настоящей заявке могут быть кислотные или основные аддитивные соли. Для кислотных аддитивных солей применяются такие неорганические кислоты как соляная кислота, серная кислота или фосфорная кислота, или такие органические кислоты как винная, лимонная, малеиновая, фумаровая, яблочная, миндальная, аскорбиновая, глюконовая и тому подобные кислоты.
Получение соединений по изобретению с R2≠Н осуществляется двухстадийным способом. На первой стадии сначала получают замещенный имидазол-2-тион (R2=H). На второй стадии его превращают таким образом, что вводят желаемый заместитель.
1) Получение имидазол-2-тиона
Для получения имидазол-2-тиона имеются два варианта способа. Оба варианта поясняются как пример на соединениях, при которых R3 означает 4-фторфенил и R4 означает 4-пиридил. Соединения с другими остатками R3 и R4 могут быть получены соответствующим путем.
Вариант 1
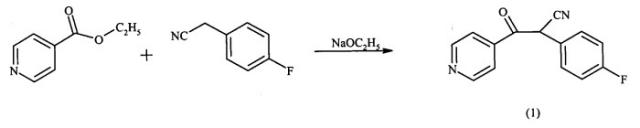
Синтез замещенного имидазол-2-тиона осуществляют исходя из сложного эфира изоникотиновой кислоты и 4-фторфенилацетонитрила посредством реакции по схеме 1.
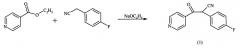
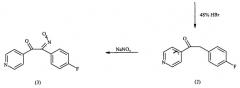
Исходные вещества подвергают реакции конденсации с помощью металлического натрия в спирте, например этаноле, с получением 2-циано-2-(4-фторфенил)-1-(4-пиридил)этанона (соединение 1). После этого гидролизом, например бромводородной кислотой, и декарбоксилированием удаляют цианогруппу, так что образуется 2-(4-фторфенил)-1-(4-пиридил)этанон (соединение 2). На следующей стадии соединение 2 нитрозируют во 2-положении, например, с применением нитритов, таких как нитрит натрия или изоамилнитрит. При этом образуется соединение формулы (3), оксим 2-(4-фторфенил)-1-(4-пиридил)-α-гидроксииминоэтан.
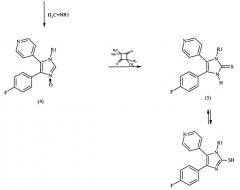
Исходя из этого промежуточного соединения вследствие взаимодействия с имином общей формулы H2C=NR1, который представляет собой 1,3,5-тризамещенный гексагидро-1,3,5-триазин, в спиртовом растворе, таком как этанол, и при повышенной температуре (50-90°С) осуществляется циклизация с получением имидазолпроизводного формулы (4), а именно замещенного 5-(4-фторфенил)-4-(4-пиридил)имидазол-N-оксида, который имеет в атоме азота в 3-положении заместитель R1. Имидазол-N-оксид формулы (4) затем подвергают взаимодействию с 2,2,4,4-тетраметил-3-тиоциклобутаноном в хлорированном растворителе с получением соответствующего 3-замещенного 5-(4-фторфенил)-4-(4-пиридил)имидазол-2-тиона (соединение 5; соединение формулы I с R2=Н).
Схема 1
Синтез тионов по изобретению (вариант 1)
Вариант 2
Сначала получают оксим формулы (3), 2-(4-фторфенил)-1-(4-пиридил)-α-гидроксииминоэтан, как описано в варианте 1 (схема 1, стадии 1 до 3). Исходя из этого синтез замещенных имидазол-2-тионов осуществляют согласно схеме 2.
Схема 2
Синтез тионов по изобретению (вариант 2)
2-(4-фторфенил)-1-(4-пиридил)-α-гидроксииминоэтан подвергают взаимодействию согласно схеме 2 с выбранным амином общей формулы NH2-R1 и формальдегидом, причем при циклизации образуется соединение формулы (6), 1-замещенный 4-(4-фторфенил)-5-(4-пиридил)имидазол-2-он. Его подвергают взаимодействию с фосфороксихлоридом в избытке, причем образуется соединение формулы (7), 1-замещенный 4-(4-фторфенил)-5-(4-пиридил)имидазол-2-хлорид. Из него получают соответствующий 1-замещенный 4-(4-фторфенил)-5-(4-пиридил)имидазол-2-тион (соединение 5) взаимодействием с 4-хлорбензилтиолом в полярном апротонном растворителе и при повышенной температуре (100-150°С).
2) Получение соединения 2-тиоимидазола
Полученные согласно вариантам 1 или 2 соединения тиона (5) превращают замещением атома серы во 2-положении в соединение по изобретению формулы I, где R2≠Н. Замещение осуществляют как показано на схеме 3 известным образом нуклеофильной реакцией замещения. Соединение 5 при этом подвергают взаимодействию с R2-X в инертном полярном растворителе, таком как спирт. Х означает легко заменяемую группу, такую как галоген, в частности, Cl, Br, I, метилсульфонил, тозил и т.п.
Соединения 2-тиоимидазола, при которых атом серы во 2-положении замещен винильным остатком, могут быть получены нуклеофильным присоединением соединения 5 к тройной связи. Для этого соединение 5 подвергают взаимодействию с основанием, например, алкоголятом щелочного металла в соответствующем спирте и после этого с избытком соединения с тройной связью.
Получение соответствующего бисарилтиоэфира осуществляют исходя из 3-замещенного 2-хлор-4-(4-фторфенил)-5-(4-пиридил)имидазола (соединение 7 из схемы 2). Соединение (7) подвергают взаимодействию с двумя эквивалентами соответствующего тиофенола в апротонном растворителе, таком как диметилформамид, с получением соединений формулы (12).
Соответствующие региоизомерные соединения могут быть получены согласно схеме (5). Исходя из 1-(4-фторфенил)-2-(4-пиридил)-α-гидроксииминоэтанона (получаемого аналогичным образом по схеме 1) получают аналогично способу по схеме 1 соединения формулы 15 взаимодействием с соответствующими иминами. Соединение (13) можно получать описанным в заявке WO 93/14081 способом.
Схема 3
3. Замещение серы
Схема 4
Бисарилтиоэфир
Схема 5
Региоизомерные тионы
Они могут превращаться далее согласно схеме 3.
Имеющие в 4-положении С1-С4-алкильную группу имидазолтиолы получают исходя из соответствующих α-гидроксииминоэтанонов (соединение 17/19 из нижеследующей схемы 6) аналогично схемам 1 и 2.
Схема 6
4-метилимидазолтионы
Они могут превращаться далее по схемам 3 и 4. Соответствующие региоизомерные соединения могут быть получены аналогично схеме 5.
Соединения формулы I, которые имеют С1-С4-алкилсульфанильный остаток, могут окисляться соответствующим окислителем, таким как м-хлорпербензойная кислота, перекись водорода, перекись бензоила и т.п., известным способом с получением соответствующего С1-С4-алкилсульфинильного или С1-С4-алкилсульфонильного соединения, см. схему 7.
Схема 7
Получение соединений, у которых вместо амино- и или амидозамещенного гетероциклического остатка, особенно пиридинового остатка, находится R4, осуществляется согласно схеме 8, на которой получение продемонстрировано на примере 2-замещенных 4-пиридиновых соединений (получение соединений, у которых вместо алкилзамещенного гетероциклического остатка находится R4, осуществляется в соответствии с ранее описанными способами с соответственно замещенными исходными соединениями):
Схема 8
(CDI=карбонилдиимидазол)
Аминогруппа исходного соединения 2-амино-γ-пиколина (24) защищается, например, введением ацетильной группы посредством ацетангидрида. После этого производится окисление метильной группы соединения (25) с получением карбоксильной группы, например, с помощью перманганата калия в водной среде при температуре от 20 до 90°С.
Взаимодействие полученной пиридинкарбоновой кислоты (26) с 4-фторфенилацетонитрилом с получением соединения (27) и последующее отщепление нитрильной группы проводится согласно варианту 1. При этом отщепляется также и ацетильная группа аминогруппы пиридина с образованием соединения (28).
На следующей стадии снова производят защиту аминогруппы, например, введением ацетильной группы посредством ацетангидрида. Полученное соединение (29) переводится согласно варианту 1 или 2 (на схеме 8 показано на примере варианта 1) в соединение тиона (32). В него вводится остаток R2, как показано на схемах 3, 4 и 7.
Для введения желаемого заместителя в пиридильную группу сначала гидролитически отщепляют ацетильную группу, например, водным раствором кислоты, причем получают аминосоединение (35). Введение ацильного остатка осуществляют посредством ацилирования, в частности, с помощью соответствующего хлорангидрида кислоты R5COCl в инертном растворителе, таком как простой эфир, например тетрагидрофуран, диоксан или хлорированный углеводород, например метиленхлорид или 1,2-дихлорэтан и т.п. Ацилирование осуществляют в общем в присутствии основания, например триэтиламина, по меньшей мере в эквивалентном количестве.
Для получения замещенных аминосоединений соединение (35) подвергают взаимодействию с одним или двумя молярными эквивалентами алкилбромида или фенилалкилбромида в инертном растворителе, таком как диметилформамид, в присутствии основания, такого как гидрид натрия, с получением соединений (37) или (38). Альтернативно соединения амида (34) или (36) могут восстанавливаться литийалюминийгидридом, например, в тетрагидрофуране с получением соединения 39.
Соединения по изобретению проявляют in vitro и in vivo иммуномодулирующее и ингибирующее высвобождение цитокина действие. Цитокины представляют собой протеины, такие как TNF-α и IL-β, которые играют важную роль при различных воспалительных заболеваниях. Соединения по изобретению благодаря своему ингибирующему действию в отношении высвобождения цитокина пригодны для лечения заболеваний, которые связаны с нарушением иммунной системы. Они пригодны, например, для лечения аутоиммунных заболеваний, рака, ревматического артрита, подагры, септического шока, остеопороза, невропатических болей, распространения вируса ВИЧ (вируса иммунодефицита человека) (HIV), вызванной ВИЧ-деменции, вирусного миокардита инсулинзависимого диабета, периодонтальных заболеваний, рестеноза, алопеции, деплеции Т-клеток при вызванных ВИЧ-инфекциях или СПИД, псориаза, острого панкреатита, реакций отторжения при аллогенных трансплантатах, вызванного аллергией воспаления легких, артериосклероза, рассеянного склероза, кахексии, болезни Альцгеймера, желтухи, апоплексии, язвенного воспаления толстой кишки, болезни Крона, воспаления кишечника, ишемии, связанной с геперемией сердечной недостаточности, фиброза легких, гепатита, глиобластомы, синдрома Guillain-Barre, системной красной волчанки, респираторного-дистресс-синдрома взрослых (ARDS) и синдрома удушья.
Соединения по изобретению могут вводиться или в виде отдельных терапевтически действующих веществ или в виде смесей с другими терапевтическими действующими веществами. Соединения могут вводиться индивидуально, в основном их дозируют и вводят в форме фармацевтических препаратов, т.е. в виде смесей активных веществ с пригодными фармацевтическими носителями или разбавителями. Соединения и препараты могут вводиться орально или парентерально, предпочтительно они вводятся в оральных дозировочных формах.
Вид фармацевтического средства или носителя и, соответственно, разбавителя зависит от желаемой формы введения. Оральные препараты могут находиться в форме таблеток или капсул и могут содержать обычные эксципиенты, такие как связующие (например, сироп, акация, желатин, сорбит, трагакант или поливинилпирролидон), наполнители (например, лактоза, сахар, кукурузный крахмал, фосфат кальция, сорбит или глицин), вещества, придающие скользкость (например, стеарат магния, тальк, полиэтиленгликоль или диоксид кремния), дезинтеграционные средства (например, крахмал) или смачивающие агенты (например, лаурилсульфат натрия). Жидкие оральные препараты могут находиться в форме водной или масляной суспензии, растворов, эмульсий, сиропов, эликсиров, спреев и т.п. Они могут также находиться в форме сухих порошков, которые для деструктурирования обрабатываются водой или другим пригодным носителем. Подобные жидкие препараты могут содержать обычные добавки, например, суспендирующие средства, вкусовые вещества, разбавители или эмульгаторы. Для парентального введения можно применять растворы или суспензии с обычными фармацевтическими носителями.
Соединения по изобретению или препараты могут применяться для млекопитающих (человека и животного) в дозе приблизительно от 0,5 мг до 100 мг на кг веса в день. Они могут применяться в отдельной дозе или в нескольких дозах. Спектр действия соединений как ингибиторов высвобождения цитокина был исследован с помощью нижеследующих тестов, описанных авторами Dona С. и Laufer S. в публикации Arch. Pharm. Med. Chem. 333, Suppl.1, 1-40, 2000.
In vitro-тест с человеческой цельной кровью
Пробы из человеческой цельной крови в калий-ЭДТУ (этилендиаминотетрауксусной кислоте) (по 400 мкл) смешивают с тест-веществом и предварительно инкубируют в течение 15 минут при 37°С в инкубаторе, содержащем двуокись углерода (5% СО2; 95% влагонасыщенного воздуха). После этого пробы стимулируют 4 часа посредством 1 мкг/мл LPS (Е.coli 026:В6) при 37°С в инкубаторе, содержащем двуокись углерода (5% CO2; 95% влагонасыщенного воздуха). Реакцию останавливают, ставя пробы на лед, их смешивают с буфером DPBS и затем центрифугируют в течение 15 минут при 1000×g. После этого определяют количество IL-1β и TNFα в фазовой надосадочной жидкости посредством твердофазного иммуноферментного анализа ELISA.
In vitro-тест с моноядерными клетками (PBMCs)
Из разбавленной в соотношении 1:3 человеческой цельной крови в калий-ЭДТУ выделяют центрифугированием с градиентом плотности (Hisopaque®-1,077) моноядерные клетки (PBMCs). Их промывают два раза буфером DPBC, ресуспендируют в среде микрофагов SFM и устанавливают на количество клеток на 1·106 клеток/мл.
Полученную суспензию с моноядерными клетками (по 390 мкл на пробу) предварительно инкубируют тест-веществом в течение 15 минут при 37°С в инкубаторе, содержащем двуокись углерода (5% CO2; 95% влагонасыщенного воздуха). После этого пробы стимулируют 4 часа посредством 1 мкг/мл LPS (Е.coli 026:В6) при 37°С в инкубаторе, содержащем двуокись углерода (5% CO2; 95% влагонасыщенного воздуха). Реакцию останавливают, ставя пробы на лед пробы смешивают с буфером DPBS и затем центрифугируют в течение 12 минут при 15880·g. После этого определяют количество IL-1β и TNFα в фазовой надосадочной жидкости посредством твердофазного иммуноферментного анализа ELISA.
Результаты тестов in vitro показаны в таблицах 1 и 2.
| Таблица 1 | |||||||
| Пример | R1 | R2 | R3 | R4 | Выход b) | TNF-a) | IL-la) |
| 1 | СНз | Н | 4-F-фенил | 4-пиридил | 36 | 19 | 3,6 |
| 2 | С2Н5 | Н | 4-F-фенил | 4-пиридил | 11 | 41 | 1,3 |
| 3 | н-С3Н7 | Н | 4-F-фенил | 4-пиридил | 31/22 | 32 | 2,4 |
| 4 | н-С3Н7 | Н | 4-F-фенил | 4-пиридил | 15 | 46% | 2,2 |
| 5 | циклогексил | Н | 4-F-фенил | 4-пиридил | 9 | 33 | 5,4 |
| 6 | циклопропил | Н | 4-F-фенил | 4-пиридил | 33 | -b) | - |
| 7 | фенил | Н | 4-F-фенил | 4-пиридил | 7 | 37 | 2,3 |
| 8 | бензил | Н | 4-F-фенил | 4-пиридил | 8 | 20 | 1,0 |
| 9 | 4-диметиламинофенил | Н | 4-F-фенил | 4-пиридил | 8 | 15 | 1,8 |
| 10 | 3-пиридил | Н | 4-F-фенил | 4-пиридил | 16 | 42% | 8,0 |
| 11 | диметиламиноэтил | Н | 4-F-фенил | 4-пиридил | 15 | 19% | 12 |
| 12 | 2,2,6,6-тетраметилпиперидин-4-ил | Н | 4-F-фенил | 4-пиридил | 13 | 45 | 1,6 |
| 13 | диметиламинопропил | Н | 4-F-фенил | 4-пиридил | 22 | - | - |
| 14 | N-морфолинопропил | Н | 4-F-фенил | 4-пиридил | 38 | 100 | 18 |
| 15 | 4-метилсульфанилфенил | Н | 4-F-фенил | 4-пиридил | 13 | - | - |
| 16 | N-морфолиноэтил | Н | 4-F-фенил | 4-пиридил | 16 | 34% | 44% |
| 17 | 3-гидроксипропил | Н | 4-F-фенил | 4-пиридил | 13 | 49% | 7,3 |
| 18 | 1-бензилпиперидин-4-ил | Н | 4-F-фенил | 4-пиридил | 18 | 38 | 5,8 |
| 19 | аллил | Н | 4-F-фенил | 4-пиридил | 28 | - | - |
| 20 | СН3 | СН3 | 4-F-фенил | 4-пиридил | 15 | 2,5 | 0,45 |
| 21 | н-С3Н7 | СН3 | 4-F-фенил | 4-пиридил | 6 | 1,3 | 0,36 |
| 22 | циклопропил | СН3 | 4-F-фенил | 4-пиридил | 12 | 1,1 | 0,34 |
| 23 | N-морфолиноэтил | СН3 | 4-F-фенил | 4-пиридил | 3 | ||
| 24 | N-морфолинопропил | СН3 | 4-F-фенил | 4-пиридил | 4 | 2,7 | 1,0 |
| 25 | 2,2,6,6-тетраметилпиперидин-4-ил | СН3 | 4-F-фенил | 4-пиридил | 11 | 16 | 0,85 |
| 26 | 1-бензилпиперидин-4-ил | СН3 | 4-F-фенил | 4-пиридил | 3 | - | - |
| 27 | C2H5 | 4-СН3-SO2-бензил | 4-F-фенил | 4-пиридил | 6 | 4,1 | 0,95 |
| 28 | н-С3Н7 | бензил | 4-F-фенил | 4-пиридил | 24 | 29 | 0,65 |
| 29 | н-С3Н7 | 4-Cl-бензил | 4-F-фенил | 4-пиридил | 20 | 62 | 1,3 |
| 30 | н-С3Н7 | 4-СН3-бензил | 4-F-фенил | 4-пиридил | 20 | 22 | 1,3 |
| 31 | н-С3Н7 | 4-СН3-S-бензил | 4-F-фенил | 4-пиридил | 12 | 35% | 4,7 |
| 32 | н-С3Н7 | 4-СН3-SO-бензил | 4-F-фенил | 4-пиридил | 3 | 24 | 1,6 |
| 33 | н-С3Н7 | 4-СН3-SO2-бензил | 4-F-фенил | 4-пиридил | 9 | 6,8 | 0,72 |
| 34 | н-С3Н7 | 4-Cl-бензил | 4-F-фенил | 4-пиридил | 6 | 53 | 5,3 |
| 35 | н-С3Н7 | 4-СН3-SO2-бензил | 4-F-фенил | 4-пиридил | 7 | 2,7 | 1,5 |
| 36 | циклопропил | -СН2-СН=СН-фенил | 4-F-фенил | 4-пиридил | 27 | - | - |
| 37 | циклопропил | -СН2-СН=СН-4-Cl-фенил(транс) | 4-F-фенил | 4-пиридил | 11 | - | - |
| 38 | циклопропил | -СН2-СН=СН-фенил | 4-F-фенил | 4-пиридил | 12 | - | - |
| 39 | циклогексил | 4-СН3-SO2-бензил | 4-F-фенил | 4-пиридил | 5 | 13 | 1,8 |
| 40 | фенил | 4-СН3-SO2-бензил | 4-F-фенил | 4-пиридил | 2 | 3,4 | 1,3 |
| 41 | бензил | 4-СН3-SO2-бензил | 4-F-фенил | 4-пиридил | 3 | 1,0 | 0,36 |
| 42 | N-морфолиноэтил | Бензил | 4-F-фенил | 4-пиридил | 5 | 11 | 1,3 |
| 43 | N-морфолинопропил | Бензил | 4-F-фенил | 4-пиридил | 25 | 5,4 | 0,89 |
| 44 | N-морфолинопропил | 4-СН3-SO2-бензил | 4-F-фенил | 4-пиридил | 31 | 12 | 1,4 |
| 45 | N-морфолинопропил | 4-СН3-SO-бензил | 4-F-фенил | 4-пиридил | 4 | 12 | 2,4 |
| 46 | 2,2,6,6-тетраметилпиперидин-4-ил | Бензил | 4-F-фенил | 4-пиридил | 9 | 12 | 0,87 |
| 47 | СН3 | N-морфолиноэтил | 4-F-фенил | 4-пиридил | 26 | 28 | 1,7 |
| 48 | СН3 | Цис-фенилэтенил | 4-F-фенил | 4-пиридил | 10 | 22 | 1,7 |
| 49 | н-С3Н7 | Цис-фенилэтенил | 4-F-фенил | 4-пиридил | 20 | - | - |
| 50 | циклопропил | Цис-фенилэтенил | 4-F-фенил | 4-пиридил | 3 | - | - |
| 51 | н-С3Н7 | -CHBr-CHBr-фенил | 4-F-фенил | 4-пиридил | 20 | - | - |
| 52 | н-С3Н7 | Фенил | 4-F-фенил | 4-пиридил | 26 | 14 | 1,0 |
| 53 | н-С3Н7 | 4-Cl-фенил | 4-F-фенил | 4-пиридил | 25 | 29 | 3,3 |
| 54 | н-С3Н7 | 4-СН3-S-фенил | 4-F-фенил | 4-пиридил | 22 | 68 | 2,5 |
| 55 | н-С3Н7 | 4-СН3-SO-фенил | 4-F-фенил | 4-пиридил | 16 | 6,2 | 0,72 |
| 56 | н-С3Н7 | 4-СН3-SO2-фенил | 4-F-фенил | 4-пиридил | 15 | 19 | 1,5 |
| 57 | 4-F-фенил | Н | СНз | 4-пиридил | 7 | 34% | 19 |
| 58 | 3-пиридил | Н | 4-F-фенил | СН3 | 15 | 32% | 28 |
| 59 | н-С3Н7 | Н | 4-пиридил | 4-F-фенил | 5 | 83 | 16% |
| 60 | N-морфолиноэтил | Н | 4-пиридил | 4-F-фенил | 5 | - | - |
| a) IC50 [мкмоль×I-1]b) Общий выход [%] по всем стадиям | |||||||
| Таблица 2 | |||||||
| Пример | R1 | R7 | R2 | TNF-a) | IL-la) | ||
| 61 | СН3 | -СОСН3 | СН3 | 0,87 | 0,07 | ||
| 62 | С3Н7 | -СОСН3 | СН3 | 0,49 | 0,12 | ||
| 63 | 2,2,6,6-тетраметилпиперидин-4-ил | -СОСН3 | СН3 | 4,5 | 0,46 | ||
| 64 | N-морфолинопропил | -СОСН3 | СН3 | - | - | ||
| 65 | 3-гидроксипропил | -СОСН3 | СН3 | - | - | ||
| 66 | СН3 | -Н | СН3 | 2,3 | 0,27 | ||
| 67 | СН3 | -п-метоксибензоил | СН3 | 0,64 | 0,44 | ||
| 68 | СН3 | -СО-циклопропил | СН3 | - | - | ||
| 69 | СН3 | -СО-циклопентил | СН3 | - | - | ||
| 70 | СН3 | -Bz | СН3 | 0,39 | 0,08 | ||
| 71 | СН3 | -1-фенилэтил | СН3 | 0,13 | 0,01 | ||
| 73 | СН3 | -С2Н5 | СН3 | 0,35 | 0,05 | ||
| 74 | С3Н7 | -С2Н5 | СН3 | 0,41 | 0,15 | ||
| 75 | 2,2,6,6-тетраметилпиперидин-4-ил | -С2Н5 | СН3 | 2,9 | 0,62 | ||
| 76 | N-морфолинопропил | -СОСН3 | 4-метилсульфинил |