Антигенные пептиды neisseria
Иллюстрации
Показать всеИзобретение относится к иммунологии и биотехнологии. Приведены варианты белков, полученных из Neisseria meningitides, которые имеют свойства антигена и обладают общими антигенными детерминантами. Аминокислотная последовательность представлена в описании. Раскрыты варианты нуклеиновых кислот, кодирующих указанные белки. Описаны варианты фармацевтической композиции, содержащие эффективное количество любого из указанных белков или эффективное количество любой из раскрытых нуклеиновых кислот, кодирующих указанные белки. Фармацевтические композиции применяют в качестве вакцины или иммуногенной композиции для лечения и профилактики инфекции, вызываемой бактерией Neisseria. Фармацевтические композиции применяют как диагностический реагент для обнаружения бактерий Neisseria. Предложен способ лечения инфекции, вызываемой бактерией Neisseria. Использование изобретения позволяет проводить диагностику и профилактику заболевания, опосредованного Neisseria meningitides. 7 н. и 14 з.п. ф-лы, 2 табл.
Реферат
Все цитируемые документы во всей своей полноте вводятся в настоящее описание посредством ссылки. В частности, настоящее описание полностью включает содержание Международной патентной заявки WO 99/24578.
Область, к которой относится изобретение
Настоящее изобретение относится к антигенным пептидным последовательностям, происходящим от бактерий Neisseria meningitidis и Neisseria gonorrhoeae.
Предпосылки создания изобретения
Neisseria meningitidis и Neisseria gonorrhoeae представляют собой неподвижные грамотрицательные диплоккоки, которые являются патогенными для человека.
Исходя из наличия инкапсулированного полисахарида у данного микроорганизма, были идентифицированы 12 серологических групп N.meningitidis. Микроорганизм группы А является патогеном, наиболее часто вызывающим эпидемические заболевания в регионах Африки, простирающихся ниже Сахары. Серологические группы В и С ответственны за подавляющее большинство случаев возникновения данных заболеваний в Соединенных Штатах и в большинстве развитых стран. В остальных случаях возникновения этого заболевания в Соединенных Штатах и в развитых странах ответственны серологические группы W135 и Y.
Используемая в настоящее время менингококковая вакцина представляет собой тетравалентную полисахаридную вакцину, представленную серологическими группами А, С, Y и W135, однако использование MenB связано с определенными проблемами. Метод на основе данного полисахарида не может быть использован, поскольку капсулярный полисахарид MenB является полимером α(2-8)-связанной N-ацетилнейраминовой кислоты, которая также присутствует в тканях млекопитающих. В одном из методов получения вакцин на основе menB были использованы смеси внешних мембранных белков (OMPs). Для преодоления антигенной изменчивости были сконструированы мультивалентные вакцины, содержащие вплоть до девяти различных поринов (см., например, Poolman J.T. (1992) Development of a meningococcal vaccine. Infect. Agents Dis.4: 13-28). Другими белками, используемыми в вакцинах на основе внешних мембран, были белки ора и орс, но ни один из этих вариантов не позволял преодолеть антигенную изменчивость (см., например, Ala'Aldeen & Borriello (1996) The meningococcal transferrin-binding proteins 1 and 2 are both surface exposed and generate bactericidal antibodies capable of killing homologous and heterologous strains. Vaccine 14(1):49-53).
Описание изобретения
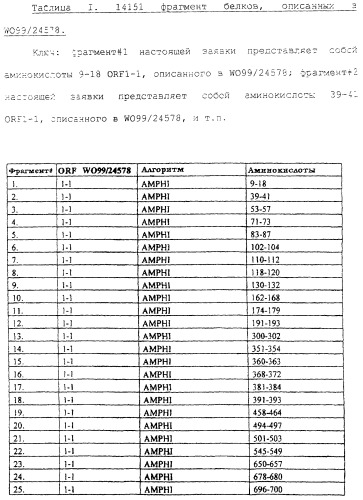
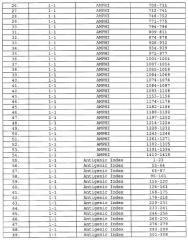
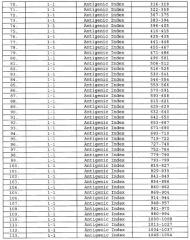
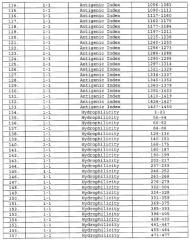
Настоящее изобретение относится к фрагментам белков, описанных в Международной патентной заявке WO 99/24578, где указанные фрагменты содержат, по крайней мере, одну антигенную детерминанту. Таким образом, если длина любой конкретной белковой последовательности, описанной в WO 99/24578, составляет х аминокислот (см. таблицу II), то настоящее изобретение относится к фрагментам, состоящим, максимум, из х-1 аминокислот данного белка. Конкретный фрагмент может быть короче, чем указанный фрагмент (например, х-2, х-3, х-4, ...), а предпочтительно его длина составляет 100 аминокислот или менее (например, 90 аминокислот или менее, 80 аминокислот и т.п.). Данный фрагмент может иметь длину минимум 3 аминокислоты, но предпочтительно он является более длинным (например, имеет длину вплоть до 6, 7, 8, 9, 10, 12, 15, 20, 25, 30, 35, 40, 50, 75 или 100 аминокислот).
Предпочтительные фрагменты содержат пептидные последовательности Neisseria, описанные в таблице I, или их субпоследовательности. Эти фрагменты могут быть длиннее, чем фрагменты, указанные в таблице I, например, если фрагмент в таблице I начинается от аминокислотного остатка p до остатка q белка, то настоящее изобретение также относится к фрагментам, начинающимся от остатка (р-1), (р-2) или (р-3) до остатка (q+1), (q+2) или (q+3).
Настоящее изобретение также относится к полипептидам, которые являются гомологичными (т.е. имеющими идентичные последовательности) этим фрагментам. В зависимости от конкретного фрагмента степень идентичности последовательности предпочтительно превышает 50% (например, 60%, 70%, 80%, 90%, 95%, 99% или более). Этими гомологичными полипептидами являются мутанты и аллельные варианты данных фрагментов. Идентичность двух последовательностей предпочтительно определяют с помощью алгоритма поиска гомологии Smith-Waterman, выполняемого в программе MPSRCH (Oxford Molecular) и проводимого с использованием аффинных брешей с параметрами: ″штраф на брешь-пропуск″=12 и ″штраф на брешь-удлинение″=1.
Настоящее изобретение также относится к белкам, содержащим один или несколько фрагментов, определенных выше.
Настоящее изобретение ограничивается условием, что в его объем не входят белки, содержащие любую из 446 последовательностей белка, описанных в WO 99/24578 (то есть четные номера SEQ ID NO: 2, 4, 6, 8, 10, ..., 888, 890, 892 WO 99/24578).
Само собой разумеется, что белки настоящего изобретения могут быть получены различными способами (например, путем экспрессии рекомбинантных последовательностей, очистки из клеточных культур, химического синтеза и т.п.) и в различных формах (например, в нативной форме, в форме С-концевых и/или N-концевых гибридов и т.п.). Эти белки предпочтительно получают, в основном, в чистом виде (т.е. в форме, в основном, не содержащей других белков Neisseria или белков клеток хозяина). Белки с короткой цепью предпочтительно продуцируют методами химического пептидного синтеза.
В другом своем аспекте настоящее изобретение относится к антителам, которые распознают фрагменты настоящего изобретения, при условии, что в объем настоящего изобретения не входят антитела, распознающие одну из 446 полноразмерных последовательностей белка, описанных в WO 99/24578. Этими антителами могут быть поликлональные или предпочтительно моноклональные антитела, которые могут быть получены любыми подходящими способами.
Настоящее изобретение также относится к белкам, содержащим пептидные последовательности, распознаваемые этими антителами. Самом собой разумеется, что указанные пептидные последовательности будут включать фрагменты белков Neisseria, описанных в WO 99/24578, а также пептиды, имитирующие антигенную структуру пептидов Neisseria при связывании с иммуноглобулином.
В еще одном своем аспекте настоящее изобретение относится к нуклеиновой кислоте, кодирующей фрагменты и белки настоящего изобретения, при условии, что в объем настоящего изобретения не входит нуклеиновая кислота, кодирующая одну из 446 полноразмерных последовательностей белка, описанных в WO 99/24578.
Кроме того, настоящее изобретение относится к нуклеиновой кислоте, содержащей последовательности, гомологичные (т.е. имеющие идентичность) указанным последовательностям. Кроме того, настоящее изобретение относится к нуклеиновой кислоте, которая может гибридизоваться с указанными последовательностями предпочтительно в условиях "высокой жесткости" (например, при 65°С в растворе 0,1×SSC, 0,5% ДСН).
Следует также отметить, что настоящее изобретение относится к нуклеиновой кислоте, содержащей последовательности, комплементарные последовательностям, описанным выше (например, для получения антисмысловой последовательности или для зондирования).
Само собой разумеется, что нуклеиновая кислота настоящего изобретения может быть получена многими способами (например, методом химического синтеза, из геномной или кДНК-библиотек, из самого микроорганизма и т.п.) и может иметь различные формы (например, одноцепочечную, двухцепочечную, векторы, зонды и т.п.). Кроме того, термин "нуклеиновая кислота" означает ДНК и РНК, а также их аналоги, такие как аналоги, содержащие модифицированные остовы, а также связанные с пептидами нуклеиновые кислоты (ПНК) и т.п.
В другом своем аспекте настоящее изобретение относится к векторам, содержащим нуклеотидные последовательности настоящего изобретения (например, экспрессирующие векторы) и клетки-хозяева, трансформированные такими векторами.
В другом своем аспекте настоящее изобретение относится к композициям, содержащим белок, антитело, и/или нуклеиновую кислоту настоящего изобретения. Эти композиции могут быть получены, например, в виде вакцин или в виде диагностических реагентов, либо в виде иммуногенных композиций.
Настоящее изобретение также относится к нуклеиновой кислоте, белку или антителу настоящего изобретения для использования в качестве лекарственных препаратов (например, в качестве вакцин или их иммуногенных композиций) или в качестве диагностических реагентов. Настоящее изобретение также относится к использованию нуклеиновой кислоты, белка или антитела настоящего изобретения в целях изготовления (i) лекарственного средства для лечения или профилактики инфекции, вызываемой бактериями Neisseria; (ii) диагностического реагента для обнаружения присутствия бактерии Neisseria или антител, вырабатываемых против бактерии Neisseria; и/или (iii) реагента, который может способствовать продуцированию антител против бактерии Neisseria. Указанными бактериями Neisseria могут быть бактерии любого вида или штамма (такие как N.gonorrhoeae), но предпочтительно N.meningitidis, а в частности, штамм А или штамм В.
Настоящее изобретение также относится к способу лечения пациента, предусматривающему введение этому пациенту терапевтически эффективного количества нуклеиновой кислоты, белка и/или антитела настоящего изобретения.
В соответствии с другими своими аспектами, настоящее изобретение относится к различными способам.
Настоящее изобретение относится к способу продуцирования белков, предусматривающему проведение стадии культивирования клетки-хозяина настоящего изобретения в условиях, благоприятствующих индуцированию экспрессии белка.
Настоящее изобретение относится к способу продуцирования белка или нуклеиновой кислоты настоящего изобретения, где этот белок или нуклеиновая кислота синтезируются частично или целиком с использованием химических методов.
Настоящее изобретение относится к способу обнаружения полинуклеотидов настоящего изобретения, предусматривающему проведение стадий: (а) контактирования нуклеотидного зонда настоящего изобретения с биологическим образцом в условиях гибридизации с образованием дуплексов и (b) обнаружения указанных дуплексов.
Настоящее изобретение относится к способу обнаружения белков настоящего изобретения, предусматривающему проведение стадий: (а) контактирования антитела настоящего изобретения с биологическим образцом в условиях, благоприятствующих образованию комплексов антитело-антиген и (b) обнаружения указанных комплексов.
Ниже приводится краткое описание стандартных методов и процедур, которые могут быть использованы для осуществления настоящего изобретения (например, для использования описанных последовательностей в целях вакцинации или диагностики). Это краткое описание не должно рассматриваться как ограничение изобретения и приводится лишь в качестве примеров, которые могут быть использованы, но которые не являются обязательными.
Общее описание
Для осуществления настоящего изобретения, если это не оговорено особо, могут быть использованы стандартные методы молекулярной биологии, микробиологии, рекомбинантных ДНК и иммунологии, известные специалистам. Такие методы полностью описаны в литературе, например, Sambrook Molecular Cloning, A Laboratory Manual, Second Edition, (1989); DNA Cloning, Volumes I and II (D.N.Glover ed. 1985); Oligonucleotide Synthesis (M.J.Gait ed, 1984); Nucleic Acid Hybridization (B.D.Hames & S.J.Higgins eds. 1984); Transcription and Translation (B.D.Hames & S.J.Higgins eds. 1984); Animal Cell Culture (R.I.Freshney ed. 1986); Immobilized Cells and Enzymes (IRL Press, 1986); B.Perbal, A Practical Guide to Molecular Cloning (1984); the Methods in Enzymology series (Academic Press, Inc.), especially volumes 154&155; Gene Transfer Vectors for Mammalian Cells (J.H.Miller & M.P.Calos eds. 1987, Cold Spring Harbor Laboratory); Mayer & Walker, eds. (1987), Immunochemical Methods in Cell and Molecular Biology (Academic Press, London); Scopes, (1987) Protein Purification: Principles and Practice, Second Edition (Springer-Verlag, N.Y.), и Handbook of Experimental Immunology, Volumes I-IV (D.M.Weir and C.C.Blackwell eds. 1986).
В этом описании используются сокращения, обычно принятые для нуклеотидов и аминокислот.
Все цитированные публикации, патенты и патентные заявки во всей своей полноте вводятся в настоящее описание посредством ссылки.
Определения терминов
Термин "композиция, содержащая X" означает "композицию, по существу, не содержащую Y", если в этой композиции содержание Х составляет, по крайней мере, 85% по общей массе Х+Y. Предпочтительно, чтобы в данной композиции Х составлял, по крайней мере, около 90% по общей массе X+Y, а более предпочтительно, по крайней мере, 95% или даже 99% масс.
Термин "содержащий" означает "включающий", а также "состоящий", например, композиция, "содержащая" X, может состоять исключительно из X, либо она, помимо X, может содержать еще какой-либо компонент, такой как X+Y.
Термин "антигенная детерминанта" означает В-клеточные эпитопы и Т-клеточные эпитопы.
Термин "гетерологичный" относится к двум биологическим компонентам, которые вместе в природе не обнаружены. Этими компонентами могут быть клетки-хозяева, гены или регуляторные области, такие как промоторы. Хотя эти гетерологичные компоненты в сочетании друг с другом в природе не обнаруживаются, однако, они могут функционировать вместе в случае, когда к этому гену функционально присоединен промотор, гетерологичный данному гену. В другом примере последовательность Neisseriae является гетерологичной последовательности мышиных клеток-хозяев. Другими примерами могут служить два эпитопа от одинаковых или различных белков, которые были ассоциированы в один белок с образованием структуры, не обнаруживаемой в природе.
Термин "сайт инициации репликации" означает полинуклеотидную последовательность, которая инициирует и регулирует репликацию полинуклеотидов, такую как экспрессирующий вектор. Сайт инициации репликации ведет себя как автономная единица репликации полинуклеотидов в клетке, способной реплицироваться под своим собственным контролем. Сайт инициации репликации может быть необходим вектору для его репликации в конкретной клетке-хозяине. С помощью некоторых сайтов инициации репликации экспрессирующий вектор может быть репродуцирован с большим числом копий в присутствии соответствующих белков в этой клетке. Примерами сайтов инициации репликации могут служить автономно реплицирующиеся последовательности, которые являются эффективными в дрожжах; и вирусный Т-антиген, эффективный в клетках COS-7.
Экспрессирующие системы
Нуклеотидные последовательности Neisseriae могут быть экспрессированы в ряде различных экспрессирующих систем; например, такими экспрессирующими системами являются клетки млекопитающих, бакуловирусы, растения, бактерии и дрожжи.
i. Системы млекопитающих
Экспрессирующие системы млекопитающих хорошо известны специалистам. Промотором млекопитающих является любая ДНК-последовательность, способная связываться с РНК-полимеразой млекопитающих и инициировать прямую транскрипцию (в направлении 5'→3') кодирующей последовательности (например, структурного гена) с образованием мРНК. Промотор может иметь сайт инициации транскрипции, который обычно расположен с 5'-конца от кодирующей последовательности, и ТАТА-бокс, который обычно расположен на 25-30 пар оснований (п.о.), выше (в направлении 5'→3') от сайта инициации транскрипции. ТАТА-бокс, очевидно, ориентирует РНК-полимеразу II для инициации синтеза РНК в нужном сайте. Промотор млекопитающих может также содержать расположенный выше промоторный элемент, обычно локализованный в области 100-200 п.н., расположенной выше ТАТА-бокса. Локализованный выше промоторный элемент определяет степень инициации транскрипции и может действовать в любой ориентации [Sambrook et al. (1989), "Expression of Cloned Genes in Mammalian Cells." In Molecular Cloning: A laboratory Manual, 2 nd ed.].
Вирусные гены млекопитающих часто являются высокоэкспрессируемыми и имеют широкий круг хозяев; поэтому последовательности, содержащие вирусные гены млекопитающих, имеют особенно ценные промоторные последовательности. Примерами таких последовательностей являются: ранний промотор SV40, промотор LTR вируса опухоли молочной железы мыши, главный поздний промотор аденовируса (Ad MLP) и промотор вируса простого герпеса. Кроме того, последовательности, происходящие от невирусных генов, таких как ген металлотеионеина мыши, также имеют ценные промоторные последовательности. Экспрессия может быть конститутивной или регулируемой (индуцибельной) в зависимости от промотора, который может быть индуцирован глюкокортикоидом в восприимчивых к гормону клетках.
Присутствие энхансерного элемента (энхансера), объединенного с промоторными элементами, описанными выше, обычно способствует увеличению уровней экспрессии. Энхансер представляет собой регуляторную ДНК-последовательность, которая при присоединении к гомологичным или гетерологичным промоторам может стимулировать транскрипцию вплоть до в 1000 раз, при этом синтез инициируется в нормальном старт-сайте РНК. Энхансеры также являются активными в том случае, если они расположены выше или ниже от сайта инициации транскрипции, либо в нормальной или во флип-ориентации, либо на расстоянии более чем 1000 нуклеотидов от промотора [Maniatis et al. (1987) Science 236:1237; Alberts et al. (1989) Molecular Biology of the Cell, 2nd ed.]. Энхансерные элементы, происходящие от вирусов, могут быть особенно ценными, поскольку они обычно имеют более широкий круг хозяев. Примерами таких энхансерных элементов являются энхансер раннего гена SV40 [Dijkema et al. (1985) EMBO J. 4:761] и энхансеры/промоторы, происходящие от длинного концевого повтора (LTR) вируса саркомы Рауса [German et al., (1982b) Proc. Natl. Acad. Sci. 79:6777] и от цитомегаловируса человека [Boshart et ai., (1985) Cell 41:521]. Помимо этого, некоторые энхансеры являются регулируемыми и становятся активными только в присутствии индуктора, такого как гормон или ион металла [Sassone-Corsi and Borelli (1986) Trends Genet. 2:215; Maniatis et al., (1987) Science 236:12371].
ДНК-молекула может быть экспрессирована в клетках млекопитающих. Промоторная последовательность может быть непосредственно присоединена к ДНК-молекуле; причем в этом случае, первая аминокислота у N-конца рекомбинантного белка всегда является метионином, который кодируется старт-кодоном ATG. Если это необходимо, то N-конец может быть отщеплен от белка путем in vitro-инкубирования с бромистым цианом.
Альтернативно, чужеродные белки могут быть также секретированы из клетки в культуральную среду путем создания химерных ДНК-молекул, кодирующих гибридный белок, который состоит из фрагмента лидерной последовательности, обеспечивающий секрецию чужеродного белка в клетках млекопитающих. При этом предпочтительно, чтобы присутствовали сайты процессинга, локализованные между фрагментом лидерной последовательности и чужеродным геном, которые могут быть расщеплены либо in vivo, либо in vitro. Фрагмент лидерной последовательности обычно кодирует сигнальный пептид, состоящий из гидрофобных аминокислот, которые обеспечивают направленную секрецию белка из клетки. Примером лидерной последовательности, которая обеспечивает секрецию чужеродного белка в клетках млекопитающих, является трехкомпонентная лидерная последовательность аденовируса.
Обычно, последовательностями терминации транскрипции и последовательностями полиаденилирования, распознаваемыми клетками млекопитающих, являются регуляторные области, расположенные с 3'-конца от кодона терминации трансляции, и, таким образом, эти области, взятые вместе с промоторными элементами, фланкируют кодирующую последовательность. 3'-Конец зрелой мРНК образуется благодаря сайт-специфическому посттранскрипционному расщеплению и полиаденилированию [Birnstiel et al., (1985) Cell, 41:349; Proudfoot & Whitelaw (1988) "Termination and 3' end processing of eukaryotic RNA" в Transcription and. splicing (ed. B.D.Hames & D.M.Glover); Proudfoot (1989) Trends Biochem. Sci. 14:105). Эти последовательности обеспечивают направленную транскрипцию мРНК, которая может транслироваться с образованием полипептида, кодируемого ДНК. Примерами сигналов терминации транскрипции/полиаденилирования являются сигналы, происходящие от SV40 [Sambrook et al. (1989), "Expression of cloned genes in cultured mammalian cells." In Molecular Cloning: A Laboratory Manual].
Обычно, вышеуказанные компоненты, содержащие промотор, сигнал полиаденилирования и последовательность терминации транскрипции, помещают вместе в экспрессирующие конструкции. Если необходимо, то в экспрессирующую конструкцию могут быть также введены энхансеры, интроны с донорными и акцепторными сайтами функционального сплайсинга и лидерные последовательности. Экспрессирующие конструкции часто встраивают в репликон, такой как внехромосомный элемент (например, плазмида), который может стабильно поддерживаться в хозяине, таком как клетки млекопитающих или бактерии. Системами репликации млекопитающих являются системы, происходящие от вирусов животных, для репликации которых требуются трансдействующие факторы. Так, например, плазмиды, содержащие системы репликации паповавирусов, таких как SV40 [Gluzman (1981) Cell, 23:175] или полиомавирусов, реплицируются с чрезвычайно высоким числом копий в присутствии соответствующего вирусного Т-антигена. Другими примерами репликонов млекопитающих являются репликоны, происходящие от коровьих папиломавирусов и вируса Эпштейна-Барра. Кроме того, этот репликон может иметь две системы репликации, что позволяет его использовать, например, для экспрессии в клетках млекопитающих и для клонирования и амплификации в прокариотическом хозяине. Примерами таких челночных векторов, происходящих от млекопитающего и от бактерии, являются рМТ2 [Kaufman et al. (1989) Mol. Cell. Biol. 9:946] и рНЕВО [Shimizu et al. (1986) Mol. Cell. Biol. 6:1074].
Используемый способ трансформации зависит от трансформируемого хозяина. Методы введения гетерологичных полинуклеотидов в клетки млекопитающих известны специалистам, и такими методами являются декстран-опосредованная трансфекция, преципитация фосфатом кальция, полибрен-опосредованная трансфекция, слияние протопластов, электропорация, инкапсулирование полинуклеотида(ов) в липосомы и непосредственное микроинъецирование ДНК в ядра клеток.
Клетки млекопитающих, пригодных для их использования в качестве хозяев, известны специалистам, и такими клетками являются многие иммортализованные линии клеток, депонированные в Американской коллекции типовых культур (АТСС), включая, но не ограничиваясь ими, клетки яичника китайского хомячка (СНО), клетки HeLa, клетки почки детеныша хомяка (ВНК), клетки почек обезьян (COS), клетки гепатоцеллюлярной карциномы человека (например, Нер G2) и ряд других клеточных линий.
(ii) Бакуловирусные системы
Полинуклеотид, кодирующий белок, может быть также встроен в подходящий экспрессирующий вектор насекомого и функционально присоединен к регуляторному элементу, присутствующему в этом векторе. При конструировании вектора используют известные методы. В основном, компонентами экспрессирующей системы являются вектор переноса, обычно, бактериальная плазмида, которая содержит как фрагмент бакуловирусного генома, так и стандартный сайт рестрикции для встраивания гетерологичного гена или генов, предназначенных для экспрессии; бакуловирус дикого типа, имеющий последовательность, гомологичную бакуловирус-специфическому фрагменту в векторе переноса (что позволяет осуществлять гомологичную рекомбинацию гетерологичного гена в бакуловирусном геноме); а также подходящие клетки-хозяева насекомых и среда для культивирования.
После встраивания ДНК-последовательности, кодирующей белок, в вектор переноса этот вектор и вирусный геном дикого типа трансфецируют в клетки-хозяева насекомых, где указанный вектор и вирусный геном подвергаются рекомбинации. Упакованный рекомбинантный вирус экспрессируется, после чего рекомбинантные бляшки идентифицируют и очищают. Материалы и методы для экспрессирующих систем "бакуловирус/клетка насекомого" являются коммерчески доступными в виде набора, поставляемого, среди прочих, фирмой Invitrogen, San Diego CA (набор "МахВас"). Эти методы известны специалистам и подробно описаны в работе Summers & Smith, Texas Agricultural Experiment Station Bulletin No 1555 (1987) (цитируемой далее как "Summers & Smith").
Перед встраиванием ДНК-последовательности, кодирующей белок, в бакуловирусный геном вышеописанные компоненты, включающие промотор, лидерную последовательность (если это необходимо), нужную кодирующую последовательность и последовательность терминации транскрипции, обычно объединяют с получением промежуточной конструкции для замены генов (вектор переноса). Эта конструкция может содержать один ген и функционально присоединенные регуляторные элементы; множество генов, каждый из которых имеет свой собственный набор функционально присоединенных регуляторных элементов; или множество генов, регулируемых тем же самым набором регуляторных элементов. Промежуточные конструкции для замены генов часто встраиваются в репликон, такой как внехромосомный элемент (например, плазмиды), способный стабильно поддерживаться в хозяине, таком как бактерия. Этот репликон имеет систему репликации, которая позволяет его использовать для клонирования и амплификации в подходящем хозяине.
В настоящее время, вектором переноса, наиболее часто используемым для введения чужеродных генов в AcNPV, является рАс373. Может быть также использовано множество других векторов, известных специалистам. Такими векторами, являются например, pVL985 (который заменяет полиэдриновый старт-кодон ATG на АТТ, и который вводит BamHI-сайт клонирования в положение, находящееся на 32 пары оснований ниже кодона АТТ; см., Luckow & Summers, Virology (1989) 17:31.
Эта плазмида, обычно, также содержит полиэдриновый сигнал полиаденилирования (Miller et al. (1988) Ann. Rev. Microbiol. 42:177), и прокариотический ген резистентности к ампициллину (amp) и сайт инициации репликации для осуществления отбора и размножения в E.coli.
Бакуловирусные векторы переноса обычно содержат бакуловирусный промотор. Бакуловирусный промотор представляет собой любую ДНК-последовательность, способную связываться с бакуловирусной РНК-полимеразой и инициировать транскрипцию кодирующей последовательности (например, структурного гена) в прямом направлении (5'→3') с образованием мРНК. Промотор может иметь область инициации транскрипции, которая обычно находится с 5'-конца от кодирующей последовательности. Эта область инициации транскрипции обычно включает сайт связывания с РНК-полимеразой и сайт инициации транскрипции. Бакуловирусный вектор переноса может также иметь второй домен, называемый энхансером, который, если он присутствует, обычно расположен далеко от структурного гена. Экспрессия может быть либо регулируемой, либо конститутивной.
Структурные гены, которые в избытке транскрибируются в заключительных стадиях инфекционного цикла вируса, имеют особенно ценные промоторные последовательности. Примерами таких последовательностей являются последовательности, происходящие от гена, кодирующего вирусный белок полиэдрон, Friesen et al. (1986) "The Regulation of Baculovirus Gene Expression", в "The Molecular Biology of Baculoviruses" (ed. Walter Doerfler); EPO Publ. Nos. 127839 and 155476; и гена, кодирующего белок р10, Vlak et al. (1988), J. Gen. Virol. 69:765.
ДНК, кодирующая подходящие сигнальные последовательности, может происходить из генов, кодирующих секретируемые белки насекомых или бакуловирусов, таких как бакуловирусный ген полиэдрина (Carbonell et al. (1988) Gene, 73:409). Альтернативно, поскольку сигналы для посттрансляционной модификации в клетках млекопитающих (таких как отщепление сигнального пептида, протеолитическое отщепление и фосфорилирование), очевидно, распознаются клетками насекомых, а сигналы, необходимые для секреции и аккумуляции в ядрах, очевидно, также являются консервативными для клеток беспозвоночных и позвоночных, то для обеспечения секреции в клетках насекомых могут быть также использованы лидерные последовательности, не происходящие от насекомых, такие как последовательности, происходящие от генов, кодирующих α-интерферон человека, Maeda et al. (1985), Nature 315:592; гастрин-высвобождающий пептид человека, Lebacq-Verheyden et al. (1988), Molec. Cell. Biol. 8:3129; IL-2 человека. Smith et al. (1985) Proc. Natl. Acad. Sci. USA, 82:8404; IL-3 мыши (Miyajima et al. (1987) Gene 58:273;и глюкоцереброзидазу человека, Martin et al. (1988) DNA, 7:99.
Рекомбинантный полипептид или полипротеин могут экспрессироваться внутриклеточно, либо, если они экспрессируются с подходящими регуляторными последовательностями, они могут быть секретированы. Для хорошей внутриклеточной экспрессии негибридных чужеродных белков, обычно, требуется присутствие гетерологичных генов, которые, в идеальном случае, имеют короткую лидерную последовательность, содержащую подходящие сигналы инициации трансляции перед старт-сигналом ATG. Если это необходимо, то метионин у N-конца может быть отщеплен от зрелого белка путем in vifcro-инкубирования с бромцианом.
Альтернативно, рекомбинантные полипротеины или белки, которые не секретируются в природных условиях, могут быть секретированы из клеток насекомых путем создания химерных ДНК-молекул, кодирующих гибридный белок, состоящий из фрагмента лидерной последовательности, которая обеспечивает секрецию чужеродного белка у насекомых. Фрагмент лидерной последовательности обычно кодирует сигнальный пептид, состоящий из гидрофобных аминокислот, которые способствуют транспорту белка в эндоплазматический ретикулум.
После введения ДНК-последовательности и/или гена, кодирующего предшественник продукта экспрессии белка, клетка-хозяин насекомого ко-трансформируется гетерологичной ДНК вектора переноса и геномной ДНК бакуловируса дикого типа, обычно, посредством ко-трансфекции. Промоторная последовательность и последовательность терминации транскрипции этой конструкции обычно содержит 2-5 т.п.н.-область генома бакуловируса. Методы встраивания гетерологичной ДНК в нужный сайт бакуловируса известны специалистам (см. Summers & Smith, см. выше; Ju et al. (1987); Smith et al., Mol. Cell. Biol. (1983) 3:2156; и Luckow & Summers (1989)). Например, такая инсерция может быть введена в ген, такой как ген полиэдрина, путем гомологичной рекомбинации посредством двойного кроссинговера; эта инсерция может быть также введена в рестрикционный сайт, сконструированный в нужном бакуловирусном гене. Miller et al. (1989), Bioassays 4:91. ДНК-последовательность, при ее клонировании в экспрессирующий вектор вместо гена полиэдрина, фланкирована по обоим 5'- и 3'-концам полиэдрин-специфическими последовательностями и расположена ниже промотора полиэдрина.
Затем, вновь сконструированный бакуловирусный экспрессирующий вектор упаковывают в инфекционный рекомбинантный бакуловирус. Гомологичная рекомбинация происходит при низкой частоте (в пределах от около 1% до около 5%), а поэтому большинство вирусов, продуцированных после ко-трансфекции, все еще являются вирусами дикого типа. Следовательно, необходимо разработать метод для идентификации рекомбинантных вирусов. Преимущество данной экспрессирующей системы заключается в том, что она позволяет идентифицировать рекомбинантные вирусы методом визуального скрининга. Белок полиэдрина, продуцируемый нативным вирусом, продуцируется в ядрах инфецированных клеток в очень больших количествах на последних стадиях после инфекционного цикла вируса. Аккумулированный белок полиэдрина образует тельца включения, которые также содержат встроенные частицы. Эти тельца включения размером вплоть до 15 мкм, обладают в высокой степени преломляющими свойствами, что придает им блестящий яркий цвет, который легко визуализируется с помощью оптического микроскопа. Клетки, инфецированные рекомбинантными вирусами, не обнаруживают телец включения. Для дифференциации рекомбинантного вируса от вируса дикого типа, трансфекционный супернатант наносят пятнами на монослой клеток насекомых с помощью техники, известной специалистам. А именно, бляшки скринируют с помощью оптического микроскопа на присутствие (указывающее на вирус дикого типа) или отсутствие (указывающее на рекомбинантный вирус) телец включения. "Current Protocols in Microbiology" Vol.2 (Ausubel et al., eds) at 16,8 (Supp.10, 1990); Summers and Smith, см. выше; Miller et al. (1989).
Рекомбинантные бакуловирусные экспрессирующие векторы были сконструированы для инфицирования некоторых клеток насекомых. Например, рекомбинантные бакуловирусы были сконструированы, помимо прочего, для: Aedes aegypti, Autographa californica, Bombyx mori, Drosophila melanogaster, Spodoptera frugiperda и Trichoplusia ni (WO 89/046699; Carbonell et al. (1985) J. Virol. 56:153; Wright (1986) Nature 321:718; Smith et al. (1983) Mol. Cell. Biol. 3:2156; и, в общих чертах, см. Fraser et al. (1989) In Vitro Cell. Dev. Biol. 25:225).
Клетки и среды для культивирования клеток являются коммерчески доступными материалами, используемыми для прямой экспрессии и экспрессии гетерологичных полипептидов в виде гибридов в бакуловирусных/экспрессионных системах; метод культивирования клеток, в основном, известен специалистам. См., например, Summers & Smith, см. выше.
Затем, модифицированные клетки насекомых могут быть культивированы в соответствующей питательной среде, которая обеспечивает стабильность плазмиды (плазмид), присутствующей в модифицированном насекомом-хозяине. Если ген экспрессируемого продукта находится под индуцибельным контролем, то клетки-хозяева могут быть культивированы до высокой плотности и экспрессия является индуцируемой. Альтернативно, если экспрессия является конститутивной, то данный продукт будет непрерывно экспрессироваться в среду, а поэтому питательная среда должна непрерывно циркулировать с удалением нужного продукта и с истощением питательных веществ. Этот продукт может быть очищен с помощью такой техники, как хроматография, например, ВЭЖХ, аффинная хроматография, ионообменная хроматография и т.п.; электрофорез; центрифугирование в градиенте плотности; экстракция растворителем или т.п. При необходимости, этот продукт может быть дополнительно очищен, например, для удаления, по существу, любых белков насекомых, которые также секретируются в этой среде или высвобождаются в нее в результате лизиса клеток насекомых, с получением, в итоге, продукта, который не содержит, по крайней мере, значительного количества клеточного дебриса хозяина, например белков, липидов и полисахаридов.
Для получения экспрессии белка рекомбинантные клетки-хозяева, происходящие от трансформантов, инкубируют в условиях, которые позволяют осуществлять экспрессию последовательности, кодирующей рекомбинантный белок. Эти условия могут варьироваться в зависимости от выбранной клетки-хозяина. Однако эти условия легко могут быть установлены каждым специалистом на основе имеющегося опыта.
iii. Растительные системы
Существует множество растительных клеточных культур и цельных систем для экспрессии генов в растениях. Примерами систем для экспрессии генов в клетках растений являются системы, описанные в патентах, таких как патенты США №5693506; 5659122 и 5608143. Другие примеры экспрессии генов в клеточных культурах растений описаны Zenk, Phytochemistry 30: 3861-3863 (1991). Описания сигнальных пептидов растительных белков можно найти, кроме того, в работах, указанных выше, Vaulcombe et al., Mol. Gen. Genet. 209:33-40 (1987); Chandler et al., Plant Molecular Biology 3:407-418 (1984); Rogers, J. Biol. Chem. 260:3731-3738 (1985); Rothstein et al., Gene 55:353-356 (1987); Whittier et al., Nucleic Acids Research 15:2515-2535 (1987); Wirsel et al., Molecular Microbiology 3:3-14 (1989); Yu et al., Gene 122:247-253 (1992). Описание регуляции экспрессии генов растений под действием фитогормона, гибберелловой кислоты и секретированных ферментов, индуцированных гибберелловой кислотой, можно найти в работах R.L.Jones and J.MacMillin, Gibberellins, в Advanced Plant Physiology, Malcolm B.Wilkins, ed., 1984 Pitman Publishing Limited, London, pp.21-52. Описание других метаболически регулируемых генов можно найти в работах: Sheen, Plant Cell, 2:1027-1038 (1990); Maas et al., EMBO J. 9:3447-3452 (1990); Benkel & Hickey, Proc. Natl. Acad. Sci. 84:1337-1339 (1987).
Обычно, с использованием техники, известной специалистам, нужную полинуклеотидную последовательность встраивают в экспрессирующий кластер, содержащий генные регуляторные элементы, сконструированные для проведения манипуляций в растениях. Этот экспрессирующий кластер встраивают в нужный экспрессирующий вектор вместе с сопровождающими последовательностями, расположенными выше и ниже от экспрессирующего кластера, подходящего для экспрессии в растительной клетке-хозяине. Эти сопровождающие последовательности происходят от плазмиды или вируса и наделяют вектор необходимыми свойствами, позволяющими переносить ДНК из первоначального клонирующего хозяина, такого как бактерия, в нужную растительную клетку-хозяина. Предпочтительно, чтобы основная конструкция бактериального/растительного вектора имела сайт инициации репликации для широкого круга хозяев-прокариотов; селектиуемый маркер прокариота; а для трансформации Agrobacterium, Т-ДНК-последовательности для Agrobacterium-опосредованного переноса в хромосомы растения. Если гетерологичный ген трудно поддается обнаружению, то предпочтительно, чтобы эта конструкция также содержала селектируемый маркерный ген, который позволил бы определить, является ли растительная клетка трансформированной. Общий обзор подходящих маркеров, например, для членов