Способ моделирования токсической ретинопатии
Иллюстрации
Показать всеИзобретение относится к экспериментальной медицине, а именно к экспериментальной офтальмологии, и может быть использовано для моделирования токсической ретинопатии. Для этого в стекловидное тело глаза кролика однократно вводят 0,04 мг каиновой кислоты в 0,1 мл физиологического раствора. Способ обеспечивает получение устойчивой, легко воспроизводимой модели ретинопатии. 1 табл., 2 ил.
Реферат
Предлагаемое изобретение относится к офтальмологии и предназначено для экспериментального моделирования токсической ретинопатиии.
Патогенез ретинальных дистрофических процессов, относящихся к распространенным и весьма тяжелым видам офтальмопатологии, остается малоизученным. Недостаточно разработаны и экспериментальные модели дистрофических поражений сетчатки. Между тем, экспериментальное моделирование дегенерации сетчатки с использованием различных повреждающих факторов расширяет возможности исследования патогенетических механизмов заболеваний сетчатой оболочки у человека, а следовательно, и возможности экспериментальной терапии.
Известно развитие ретинопатии у человека в ответ на длительное применение антималярийного препарата хлорохина и психотропного препарата фенотиазинового ряда - тиоридазина (сонапакс, меллерил). Оба вещества принадлежат к так называемым амфифилическим катионактивным соединениям, вызывающим липидозы, нарушение процессов перикисного окисления липидов и повреждение фоторецепторных клеток. Недостатком применения этих препаратов в эксперименте является необходимость их длительного введения: снижение электрофизиологических показателей сетчатки у крыс проявляется только через 5-8 месяцев, а морфологические изменения через 10 месяцев от начала введения препаратов (Т.А.Иванина и др. "Ультраструктура сетчатки при моделировании дегенеративных процессов" // Сб. научн. работ "Морфологич. аспекты офтальмологии", М., 1983, с.23-25).
Наиболее распространенной моделью токсической дегенерации является ретинопатия, вызываемая внутривенным введением 4% монойодуксусной кислоты по методу Noell W.K. (Noell W.К. Monin dected corneal ulcers // Ophthalmology, 1958, Vol.14, №1. - p.44-51) или ее солей, главным образом монойодацетата (Зуева М.В. и др. "Экспериментальная йодацетатная ретинопатия"// Вестн. офтальм., 1977, №3, с.59-60). Это экспериментальное повреждение сетчатки по многим своим проявлениям сходно с наследственными тапето-ретинальными дегенерациями. Несмотря на то, что биохимические проявления этих патологий, их этиология весьма различны, в обоих случаях повреждение начинается в фоторецепторном слое и пигментном эпителии сетчатки. Однако создание экспериментальной йодацетатной модели дегенерации сетчатки является сложной задачей из-за трудности выбора доз яда. На одну и ту же дозу животные реагируют чрезвычайно индивидуально: на одних она не отражается, другие гибнут (Р.В.Самсоненко, М.В.Ойзерман "Электрофизиологические и морфологические исследования сетчатки кролика при йодацетатной ретинопатии" // Мат. 3-го Всероссийского съезда офтальм. Т.2, М., 1975, с.199-202). Данный способ принят за ближайший аналог.
В связи с этим нами проявлен интерес к поиску новых видов экспериментальной ретинопатии. В нейрофизиологии известно использование каиновой кислоты и ее солей при моделировании нейродегенеративных состояний в центральной и периферической нервной системе. Каиновая кислота относится к возбуждающим аминокислотам и, являясь прямым агонистом глутаматного рецептора, обладает в 100 раз большей активностью чем α-глутамат (Johnston GAR., Curtis DR., Davies J., Mc Culloch RN. Spinal interneurone excitation by conformationally restricted analogues of α-glutamic acid. // Nature (Lond.).- 1974. - 248. - P.804-805; Olney JW., Rhee V., Ho О1. Kainic acid: A powerful neurotoxic analogue of glutamate. // Brain. Res. - 1974. - 77. - P.507-512). Характерная стереоизомерическая структура каиновой кислоты, а именно боковые цепи карбоксигрупп, способные образовывать сложный эфир и алкилирование нитроколец, обуславливает сильное возбуждающее действие каината (Biscoe TJ., Evans RH., Headley PM. et al. Structure-activity relations of excitatory amino acids on frog and rat spinal neurons. // Br. J. Pharmacol. - 1976. - 58. - P.373-382). Введение данного экситоксина in situ приводит к длительной стимуляции глутаматного рецептора, возрастанию экстраклеточной концентрации глутамата, блокаде синаптической передачи между нейронами, в результате чего в клетки поступает большое количество ионов кальция и других катионов, что ведет к гибели нейрона (Ferkany J.W., Zaczek R., Coyle J.Т. Kainic acid stimulates excitatory amino acid neurotransmitter release at presynaptic receptors // Nature (Lond.). - 1982. - V.298. P.757-759; Garthwaite J., Gartwaite G. The mechanism of kainic acid neurotoxicity // Nature (Lond.). - 1983. - V.305. - N 8. - P.138-140).
Техническим результатом предлагаемого изобретения является получение устойчивой, легко воспроизводимой модели ретинопатии.
Технический результат достигается за счет однократного введения в стекловидное тело раствора каиновой кислоты в определенной дозе.
Первоначальным этапом данного эксперимента явилась отработка дозы каиновой кислоты. Всего было проведено 3 серии эксперимента на 12 животных (кролики). Глаз кролика, как известно, является наиболее частым объектом моделирования в офтальмологии. Оптимальной как для клинического исследования, так и для изучения функциональной активности сетчатки оказалась доза 0,04 мг (в примерах отражен процесс подбора доз). При введении в полость стекловидного тела указанной дозы каиновой кислоты в 0,1 мл физиологического раствора на глазном дне к 7-м суткам наблюдения появляется легкое облаковидное преретинальное помутнение. На 20-е сутки развиваются выраженные фиброзные изменения сетчатки по типу витреоретинальной решетчатой дистрофии. На 30-е сутки отмечается прогрессирование пролиферации: выраженный фиброз сетчатки с развитием глиоза.
Степень повреждения сетчатки оценивали по показателям функционального состояния, а именно по уровню ее биоэлектрической активности, определяемой методом электроретинографии: регистрировали ганц-фельд ЭРГ и ритмическую ЭРГ (РЭРГ) на низкую (12 Гц) и высокую (32 Гц) частоту мельканий. Токсический эффект каината проявляется в дегенерации нейронов 2 и 3 порядка и не затрагивает структуру и функцию фоторецепторов (в ганц-фельд ЭРГ выявлялась грубая редукция амплитуды b-волны на фоне сохранной a-волны, генерируемой фоторецепторами). Учитывая, что в образовании b-волны принимают участие и МК, ее полное исчезновение на фоне некоторой сохранности РЭРГ позволяет предполагать, что первичной мишенью воздействия каината скорее являются МК. Отсутствие b-волны ЭРГ отмечалось в течение всего срока наблюдения - 30 дней.
При регистрации РЭРГ выявлено уменьшение ее амплитуды, что также можно связать со снижением функции биполярных клеток. Поскольку в генерацию РЭРГ вносят вклад не только биполярные клетки, но и фоторецепторы, то, возможно, именно их доля регистрируется в остаточной РЭРГ после блокады синаптической передачи между фоторецепторами и ON-биполярными клетками.
Параметром для определения функции МК является глиальный индекс: отношение b-волны ЭРГ к амплитуде РЭРГ на мелькания 8-12 Гц. Поскольку у большинства животных в контроле наблюдалось полное отсутствие b-волны ЭРГ, то значение Кг следует рассматривать близкими к нулю, что является признаком значительного угнетения активности МК и развитием глиоза сетчатки, что коррелирует с клиническими данными, В таблице представлены значения Кг для тех случаев, когда его можно было рассчитать. Через 1 нед. обнаруживалась резкая активизация метаболизма мюллеровской глии с возрастанием Кг до 8-10 ед. Подобное увеличение Кг отражает напряженность компенсаторно-приспособительных механизмов в сетчатке и является свидетельством развития ишемии и гипоксии в сетчатке.
Способ осуществляют следующим образом: животное наркотизируют в/м введением 2 мл тиопентала, инсталлируют в конъюнктивальную полость 0,5% раствор дикаина, после чего разрезают и отсепаровывают конъюнктиву в верхнем квадранте. Методом инъекции в стекловидное тело в 10 мм от лимба вводят 0,04 мг каиновой кислоты в 0,1 мл физиологического раствора с помощью инсулинового шприца с ограничителем на глубину 5 мм.
Пример 1. Каиновую кислоту вводили в стекловидное тело глаз кроликов в дозе 0,1 мг на 0,1 мл физиологического раствора. Указанная доза яда вызывает тяжелую степень повреждения сетчатки. На следующие сутки волна "b" ЭРГ полностью исчезала. На 5-6-е сутки животные погибали.
Пример 2. Каиновую кислоту вводили в стекловидное тело глаз кроликов в дозе 0,01 мг на 0,1 мл физиологического раствора. Указанная доза яда вызывает менее значительную степень повреждения сетчатки. На следующие сутки амплитуда волны "b" ЭРГ составляла в среднем 25-30% от исходного уровня и в течение 1-го месяца наблюдения повышалась до 40-50-ти % от исходного уровня без каких-либо вмешательств.
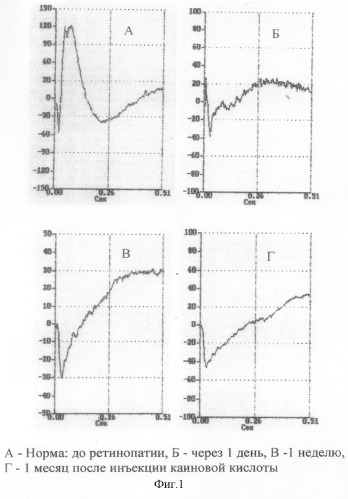
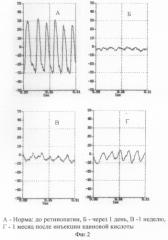
Пример 3. Каиновую кислоту вводили в стекловидное тело глаз кроликов в дозе 0,04 мг на 0,1 мл физиологического раствора. Указанная доза оказалась оптимальной для моделирования ретинопатии. В электроретинографических исследованиях выявлялась грубая редукция амплитуды низкочастотной ритмической ЭРГ, объективно отражающей суммарную функцию преимущественно ON-биполяров, и b-волны ЭРГ на фоне сохранной а-волны, генерируемой фоторецепторами сетчатки. У некоторых кроликов регистрировалась негативная ЭРГ: b-волна ниже изолинии при сохранной а-волне. Подобные изменения сохранялись в течение всего срока наблюдения. Результаты электроретинографических исследований суммированы в таблице 1. На фиг. 1 и 2 приведены записи ЭРГ и РЭРГ.
Таким образом, предложенный способ позволяет осуществить экспериментальное моделирование токсической ретинопатии с характерными изменениями на глазном дне и показательным снижением амплитуды b-волны ЭРГ, по динамике которой можно судить о эффекте различных нейропротекторных препаратов. Учитывая простую методику и отработанную дозу каиновой кислоты, данная модель ретинопатии представляется перспективной для экспериментальной офтальмологии.
| Таблица 1Динамика амплитуды волн ЭРГ и РЭРГ при моделировании каинатной ретинопатии (М+m) | |||||
| Показатели | До ретинопатии | Через 1 сутки | Через 7-8 суток | Через 3 недели | Через 1 месяц |
| а-волна ЭРГ | 38, 3±4,4 | 25,5±9,3 | 36,5±10,0 | 26,25±13,9 | 39,9±20,0 |
| b-волна ЭРГ | 140,0±16,7 | 0 и 15,5±9,9 | 0 и 49,0±15,4 | 0 и 57,0±9,6 | 0 и 49,5±11,0 |
| Кг | 2,3 | 3,9 и 0 | 9,6 и 0 | 4,1 и 0 | 7,6 и 0 |
| РЭРГ12 Гц | 60,0±12,3 | 4,0±2,2 | 5,1±2,6 | 14,0±12,0 | 6,5±3,6 |
| РЭРГ32 Гц | 12,3±2,5 | 0,7±1,2 | 2,0±1,3 | 2,0±0,9 | 1,2±1,0 |
Способ моделирования токсической ретинопатии, отличающийся тем, что в стекловидное тело глаза кролика однократно вводят 0,04 мг каиновой кислоты в 0,1 мл физиологического раствора.