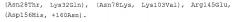Новые мутантные аллергены
Иллюстрации
Показать всеИзобретение относится к биотехнологии и может найти применение в медицине для приготовления вакцины против аллергических реакций. Рекомбинантные аллергены по изобретению представляют собой мутанты аллергенов природного происхождения, имеющие по меньшей мере четыре мутации. Примерами рекомбинантных аллергенов являются аллергены Bet v 1 и Ves v 1. Первичные мутации в рекомбинантном аллергене отделены друг от друга промежутком по меньшей мере в 15Å и расположены таким образом, что по меньшей мере одна круговая область поверхности с зоной в 800Å2 не содержит мутаций. Рекомбинантные аллергены применяются в качестве фармацевтического агента в составе фармацевтической композиции, представляющей вакцину против аллергических реакций. В изобретении описаны способы использования рекомбинантных аллергенов и фармацевтической композиции для выработки иммунного ответа у субъекта. Представлены последовательности ДНК, представленные в формуле, кодирующие рекомбинантные аллергены, экспрессирующий вектор, включающий ДНК, и клетка-хозяин для получения рекомбинантного аллергена. Описаны также способы получения фармкомпозиции и рекомбинантного мутантного аллергена. Использование рекомбинантных аллергенов позволяет снизить специфическую IgE-связывающую способность по сравнению с IgE-связывающей способностью аллергена природного происхождения. 12 н. и 21 з.п. ф-лы, 44 ил., 3 табл.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к новым рекомбинантным аллергенам, которые являются мутантами существующих в природе аллергенов. Изобретение относится также к композиции, включающей в себя смесь новых рекомбинантных мутантных аллергенов. Кроме того, изобретение относится к способу получения таких рекомбинантных мутантных аллергенов, а также к фармацевтическим композициям, включая вакцины, содержащим рекомбинантные мутантные аллергены. В дополнительных осуществлениях настоящее изобретение относится к способам индукции иммунных ответов у субъекта, вакцинации или лечения субъекта, а также к способам получения композиций согласно изобретению.
Известный уровень техники
Генетически предрасположенные индивидуумы становятся сенсибилизированными (аллергизированными) к антигенам, происходящим от разнообразных природных источников, к аллергенам, с которыми встречаются индивидуумы. Аллергическая реакция наступает тогда, когда ранее сенсибилизированный индивидуум повторно встречается с тем же самым или гомологичным антигеном. Аллергические ответы варьируют от сенной лихорадки, риноконъюнктивита, ринита и астмы до системной анафилаксии и смерти в ответ, например, на ужаливание пчелы или осы или укус насекомых. Реакция является немедленной и может быть вызвана множеством атопических аллергенов, таких как соединения, имеющиеся в травах, деревьях, сорняках, насекомых, пище, лекарствах, химических соединениях и парфюмерии.
Однако ответы не наступают, когда индивидуум встречается с аллергеном впервые. Развивается первоначальный адаптивный ответ, и обычно не возникает никаких симптомов. Но когда продуцируются антитела и Т-клетки, способные взаимодействовать с аллергеном, любая последующая экспозиция может провоцировать симптомы. Таким образом, аллергические ответы показывают, что сам иммунный ответ может вызвать существенные патологические состояния, которые могут представлять собой угрозу для жизни.
Антитела, вовлеченные в атопическую аллергию, принадлежат в первую очередь к иммуноглобулинам класса Е. IgE связываются со специфическими рецепторами на поверхности тучных клеток и базофилов. После образования комплекса специфического аллергена с IgE, связанным с тучными клетками, перекрестная сшивка рецепторов на клеточной поверхности ведет к проведению сигнала через рецепторы и физиологическому ответу клеток-мишеней. Дегрануляция заключается в высвобождении, среди прочего, гистамина, гепарина, хемотаксического фактора для эозинофильных лейкоцитов, лейкотриенов C4, D4 и E4, которые вызывают продолжительное сокращение клеток гладких мышц бронхов. Получаемые в результате этого эффекты могут быть системными или местными по природе.
Реакции гиперчувствительности, опосредуемые антителами, могут быть подразделены на четыре класса, обозначаемые как тип I, тип II, тип III и тип IV. Аллергические реакции типа I представляют собой классическую реакцию немедленной гиперчувствительности, наступающей в течение секунд или минут после экспозиции с антигеном. Данные симптомы опосредуются аллерген-специфичными IgE.
Обычно аллергические реакции наблюдаются в виде ответа на белковые аллергены, присутствующие, например, в пыльце, клещах домашней пыли, шерсти и перхоти животных, яде и пищевых продуктах.
Для того чтобы снизить или уничтожить аллергические реакции, обычно применяют точно контролируемое и повторное введение вакцин аллергенов. Вакцинацию аллергеном обычно осуществляют с помощью парентерального, интраназального или подъязычного введения в увеличивающихся дозах в течение довольно длительного периода времени, в результате чего происходит десенсибилизация пациента. Точный иммунологический механизм не известен, но индуцированные различия в фенотипе аллерген-специфичных Т-клеток, как предполагается, имеет особое значение.
Вакцинация аллергеном
Концепция вакцинации основывается на двух фундаментальных характеристиках иммунной системы, называемых специфичностью и памятью. Вакцинация будет праймировать иммунную систему реципиента и при повторной экспозиции со сходными белками иммунная система будет в состоянии более точно отвечать на контрольное заражение, например инфицирование микробами. Вакцины представляют собой смеси белков, предназначенные для применения при вакцинации, с целью выработки такого защитного иммунного ответа у реципиента. Защита должна охватывать только компоненты, присутствующие в вакцине, и гомологичные антигены. По сравнению с другими типами вакцинации вакцинация аллергеном осложняется существованием текущего иммунного ответа у пациентов с аллергией. Данный иммунный ответ характеризуется присутствием IgE, аллерген-специфичного, опосредующего реализацию аллергических симптомов при экспозиции с аллергенами. Таким образом, вакцинация аллергеном с применением аллергенов из природных источников имеет присущий ей риск побочных эффектов, имеющих весьма существенные последствия, угрожающие жизни пациента.
Попытки обойти данную проблему можно подразделить на три категории. При практических мерах часто сочетают более одной категории. Первая категория мер включает в себя введение нескольких небольших доз в течение продолжительного времени для достижения существенной аккумулированной дозы. Вторая категория мер включает в себя физическую модификацию аллергенов путем включения аллергенов в образующие гель вещества, такие как гидроксид алюминия. Состав гидроксида алюминия имеет эффект адъюванта и эффект депо для медленного высвобождения аллергена, снижающий тканевую концентрацию активных компонентов аллергена. Третья категория мер включает в себя химическую модификацию аллергенов с целью снижения аллергенности, т.е. связывания IgE.
Подробный механизм после успешной вакцинации аллергеном остается противоречивым. Установлено, однако, что Т-клетки играют ключевую роль в общей регуляции иммунных ответов. В соответствии с имеющимся в настоящее время всеобщим мнением отношение между двумя крайними фенотипами Т-клеток, Th1 и Th2 определяет аллергический статус индивидуума. При стимуляции аллергеном клетки Th1 секретируют интерлейкины с преобладанием интерферона-γ, что ведет к защитному иммунитету и к сохранению здоровья индивидуума. Клетки Th2, с другой стороны, секретируют преимущественно интерлейкин 4 и 5, что ведет к синтезу IgE и эозинофилии и к индукции аллергии у индивидуума. Исследования in vitro продемонстрировали возможность изменения ответов Т-клеток, аллерген-специфичных, путем нагрузки пептидами, происходящими из аллергена и содержащими эпитопы, связанные с Т-клетками. Имеющиеся в настоящее время подходы к новым вакцинам аллергенов, следовательно, основаны главным образом на воздействиях на Т-клетки с целью вызова ареактивности Т-клеток (индукция анергии) или переключения ответа с фенотипа Th2 на фенотип Th1.
Эпитопы, связывающие антитела (В-клеточные эпитопы)
Рентгеновский кристаллографический анализ комплексов Fab-антиген способствовал пониманию структуры эпитопов, связывающих антитела. В соответствии с данным типом анализа эпитопы, связывающие антитела, могут быть определены как часть поверхности антигена, включающая в себя атомы 15-25 аминокислотных остатков, которые находятся в пределах досягаемости атомов антитела, способных к прямому взаимодействию. Аффинность взаимодействия антиген-антитело не может быть предсказана только на основе энтальпии, в которую вносят вклад силы Ван-дер-Ваальса, водородные связи или ионные связи. Энтропия, связанная почти с полным удалением молекул воды с поверхности взаимодействия, дает сходный по величине энергетический вклад. Это означает, что совершенная подгонка между контурами взаимодействующих молекул является принципиальным фактором, лежащим в основе высокой аффинности взаимодействий антиген-антитело.
В патенте WO 97/30150 (ссылка 1) заявляется панель белковых молекул, причем белковые молекулы характеризуются распределением конкретных мутаций в аминокислотной последовательности по сравнению с родительским белком. Из описания ясно, что изобретение касается получения аналогов, которые являются модифицированными по сравнению с родительским белком, но которые захватываются, гидролизуются и представляются Т-клеткам тем же самым образом, что и родительский белок (природно существующие аллергены). Тем самым получают модифицированный Т-клеточный ответ. Библиотеки модифицированных белков получены с применением способов, обозначаемых как PM (экономный мутагенез).
В патенте WO 92/02621 (ссылка 2) описаны рекомбинантные молекулы ДНК, причем молекулы включают в себя ДНК, кодирующую полипептид, имеющий по меньшей мере один эпитоп аллергена деревьев рода Fagales, причем аллерген выбран из Aln g 1, Cor a 1 и Bet v 1. Описываемые в данном описании рекомбинантные молекулы все должны иметь аминокислотную последовательность или часть аминокислотной последовательности, которая соответствует последовательности природно существующего аллергена.
Патент WO 90/11293 (ссылка 3) относится, среди прочего, к выделенным пептидам аллергена пыльцы амброзии полыннолистной и к модифицированным пептидам пыльцы амброзии полыннолистной. Раскрытые в нем пептиды имеют последовательность аминокислот, соответствующую последовательности либо природно существующего аллергена, либо его природно существующих изоформ.
Химическая модификация аллергенов
Было предпринято несколько подходов к химической модификации аллергенов. Подходы начала семидесятых включают в себя химическое присоединение аллергенов к полимерам и химическую поперечную сшивку аллергенов с применением формальдегида и так далее с получением так называемых "аллергоидов". Рациональное обоснование данных подходов состояло в рандомизированном разрушении эпитопов, связывающих IgE, путем присоединения химического лиганда, в результате чего снижалось связывание IgE при сохранении иммуногенности за счет увеличенной молекулярной массы комплексов. Недостатки, присущие получению "аллергоидов", связаны с трудностями контролирования процесса химической поперечной сшивки и с трудностями в анализе и стандартизации получаемых в результате высокомолекулярных комплексов. "Аллергоиды" в настоящее время применяются в клинической практике, и за счет рандомизированного разрушения эпитопов, связывающих IgE, могут быть введены более высокие дозы по сравнению с общепринятыми вакцинами, но параметры безопасности и эффективности не улучшаются по сравнению с применением традиционных вакцин.
Более современные подходы к химической модификации аллергенов направлены на полное разрушение третичной структуры аллергена, причем уничтожается таким образом связывание IgE и предполагается, что важной мишенью терапевтического воздействия является аллерген-специфичная Т-клетка. Такие вакцины содержат синтетические пептиды, полученные на основе последовательности аллергена, представляющие собой минимальные эпитопы для Т-клеток, более длинные пептиды, представляющие собой связанные с Т-клетками эпитопы, синтетические пептиды, полученные на основе более длинной последовательности аллергена, представляющие собой области иммунодоминантных эпитопов для Т-клеток, или молекулы аллергенов, разрезанные на две половины с помощью рекомбинантных способов. Другой подход, основанный на данном рациональном обосновании, представляет собой предложение по использованию рекомбинантных изоформ с "низким связыванием IgE". В последние годы стало ясно, что природные аллергены являются гетерогенными, содержащими изоаллергены и варианты, в которых заменено приблизительно до 25% аминокислот. Некоторые рекомбинантные изоаллергены, как обнаружено, являются менее эффективными при связывании IgE, возможно из-за разрушения третичной структуры.
Мутагенез in vitro и вакцинация аллергеном
Попытки снизить аллергенность с помощью сайт-направленного мутагенеза in vitro предпринимали с применением нескольких аллергенов, включая Der f 2 (Takai et al., ссылка 4), Der p 2 (Smith et al., ссылка 5), 39 кДа аллерген Dermatophagoides farinae (Aki et a.l, ссылка 6), фосфолипазу А2 яда пчелы (Förster et al., ссылка 7), Ara h 1 (Burks et al., ссылка 8), Ara h 2 (Stanley et al., ссылка 9), Bet v 1 (Ferreira et al., ссылка 10 и 11), профилин березы (Wiedemann et al., ссылка 12) и Ory s 1 (Alvarez et al., ссылка 13).
Обоснование данных подходов опять основывается на аллерген-специфичных Т-клетках вместе с тем, в то же самое время на снижении риска побочных эффектов, опосредованных IgE, путем снижения или уничтожения связывания IgE с помощью нарушения третичной структуры рекомбинантного мутантного аллергена. Обоснование данных подходов не включает в себя концепцию доминантных эпитопов, связывающих IgE, и не включает в себя концепцию инициации нового защитного иммунного ответа, который также вовлекает В-клетки в выработку антител.
В статье Ferreira et al. (ссылка 11) описывается применение сайт-направленного мутагенеза с целью снижения связывания IgE. Хотя трехмерная структура Bet v 1 упоминается в статье, авторы не используют структуру для предсказания экспонированных в растворитель аминокислотных остатков в отношении мутации, половина из которых характеризуется низкой степенью экспонирования в растворитель. Скорее они применяют способ, разработанный для предсказания функциональных остатков в белках, отличный от представления о структуре, основанной на идентификации консервативных областей поверхности, описываемой в данном описании. Хотя авторы действительно обсуждают консерватизм третичной структуры α-углеродного скелета, данная концепция не является частью терапевтической стратегии, а просто включена для оценки связывания IgE in vitro. Более того, представленное доказательство не является адекватным, так как нормализация спектров КД препятствует оценке денатурации доли образца, что является обычной проблемой. Описанная терапевтическая стратегия направлена на индукцию толерантности аллерген-специфичных Т-клеток и инициация нового иммунного ответа не упоминается.
В статье Wiedemann et al. (ссылка 12) описывается применение сайт-направленного мутагенеза и пептидного синтеза с целью эпитопной характеристики моноклонального антитела. Авторы знают третичную структуру антигена и они применяют данное знание для отбора экспонированной на поверхности аминокислоты для мутации. Применяемый алгоритм может быть оценен как противоположный описанному изобретателями настоящего изобретения, так как выбирается аминокислота, отличающаяся от гомологичных последовательностей. Исследование показывает, что замена поверхностно расположенной аминокислоты способна модифицировать связывающие характеристики моноклонального антитела, что не удивительно, если учесть известные факты. Описанные эксперименты не предназначены для оценки модуляции связывания поликлональных антител, таких как сывороточные IgE, пациентов с аллергией. В одном из содержащихся там экспериментов действительно применяют IgE сыворотки и, хотя данный эксперимент не подходит для количественного анализа, на связывание IgE, очевидно, не повлияли сделанные мутации.
В статье Smith et al. (ссылка 5) описывается применение сайт-направленного мутагенеза с целью картирования эпитопов моноклонального антитела и снижения связывания IgE. Авторам не известна третичная структура и они не делают попытки оценить консерватизм третичной структуры α-углеродного скелета. Применяемый алгоритм не гарантирует того, что аминокислоты, выбранные для мутагенеза, действительно экспонируются на поверхности молекулы. Только один из описанных мутантов ведет к существенному снижению связывания IgE. Данный мутант характеризуется недостаточностью связывания со всеми тестируемыми антителами, что указывает на нарушение третичной структуры. Авторы не определяют терапевтическую стратегию, и инициация нового иммунного ответа не упоминается.
В статье Colombo et al. (ссылка 14) описывается исследование эпитопа, связывающего IgE, с помощью применения сайт-направленного мутагенеза и пептидного синтеза. Авторы применяют компьютерное моделирование трехмерной структуры, основанное на кристаллической структуре гомологичного белка, для иллюстрации присутствия эпитопа на поверхности молекулы. Дополнительное присутствие эпитопа на отличном аллергене, имеющем гомологию первичной структуры, достигается применением синтетических пептидов, представляющих эпитоп. Терапевтическая стратегия основывается на лечении с применением данного синтетического пептида, представляющего эпитоп, связывающийся с моновалентным IgE. Консервативные области поверхности между гомологичными аллергенами, а также терапевтическая концепция инициации нового защитного иммунного ответа не упоминаются.
В статье Spangfort et al. (ссылка 15) описывается трехмерная структура и консервативные расположенные на поверхности зоны главного аллергена березы. В статье не упоминаются ни главные эпитопы, связывающие IgE, ни сайт-направленный мутагенез, ни цели терапевтического применения.
Ни в одном из исследований, описанных выше, связывание IgE не снижалось при замене экспонированных на поверхности аминокислот при сохранении третичной структуры α-углеродного скелета. Обоснование упомянутых выше подходов не включает в себя концепцию доминантных эпитопов связывания IgE и не включает в себя терапевтическую концепцию инициации нового защитного иммунного ответа.
В патенте WO 99/47680 раскрыто введение искусственных аминокислотных замен в определенные критические положения при сохранении третичной структуры α-углеродного скелета аллергена. В частности, в патенте WO 99/47680 раскрыт рекомбинантный аллерген, который является неприродным мутантом, ведущим начало от природного аллергена, в котором по меньшей мере один экспонированный на поверхности консервативный аминокислотный остаток эпитопа В-клеток заменен другим остатком, который не находится в том же положении в аминокислотной последовательности любого известного гомологичного белка в пределах таксономического порядка, от которого происходит указанный природный аллерген, причем указанный мутантный аллерген имеет по существу ту же самую третичную структуру α-углеродного скелета, что и указанный природный аллерген, и специфическое связывание IgE с мутантным аллергеном снижалось по сравнению со связыванием с указанным природным аллергеном.
Рекомбинантный аллерген, раскрытый в патенте WO 99/47680, получают путем a) идентификации аминокислотных остатков в природном аллергене, которые сохраняются более чем с 70% идентичностью во всех известных гомологичных белках, в пределах таксономического порядка, от которого происходит указанный природный аллерген, b) определения по меньшей мере одной зоны консервативных аминокислотных остатков, согласованно соединенных на протяжении по меньшей мере 400 Å2 поверхности трехмерной молекулы аллергена, как определяется наличием доступности для растворителя, составляющей по меньшей мере 20%, причем по меньшей мере одна зона включает в себя по меньшей мере один эпитоп В-клеток, и с) замены по меньшей мере одного аминокислотного остатка в указанной по меньшей мере одной зоне другой аминокислотой, которая является неконсервативной в конкретном положении и при этом по существу сохраняет общую третичную структуру α-углеродного скелета молекулы аллергена.
Краткое описание чертежей
На фиг.1 показаны специфичные для мутанта олигонуклеотидные праймеры, примененные для мутанта номер 1 Bet v 1. Мутантные нуклеотиды подчеркнуты.
На фиг.2 показаны два общеприменимых праймера (обозначенных "полностью смысловой" и "полностью антисмысловой"), которые синтезировали и применяли для всех мутантов.
На фиг.3 показана ДНК и аминокислотная последовательность природного аллергена 1 Bet v 1, а также ряд мутаций Bet v 1.
На фиг.4 показано ингибирование связывания биотинилированного рекомбинантного Bet v 1 с сывороточным IgE из пула сыворотки пациентов с аллергией небиотинилированным Bet v 1 и мутантом Bet v 1 Glu45Ser.
На фиг.5 показано ингибирование связывания биотинилированного рекомбинантного Bet v 1 с сывороточным IgE из пула сыворотки пациентов с аллергией небиотинилированным Bet v 1 и мутантом Bet v 1 Asn28Thr+Lys32Gln.
На фиг.6 показано ингибирование связывания биотинилированного рекомбинантного Bet v 1 с сывороточным IgE из пула сыворотки пациентов с аллергией небиотинилированным Bet v 1 и мутантом Bet v 1 Pro108Gly.
На фиг.7 показано ингибирование связывания биотинилированного рекомбинантного Bet v 1 с сывороточным IgE из пула сыворотки пациентов с аллергией небиотинилированным Bet v 1 и мутантом Bet v 1 Glu60Ser.
На фиг.8 показаны спектры КД рекомбинанта и мутанта по трем зонам, записанные при концентрациях, близких к равным.
На фиг.9 показано ингибирование связывания биотинилированного рекомбинантного Bet v 1 с сывороточным IgE из пула сыворотки пациентов с аллергией небиотинилированным Bet v 1 и мутантом Bet v 1 по трем зонам.
На фиг.10А-D показана доступность для растворителя индивидуально выровненных остатков антигена 5 и выравнивание последовательностей антигена 5 Vespula (левая панель). На правой панели фигуры 10 показана молекулярная поверхность антигена 5 с консервативными среди антигена 5:s Vespula областями.
На фиг.11 показана последовательность праймера, соответствующего аминоконцу Ves v 5, ведущая начало от смысловой цепи. Последовательность нижнего праймера берет начало от антисмысловой цепи.
На фиг.12 показаны два общеприменимых праймера (обозначенных "полностью смысловой" и "полностью антисмысловой"), которые синтезировали и применяли для всех мутантов.
На фиг.13 показана ДНК и аминокислотная последовательность природного аллергена Ves v 5, а также две мутации Ves v 5.
На фиг.14 показано ингибирование связывания биотинилированного рекомбинантного Ves v 5 с сывороточным IgE из пула сыворотки пациентов с аллергией небиотинилированным Ves v 5 и мутантом Ves v 5 Lys72Ala.
На фиг.15А и В показана теоретическая модель взаимодействия между аллергеном и тучными клетками посредством перекрестного взаимодействия с IgE.
На фиг.16 показана ДНК и аминокислотная последовательность природного аллергена Der p 2.
На фиг.17 схематически показаны праймеры, примененные для создания мутаций. (I) показывает смысловой и антисмысловой праймеры. (II) показывает конечный рекомбинантный белок, несущий мутации в указанных положениях.
На фиг.18 показана иллюстрация конструирования мутантов Bet v 1 и перечень примененных праймеров. Мутанты содержат от пяти до девяти аминокислот.
На фиг.19 показаны введенные точечные мутации на поверхности Bet v 1 (2628) и Bet v 1 (2637). В мутант Bet v 1 (2628) вводили пять первичных мутаций в одну половину Bet v 1, при этом другая половина оставалась неизмененной. В мутант Bet v 1 (2637) вводили пять первичных и три вторичных мутации в другую половину, при этом первая половина оставалась неизмененной.
На фиг.20 показаны спектры кругового дихроизма (КД) рекомбинантного Bet v 1.2801 (дикого типа) и мутанта Bet v 1 (2637), записанные при почти равных концентрациях.
На фиг.21 показано ингибирование связывания биотинилированного рекомбинантного Bet v 1.2801 (дикого типа) с сывороточным IgE из пула сыворотки пациентов с аллергией небиотинилированным Bet v 1.2801 и Bet v 1 (2628), Bet v 1 (2637) и смесью 1:1 Bet v 1 (2628) и Bet v 1 (2637).
На фиг.22 показано высвобождение гистамина базофильными клетками человека под действием Bet v 1.2801 (дикого типа), Bet v 1 (2628) и Bet v 1 (2637).
На фиг.23 показано высвобождение гистамина базофильными клетками человека под действием Bet v 1.2801 (дикого типа), Bet v 1 (2628) и Bet v 1 (2637).
На фиг.24 показаны точечные мутации на поверхности Bet v 1 (2744).
На фиг.25 показаны точечные мутации на поверхности Bet v 1 (2753).
На фиг.26 показаны точечные мутации на поверхности Bet v 1 (2744) и Bet v 1 (2753).
На фиг.27 показаны спектры кругового дихроизма (КД) Bet v 1.2801 (дикого типа) и Bet v 1 (2744), записанные при почти равных концентрациях.
На фиг.28 показано высвобождение гистамина базофильными клетками человека под действием Bet v 1.2801 (дикого типа) и мутанта Bet v 1 (2744).
На фиг.29A-D показано высвобождение гистамина базофильными клетками человека под действием Bet v 1.2801 (дикого типа) и мутанта Bet v 1 (2744).
На фиг.30 показаны точечные мутации на поверхности Bet v 1 (2733).
На фиг.31 показаны праймеры, примененные для сайт-направленного мутагенеза, Der p 2.
На фиг.32А-С показано выравнивание последовательности Der p 2 с другой группой 2 аллергенов клещей домашней пыли.
На фиг.33 показаны контуры поверхности Der p 2 под четырьмя различными углами.
На фиг.34 показаны контуры поверхности мутанта Der p 2 под четырьмя различными углами.
На фиг.35А и B показано выравнивание последовательности Der p 2 с другой группой 1 аллергенов клещей домашней пыли.
На фиг.36 показаны контуры поверхности Der p 1 под четырьмя различными углами.
На фиг.37 показаны контуры поверхности мутанта Der p 1 под четырьмя различными углами.
На фиг.38A-D показано выравнивание последовательности Phl p 5 c другой группой 5 аллергенов травы.
На фиг.39A и B показаны контуры поверхности Phl p 5, модель A и модель B соответственно, под четырьмя различными углами.
На фиг.40A и B показаны контуры поверхности мутанта Phl p 5, модель A и B соответственно, под четырьмя различными углами.
На фиг.41 показана пролиферация лимфоцитов периферической крови, выраженная в виде индекса стимуляции (SI), для различных препаратов Bet v 1.
На фиг.42-44 показан профиль цитокинов Т-клеток, стимулированных различными препаратами Bet v. На фиг.42 показан больной с профилем Th0, на фиг.43 - профиль Th1, и на фиг.44 - профиль Th2.
ЦЕЛЬ ИЗОБРЕТЕНИЯ
Обоснование настоящего изобретения
Настоящее изобретение основано на уникальном обосновании. В соответствии с данным обоснованием механизмом успешной вакцинации аллергеном является не изменение текущего иммунного ответа типа Th2, а предпочтительно параллельная инициация нового иммунного ответа, включающего в себя узнавание В-клетками эпитопа, сформированного на базе третичной структуры, и образование антител. Предполагается, что новый иммунный ответ частично представляет собой иммунный ответ типа Th1. Данная модель подтверждается обнаружением того, что на уровни специфических IgE не влияет успешное проведение вакцинации и данное успешное лечение часто сопровождается существенным ростом аллерген-специфичных IgG4. Кроме того, исследования биоптатов носовой полости перед нагрузкой аллергеном и после нее не указывают на снижение Т-клеток с Th2-подобным фенотипом, но наблюдается предпочтительно увеличение Т-клеток с Th1-подобным фенотипом. Когда вакцину (или фармацевтические композиции) вводят другим путем, отличным от воздушного, предполагается, что новый иммунный ответ развивается в месте, физически отделенном от текущего Th2 ответа, что обеспечивает тем самым возможность параллельного существования двух ответов.
Другим важным аспектом иммунной системы является признание существования так называемых доминантных эпитопов, связывающих IgE. Предполагается, что данные доминантные эпитопы, связывающие IgE, сформированы сцепленными областями поверхности, зависящими от третичной структуры, достаточно большими, чтобы приспособить связывание антитела и консервативных эпитопов среди изоаллергенов, вариантов и/или гомологичных аллергенов от родственных видов. Существование перекрестно реактивных IgE, способных связывать сходные эпитопы на гомологичных аллергенах, поддерживается клиническим наблюдением, что больные аллергией часто реагируют на несколько близкородственных видов, например ольху, березу и орешник, многие виды трав или несколько видов клещей домашней пыли рода Dermatophagoides. Это дополнительно поддерживается лабораторными экспериментами, демонстрирующими перекрестную реактивность IgE между гомологичными аллергенами от родственных видов и способность одного аллергена ингибировать связывание IgE с гомологичными аллергенами (Ipsen et al., 1992, ссылка 16). Хорошо известно, что экспозиция и иммунные ответы связаны дозо-зависимым образом. Основываясь на сочетании данных наблюдений, предполагается, что консервативные области поверхности предъявляются иммунной системе в более высоких дозах, чем неконсервативные области поверхности, что в результате ведет к выработке антител IgE с более высокой аффинностью, отсюда термин "доминантные эпитопы, связывающие IgE".
В соответствии с данным обоснованием существенно, чтобы аллерген имел третичную структуру α-углеродного скелета, которая по существу является той же самой, что и природный аллерген, обеспечивая таким образом консервативность топологии поверхности областей, окружающих консервативные зоны, представляющие собой мишени для мутагенеза, предназначенного для снижения связывания IgE. Удовлетворяющий данным критериям аллерген может вводиться в относительно более высоких дозах, что улучшает его эффективность в отношении выработки защитного иммунного ответа без риска для безопасности.
Более того, изобретение основывается на данных о том, что триггером для аллергических симптомов является перекрестное связывание аллергена с двумя специфичными IgE, связанными с поверхностью эффекторных клеток, т.е. тучных клеток и базофилов, через высокоаффинный рецептор IgE, FceRI. Для иллюстрации авторы ссылаются на фиг.15, на которой изображена теоретическая модель аллергена с эпитопами, связывающими IgE. На индукцию высвобождения медиатора тучной клеткой и, отсюда, на аллергические симптомы влияет опосредованное аллергеном перекрестное связывание IgE, связанного с поверхностью тучной клетки, сравните фиг.15А. В случае, представленном на фиг.15В, два эпитопа подвергают мутагенезу так, чтобы снизить их связывающую способность по отношению к IgE, и, следовательно, опосредуемое аллергеном перекрестное связывание предотвращается. В этой связи должно быть отмечено, что аллергены обычно включают в себя более трех В-клеточных эпитопов. Однако на основе теоретической модели, изображенной на фиг.15, можно предположить, что чем больше эпитопов, которые подвергают мутагенезу так, чтобы уничтожить или снизить их связывающую способность по отношению к IgE, тем ниже риск опосредуемого аллергеном перекрестного связывания и возникающих в результате этого аллергических симптомов.
Однако для того чтобы мутантный аллерген был способен вызывать новый иммунный ответ, включая IgG ответ, аллерген должен включать в себя по меньшей мере один интактный эпитоп. Предпочтительно, чтобы интактный эпитоп представлял собой доминантный эпитоп, так как такой мутантный аллерген должен обеспечивать улучшенную защиту при применении для вакцинации.
В заключение изобретательская идея настоящего изобретения основывается на признании того, что мутантный аллерген, несущий мутации, снижающие связывание с IgE, во многих В-клеточных эпитопах, и по меньшей мере один интактный эпитоп должен, с одной стороны, снижать опосредуемое аллергеном перекрестное связывание и, с другой стороны, давать возможность индукции IgG ответа со связывающей способностью, конкурирующей с IgE. Таким образом, указанный мутантный аллерген должен быть крайне выгодным аллергеном в результате того, что риск анафилактических реакций должен быть существенно снижен.
Настоящее изобретение также основано на признании того, что вакцина, содержащая смесь различных мутированных указанным образом аллергенов, где в идеале многие или все эпитопы представлены как интактные, должна быть столь же эффективной по свой способности индуцировать защиту против аллергических симптомов, как и природно существующий аллерген, от которого произошли мутантные аллергены.
Краткое изложение существа изобретения
Настоящее изобретение относится к введению искусственных аминокислотных замен в ряд определенных критических положений, т.е. эпитопы, связывающие IgE, с целью снижения специфической IgE-связывающей способности каждого мутантного эпитопа.
В изобретении предлагается рекомбинантный аллерген, отличающийся тем, что он является мутантом природно существующего аллергена, где мутантный аллерген имеет по меньшей мере четыре первичных мутации, каждая из которых снижает специфическую IgE-связывающую способность мутантного аллергена по сравнению с IgE-связывающей способностью указанного природно существующего аллергена, где каждая первичная мутация является заменой одного экспонированного на поверхности аминокислотного остатка другим остатком, который не встречается в том же положении в аминокислотной последовательности любого известного гомологичного белка в пределах таксономических видов, из которых происходит указанный природно существующий аллерген, где каждая первичная мутация разделена с каждой другой первичной мутацией промежутком по меньшей мере в 15 Å и где первичные мутации расположены таким образом, что по меньшей мере одна круговая область поверхности с зоной 800 Å2 не содержит мутации.
Не связывая себя теорией, авторы предполагают, что В-клеточные эпитопы могут быть распределены почти по всей поверхности аллергена. Более того, существует экспериментальное доказательство того, что по меньшей мере некоторые эпитопы составляют часть кластера эпитопов, включающего в себя большое количество перекрывающихся эпитопов. Следовательно, теоретическая основа настоящего изобретения заключается в том, что любая экспонированная на поверхности аминокислота является потенциальным сайтом для мутации, которая может приводить к пониженной способности связывания IgE.
Соответственно, первичные мутации определяют по их расположению по отношению друг к другу, т.е. они распределены по отдельности, с тем чтобы была уверенность, что они представляют собой мутации в отдельных кластерах эпитопов.
В настоящем изобретении также предлагается композиция, включающая в себя два или более указанных выше рекомбинантных мутантных аллергенных варианта, где каждый вариант определяется как имеющий по меньшей мере одну главную мутацию, которая отсутствует по меньшей мере в одном из других вариантов, где в каждом варианте не присутствует вторичной мутации в радиусе 15 Å от каждой отсутствующей первичной мутации. Композиция предпочтительно включает в себя 2-12, более предпочтительно 3-10, еще более предпочтительно 4-8 и наиболее предпочтительно 5-7 вариантов.
В настоящем изобретении также предлагается способ получения указанного выше рекомбинантного аллергена, отличающийся тем, что
а) в природно существующем аллергене идентифицируют ряд аминокислотных остатков, которые имеют по меньшей мере 20% доступность для растворителя;
b) выбирают по меньшей мере четыре идентифицированных аминокислотных остатка таким образом, что каждая выбранная аминокислота разделена с другой выбранной аминокислотой промежутком по меньшей мере в 15 Å и что выбранные аминокислоты расположены таким образом, что по меньшей мере одна круговая область поверхности с зоной 800 Å2 не содержит выбранной аминокислоты, и
с) осуществляют первичную мутацию каждой из выбранных аминокислот, которая снижает специфическую IgE-связывающую способность мутантного аллергена по сравнению со связывающей способностью указанного природно существующего аллергена, где каждая первичная мутация представляет собой замену выбранного аминокислотного остатка другой аминокислотой, которая не существует в том же самом положении в аминокислотной последовательности любого известного гомологичного белка в пределах таксономического вида, от которого происходит указанный природно существующий аллерген.
В альтернативном аспекте изобретение относится к способу получения рекомбинантного аллергена в соответствии с изобретением, отличающемуся тем, что аллерген получают из последовательности ДНК, полученной с помощью перетасовки ДНК (молекулярной селекции), от ДНК, кодирующей соответствующий природно существующий аллерген.
Более того, изобретение относится к указанному выше рекомбинантному аллергену для применения в качестве фармацевтического средства.
Кроме того, изобретение относится к применению указанного выше рекомбинантного аллергена для получения фармацевтического средства для профилактики и/или лечения аллергии.
Более того, изобретение относится к указанной выше композиции для прим