Семейство пептидов, обладающее анальгетической активностью
Иллюстрации
Показать всеИзобретение относится к химико-фармацевтической промышленности и касается получения и применения пептидов формулы (I), обладающих анальгетической активностью, для создания новых лекарственных препаратов. Пептиды обладают повышенной активностью по сравнению с пентальгином, анальгином, морфином, не токсичны.
где
А - О, - Ala, -Asp, -Glu, -Phe, -Gly, -His, -He, -Lys, -Leu, -Met, -Pro, -Arg, -Ser, -Thr, -Val, -Trp, -Tyr;
Б - О, - Ala, -Asp, -Glu, -Phe, -Gly, -His, -He, -Lys, -Leu, -Met, -Pro, -Arg, -Ser, -Thr, -Val, -Trp, -Tyr;
В - О, - Ala, -Asp, -Glu, -Phe, -Gly, -His, -He, -Lys, -Leu, -Met, -Pro, -Arg, -Ser, -Thr, -Val, -Trp, -Tyr;
X - OH, -ОСН3, -NH2. 5 табл.
Реферат
Настоящее изобретение относится к использованию пептидов общей формулы A-Б-Tyr-Pro(DPro, dHPro, DdHPro, DLdHPro, Hyp)-B-X, приведенных ниже, в качестве обезболивающих анальгетических препаратов.
Известны различные обезболивающие препараты, которые по своей химической природе и механизму действия подразделяются на наркотические (морфин и близкие к нему структуры) и ненаркотические анальгетики (производные салициловой кислоты, пиразолона, анилина и др.). Все вышеперечисленные анальгетики обладают теми или иными недостатками, которые резко сужают возможности их применения в медицине [М.Д.Машковский. Лекарственные средства, Харьков: из-во «Торсинг»,1997, издание 13, с.144-145].
Известны в организме млекопитающих эндогенные лиганды пептидной природы, ответственные за физиологические анальгетические эффекты энкефалины и эндорфины. В последние годы обнаружен и активно исследуется еще один класс эндогенных пептидов - динорфины, в частности дерморфин [Емельянова Т.Г., Незавибатько В.Н., Усенко А.Б., Андреева Л.А. Гептапептид, обладающий анальгетической активностью, сочетающейся с терморегуляторной и/или с сосудодвигательной активностью и/или с влиянием на поведенческую реакцию испытуемого, и способ изменения физиологической активности дерморфина [Патент №2134121, выдан 10 августа 1999 г.], обладающие свойствами эндогенных анальгетиков.
Однако использовать эти пептидные последовательности для создания лекарственных препаратов не удалось. Это связано с тем, что в организме наряду с системой образования эндогенных анальгетиков существует и система быстрого их уничтожения. Поэтому попытки создания новых лекарственных препаратов пептидной природы не увенчались успехом.
С целью устранения отмеченных недостатков предлагается новая группа пептидных последовательностей общей формулы
А-Б-Tyr-Pro(DPro, dHPro, DdHPro, DLdHPro, Hyp)-В-Х.
Синтезированы дипептиды формулы Tyr-Pro, Tyr-Pro-ОСН3, Tyr-Pro-NH2, трипептиды Tyr-Pro-Ser-ОСН3, Tyr-Pro-Ser-NH2, Tyr-Hyp-Ser-ОСН3, Tyr-Hyp-Ser-NH2, Tyr-DPro-Ser-ОСН3, Tyr-DPro-Ser-NH2, Tyr-DLdHPro-Ser-ОСН3, Tyr-dHPro-Ser-NH2, Tyr-Pro-Lys-NH2, Tyr-Pro-Ala-NH2, тетрапептиды: Tyr-Pro-Gly-Pro-NH2, Tyr-Tyr-Pro-Ser-NH2, Ala-Tyr-DPro-Ser-NH2, DAla-Tyr-DPro-Ser-NH2, Glu-Tyr-DPro-Ser-NH2, Met-Tyr-DPro-Ser-NH2, отвечающие вышеприведенной общей формуле, обладающие анальгетической активностью.
Приведенные аминокислотные последовательности, обладающие анальгетической активностью, обладают общей закономерностью, а именно наличием в структуре пептидной последовательности Tyr-Pro(DPro, dHPro, DdHPro, DLdHPro, Hyp) в 1,2 или 2,3-положениях вышеприведенных пептидов. Впервые обнаружена закономерность, воздействовать на центральную нервную систему пептидов общей формулы
, где
А - О, -Ala, -Asp, -Glu, -Phe, -Gly, -His, -Ile, -Lys, -Leu, -Met, -Pro, -Arg, -Ser, -Thr, -Val, -Trp, -Tyr;
Б - О, -Ala, -Asp, -Glu, -Phe, -Gly, -His, -Ile, -Lys, -Leu, -Met, -Pro, -Arg, -Ser, -Thr, -Val, -Trp, -Tyr;
В - О, -Ala, -Asp, -Glu, -Phe, -Gly, -His, -Ile, -Lys, -Leu, -Met, -Pro, -Arg, -Ser, -Thr, -Val, -Trp, -Tyr;
X - OH, -OCH3, -NH2.
Эта закономерность подтверждена синтезом и анальгетическими тестами, проведенными на животных, самых разнообразных пептидов, отвечающих общей формуле аминокислотной последовательности. Исходя из приведенных исследований, можно заключить, что пептиды, отвечающие общей формуле , могут быть использованы для создания новых лекарственных препаратов с анальгетической активностью.
Изобретение относится к области физиологии и фармакологии для создания новых лекарственных препаратов и может найти применение в медицине.
Техническим результатом, достигаемым настоящим изобретением, является создание новых пептидов, отвечающих общей формуле (I), выявление их полезных анальгетических свойств и направленная разработка на их основе лекарственных препаратов.
Указанный технический результат достигается тем, что позволяет направленно синтезировать различные пептидные последовательности, отвечающие общей формуле (I) по общей схеме. Проводить направленный скрининг обезболивающих свойств синтезированных пептидов по стандартной программе.
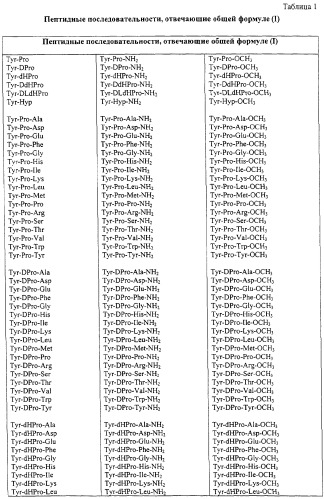
Некоторые пептиды общей формулы (I) представлены в таблице 1 и включают:
Все пептиды этого семейства обладали анальгетической активностью. Ниже приведены примеры, подтверждающие это.
Синтез пептидов формулы (I) осуществляли методами пептидной химии, как в растворе, так и твердофазным методом синтеза с использованием L и D аминокислот, а также L, D и DL дегидро-аминокислот (3,4-дегидро-аминокислота в формуле (I), в таблицах и приведенных примерах обозначена символом dHPro).
Пример 1. Синтез трипептида HCl·H-Tyr-3,4-DLdHPro-Ser-OCH3.
На примере синтеза трипептида показан общий подход при синтезе пептидов формулы (I) в растворе.
В таблице 2 приведены пептиды формулы (I), синтезированные методами пептидной химии в растворе.
| Таблица 2 | ||
| Tyr-Pro-ОСН3 | Tyr-Pro-NH2 | Tyr-Pro |
| Tyr-DPro-Ser-ОСН3 | Tyr-DPro-Ser-NH2 | Tyr-Pro-Gly-Pro |
| Tyr-Pro-Ser-ОСН3 | Tyr-Pro-Ser-NH2 | |
| Tyr-Hyp-Ser-ОСН3 | Tyr-Hyp-Ser-NH2 | |
| Tyr-DLdHPro-Ser-ОСН3 | Tyr-dHPro-Ser-NH2 |
Синтез трипептида HCl·H-Tyr-3,4-DLdHPro-Ser-ОСН3 осуществляли конденсацией дипептида DiBoc-Tyr-3,4-DLdHPro и HCl·H-Ser-ОСН3 с использованием методов пептидной химии в растворе. Фрагменты синтезировали с применением тетрабутиламмонийных солей (ТБА) и методом активированных эфиров. Упаривание растворов проводили на вакуумном испарителе при 40°С. Контроль за синтезом и индивидуальность полученных соединений осуществляли с помощью тонкослойной хроматографии на пластинках с силикагелем фирмы Silufol (ЧСФР) при опрыскивании раствором нингидрина в системах растворителей:
1 - ацетон:бензол:уксусная кислота (2:1:1);
2 - хлороформ:метанол:аммиак (8:1,75:0,25).
Все растворители абсолютировали соответствующим образом. Точки плавления не корректировали. Колоночную хроматографию проводили с использованием носителей Силикагель L-40/100m и Silasorb 600 [LC] фирмы Chemapol (ЧСФР). Проверку гомогенности пептида проводили с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ). Все растворители соответствующим образом абсолютировали.
Принятые сокращения:
Boc - трет-бутилоксикарбонильная группа;
ДЦГК - дициклогексилкарбодиимид;
OSu - сукцинимидный эфир;
ТБА - тетрабутиламмоний;
ТЭА - триэтиламин;
dHPro - 3,4 дегидро-пролин;
ВЭЖХ - высокоэффективная жидкостная хроматография;
ТСХ - тонкослойная хроматография.
I. Получение дипептида DiBoc-Tyr-3,4-DLdH Pro.
1. К 3,4-DLdHPro 315 мг (2.78 ммоль) добавляли 5.56 мл (2.78 ммоль) 13% ТБА, упаривали 1 раз с этанолом, 1 раз с изо-пропанолом, 1 раз с бензолом, охлаждали до 0°С.
2. К охлажденному раствору ТБА 3,4-DLdHPro в 20 мл абс. этилацетата при охлаждении добавляли в сухом виде DiBoc-Tyr-OSu 1.330 г (2.78 ммоль), перемешивали 1 час при комнатной температуре на магнитной мешалке, за ходом реакции следили по ТСХ в хроматографической системе (1).
По окончании реакции растворитель упаривали, добавляли воду, подкисляли NaHSO4 (5-кратный избыток), до рН 3, экстрагировали 5 раз по 50 мл этилацетатом. Объединенные фракции этилацетата промывали водой, 10% раствором KHSO4, водой, сушили над MgSO4, упаривали, высаживали из эфира гексаном (дважды). Осадок в виде порошка сушили в вакууме.
Выход 1.32 г (2.76 ммоль) 99,3%
Rf=0.382 (1)
II. DiBoc-Tyr-3,4-DLdHPro-Ser-OCH3
DiBoc-Tyr-3,4-DLdHPro 1,32 г (2.76 ммоль) растворяли в 20 мл ацетонитрила, добавляли избыток (1.3) N-гидроксисукцинимида 412.8 мг (3.59 ммоль), охлаждали до 0°С и добавляли избыток (1.3) ДЦГК 810.88 мг (3.59 ммоль). Перемешивали на магнитной мешалке 1 час, охлаждали до 0°С, добавляли избыток (1.3) HCl·Н-Ser-ОСН3 558.22 мг (3.59 ммоль) и избыток (1.3) ТЭА 0.5 мл (3.59 ммоль), перемешивали 1 час при охлаждении и двое суток при комнатной температуре. Реакционную смесь отфильтровывали, упаривали, добавляли 100 мл этилацетата, экстрагировали водой, 10% раствором KHSO4, водой, 5% раствором NaHCO3, водой, насыщ. раствором NaCI. Раствор этилацетата сушили над MgSO4, отфильтровывали, упаривали. Переосаждали дважды из ацетона гексаном. Полученный осадок сушили в вакууме.
Выход 1.38 г (2.38 ммоль) - 86.56%
Rf=0.238 (1); 0.812 (2)
III. HCl·H-Tyr-3.4-DLdHPro-Ser-OCH3.
К 1.38 г (2.38 ммоль) DiBoc-Tyr-3,4-DLdHPro-Ser-OCH3 добавляли 7.14 мл 1н. HCl/СН3СООН и 2% анизола (0.14 мл анизола). Выдерживали 45 минут при комнатной температуре, упаривали, переосаждали из метанола эфиром.
Выход: 860 мг (1.93 ммоль) - 81%
Rf=0.512 (2).
Результаты ВЭЖХ: Колонка Zorbax SB-AQ С18. 4,6*150 мм; скорость потока 1 мл/мин; элюэнт 5% МеОН-50 mM buff, pH 2.8), линейный градиент, температура 30°C, давление 9.0 МРа, время выхода 7,73 мин.
Пример 2.
В таблице 3 приведены примеры синтеза пептидов автоматическим твердофазным методом.
| Таблица 3 | |
| 1. | Tyr-Pro-Ala-NH2 |
| 2. | Tyr-Pro-Lys-NH2 |
| 3. | Met-Tyr-DPro-Ser-NH2 |
| 4. | Ala-Tyr-DPro-Ser-NH2 |
| 5. | Glu-Tyr-DPro-Ser-NH2 |
| 6. | DAla-Tyr-DPro-Ser-NH2 |
Пептиды, приведенные в таблице 3, были синтезированы автоматическим твердофазным методом по Fmoc-схеме на полимере Ринка (4-(2,4-диметоксифенил-флуоренилметокси-аминометил)-фенокси-полистирол, 0.5 ммоль амино-групп на 1 г полимера) с использованием DEPCDI/HOBt метода активации аминокислот. Пептиды отщепляли от полимера и деблокировали смесью TFA:m-crezole (95:5). Очистку пептидов проводили с помощью обращенно-фазовой ВЭЖХ (колонка Jupiter Cis (10×250 мм) в следующем градиенте ацетонитрила: 5 мин при 2%, затем линейный градиент от 2 до 60% за 50 мин в 0.1% трифторацетатном буфере при скорости потока 4 мл/мин. Пептиды были охарактеризованы при помощи масс-спектрометрии (MALDI).
Пример 3.
Проведены сравнительные биологические испытания дипептидов Tyr-Pro, Tyr-Pro-ОСН3, Tyr-Pro-NH2, трипептидов Tyr-Pro-Ser-ОСН3, Tyr-Pro-Ser-NH2, Tyr-Hyp-Ser-ОСН3, Tyr-Hyp-Ser-NH2, Tyr-DPro-Ser-ОСН3, Tyr-DPro-Ser-NH2, Tyr-DLdHPro-Ser-ОСН3, Tyr-dHPro-Ser-NH2, Tyr-Pro-Lys-NH2, Tyr-Pro-Ala-NH2, тетрапептидов: Tyr-Pro-Gly-Pro-NH2, Tyr-Tyr-Pro-Ser-NH2, Ala-Tyr-DPro-Ser-NH2, DAla-Tyr-DPro-Ser-NH2, Glu-Tyr-DPro-Ser-NH2, Met-Tyr-DPro-Ser-NH2 в тесте «отдергивания хвоста» для выявления анальгетической активности с гексапептидом Tyr-DPro-Ser-Pro-Gly-Pro, гептапептидом Tyr-DAla-Phe-Gly-Tyr-Pro-Ser-NH2 - дерморфином и известными анальгетиками - пенталгином, анальгином и морфином.
Тест «отдергивания хвоста» - tail flick (D'Amor. 1941). Животное помещали в индивидуальную пластиковую камеру, хвост погружали на 5 см в сосуд с водой с температурой 55±1°С. Рефлекс отдергивания хвоста замыкается на уровне спинного мозга. В тесте фиксировали латентный период избавления от болевого раздражителя - период времени (сек), в течение которого животное выдергивало хвост из воды полностью. Максимальное время предъявления болевого раздражителя - 30 сек. Исходную болевую чувствительность определяли как среднее арифметическое из показателей, зафиксированных на 60, 40 и 20 минут до инъекции. Латентный период избавления от болевого раздражителя фиксировали через 20, 40 и 60, 120 минут после введения. Анальгетическую активность оценивали по изменению латентного периода реакции по формуле А=ЛПоп-ЛПисх, где ЛПоп - латентный период избавления после введения вещества, ЛПисх - среднее арифметическое латентных периодов избавления до введения вещества.
Исследуемые пептиды в дозе 1 мг/кг вводили внутрибрюшинно в водном растворе самцам нелинейных белых крыс весом 200-300 г. Контрольным животным вводили внутрибрюшинно дистиллированную воду. Полученные результаты приведены в таблице 4.
| Таблица 4 | ||||||
| 20 мин | 40 мин | 60 мин | 90 мин | 120 мин | Площадь под кривой | |
| Дипептиды в дозе 1 мг/кг | ||||||
| Tyr-Pro | 1,4 | 8,2* | 6,4* | 4,3* | 2,0* | 511 |
| Tyr-Pro-ОМе | 1,4 | 7,8* | 5,7* | 4,9* | 1,5 | 496 |
| Tyr-Pro-NH2 | 1,3 | 8,4* | 4,7* | 3,8* | 0,8 | 438 |
| Трипептиды в дозе 1 мг/кг | ||||||
| Tyr-Pro-Ser-OMe | 3,1* | 2,6* | 3,0* | 1,5 | 1,4 | 255 |
| Tyr-Pro-Ser-NH2 | 4,1* | 5,1* | 4,7* | 3,6* | 1,8 | 437 |
| Tyr-Hyp-Ser-OMe | -1,8 | -1,5 | 2,0* | 1,0 | 0,3 | 18,5 |
| Tyr-Hyp-Ser-NH2 | 2,3* | 1,7 | 1,1 | 0,6 | 0,2 | 129 |
| Tyr-DPro-Ser-OMe | 4,1* | 2,3* | 0,1 | 0 | 0 | 131 |
| Tyr-DPro-Ser-NH2 | 5,7* | 4,1* | 3,0* | 2,0* | 1,0 | 346 |
| Tyr-DLΔPro-Ser-OMe | 1,9 | 2,2* | 2,6* | 1,3 | 0,5 | 194 |
| Tyr-ΔРго-Ser-NH2 | 1,8 | 2,3* | 6,0* | 3,0* | 1,1 | 339 |
| Tyr-Pro-Lys-NH2 | 3,4* | 3,1* | 8,0* | 1,4 | -0,2 | 369 |
| Tyr-Pro-Ala-NH2 | 4,8* | 4,2* | 2,5* | 2,4* | 1,0 | 330 |
| Тетрапептиды в дозе 1 мг/кг | ||||||
| Tyr-Pro-Glv-Pro-NH2 | 3,6* | 2,0* | 2,9* | 1,2 | 0,4 | 227 |
| Tyr-Tyr-Pro-Ser-NH2 | 2,5* | 2,2* | 2,2* | 1,5 | 0,3 | 199 |
| Ala-Tyr-DPro-Ser-NH2 | 1,7 | 4,8* | 3,0* | 1,9 | 0,2 | 253 |
| DAla-Tyr-DPro-Ser-NH2 | 1,8 | 2,2* | 3,8* | 2,1* | 0,7 | 249 |
| Glu-Tyr-DPro-Ser-NH2 | 2,4* | 6,1* | 6,6* | 4,3* | 0,9 | 478 |
| Met-Tyr-DPro-Ser-NH2 | 0,9 | 1,8 | 0,4 | 0,2 | 0,1 | 72 |
| Гексапептид Tyr-DPro-Ser-Pro-Gly-Pro | ||||||
| в дозе 1 мг/кг | 10,3* | 1,7 | 1,1 | 0,5 | -0,1 | 290 |
| Гептапептид Tyr-DAla-Phe-Gly-Tyr-Pro-Ser-NH2-дерморфин | ||||||
| в дозе 1 мг/кг | 3,4 | 1,9 | 0,7 | 0,3 | 0,1 | 100 |
| в дозе 10 мг/кг | 2,4 | 3,5 | 6,2 | 7,8 | 8 | 733 |
| Пенталгин в дозе 750 мг/кг | 3,9 | 7,9 | 7,5 | 7,5 | 7,5 | 802 |
| Анальгин в дозе 2500 мг/кг | -0,1 | 0 | 0,1 | 0,2 | 0,1 | 16 |
| Морфин | ||||||
| в дозе 1 мг/кг | 1,4 | 0,7 | 0,9 | 0,9 | 0,5 | 89 |
| в дозе 10 мг/кг | 7,5 | 7,5 | 7,5 | 7,5 | 7,5 | 750 |
| Контроль | 0,5 | 0,4 | 0 | 0,2 | -0,4 | 18 |
| * - р<0,05 - достоверные отличия от контрольной группы |
Из таблицы 4 видно, что внутрибрюшинное введение дипептидов формулы (I) Tyr-Pro, Tyr-Pro-ОСН3, Tyr-Pro-NH2 вызывает достоверное увеличение латентного периода реакции отдергивания хвоста в ответ на болевое раздражение через 40 минут после введения. Эффект сохраняется на протяжении 90 минут.
Внутрибрюшинное введение трипептидов формулы (I) Tyr-Pro-Ser-ОСН3, Tyr-Pro-Ser-NH2, Tyr-Hyp-Ser-ОСН3, Tyr-Hyp-Ser-NH2, Tyr-DPro-Ser-ОСН3, Tyr-DPro-Ser-NH2, Tyr-DLdHPro-Ser-OCH3, Tyr-dHPro-Ser-NH2, Tyr-Pro-Lys-NH2, Tyr-Pro-Ala-NH2 также приводило к увеличению латентного периода реакции отдергивания хвоста. Введение Tyr-Pro-Ser-NH2, Tyr-DPro-Ser-NH2 или Tyr-Pro-Ala-NH2 вызывало достоверное удлинение времени реакции на протяжении 90 минут после инъекции. Tyr-Pro-Ser-ОСН3 и Tyr-Pro-Lys-NH2 вызывали обезболивающее действие в течение часа. Эффект Tyr-DLdHPro-Ser-ОСН3, Tyr-dHPro-Ser-NH2 развивался на 40 минуте после введения и длился до 60 минуты у Tyr-DLdHPro-Ser-ОСН3 и до 90 минуты у Tyr-dHPro-Ser-NH2, Tyr-DPro-Ser-ОСН3 вызывал анальгетическую реакцию на 20 и 40 минуте после введения. Обезболивающее действие Tyr-Hyp-Ser-ОСН3, Tyr-Нур-Ser-NH2 было слабым. Таким образом, было остановлено, что амидирование С-концевого аминокислотною остатка приводит к удлинению и усилению апальгетического эффекта трипептидов общей формулы (I). Модификации Pro остатка также изменяют анальгетическую активность.
Внутрибрюшинное введение тетрапептидов формулы (I) Tyr-Pro-Gly-Pro-NH2, Tyr-Tyr-Pro-Ser-NH2, Ala-Tyr-DPro-Ser-NH2, DAla-Tyr-DPro-Ser-NH2, Glu-Tyr-DPro-Ser-NH2, Met-Tyr-DPro-Ser-NH2 изменяло латентный период реакции отдергивания хвоста. Наибольшей анальгетической активностью обладал Glu-Tyr-DPro-Ser-NH2. Увеличение латентного периода реакции наблюдалось в течение 90 минут наблюдения. Tyr-Pro-Gly-Pro-NH2 и Tyr-Tyr-Pro-Ser-NH2 удлиняли латентный период отдергивания хвоста па протяжении 60 минут наблюдения. Эффект Ala-Tyr-DPro-Ser-NH2 и DAla-Tyr-DPro-Ser-NH2 начинался на 40 минуте после введения и длился у Ala-Tyr-DPro-Ser-NH2 до 60 минуты, a DAla-Tyr-DPro-Ser-NH2 - до 90 минуты. Met-Tyr-DPro-Ser-NH2 достоверно не изменял латентный период реакции отдергивания хвоста. Таким образом, изменение аминокислотных остатков вокруг последовательности Tyr-Pro влияет на анальгетическую активность.
Пример 4.
Проведены биологические испытания дипептидов Tyr-Pro, Tyr-Pro-ОСН3, Tyr-Pro-NH2, трипептидов Tyr-Pro-Ser-ОСН3, Tyr-Pro-Ser-NH2, Tyr-Hyp-Ser-ОСН3, Tyr-Hyp-Ser-NH2, Tyr-DPro-Ser-ОСН3, Tyr-DPro-Ser-NH2 Tyr-DLdHPro-Ser-ОСН3, Tyr-dHPro-Ser-NH2, Tyr-Pro-Lys-NH2, Tyr-Pro-Ala-NH2, тетрапептидов Tyr-Pro-Gly-Pro-NH2, Tyr-Tyr-Pro-Ser-NH2, Ala-Tyr-DPro-Ser-NH2, DAla-Tyr-DPro-Ser-NH2, Glu-Tyr-DPro-Ser-NH2, Met-Tyr-DPro-Ser-NH2, в тесте корчей, вызванных уксусной кислотой.
Тест корчей, вызванных уксусной кислотой (Chernov et. al., 1967). Исследования проводились на самцах нелинейных белых мышей весом 20-30 г. Животных случайным образом разделяли на две группы по 10 мышей. Исследуемые пептиды в дозе 1 мг/кг вводили внутрибрюшинно за 20 минут до внутрибрюшинного введения 0,6% раствора уксусной кислоты. Контрольным животным вводили внутрибрюшинно дистиллированную воду также за 20 минут до внутрибрюшинного введения 0,6% раствора уксусной кислоты. Животные помещались в индивидуальные боксы. Регистрировалось число корчей на протяжении 30 минут после внутрибрюшинного введения 0,6% раствора уксусной кислоты (из расчета 10 мл на 1 кг веса). Число корчей в контрольной группе принималось за 100%. Полученные результаты приведены в таблице 5.
| Таблица 5 | ||
| Число корчей | % | |
| Контроль | 26,1 | 100 |
| Дипептиды | ||
| Tyr-Pro-ОСН3 | 4 | 15,3* |
| Трипептиды | ||
| Tyr-Pro-Ser-ОСН3 | 7,5 | 28,7* |
| Tvr-Pro-Ser-NH2 | 3,3 | 12,6* |
| Tyr-Hyp-Ser-ОСН3 | 3,6 | 13,8* |
| Tyr-Hyp-Ser-NH2 | 2,8 | 10,7* |
| Tyr-DPro-Ser-ОСН3 | 5,0 | 19,1* |
| Tyr-DPro-Ser-NH2 | 7,0 | 26,8* |
| Tyr-DLdHPro-Ser-OCH3 | 3,6 | 13,8* |
| Tyr-dHPro-Ser-NH2 | 1,3 | 5,0* |
| Tyr-Pro-Lys-NH2 | 3,6 | 13,8* |
| Tyr-Pro-Ala-NH2 | 5,1 | 19,5* |
| Тетрапептиды | ||
| Tyr-Pro-Gly-Pro-NH2 | 3,6 | 13,8* |
| Met-Tyr-DPro-Ser-NH2 | 1,8 | 7,0* |
| Контроль | 16,8 | 100 |
| Тетрапептиды | ||
| Ala-Tyr-DPro-Ser-NH2 | 3,6 | 21,4* |
| DAla-Tyr-DPro-Ser-NH2 | 1,0 | 5,9* |
| Glu-Tyr-DPro-Ser-NH2 | 2,1 | 12,5* |
| * - p<0.05 - достоверные отличия от контрольной группы. |
Из таблицы 5 видно, что внутрибрюшинное введение дипептида формулы (I) Tyr-Pro-ОСН3, трипептидов формулы (I) Tyr-Pro-Ser-ОСН3, Tyr-Pro-Ser-NH2, Tyr-Hvp-Ser-ОСН3, Tyr-Hyp-Ser-NH2, Tyr-DPro-Ser-ОСН3, Tyr-DPro-Ser-NH2, Tyr-DLdHPro-Ser-ОСН3, Tyr-dHPro-Ser-NH2, Tyr-Pro-Lys-NH2, Tyr-Pro-Ala-NH2 тетрапептидов формулы (I) Tyr-Pro-Gly-Pro-NH2, Ala-Tyr-DPro-Ser-NH2, DAla-Tyr-DPro-Ser-NH2, Glu-Tyr-DPro-Ser-NH2, Met-Tyr-DPro-Ser-NH2, вызывает достоверное уменьшение числа корчей после введения уксусной кислоты по сравнению с контрольной группой.
Таким образом, дипептид, трипептиды, тетрапептиды формулы (I) обладают выраженным анальгетическнм эффектом в тесте корчей, вызванных уксусной кислотой.
Пептиды общей формулы
A-Б-Tyr-Pro(DPro, dHPro, DdHPro, DLdHPro, Hyp)-B-X,
где А - О, -Ala, -Asp, -Glu, -Phe, -Gly, -His, -He, -Lys, -Leu, -Met, -Pro, -Arg, -Ser, -Thr, -Val, -Trp, -Tyr;
Б - О, -Ala, -Asp, -Glu, -Phe, -Gly, -His, -He, -Lys, -Leu, -Met, -Pro, -Arg, -Ser, -Thr, -Val, -Trp, -Tyr;
В - О, - Ala, -Asp, -Glu, -Phe, -Gly, -His, -He, -Lys, -Leu, -Met, -Pro, -Arg, -Ser, -Thr, -Val, -Trp, -Tyr;
X - OH, -ОСН3, -NH2,
обладающие анальгетической активностью (О - обозначает отсутствие аминокислоты).