Вакцины, содержащие рибавирин, и способы их использования
Иллюстрации
Показать всеИзобретение относится к области медицины и касается нового полипептида вируса гепатита С NS3/4A и его использования в вакцине. Сущность изобретения включает новый полипептид вируса гепатита С NS3/4A, имеющий последовательность SEQ. ID. NO.: 17, полинуклеотид, кодирующий этот полипептид с последовательностью SEQ. ID. NO.: 16, рекомбинантный вектор экспрессии, содержащий этот полинуклеотид, генетически сконструированную клетку-хозяина, содержащую этот рекомбинантный вектор, антитело, которое взаимодействует с полипептидом NS3/4A, и иммуногенные составы, содержащие полипептид NS3/4A и рибавирин, а также полинуклеотид SEQ. ID. NO.: 16 и рибовирин. Преимущество изобретения заключается в повышении иммуногенности нового полипептида NS3/4A, 8 н. и 6 з.п. ф-лы, 15 табл., 5 ил.
Реферат
Область изобретения
Настоящее изобретение относится к составам и способам усиления эффекта, оказываемого вакцинами на животных, таких как сельскохозяйственные, спортивные, домашние, и на людей. В частности, предпочтительные варианты выполнения связаны с использованием рибавирина в качестве вспомогательного фармацевтического вещества и составов, содержащих рибавирин и антиген.
Существующий уровень техники
Использование вакцин для предотвращения заболеваний у людей, домашнего скота, спортивных и домашних животных является общепринятой практикой. Однако зачастую антиген, используемый в вакцине, не является достаточно иммуногенным для повышения титра антител до уровней, достаточных для обеспечения защиты от последующего заражения или для поддержания потенциала для закрепления этих уровней на длительные периоды времени. Далее, многие вакцины являются недостаточными для того, чтобы вызвать опосредованный клетками иммунитет, который является первичной иммунной защитой от бактериальной и вирусной инфекции. Значительная часть исследований в настоящее время сфокусирована на разработке более мощных вакцин и способов усиления иммуногенности содержащих антиген препаратов (См., например, патенты США №№6056961, 6060068, 6063380 и Li et al., Science 288:2219-2222 (2000)).
Среди таких "слабых" вакцин печально известны вакцины гепатита В. Например, рекомбинантные вакцины против вируса гепатита В, такие как Genhevacb (Pasteur Merieux Serums tn Vaccines, 58, Avenue Leclerc 69007 Lyon, France), Engerixb (Smith, Kline and Symbol French) и Recombivaxhb (Merck, Sharp, and Dhome) эффективны только после по меньшей мере трех инъекций на 0, 30 и 60 или 180 дни с обязательной бустерной дозой через год (Chedid et al., патент США №6063380). Далее, многие субъекты, получавшие эти вакцины, реагировали слабо, если вообще реагировали. Поскольку многие регионы мира являются эндемичными для инфекции HBV, слабый иммуногенный характер существующих HBV-вакцин стал крайне серьезной проблемой.
Для получения более сильной гуморальной и/или клеточной реакции общепринятым является введение вакцины в веществе, которое усиливает иммунную реакцию пациента на антиген, присутствующий в вакцине. Наиболее часто используемыми вспомогательными фармацевтическими веществами (адъювантами) для вакцинных протоколов являются масляные препараты и квасцы (Chedid et al., патент США №6063380). Необходим более широкий спектр безопасных и эффективных адъювантов.
Нуклеозидные аналоги широко использовались при антивирусных терапиях из-за своей способности снижать вирусную репликацию (Hosoya et al., J. Inf. Dis., 168:641-646 (1993)). Рибавирин (1-β-D-рибофуранозил-1,2,4-триазол-3-карбоксамид) является синтетическим гуанозиновым аналогом, который использовался для ингибирования репликации RNA и DNA вирусов (Huffman et al., Antimicrob. Agents. Chemother., 3:235 (1973); Sidwell et al., Science, 177:705 (1972)). Показано, что рибавирин является конкурентоспособным ингибитором инозитол монофосфата (IMP) дегидрогеназы (IMPDH), которая преобразует IMP в IMX (который затем преобразуется в гуаниловую кислоту GMP). (De Clercq, Anti viral Agents: characteristic activity spectrum depending on the molecular target with which they interact. Academic press, Inc., New York, N.Y., pp.1-55 (1993)). Внутриклеточные емкости гуанозин 5'-трифосфата (GTP) истощаются в результате долговременной обработки рибавирином.
В дополнение к антивирусной активности исследователи наблюдали, что некоторые гуанозиновые аналоги оказывают влияние на иммунную систему (Патенты США №№6063772 и 4950647). Показано, что рибавирин ингибирует функциональные гуморальные иммунные реакции (Peavy et al., J. Immunol., 126:861-864 (1981); Powers et al., Antimicrob. Agents. Chemother., 22:108-114 (1982)) и опосредованную IgE модуляцию секреции тучных клеток (Marquardt et al., J. Pharmacol. Exp.Therapeutics, 240:145-149 (1987)). Некоторые исследователи докладывали, что ежедневная пероральная терапия рибавирином оказывает модулирующий эффект на людей и мышей (Hultgren et al., J. Gen. Virol., 79:2381-2391 (1998) и Cramp et al., Gastron. Enterol., 118:346-355 (2000)). Тем не менее, современное понимание воздействий рибавирина на иммунную систему находится в зародышевом состоянии.
Сущность изобретения
Обнаружено, что рибавирин может использоваться в качестве адъюванта для усиления или облегчения иммунного отклика на антиген. Варианты выполнения изобретения, описанные здесь, содержат "сильные" вакцинные препараты, содержащие антиген и рибавирин. В общем случае эти препараты содержат количество рибавирина, достаточное для усиления или облегчения иммунной реакции на антиген. Прочие аспекты изобретения содержат способы усиления или облегчения иммунной реакции животного, в том числе человека, на антиген. В соответствии с одним из аспектов, к примеру, животное, нуждающееся в мощной иммунной реакции на антиген, идентифицируется, а затем обеспечивается некоторым количеством рибавирина вместе с антигеном. В некоторых способах рибавирин и антиген вводятся совместно (то есть в виде одного состава), а в других рибавирин и антиген вводятся по отдельности. Несколько вариантов выполнения также касаются производства и использования составов, содержащих рибавирин и антиген.
Хотя реализованные составы содержат рибавирин и практически любой антиген или эпитоп, предпочтительные варианты выполнения содержат рибавирин и вирусный антиген или антигенную детерминанту (эпитоп) гепатита. Антиген или эпитоп могут быть основаны на пептиде или нуклеиновой кислоте (например, RNA, кодирующей пептидный антиген или конструкт, который экспрессирует пептидный антиген при введении в субъекта). Вариантами выполнения являются составы, содержащие рибавирин и пептид, содержащий антиген или эпитоп из вируса гепатита A(HAV), или нуклеиновую кислоту, кодирующую упомянутый пептид. Вариантами выполнения являются составы, содержащие рибавирин и пептид, содержащий антиген или эпитоп из вируса гепатита B(HBV), или нуклеиновую кислоту, кодирующую упомянутый пептид. К пригодным антигенам HBV относятся, например, поверхностный антиген гепатита B(HBsAg), ядерный антиген гепатита (HBcAg), е-антиген гепатита (HBeAg) и нуклеиновые кислоты, кодирующие эти молекулы. Далее, вариантами выполнения являются составы, содержащие рибавирин и пептид, содержащий антиген или эпитоп из вируса гепатита C(HCV), или нуклеиновую кислоту, кодирующую упомянутый пептид. К подходящим антигенам HCV относятся, не в порядке исключения, один или несколько доменов последовательности HCV (например, NS3 и/или NS4/A) и нуклеиновые кислоты, кодирующие эти молекулы.
Была также обнаружена новая последовательность HCV. Новый фрагмент NS3/4A генома HCV был клонирован, и его последовательность была определена у пациента, инфицированного HCV (SEQ.ID.NO.:16). Было обнаружено, что эта последовательность только на 93% гомологична наиболее близкородственной последовательности HCV. Этот новый пептид (SEQ.ID.NO.:17) и ее фрагменты длиной по меньшей мере 3, 4, 6, 8, 10, 12, 15 или 20 аминокислот, нуклеиновые кислоты, кодирующие молекулы, векторы, содержащие упомянутые нуклеиновые кислоты, и клетки, содержащие упомянутые векторы, нуклеиновые кислоты или пептиды, также являются вариантами выполнения настоящего изобретения. Частное предпочтительное выполнение является вакцинным составом, содержащим рибавирин и пептид HCV из SEQ.ID.NO.:17 или его фрагмент длиной по меньшей мере 3, 4, 6, 8, 10, 12, 15 или 20 аминокислот (например, SEQ.ID.NO.:25) или нуклеиновую кислоту, кодирующую упомянутые пептид или фрагменты.
В дополнение к этому было обнаружено, что усеченные мутанты или мутанты пептида NS3/4A, у которых отсутствует сайт протеолитического расщепления, являются сильно иммуногенными. Эти новые пептиды (SEQ.ID.NO.:29-32 и 43-49) и их фрагменты длиной по меньшей мере 3, 4, 6, 8, 10, 12, 15 или 20 аминокислот (например, SEQ.ID.NO.:26, 27 и 33-42), нуклеиновые кислоты, кодирующие эти молекулы, векторы, содержащие эти нуклеиновые кислоты, и клетки, содержащие упомянутые векторы, нуклеиновые кислоты или пептиды, также является вариантами выполнения изобретения. Частное предпочтительное выполнение является вакцинным составом, содержащим рибавирин и пептид HCV из SEQ.ID.NO.:29-32 и 43-49 или его фрагмент длиной по меньшей мере 3, 4, 6, 8, 10, 12, 15 или 20 аминокислот (например, SEQ.ID.NO.:26, 27 и 33-42) или нуклеиновую кислоту, кодирующую упомянутые пептиды или фрагменты.
Более того, составы, содержащие смесь вышеупомянутых антигенов, являются вариантами выполнения изобретения. Например, некоторые составы содержат антиген HBV, антиген HAV и рибавирин, или антиген HBV, антиген HCV и рибавирин, или антиген HAV, антиген HCV и рибавирин, или антиген HBV, антиген HAV, антиген HCV и рибавирин. Прочие варианты выполнения содержат рибавирин и нуклеиновую кислоту, кодирующую смесь описанных выше антигенов. Некоторые варианты выполнения также содержат прочие адъюванты, связыватели, эмульгаторы, носители и наполнители, известные из уровня техники, в том числе, не в порядке ограничения, квасцы, масло и прочие соединения, усиливающие иммунную реакцию.
Также аспектами изобретения являются способы изготовления и использования описанных здесь составов. Некоторые способы осуществляются путем смешивания рибавирина с пептидным или нуклеиново-кислотным антигеном (например, антигеном HAV, HBV, HCV) для получения единого состава (например, вакцинного состава). Предпочтительные способы содержат смешивание рибавирина с антигеном HCV, который содержит эпитоп, присутствующий на одном или нескольких доменах HCV (например, NS3 и/или NS4A).
Предпочтительные способы использования описанных здесь составов содержат введение нуждающемуся животному достаточного количества рибавирина и гепатитного вирусного антигена (например, антигена HBV, антигена HAV, антигена HCV, нуклеиновой кислоты, кодирующей один из этих антигенов, или любой их комбинации). В соответствии с одним из подходов, например, идентифицируется животное, нуждающееся в мощной иммунной реакции на гепатитный вирусный антиген (например, животное с риском заразиться или уже заразившееся гепатитной инфекцией), и этому животному вводится количество рибавирина и гепатитного вирусного антигена (либо в виде единого состава, либо по отдельности), эффективное для усиления или облегчения иммунной реакции на гепатитный вирусный антиген. Предпочтительно, идентифицируется животное, нуждающееся в мощной иммунной реакции на HCV, и этому животному вводится состав, содержащий рибавирин и пептид, содержащий антиген или эпитоп, присутствующий в SEQ.ID.NO.:1, 6, 7 или 17, или нуклеиновая кислота, кодирующая упомянутый пептид. Частные предпочтительные варианты выполнения содержат идентификацию животного, нуждающегося в мощной иммунной реакции на HCV и введение упомянутому животному состава, содержащего рибавирин и антиген HCV (например, NS3/4A (SEQ.ID.NO.:17), мутант NS3/4A SEQ.ID.NO.:29-32 и 43-49 или его фрагмент длиной по меньшей мере 3,4-10, 10-20, 20-30 или 30-50 аминокислот (например, SEQ.ID.NO.:25-27 и 33-42) или нуклеиновую кислоту, кодирующую одну или несколько из этих молекул), которых достаточно, чтобы усилить или упростить иммунную реакцию на упомянутый антиген.
Краткое описание чертежей
Фиг.1 является диаграммой, показывающей гуморальную реакцию на 10 и 100 мкг неструктурного 3 белка (NS3) рекомбинантного вируса гепатита C(HCV), определенную по средним конечным титрам, при совместном введении одной дозы 1 мг рибавирина.
Фиг.2 является диаграммой, показывающей гуморальную реакцию на 20 мкг неструктурного 3 белка (NS3) рекомбинантного вируса гепатита C(HCV), определенную по средним конечным титрам, при совместном введении одной дозы 0,1, 1,0 или 10 мг рибавирина.
Фиг.3 является диаграммой, показывающей воздействия единственной дозы 1 мг рибавирина на NS3-специфические пролиферативные реакции лимфатического узла, как определено по анамнестическим реакциям in vitro.
Фиг.4 является диаграммой, показывающей антительный титр против NS3 у мышей Н-2d в виде функции времени после первой иммунизации. Ромбами отмечен антительный титр мышей, иммунизированных с помощью NS3/4A-pVAX, а квадратами отмечен антительный титр мышей, иммунизированных NS3-pVAX.
Фиг.5А является диаграммой, показывающей процент специфического CTL-опосредованного лизиса клеток-мишеней SP2/0 в виде функции отношения эффектора к мишени. Фосфатный буферный солевой раствор (PBS) использовался в качестве контрольного иммуногена.
Фиг.5Б является диаграммой, показывающей процент специфического CTL-опосредованного лизиса клеток-мишеней SP2/0 в виде функции отношения эффектора к мишени. Плазмид NS3/4A-pVAX использовался в качестве иммуногена.
Подробное описание изобретения
Обнаружено, что составы, содержащие рибавирин и антиген (например, молекулу, содержащую эпитоп такого патогена как вирус, бактерия, плесень, дрожжи или паразит), усиливают и/или облегчают иммунную реакцию животного на антиген. То есть было обнаружено, что рибавирин является эффективным "адъювантом", что, в целях настоящего раскрытия, означает вещество, имеющее способность усиливать или облегчать иммунную реакцию на отдельный антиген. Адъювантная активность рибавирина проявлялась в значительном увеличении иммунно-опосредованной защиты от антигена, увеличении титра антитела к антигену и увеличении пролиферативных реакций Т-клеток.
Здесь описаны некоторые составы (например, вакцины), содержащие рибавирин и антиген или эпитоп. Вакцинные формулы, содержащие рибавирин, например, могут варьироваться в соответствии с количеством рибавирина, формой рибавирина и типом антигена. Антиген может являться пептидом или нуклеиновой кислотой (например, RNA, кодирующей пептидный антиген, или конструктом, экспрессирующим пептидный антиген при вводе субъекту). Предпочтительные составы содержат рибавирин и гепатитный вирусный антиген (например, антиген HAV, антиген HBV, антиген HCV, нуклеиновую кислоту, кодирующую эти молекулы, или любые их комбинации). В частности, по меньшей мере один антиген HCV или эпитоп, присутствующий в SEQ.ID.NO.:1, или нуклеиновая кислота, кодирующая такой антиген HCV, желательны для смешивания с рибавирином для приготовления упомянутых составов. Таким образом, некоторые варианты выполнения содержат, не в порядке ограничения, составы, содержащие рибавирин и пептид, составляющий SEQ.ID.NO.:1 или ее фрагмент, содержащий по меньшей мере 2500, 2000, 1600, 1200, 800, 400, 200, 100, 50, 10 или 3 последовательные аминокислоты SEQ.ID.NO.:1. Дополнительные варианты выполнения относятся к составам, содержащим рибавирин и нуклеиновую кислоту, кодирующую SEQ.ID.NO.:13 или ее фрагмент, содержащий по меньшей мере 9, 12, 15, 20, 30, 50, 75, 100, 200, 500 последовательных нуклеотидов SEQ.ID.NO.:13.
Остальные варианты выполнения содержат состав (например, вакцину), которая содержит рибавирин и специфический фрагмент SEQ.ID.NO.:1, причем упомянутый фрагмент соответствует отдельному домену HCV. Некоторые выполнения, например, содержат фрагмент HCV, соответствующий аминокислотам 1-182, 183-379, 380-729, 730-1044, 1045-1657, 1658-1711, 1712-1971 или 1972-3011 SEQ.ID.NO.:1. Также вариантами выполнения изобретения являются составы, содержащие рибавирин и нуклеиновую кислоту, кодирующую один или несколько из этих фрагментов.
Дополнительно, была обнаружена новая последовательность HCV. Новые нуклеиновая кислота и белок, соответствующие домену NS3/4A HCV, были клонированы из материала пациента, инфицированного HCV (SEQ.ID.NO.:16). Поиск по базе Genebank показал, что клонированная последовательность имеет наибольшую гомологию с последовательностями HCV, но только на 93% гомологична ближайшему HCV-родственнику (каталожный номер AJ278830). Этот новый пептид (SEQ.ID.NO.:17) и его фрагменты длиной по меньшей мере 3, 4, 6, 8, 10, 12, 15 или 20 аминокислот, нуклеиновые кислоты, кодирующие эти молекулы, векторы, содержащие эти нуклеиновые кислоты, и клетки, содержащие упомянутые векторы, нуклеиновые кислоты или пептиды, также являются вариантами выполнения изобретения. Дополнительно некоторые из описанных здесь вакцинных вариантов выполнения содержат рибавирин и этот новый пептид NS3/4A или его фрагмент длиной по меньшей мере 3, 4, 6, 8, 10, 12, 15 или 20 аминокислот (например, SEQ.ID.NO.:25), или нуклеиновую кислоту, кодирующую одну или несколько этих молекул.
Были также созданы мутанты нового пептида NS3/4A. Было обнаружено, что усеченные мутанты (например, SEQ.ID.NO.:29) и мутанты, у которых отсутствует сайт протеолитического расщепления, являются сильно иммуногенными. Эти новые пептиды SEQ.ID.NO.:29-32 и 43-49 и их фрагменты длиной по меньшей мере 3, 4, 6, 8, 10, 12, 15 или 20 аминокислот (например, SEQ.ID.NO.:26, 27 и 33-42), нуклеиновые кислоты, кодирующие эти молекулы, векторы, содержащие упомянутые нуклеиновые кислоты, и клетки, содержащие упомянутые векторы, нуклеиновые кислоты или пептиды, также являются вариантами выполнения. Более того, некоторые из описанных здесь составов содержат рибавирин и по меньшей мере один из мутантных пептидов HCV, описанных выше, или его фрагмент длиной по меньшей мере 3, 4, 6, 8, 10, 12, 15 или 20 аминокислот. Прочие вакцинные варианты выполнения содержат рибавирин и нуклеиновую кислоту (например, DNA), кодирующую один или несколько пептидов, описанных выше.
Способы изготовления и использования составов также являются вариантами выполнения. Например, описанные выше составы могут приготавливаться путем подачи рибавирина, подачи антигена (например, пептида, содержащего антиген HCV или нуклеиновую кислоту, кодирующую упомянутый пептид) и смешивания упомянутого рибавирина и упомянутого антигена так, чтобы получить состав, который может использоваться для усиления или облегчения иммунной реакции субъекта на упомянутый антиген. Предпочтительные способы включают в себя смешивание предпочтительного антигена или эпитопа (например, пептида, содержащего SEQ.ID.NO.:1, 6, 7 или 17, или его специфических фрагментов, таких как аминокислоты 1-182, 183-379, 380-729, 730-1044, 1045-1657, 1658-1711, 1712-1971, 1972-3011 в SEQ.ID. NO.:1, и нуклеиновых кислот, кодирующих эти молекулы) с рибавирном.
Прочие антигены или эпитопы также могут смешиваться с рибавирином, в том числе, не в порядке ограничения, фрагменты SEQ.ID.NO.:1, содержащие по меньшей мере 2500, 2000, 1600, 1200, 800, 400, 200, 100, 50, 10 или 3 последовательные аминокислоты, и нуклеиновые кислоты, кодирующие эти фрагменты. В частности, к предпочтительным способам относятся изготовление вакцинных составов, содержащих новообнаруженный NS3/4A-фрагмент или NS3/4А-мутант (например, усеченный мутант или мутант с отсутствующим сайтом протеолитического расщепления) или его фрагмент длиной по меньшей мере четыре аминокислоты или нуклеиновую кислоту, кодирующую одну или несколько из этих молекул.
Способы усиления или облегчения иммунной реакции животных, в том числе и человека, на антиген являются вариантами выполнения изобретения. Такие способы могут быть реализованы, например, посредством идентификации животного, нуждающегося в мощной иммунной реакции на антиген/эпитоп, и введении упомянутому животному состава, содержащего антиген/эпитоп и количество рибавирина, эффективное для усиления или облегчения иммунной реакции на антиген/эпитоп. В некоторых вариантах выполнения рибавирин и антиген вводятся по отдельности, а не в составе единой смеси. В этом случае рибавирин предпочтительно вводится спустя короткое время после введении антигена. Предпочтительные способы содержат введение нуждающемуся животному рибавирина и антигена гепатита (например, антигена HAV, антигена HBV, антигена HCV, нуклеиновой кислоты, кодирующей эти молекулы, или любых их комбинаций). Некоторые из этих способов содержат антигены HCV, такие как пептид, содержащий SEQ. ID.NO.:1, или его фрагмент, содержащий по меньшей мере 2500, 2000, 1600, 1200, 800, 400, 200, 100, 50, 10 или 3 последовательные аминокислоты SEQ.ID.NO.:1.
Дополнительные способы содержат составы, содержащие рибавирин и нуклеиновую кислоту, кодирующую SEQ.ID.NO.:13, или нуклеиновую кислоту, кодирующую один или несколько из обсуждавшихся выше фрагментов.
Некоторые предпочтительные способы, например, относятся к использованию состава (например, вакцины), который содержит рибавирин и пептид, содержащий SEQ.ID.NO.:1, или его специфический фрагмент, соответствующий домену HCV, в том числе, не в порядке ограничения, пептид, содержащий аминокислоты 1-182, 183-379, 380-729, 730-1044, 1045-1657, 1658-1711, 1712-1971, 1972-3011 SEQ.ID.NO.:1. В частности, предпочтительные варианты выполнения относятся к использованию вакцинного состава, содержащего NS3/4А-фрагмент SEQ.ID.NO.:17 или мутант NS3/4A (например, SEQ.ID.NO.:29-32 и 43-49), у которого отсутствует сайт протеолитического расщепления, или его фрагмент длиной по меньшей мере 3, 4, 6, 8, 10, 12, 15 или 20 аминокислот (например, SEQ.ID.NO.:26, 27 и 33-42). Составы, содержащие рибавирин и нуклеиновую кислоту, кодирующую эти фрагменты, также могут использоваться в описанных здесь способах.
Остальные варианты выполнения относятся к способам лечения и предотвращения инфекции HCV. В соответствии с одним из подходов рибавирин и антиген или эпитоп HCV используются для приготовления медикамента для лечения и/или предотвращения инфекции HCV. В соответствии с другим подходом идентифицируется индивид, нуждающийся в медикаменте, предотвращающем и/или лечащем инфекцию HCV, и упомянутому индивиду вводится медикамент, содержащий рибавирин и антиген или эпитоп HCV, предпочтительно эпитоп, присутствующий в SEQ.ID.NO.:1, более предпочтительно - фрагмент SEQ.ID.NO.:1, содержащий по меньшей мере 2500, 2000, 1600, 1200, 800, 400, 200, 100, 50, 10 или 3 последовательные аминокислоты или, наиболее предпочтительно - такой фрагмент SEQ.ID.NO.:1, как аминокислоты 1-182, 183-379, 380-729, 730-1044, 1045-1657, 1658-1711, 1712-1971 или 1972-3011, или нуклеиновая кислота, кодирующая SEQ.ID.NO.:1, или ее вышеупомянутые фрагменты. В частности, предпочтительные способы относятся к использованию вакцинного состава, содержащего рибавирин и NS3/4A-фрагмент SEQ.ID.NO.:17 или мутантный NS3/4A, у которого отсутствует сайт протеолитического расщепления (например, SEQ.ID.NO.:29-32 и 43-49), или его фрагмент длиной по меньшей мере 3, 4, 6, 8, 10, 12, 15 или 20 аминокислот (например, SEQ.ID.NO.:26, 27 и 33-42), или нуклеиновую кислоту, кодирующую одну или несколько из этих молекул. В нижеследующем разделе более подробно обсуждается использование рибавирина в качестве адъюванта.
Рибавирин
Состав, описанный здесь, может быть произведен с помощью общепринятых способов галеновой фармакологии для получения медицинских агентов для введения животным, например млекопитающим, в том числе и человеку. Рибавирин может быть получен у коммерческих поставщиков (например, Sigma и ICN). Рибавирин и/или антиген может быть представлен вакциной с модифицированием и без него. Например, рибавирин и/или антиген может быть модифицирован, или от него могут быть взяты производные, для получения более стабильной молекулы и/или более мощного адъюванта. В соответствии с одним из подходов стабильность рибавирина и/или антигена может быть увеличена путем связывания молекул с такой поддерживающей структурой, как гидрофильный полимер (например, полиэтиленгликоль).
Множество производных рибавирина могут быть получены с помощью методов, обычных при нормальном создании лекарств и в комбинаторной химии. Например, компания Molecular Simulations Inc. (MSI), как и многие другие поставщики, поставляют программное обеспечение, которое позволяет специалисту построить комбинаторную библиотеку органических молекул. Например, программа С2.Analog Builder может быть интегрирована с набором программного обеспечения Cerius2 molecular diversity компании MSI для разработки библиотеки рибавириновых производных, которые могут использоваться в описанных здесь вариантах выполнения (См., например, http://msi.com/life/products/cerius2/index.html).
В соответствии с одним из подходов химическая структура рибавирина записывается на машиночитаемый носитель, и одна или несколько моделирующих прикладных программ осуществляют к ней доступ. Программа C2.Analog Builder совместно с программой C2Diversity позволяют пользователю вырабатывать очень большую виртуальную библиотеку на основании, например, разнообразия R-групп для каждой позиции заместителя. Соединения, имеющие такую же структуру, что и смоделированные производные рибавирина, созданные в виртуальной библиотеке, затем получаются с помощью общепринятой химии, либо могут быть получены из коммерческого источника.
Вновь произведенные производные рибавирина затем исследуются в тестах, которые определяют степень адъювантной активности молекулы и/или степень ее способности модулировать иммунную реакцию. Некоторые тесты могут использовать такое программное обеспечение виртуального исследования медикаментов, как C2.Ludi. C2.Ludi является программой, позволяющей пользователю исследовать базы данных по молекулам (например, производным рибавирина) на предмет их способности взаимодействовать с активным сайтом интересующего белка (например, RAC2 или другого связывающего GTP белка). На основании предсказанных взаимодействий, обнаруженных с помощью программного обеспечения виртуального исследования медикаментов, производные рибавирина могут быть распределены в приоритетном порядке для дальнейшего исследования в общепринятых тестах, определяющих адъювантную активность и/или степень модулирования молекулой иммунной реакции. Пример 1 описывает некоторые тесты, которые использовались для оценки адъювантной активности рибавирина.
ПРИМЕР 1
Нижеследующие тесты могут использоваться с любым производным рибавирина или комбинациями производных рибавирина для определения степени адъювантной активности конкретного состава. В первом множестве экспериментов группы из трех-пяти мышей Balb/c (BK Universal, Uppsala, Sweden) иммунизировались внутрибрюшинно или подкожно (например, у основания хвоста) с помощью 10 мкг или 100 мкг рекомбинантного неструктурного-3 белка (rNS3) вируса гепатита С в недели 0 и 4. rNS3 был растворен в фосфатном буферном солевом растворе (PBS) или в PBS, содержащем 1 мг рибавирина (полученного у ICN, Costa Mesa, CA). Мышам вводили суммарный объем 100 мкл за одну инъекцию.
Через две, четыре и шесть недель после первой внутрибрюшинной иммунизации у всех мышей брали кровь из заднеглазничной области. Образцы сыворотки собирались и анализировались на наличие антител к rNS3. Для определения антительного титра производился ферментный иммунотест (EIA). (См., например, Hultgren et al., J Gen Virol. 79:2381-91 (1998) и Hultgren et al., din. Diagn. Lab. Immunol. 4:630-632 (1997)). Уровни антител записывались в виде наивысшего разбавления сыворотки, дающего при 405 нм оптическую плотность, более чем в два раза превышающую тот же показатель у неиммунизированной мыши.
Мыши, получившие 10 мкг или 100 мкг rNS3, смешанного с 1 мг рибавирина в PBS, показали значительно более высокие уровни антител к NS3. Антительный титр, который был обнаружен путем EIA через две недели после иммунизации, показан на фиг.1. Вакцинные формулы, содержащие 1 мг рибавирина и либо 10 мкг, либо 100 мкг rNS3, вызывали значительно более высокий антительный титр, чем вакцинные формулы, составленные только из rNS3.
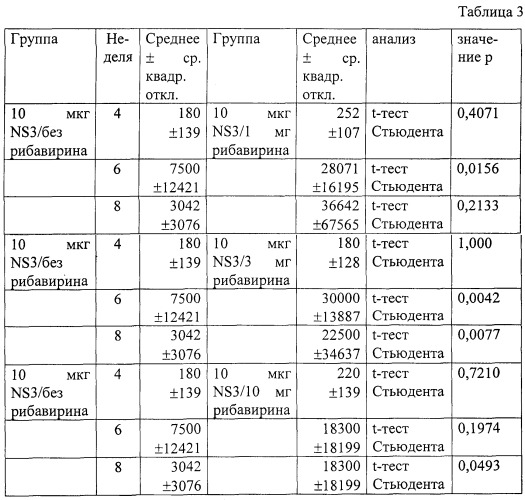
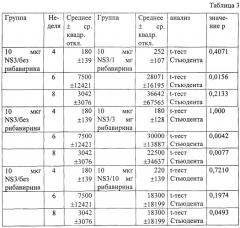
Во втором множестве экспериментов группы из восьми мышей Balb/c в недели 0 и 4 иммунизировались внутрибрюшинно 10 или 50 мкг rNS3 в 100 мкл фосфатного буферного солевого раствора, содержащего 0 мг, 1 мг, 3 мг или 10 мг рибавирина (Sigma). На четвертой, шестой и восьмой неделях у мышей бралась кровь, а сыворотка отделялась и замораживалась. После завершения исследования сыворотки исследовались на предмет уровней антител к рекомбинантному NS3, как описано выше. Средние уровни антител к rNS3 сравнивались для разных групп с помощью t-теста Стьюдента (параметрический анализ) или теста Манна-Уитни (непараметрический анализ) и программного пакета StatView 4.5 (Abacus Concepts, Berkley, CA). Адъювантные эффекты рибавирина при добавлении трех дозировок к 10 мкг rNS3 показаны в Таблице 1. Адъювантные эффекты рибавирина при добавлении трех дозировок к 50 мкг rNS3 показаны в Таблице 2. Параметрическое сравнение средних антительных титров rNS3 у мышей, получавших 10 мкг или 50 мкг rNS3 и различные дозы рибавирина, показаны в Таблицах 3 и 4 соответственно. Непараметрическое сравнение средних антительных титров rNS3 у мышей, получавших 10 мкг или 50 мкг rNS3 и различные дозы рибавирина, показаны в Таблицах 3 и 4 соответственно. Приведенные значения представляют конечные титры для рекомбинантного rNS3.
| Таблица 1 | |||||
| Количество рибавирина (мг/доза) | Количество иммуногена (мкг/доза) | Идентификатор мыши | Антительный титр к rNS3 в указанную неделю | ||
| Неделя 4 | Неделя 6 | Неделя 8 | |||
| Нет | 10 | 5:1 | 300 | 1500 | 1500 |
| Нет | 10 | 5:2 | <60 | 7500 | 1500 |
| Нет | 10 | 5:3 | <60 | 1500 | 300 |
| Нет | 10 | 5:4 | 60 | 1500 | 1500 |
| Нет | 10 | 5:5 | <60 | 1500 | НТ |
| Нет | 10 | 5:6 | 60 | 1500 | 1500 |
| Нет | 10 | 5:7 | <60 | 7500 | 7500 |
| Нет | 10 | 5:8 | 300 | 37500 | 7500 |
| Средний титр для группы (среднее ± ср. квадр. откл.) | 180±139 | 7500±12421 | 3042±3076 | ||
| 1 | 10 | 6:1 | 300 | 37500 | 37500 |
| 1 | 10 | 6:2 | <60 | 1500 | 1500 |
| 1 | 10 | 6:3 | 300 | 37500 | 187500 |
| 1 | 10 | 6:4 | 300 | 37500 | 7500 |
| 1 | 10 | 6:5 | 60 | НТ | НТ |
| 1 | 10 | 6:6 | <60 | 37500 | 7500 |
| 1 | 10 | 6:7 | <60 | 37500 | 7500 |
| 1 | 10 | 6:8 | 300 | 7500 | 7500 |
| Средний титр для группы (среднее ± ср. квадр. откл) | 252±107 | 28071±16195 | 36642±67565 | ||
| 3 | 10 | 7:1 | 60 | 37500 | 7500 |
| 3 | 10 | 7:2 | 60 | 37500 | 37500 |
| 3 | 10 | 7:3 | 300 | 7500 | 7500 |
| 3 | 10 | 7:4 | 300 | 37500 | 7500 |
| 3 | 10 | 7:5 | 300 | 37500 | 37500 |
| 3 | 10 | 7:6 | 300 | 37500 | 37500 |
| 3 | 10 | 7:7 | 60 | 7500 | 7500 |
| 3 | 10 | 7:8 | 60 | 37500 | 37500 |
| Средний титр для группы (среднее ± ср. квадр. откл) | 180±128 | 30000±13887 | 22500±34637 | ||
| 10 | 10 | 8:1 | 300 | 37500 | 37500 |
| 10 | 10 | 8:2 | 300 | 37500 | 37500 |
| 10 | 10 | 8:3 | <60 | 300 | 300 |
| 10 | 10 | 8:4 | 60 | 7500 | 7500 |
| 10 | 10 | 8:5 | <60 | 300 | 300 |
| 10 | 10 | 8:6 | <60 | 37500 | 37500 |
| 10 | 10 | 8:7 | <60 | 7500 | 7500 |
| 10 | 10 | 8:8 | <60 | НТ | НТ |
| Средний титр для группы (среднее ± ср. квадр. откл) | 220±139 | 18300±18199 | 18300±18199 |
Таблица 2
| Количество рибавирина (мг/доза) | Количество иммуногена (мкг/доза) | Идентификатор мыши | Антительный титр к rNS3 в указанную неделю | ||
| Неделя 4 | Неделя 6 | Неделя 8 | |||
| Нет | 50 | 1:1 | 60 | 7500 | 7500 |
| Нет | 50 | 1:2 | 60 | 7500 | 7500 |
| Нет | 50 | 1:3 | 60 | 7500 | 7500 |
| Нет | 50 | 1:4 | <60 | 1500 | 300 |
| Нет | 50 | 1:5 | 300 | 37500 | 387500 |
| Нет | 50 | 1:6 | 60 | 7500 | 7500 |
| Нет | 50 | 1:7 | 60 | 37500 | 7500 |
| Нет | 50 | 1:8 | |||
| Средний титр для группы (среднее ± ср. квадр. откл) | 100±98 | 15214±15380 | 10757±12094 | ||
| 1 | 50 | 2:1 | 60 | 7500 | 7500 |
| 1 | 50 | 2:2 | 300 | 37500 | 7500 |
| 1 | 50 | 2:3 | 60 | 187500 | 7500 |
| 1 | 50 | 2:4 | 60 | 37500 | 187500 |
| 1 | 50 | 2:5 | 60 | 37500 | 7500 |
| 1 | 50 | 2:6 | 60 | 37500 | 37500 |
| 1 | 50 | 2:7 | 300 | 37500 | 7500 |
| 1 | 50 | 2:8 | 300 | 37500 | 37500 |
| Средний титр для группы (среднее ± ср. квадр. откл) | 150±124 | 52500±55549 | 37500±62105 | ||
| 3 | 50 | 3:1 | 60 | 37500 | 7500 |
| 3 | 50 | 3:2 | 300 | 37500 | 37500 |
| 3 | 50 | 3:3 | 300 | 37500 | 7500 |
| 3 | 50 | 3:4 | 60 | 37500 | 7500 |
| 3 | 50 | 3:5 | 300 | 37500 | 7500 |
| 3 | 50 | 3:6 | 60 | 37500 | 7500 |
| 3 | 50 | 3:7 | - | 7500 | 37500 |
| 3 | 50 | 3:8 | 1500 | 7500 | 37500 |
| Средний титр для группы (среднее ± ср. квадр. откл) | 387±513 | 30000±13887 | 187500±15526 | ||
| 10 | 50 | 4:1 | 300 | 7500 | 7500 |
| 10 | 50 | 4:2 | 300 | 37500 | 37500 |
| 10 | 50 | 4:3 | 60 | 7500 | 7500 |
| 10 | 50 | 4:4 | 60 | 7500 | 7500 |
| 10 | 50 | 4:5 | 60 | 1500 | 1500 |
| 10 | 50 | 4:6 | 60 | 7500 | 37500 |
| 10 | 50 | 4:7 | - | 7500 | 7500 |
| 10 | 50 | 4:8 | 60 | 37500 | 7500 |
| Средний титр для группы (среднее ± ср. квадр. откл) | 140±124 | 10929±11928 | 15214±15380 |
| Таблица 6 | ||||||
| Группа | Неделя | Среднее ± ср. квадр. откл | Группа | Среднее ± ср. квадр. откл | анализ | Значение р |
| 50 мкг NS3/без рибавирина | 4 | 100±98 | 50 мкг NS3/1 мг рибавирина | 150±124 | тест Манна-Уитни | 0,1128 |
| 6 | 15214±15380 | 52500±55549 | тест Манна-Уитни | 0,0210 | ||
| 8 | 10757±12094 | 37500±62105 | тест Манна-Уитни | 0,1883 | ||
| 50 мкг NS3/без рибавирина | 4 | 100±98 | 50 мкг NS3/3 мг рибавирина | 387±513 | тест Манна-Уитни | 0,1400 |
| 6 | 15214±15380 | 30000±13887 | тест Манна-Уитни | 0,0679 | ||
| 8 | 10757±12094 | 18750±15526 | тест Манна-Уитни | 0,2091 | ||
| 50 мкг NS3/без рибавирина | 4 | 100±98 | 50 мкг NS3/10 мг рибавирина | 140±124 | тест Манна-Уитни | 0,4292 |
| 6 | 15214±15380 | 10929±11928 | тест Манна-Уитни | 0,9473 | ||
| 8 | 10757±12094 | 15214±15380 | тест Манна-Уитни | 0,6279 | ||
| Уровни значимости: NS = не значимо; *=р0,05; **=р<0,01; ***=р<0,001 |
Вышеприведенные данные демонстрируют, что рибавирин облегчает или усиливает иммунную реакцию на антиген HCV или эпитопы HCV. Мощная иммунная реакция на rNS3 проявлялась после иммунизации с помощью вакцинного состава, содержащего всего 1 мг рибавирина и 10 мкг антигена к rNS3. Вышеприведенные данные также доказывают, что количество рибавирина, достаточное для облегчения иммунной реакции на антиген, составляет от 1 до 3 мг на инъекцию для мыши Balb/c весом 25-30 г.Следует, однако, учитывать, что такие количества являются только ориентирами, и их не следует интерпретировать в качестве какого-либо ограничения объема изобретения. Тем не менее, эти данные показывают, что вакцинные составы, содержащие дозы приблизительно от 1 до 3 мг рибавирина, вызывают иммунную реакцию, которая более чем в 12 раз сильнее, чем иммунная реакция, вызываемая в отсутствии рибавирина (Таблицы 3 и 4). Таким образом, рибавирин оказывает значительный адъювантный эффект на гуморальную иммунную реакцию животного и благодаря этому усиливает или облегчает иммунную реакцию на антиген. Нижеприводимый пример описывает эксперименты, которые выполнялись для того, чтобы лучше понять, какое количество рибавирина требуется для усиления или облегчения иммунной реакции на антиген.
ПРИМЕР 2
Для определения дозы рибавирина, которая достаточна для обеспечения адъювантного эффекта, выполнялись следующие эксперименты. В первом множестве экспериментов группы мышей (по три в группе) иммунизировались с помощью только 20 мкг rNS3 или смеси 20 мкг rNS3 и 0,1 мг, 1 мг или 10 мг рибавирина. Уровни антител к антигену определялись посредством EIA. Отмечались средние конечные титры в недели 1 и 3, они показаны на фиг.2. Было обнаружено, что адъювантный эффект рибавирина имел различную кинетику в зависимости от вводимой дозы рибавирина. Например, было обнаружено, что даже низкие дозы (<1 мг) рибавирина увеличивают уровни антител на первой неделе, но не на третьей неделе, в то время как более высокие дозы (1-10 мг) увеличивают уровни антител на третьей неделе. Так же выполнялось второе множество экспериментов. В этих экспериментах группы мышей инъецировались с помощью вакцинных составов, содержащих различные количества рибавирина и rNS3, и отслеживалась реакция IgG у этих животных. Вакцинные составы содержали приблизительно 100 мкл фосфатного буферного солевого раствора и 20 мкг rNS3 с или без 0,1 мг, 1,0 мг или 10 мг рибавирина (Sigma). Кровь у мышей бралась на шестой неделе, а уровни rNS3-специфического IgG определялись посредством EIA, как описано ранее. Как показано в Таблице 7, адъювантные эффекты, оказываемые на поддерживаемые уровни антител, были наиболее очевидны при дозе в диапазоне от 1 до 10 мг на инъекцию для мыши весом 25-30 г.
| Таблица 7 | |||||
| Иммуноген | Количество (мг) рибавирина, смешанного с иммуногеном | Идентификатор мыши | Конечный титр IgG rNS3 в указанную неделю | ||
| Неделя 1 | Неделя 2 | Неделя З | |||
| 20 мкг rNS3 | Нет | 1 | 60 | 360 | 360 |
| 20 мкг rNS3 | Нет |