Способ комбинированного органосохраняющего лечения злокачественных опухолей орбиты
Иллюстрации
Показать всеИзобретение относится к офтальмологии, а именно к офтальмоонкологии и предназначено для комбинированного органосохраняющего лечения больных со злокачественными опухолями орбиты. Проводят орбитотомию с иссечением опухоли ad maximum, интраоперационную фотодинамическую терапию и химиотерапию. За 3 суток до операции вводят фотосенсибилизатор Фотосенс в дозе от 0,1 до 1,0 мг/кг веса. Непосредственно после иссечения опухоли и отмывания операционной раны от крови заполняют образовавшуюся полость физиологическим раствором, вводят в нее цилиндрический диффузорный световод и проводят облучение лазерным воздействием с длиной волны 670 нм и плотностью мощности от 120 до 800 мВт/см2. Удаляют физиологический раствор. Извлекают световод. Ушивают рану. В постоперационном периоде проводят химиотерапию. Способ позволяет добиться полноценной деструкции опухоли, избежать лучевой резистентности и широкого ряда постлучевых осложнений. 5 ил.
Реферат
Изобретение относится к офтальмологии, а именно - к офтальмоонкологии, и предназначено для оптимизации лечения злокачественных опухолей орбиты.
Уровень техники. На сегодняшний день лечение злокачественных опухолей орбиты подразделяется на два вида: ликвидационное и органосохранное.
Ликвидационные способы лечения включают экзентерацию орбиты (удаление всего содержимого орбиты). Экзентерацию орбиты на протяжении многих десятилетий расценивали как радикальный метод лечения злокачественных опухолей орбиты [Руководство по офтальмоонкологии. - под руководством проф. А.Ф.Бровкиной. М.: Медицина, 2002, с.112]. Они проводятся в тех случаях, когда органосохранное лечение невозможно, например, в случае распространения опухоли до вершины орбиты, когда шансов на ее уничтожение с помощью лучевой и/или химиотерапии терапии не остается или они ничтожно малы, и вероятность прорастания опухоли в полость черепа настолько высока, что на передний план выступает борьба за жизнь пациента, а не спасение глаза, как органа зрения. Показанием к экзентерации орбиты могут быть рецидивные опухоли, обладающие резистентностью к химиотерапии и/или лучевой терапии. К разряду таковых относится, например, ботриоидный тип эмбриональной рабдомиосаркомы у взрослых.
В последние годы доказано, что радикальность этого метода весьма относительная. «Продолжительное наблюдение за больными после экзентерации орбиты показало, что переживают 1 год после операции только 89%, 5 лет - 63%, а 10 лет - 48%. Таким образом, продолжительность жизни пациентов после этой калечащей операции не выше, чем после комбинированного органосохранного лечения» [Руководство по офтальмоонкологии. - под руководством проф. А.Ф.Бровкиной. М.: Медицина, 2002, с.112].
Но при этом экзентерация приводит еще и к инвалидизации больного, а также к тяжелым косметическим дефектам, которые существенно ухудшают качество жизни этого тяжелого контингента больных.
Органосохраняющее лечение заключается в применении комбинации нескольких видов лечения: например, способ орбитотомии с иссечением опухоли ad maximum, лучевую терапию и химиотерапию. В международном протоколе лечения злокачественных сарком орбиты сразу после операции проводят курс химиотерапии в течение двух недель, после чего подключают наружное облучение орбиты. Облучение орбиты проводят с помощью дистанционной гамма-терапии [Руководство по офтальмоонкологии. - под руководством проф. А.Ф.Бровкиной. М.: Медицина, 2002, с.375].
Выбор схемы и комбинации полихимиотерапии определяется гистогенезом опухоли. 26% злокачественных опухолей орбиты представлено мягкотканными саркомами, при которых лучевая терапия применяется в качестве адъювантной, то есть, является дополнением к хирургическому и химиотерапевтическому видам лечения [Baker KS, Anderson JR, Link MP, et al: Benefit of intensified therapy for patients with local or regional embryonal rhabdomyosarcoma: Results from the Intergroup Rhabdomyosarcoma Study IV. J Clin Oncol - 2000 - vol.18 - pp.2427-2434].
Целью лучевой терапии является постлучевая регрессия остаточной опухоли (радикальная программа облучения) или предотвращение рецидива. При этом суммарная доза дистанционной гамма-терапии зависит от стадии неопластического процесса и колеблется от 40 до 60 Гр (1,5-1,8 Гр за фракцию) [Donaldson SS, et al: Results from the IRS-IV randomized trial ofhyperfractionated radiotherapy in children with rhabdomyosarcoma: A report from the IRSG.// Int J Radiat Oncol Biol Phys - 2001 - vol. 51 - pp.718-728 - 2001; Wolden SL, Anderson JR, et al: Indications for radiotherapy and chemotherapy after complete resection in rhabdomyosarcoma: A report from the Intergroup Rhabdomyosarcoma Studies I to III.// J Clin Oncol - 1999 - vol.17 - pp.3468-3475].
Несмотря на высокую эффективность комбинированного метода лечения злокачественных сарком орбиты (5-летняя выживаемость достигает 93%), до 10% рабдомиосарком могут оказаться рефракторными как к химио-, так и к лучевой терапии [Руководство по офтальмоонкологии. - под руководством проф. А.Ф.Бровкиной. М.: Медицина, 2002, с.112].
Этот способ комбинированного органосохраняющего лечения злокачественных опухолей орбиты с помощью орбитотомии с иссечением опухоли ad maximum, лучевой терапии и химиотерапии принят за ближайший аналог предлагаемого изобретения [там же, стр.375]. Он обладает рядом преимуществ перед ликвидационной экзентерацией. Он позволяет усилить лечебный компонент. В случае остатков опухолевых клеток в орбите лучевая терапия вызывает их гибель. Вместе с тем, у него есть некоторые недостатки.
Во-первых, дистанционная гамма-терапия влечет за собой ряд серьезных ранних и поздних осложнений. К ранним осложнениям относятся постлучевые кератиты, кератопатии, дерматиты, иридоциклиты, нейроретинопатии [Abramson DH, Notis CM: Visual acuity after radiation for orbital rhabdomyosarcoma.// Am J Ophthalmol - 1994 - vol.11 - pp.808-809].
К поздним осложнениям постлучевой терапии относят развивающиеся гипоплазию или асимметрию тканей лицевой области, порой требующую реконструктивной хирургии, деформации зубов, ухудшение зрительных функций в связи с развившимися катарактами и роговичными изменениями, атрофией зрительного нерва [Raney RB, et al: Late complications of therapy in 213 children with localized, nonorbital soft-tissue sarcoma of the head and neck: A descriptive report from the Intergroup Rhabdomyosarcoma Studies (IRS)-II and III.// Med Pediatr Oncol - 1999 - vol.33 - pp.362-371; Merriam GR Jr, Focht EF: A clinical study of radiation cataracts and the relationship to dose.// Am J Roentgenol Rad Ther Nuclear Med - 1957 - vol.77-pp.759-789].
Во-вторых, лучевая терапия в ряде случаев приводит к развитию вторых опухолей (сарком, карцином, лейкемии) [Raney RB, et al: Late complications of therapy in 213 children with localized, nonorbital soft-tissue sarcoma of the head and neck: A descriptive report from the Intergroup Rhabdomyosarcoma Studies (IRS)-II and III.// Med Pediatr Oncol - 1999 - vol.33 - pp.362-371].
В-третьих, некоторые гистогенетические типы опухолей могут проявить резистентность к лучевым механизмам деструкции [Mandell L, et al. Ra-diocurability of microscopic disease in childhood rhabdomyosarcoma with radiation doses less than 4,000 cGy// Journal of Clinical Oncology - 2001 - vol. 8 -pp. 1536-1542; Komdeur R, et al. Multidrug resistence proteins in rhabdomyosarcomas: comparison between children and adults.// Cancer - 2003 - vol.97 - №8 - pp.1999-2005].
В связи с этим поиск новых, перспективных методов органосохранного лечения при злокачественных опухолях оправдан и чрезвычайно актуален.
Фотодинамическая терапия как метод лечения злокачественных опухолей появился сравнительно недавно. Она активно развивается в передовых странах мира. Суть метода заключается во введении фотосенсибилизирующего вещества, которое избирательно накапливается в активно пролиферирующей злокачественной опухоли и последующем лучевом воздействии на патологический очаг. Сроки и режимы проведения облучения определяются в зависимости от применяемого фотосенсибилизатора и локализации опухоли. В офтальмоонкологии метод только начал применяться для лечения внутриглазных опухолей [Jurklies, G Anastassiou, S Ortmans, et al. Photodynamic therapy using verteporfin in circumscribed choroidal haemangioma.// British Journal of Ophthalmology. - 2003. - Vol.87. - P.84-89; Kim RY, Hu LK, Foster BS, et al. Photodynamic therapy of pigmented choroidal melanomas of greater than 3-mm thickness.// Ophthalmology. - 1996. - Vol.103. - P.2029-2036].
К настоящему моменту в клинической онкологии уже определен ряд областей, где ФДТ высоко эффективна. Так, Министерством здравоохранения Российской Федерации опубликован анализ результатов ФДТ злокачественных новообразований кожи, молочной железы, слизистой оболочки полости рта, языка, нижней губы, гортани, легкого, пищевода, желудка, мочевого пузыря, прямой кишки и других локализаций [Опубликовано в Интернете на сайте: http://www.magicray.ru/RU/lecture/L1/1.html].
Анализ результатов клинических испытаний ФДТ позволил определить основные направления применения ФДТ:
- При начальных стадиях рака ФДТ по радикальной программе, рассчитанной на полное излечение; при раке кожи (обширном поверхностном, множественном, при "неудобных" локализациях на лице, ушных раковинах), при раке легкого, пищевода, мочевого пузыря (поверхностно-стелющийся, множественный узловой), гениталий.
- При далеко зашедших опухолевых процессах трахеи, крупных бронхов, пищевода, кардиального отдела желудка ФДТ применяется с целью реканализации.
- В комбинированном и комплексном лечении при рецидивах рака кожи, нижней губы, языка, внутрикожных метастазах и рецидивах рака молочной железы на грудной стенке, при внутрикожных метастазах меланомы, как правило, в сочетании с полихимиотерапией.
Выявляется отчетливая тенденция к использованию ФДТ в предоперационном периоде для уменьшения объема резекции, во время некоторых нерадикальных операций, например при опухолях головного мозга, билиодигестивной зоны, для повышения радикализма операции и улучшения результатов лечения. Высказываются предположения о том, что ФДТ может оказаться полезной в качестве предоперационной подготовки при распространенных формах бронхогенного рака, эзофагите Барретта, а также при пересадке красного костного мозга.
ФДТ возможна с паллиативной целью при обширных распадающихся опухолях для гемостаза. Учитывая безвредность и хорошую переносимость метода ФДТ, его можно применять в сочетании с хирургическим вмешательством, лучевым лечением и химиотерапией. Не вызывает сомнения значительный экономический эффект данного метода за счет краткосрочности лечения преимущественно в амбулаторных условиях [http://www.magicray.ru/RU /lecture/L 1/1.html.].
Адъювантная местная терапия, проводимая после хирургического удаления опухоли, признана одной из самых перспективных сфер применения ФДТ. ФДТ показана и эффективна при локализациях, чреватых высоким риском местных рецидивов и тяжелыми осложнениями лучевой терапии. Теоретически идеально применять ФДТ в ходе хирургического вмешательства (интраоперационно), поскольку максимально открыт доступ к патологическому очагу. Это позволяет адекватно оценить дозу светового облучения и доставить свет к тканям с высоким риском. На сегодняшний день областями применения ФДТ с адъювантной целью и заболеваниями являются: брюшная полость после удаления злокачественных новообразований желудочно-кишечного тракта; саркомы, расположенные забрюшинно или поражающие кишечник и имеющие небольшие размеры; злокачественные глиомы; состояния после радикальной простатэктомии; плевральная полость.
Совместное применение химиотерапии и ФДТ может повысить результативность лечения. Это подтверждают работы отечественных и зарубежных авторов [http://www.magicray.ru/RU/lecture/L1/1.html.].
Преимущества ФДТ в лечении перечисленных опухолевых заболеваний указанных локализаций сегодня неоспоримы. Данные о возможности использования фотодинамической терапии в лечении злокачественных опухолей орбиты в доступной литературе отсутствуют. Это определяется сразу несколькими моментами.
Во-первых, трудной доступностью для проведения ФДТ как самостоятельного вида лечения без операции и разреза; во-вторых, замкнутостью и теснотой пространства, именуемого орбитой, где так тесно, что опухоль величиной с горошину вызывает смещение глазного яблока с экзофтальмом, величиной до 3 мм. Проведению ФДТ при этом препятствует ограниченность способа по глубине проникновения в биологические объекты - ткани. Излучение не проникает глубже 7 мм. Злокачественные опухоли орбиты, как правило, стелятся вдоль верхней стенки, уходя вглубь, к ее вершине. А глубина орбиты, как известно, колеблется от 3 до 4,5 см. Мы предположили, что если ФДТ непригодна в качестве самостоятельного способа лечения злокачественных опухолей орбиты, то она может быть полезной в качестве адъювантной местной терапии, проводимой интраоперационно в комбинации с орбитотомией с иссечением опухоли ad maximum и химиотерапией. Мы попытались применить этот способ в лечении безнадежных пациентов. В качестве фотосенсибилизатора мы взяли отечественный препарат Фотосенс. Указанный фотосенсибилизатор ввели в предоперационном периоде за 3-е суток до проведения операции.
Таким образом, предлагаемый нами способ органосохраняющего лечения злокачественных опухолей орбиты, также как и способ, взятый нами за ближайший аналог, состоит из комбинации, включающей орбитотомию с иссечением опухоли ad maximum, химиотерапию и лучевую терапию. Но, при этом, наш способ имеет существенные отличия от аналога, заключающиеся в том, в качестве лучевого метода мы предлагаем фотодинамическую терапию. Для проведения ФДТ за 3 суток до операции вводят фотосенсибилизатор Фотосенс. Фотодинамическая терапия теоретически вполне может заменить дистанционную гамма-терапию, при этом она должна проводиться на операционном столе сразу после иссечения опухоли ad maximum.
Преимуществами предлагаемого нами способа, на наш взгляд, является избирательность или адресная доставка лучевого воздействия в опухолевую ткань, представляющую депо фотосенсибилизатора. Это позволяет свести к минимуму постлучевые осложнения дистанционной гамма-терапии в виде кератитов, атрофии зрительного нерва, нейроретинопатии, кератопатии, катаракты и постлучевых иридоциклитов. К тому же резистентности каких-либо опухолей к ФДТ не отмечено. Наличие одновременно нескольких механизмов опухолевой деструкции (запуск реакций лучевого апоптоза, фототромбоза, посттромботического паравазального апоптоза, перекисного взрыва и т.д.) в арсенале этого метода позволяет надеяться на успех /http://www.magicray.m/RU/lecture/L1/1.html
Мы реализовали наше изобретение на практике и получили подтверждение его правомочности и простоты в техническом выполнении.
Техническим результатом изобретения является полноценная деструкция опухоли, расположенной в технически доступной зоне - орбите.
Технический результат достигается благодаря комбинации трех способов: орбитотомии с иссечением опухоли ad maximum, фотодинамической терапии с использованием определенных доз фотосенсибилизатора Фотосенса и при равномерном распределении световой энергии в полости орбиты после иссечения опухоли и при выбранном режиме лазерного воздействия, а также химиотерапии.
Цель орбитотомии с иссечением опухоли ad maximum заключается в уменьшении объема /массива злокачественной опухоли, что позволяет повысить эффективность последующей фотодинамической терапии с применением фотосенсибилизатора Фотосенс. При этом ее эффективность повышается благодаря более равномерному облучению остатков опухоли за счет использования цилиндрического диффузорного световода, погруженного в водную среду, являющуюся посредником между остатками опухоли и источником излучения. Наличие водной среды способствует более равномерному распределению световой энергии в полости орбиты. Химиотерапия применяется по одному из известных классических рекомендуемых вариантов, например, винкристин+циклофосфан+актиномицин Д или топотекан+циклофосфамид и/или топотекан+циклофосфамид+винкристин или любая другая схема, выбор которой определяется гистогенезом опухоли и ее чувствительностью к химиопрепаратам [Baker KS, Anderson JR, Link MP, et al: Benefit of intensified therapy for patients with local or regional embryonal rhabdomyosarcoma: Results from the Intergroup Rhabdomyosarcoma Study IV. J Clin Oncol - 2000 - vol.18 - pp.2427-2434; Руководство по офтальмоонкологии. - под руководством проф. А.Ф.Бровкиной. М.: Медицина, 2002, с.112].
При выборе доз Фотосенса мы ориентировались на тот факт, что массив оставшейся в орбите опухоли не может быть обширен, как при плевральных или внутрибрюшинных полостях, а следовательно, не должен выходить за пределы 1,0 мг/кг. Но вместе с тем, они не могут быть ниже 0,1 мг/кг веса больного, поскольку иначе мы не сможем достигнуть фотодеструкции опухоли из-за низкой концентрации препарата в опухолевом массиве. Депо препарата в опухоли будет недостаточным, коэффициент контрастности будет низким и в процессе облучения пострадают одинаково и здоровые окружающие ткани и ткани опухоли. Разовьется фиброз орбиты.
При выборе доз световой энергии мы базировались на тот факт, что биологические эффекты фотодеструкции, вызываемые фотодинамической терапией, развиваются при значениях световой энергии не ниже 120 мВт/см2, а при энергии выше 800 мВт/см2 развиваются побочные тепловые эффекты, инициирующие такие осложнения, как уже упомянутый фиброз орбиты.
Способ осуществляется следующим образом:
На этапе планирования операции за трое суток до ее проведения внутривенно вводят фотосенсибилизатор Фотосенс в количестве, от 0,1 до 1 мг/кг веса больного в зависимости от предполагаемого остаточного объема опухоли. Затем в указанные сроки (на третьи сутки), пациенту проводят орбитотомию с иссечением опухоли ad maximum (удаляют основной массив опухоли без разрушения жизненно важных структур орбиты, обеспечивающих жизнедеятельность глаза: мышцы, зрительный нерв).
В конце операции отмывают ретробульбарные ткани от крови, заполняют полость орбиты физиологическим раствором, вводят цилиндрический диффузорный световод, с помощью которого проводят облучение лазерным излучением с длиной волны 670 нм, находящейся в максимуме спектра поглощения применяемого фотосенсибилизатора с суммарной плотностью мощности 120-800 мВт/см2.
Операцию завершают после извлечения световода, удаления физ. раствора, ушиванием раны.
Пример 1.
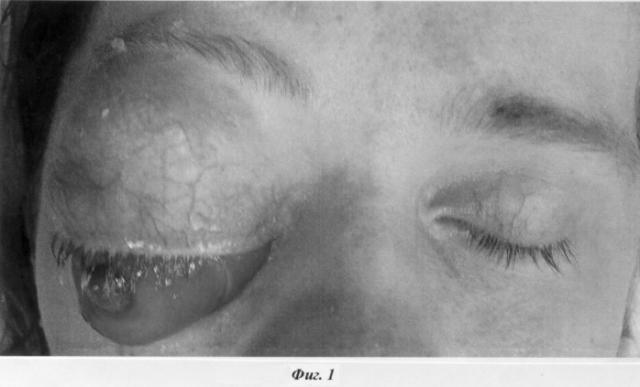
Пациентка 27 лет. Д-з: третий рецидив рабдомиосаркомы правой орбиты. Экзофтальмометрия по Гертелю невозможна.
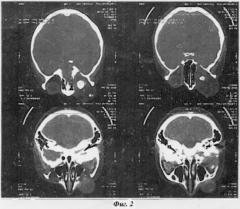
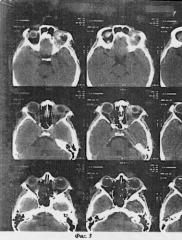
Глаз вывихнут из орбиты, практически «висит» на зрительном нерве (фиг.1). На представленных серийных снимках компьютерной томографии орбиты полость орбиты практически забиты опухолевыми массами до самой вершины (фиг.2)
Из анамнеза: 2 года назад проведена орбитотомия, в послеоперационном периоде проведен стандартный курс химиотерапии и лучевой терапии на область орбиты с суммарной лучевой дозой - 30 Гр. Рецидив наступил спустя 1 год после проведенного курса. Вновь получила лучевую терапию - 40 Гр и курс химиотерапии. Перенесла лечение плохо. Неоднократно отмечала эпизоды рвоты. После курса имел место аллопецийный эффект с полным облысением. От предложенной экзентерации категорически отказывается. Проведены многократные беседы в присутствии мужа и матери пациентки. Настаивает на попытке органосохранного лечения. Предупреждена о риске возможных осложнений, включая прорастание в полость черепа и метастазирование.
Введен фотосенсибилизатор Фотосенс из расчета 0,3 мг/кг веса больной, исходя из факта предполагаемого объема остаточной опухоли не более 5 см3. На третьи сутки после общепринятой регистрации накопления фотосенсибилизатора проведена орбитотомия с иссечением опухоли ad maximum, в ходе которой удален основной массив опухоли, рана отмыта от крови. Образовавшаяся полость заполнена физиологическим раствором, затем введен цилиндрический диффузорный световод, с помощью которого проведено облучение на длине волны 670 нм (максимум спектра поглощения применяемого фотосенсибилизатора Фотосенс) тканей опухоли с суммарной дозой 350 мВт/см2. При выборе дозы мы исходили из объема остаточной опухоли: опухолевая ткань оставалась практически только на стенках орбиты и у ее вершины. Затем, по завершении облучения, рана была освобождена от физиологического раствора и световода, ушита.
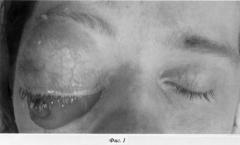
Гистологические исследования выявили ботриоидный тип рабдомиосаркомы, который является резистентным к лучевой терапии. В постоперационном периоде мы провели 3 курса химиотерапии. Использовали стандартную схему: винкристин+циклофосфан+актиномицин Д. Сразу после операции имел место постоперационный отек тканей орбиты (фиг.3)
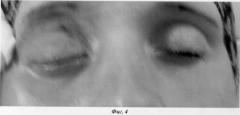
Спустя 2 недели был отмечен положительный эффект в виде уменьшения отека ретробульбарных и периорбитальных тканей, репозиции глазного яблока в орбиту. 5 месяца спустя отмечается легкий энофтальм (западение глазного яблока в орбите), обусловленный втяжением глазного яблока фиброзно-измененными тканями (фиг.4). Птоз до середины зрачка. Признаков опухолевого роста не отмечено.
На контрольном КТ выявляется фиброз остаточной опухолевой ткани, что определяется по КТ-плотности (55 ЕД Намсфелда), признаков продолженного роста или рецидива опухоли нет.
На УЗИ - зафиксировано появление кровотока в магистральных сосудах глаза.
Острота зрения на больном глазу - 0,1.
Таким образом, проведенное лечение позволило сохранить пациентке глаз как орган, уберечь ее от прорастания опухоли в полость черепа и сохранить ей жизнь, а также существенно повысить качество ее жизни. Предложенный способ может быть альтернативой экзентерации и комбинации орбитотомии+лучевой терапии (дистанционной гамма-терапии)+химиотерапии.
Преимуществами предлагаемого нами способа являются ускорение процесса реабилитации. Он позволяет избежать такой факт, как лучевая резистентность и весь широкий ряд постлучевых осложнений в виде иридоциклитов, катаракты, нейроретинопатии, атрофии зрительного нерва, постлучевых дерматитов, кератитов и кератопатий, склеромаляций и субатрофий глазного яблока и др.
Способ комбинированного органосохраняющего лечения злокачественных опухолей орбиты, включающий орбитотомию с иссечением опухоли ad maximum, интраоперационную лучевую терапию и химиотерапию, отличающийся тем, что в качестве лучевой терапии используют фотодинамическую терапию, для чего за 3 суток до операции внутривенно вводят фотосенс в дозе 0,1 мг/г веса, а непосредственно после иссечения опухоли и отмывания операционной раны от крови заполняют образовавшуюся полость физиологическим раствором, вводят в нее цилиндрический диффузорный световод и проводят лазерное воздействие с длиной волны 670 нм и плотностью мощности от 120 до 800 мВт/см2, после чего удаляют физиологический раствор, извлекают световод и ушивают рану.