Бифункциональный катализатор и способ получения обогащенной по водороду газовой смеси из диметилового эфира
Иллюстрации
Показать всеИзобретение относится к каталитическому способу осуществления реакции паровой конверсии диметилового эфира (ДМЭ) с целью получения обогащенной по водороду газовой смеси, которая может использоваться в водородной энергетике, в частности, в качестве топлива для питания топливных элементов различного назначения. Описан бифункциональный катализатор паровой конверсии диметилового эфира, содержащий кислотные центры для гидратации ДМЭ в метанол и медьсодержащие центры для паровой конверсии метанола, представляющий собой медно-цериевый оксид, нанесенный на оксид алюминия. Описан также способ получения обогащенной по водороду газовой смеси взаимодействием ДМЭ и паров воды при температуре 200-400°С, давлении 1-100 атм, мольном соотношении Н2О/ДМЭ, равном 2-10, в присутствии описанного выше катализатора. Технический результат - высокая производительность по водороду, получение водородсодержащего газа с низким содержанием оксида углерода при соотношении водяной пар/ДМЭ, равном стехиометрическому (Н2O/ДМЭ=3), что имеет важное технологическое значение. 2 н. и 3 з.п. ф-лы, 6 табл.
Реферат
Изобретение относится к каталитическому способу осуществления реакции паровой конверсии диметилового эфира (ДМЭ) с целью получения обогащенной по водороду газовой смеси, которая может использоваться в водородной энергетике, в частности, в качестве топлива для питания топливных элементов различного назначения, в том числе и для топливных элементов, установленных на передвижных средствах.
В настоящее время топливные элементы рассматриваются как альтернативный и экологически чистый источник электрической энергии. Водород или обогащенная по водороду газовая смесь являются основным топливом для питания топливных элементов и могут быть получены посредством паровой конверсии природного газа, бензина, метанола и ДМЭ. Несмотря на развитую инфраструктуру и относительно низкую цену природного газа и бензина, они конвертируются при высокой температуре (выше 600°С для природного газа и выше 800°С для бензина), и полученный водородсодержащий газ содержит большое количество оксида углерода. Диметиловый эфир так же, как и метанол, может легко и селективно конвертироваться в водородсодержащий газ при относительно низкой температуре (150-300°С). При этом ДМЭ коррозионно инертен и нетоксичен по сравнению с метанолом.
Известно, что диметиловый эфир так же, как и метанол, может быть получен прямым синтезом из синтез-газа (F.S.Ramos, A.M.Duarte de Farias, L.E.P.Borges, J.L.Monteiro, M.A.Fraga, E.F.Sousa-Aguiar, L.G.Appel, Role of dehydration catalyst acid properties on one-step DME synthesis over physical mixtures, Catalysis Today 101 (2005) 39-44, Т.Н. Fleisch, A. Basu, M.J. Gradassi, J.G. Masin, Dimethyl ether: A fuel for the 21st century. Studies Surface Science and Catalysis, vol. 107 (1997) p.117-125), причем прямой синтез диметилового эфира может быть более выгоден, чем синтез метанола (Т.Shikada, Y.Ohno, Т.Ogawa, M.Ono, M.Mizuguchi, К.Tomura, К.Fujimoto, Direct Synthesis of Dimethyl Ether from synthesis Gas, Studies Surface Science and Catalysis, vol. 119 (1998) p.515-520).
Учитывая это, а также то, что физико-химические свойства ДМЭ аналогичны свойствам сжиженного нефтяного газа (I.Dybjaer, J.B.Hansen, Large Scale Production of Alternative Synthesis Fuel from Natural Gas, Studies Surface Science and Catalysis, vol.107 (1997) р.99-118) процесс паровой конверсии ДМЭ с целью получения водорода для питания топливного элемента является серьезной альтернативой процессу паровой конверсии метанола.
Известно, что реакция паровой конверсии ДМЭ может протекать последовательно по двухстадийной схеме через гидратацию ДМЭ в метанол (1) и паровую конверсию образовавшего метанола в водородсодержащий газ (2):
СН3ОСН3+Н2О=2СН3ОН(1)
СН3ОН+H2O=СО2+3Н2(2)
Суммарная реакция:
СН3ОСН3+3Н3О=2СО2+6Н2(3)
Для осуществления паровой конверсии ДМЭ известны два типа катализаторов: механическая смесь катализатора гидратации ДМЭ и медьсодержащего катализатора паровой конверсии метанола и бифункциональный катализатор, содержащий на поверхности кислотные центры для гидратации ДМЭ и медьсодержащие центры для паровой конверсии метанола.
Известны следующие системы, представляющие собой механическую смесь катализатора гидратации ДМЭ и медьсодержащего катализатора паровой конверсии метанола. В работе (Пат. РФ 2165790, B 01 J 23/85, 27.4.2001) используют механическую смесь нанесенной гетерополикислот и медьсодержащие катализаторы синтеза метанола. В работе (Matsumoto Т., Nishiguchi Т., Kanai H., Utani К., Matsumura Y., Imamura S., Steam reforming of dimethyl ether over H-mordenite-Cu/CeO2 catalysts, Applied Catalysis A: General 276 (2004) 267-273) используют механическую смесь медно-цериевого катализатора и морденита. Недостатком использования катализатора, представляющего механическую смесь, является его расслоение на катализаторы гидратации ДМЭ и паровой конверсии метанола под воздействием вибрации и, как следствие, падение активности катализатора.
Наиболее близкими к заявляемым катализаторам являются бифункциональные катализаторы, которые содержат на поверхности оба типа центров: кислотные центры для гидратации ДМЭ и медьсодержащие центры для паровой конверсии метанола.
В качестве бифункциональных катализаторов известны Cu/Al2О3, Cu-Zn/ Al2О3, Cu-Pd/ Al2О3, Cu-Ru/ Al2О3, Cu-Pt/ Al2О3, Cu-Rh/ Al2О3, Cu-Au/ Al2О3, Cu/Ga8 Al2О15 (Т.Mathew, Y.Yamada, A.Ueda, H.Shioyama, T.Kobayashi, Appl. Catal. A: Gen. 286 (2005) 11, Takeishi K." Suzuki H., Steam Reforming of Dimethyl Ether, Applied Catalysis A:General 260 (2004) 111; JP 2002263504 A2, 17.09.2002); Cu-Zn/ Al2О3 (JP 2003038957 A2, 12.02.2003). Реакцию осуществляют при температуре 350°С, давлении 1 атм. Недостатком является невысокая производительность по водороду, которая не превышает 65 ммоль г-1ч-1.
Изобретение решает задачу разработки катализатора, обладающего высокой каталитической активностью, селективностью и стабильностью в отношении паровой конверсии диметилового эфира (ДМЭ), а также разработки высокопроизводительного процесса получения из ДМЭ газовой смеси, обогащенной по водороду, с использованием этого катализатора.
Задача решается разработкой новой каталитической системы для получения обогащенной по водороду газовой смеси взаимодействием диметилового эфира и паров воды, представляющего собой бифункциональный катализатор, содержащий кислотные центры для гидратации ДМЭ и медьсодержащие центры для паровой конверсии метанола.
Предложен катализатор для получения обогащенной по водороду газовой смеси взаимодействием диметилового эфира и паров воды, представляющий собой бифункциональный катализатор, содержащий на поверхности центры гидратации диметилового эфира и паровой конверсии метанола, содержащий медно-цериевый оксид, нанесенный на оксид алюминия.
Катализатор содержит медно-цериевый оксид в количестве 1-20 мас.%, остальное - оксид алюминия.
Весовое соотношение Cu: Се в медно-цериевом оксиде составляет 1:1-4:1.
Задача также решается разработкой способа получения обогащенной по водороду газовой смеси взаимодействием диметилового эфира и водяного пара в присутствии бифункционального катализатора, представляющего собой медно-цериевый оксид, нанесенный на оксид алюминия.
Реакцию осуществляют при температуре 200-400°С, предпочтительно 300-370°С, давлении 1-100 атм, предпочтительно 1 атм, и мольном отношении вода/диметиловый эфир Н2О/ДМЭ, равном 2-10, предпочтительно 3.
Отличительным признаком предлагаемой бифункциональной каталитической системы является то, что в качестве активного компонента паровой конверсии метанола используется медно-цериевые системы, нанесенные на носитель - оксид алюминия. Кроме того, используемый в качестве носителя оксид алюминия, является катализатором для гидратации ДМЭ.
Отличительным признаком предлагаемого способа получения обогащенной по водороду газовой смеси путем взаимодействия диметилового эфира и водяного пара является использование вышеописанного бифункционального катализатора.
Бифункциональные катализаторы готовят методом нанесения путем обработки оксида алюминия в растворе азотнокислых солей меди и церия, взятых в требуемом соотношении, с последующей сушкой и прокалкой на воздухе при температуре 400-450°С.
Предлагаемое изобретение иллюстрируется следующими примерами, описывающими состав катализаторов и результаты их испытаний в реакции паровой конверсии диметилового эфира.
Пример 1.
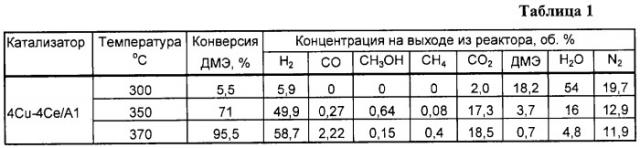
Паровую конверсию диметилового эфира осуществляют в установке проточного типа в кварцевом реакторе с внутренним диаметром 8 мм на навеске катализатора 0,4 г при соотношении Н2О:ДМЭ=3:1, времени контакта 10000 ч-1, 350°С и 1 атм. Состав оксидного катализатора в пересчете на металлы составляет, мас.%: меди - 4, церия - 4, остальное - алюминий. Полученные результаты приведены в таблицах 1 и 6.
Пример 1а. Аналогично примеру 1, но реакцию проводят при температуре 300°С, результаты приведены в таблице 1.
Пример 1б. Аналогично примеру 1, но реакцию проводят при температуре 370°С, результаты приведены в таблице 1.
Пример 2.
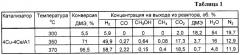
Аналогично примеру 1, но содержание меди составляет 8 мас.%, полученные результаты приведены в таблицах 2 и 6.
Пример 2а. Аналогично примеру 2, но реакцию проводят при температуре 300°С, результаты приведены в таблице 2.
Пример 2б. Аналогично примеру 2, но реакцию проводят при температуре 370°С, результаты приведены в таблице 2.
Пример 3.
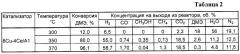
Аналогично примеру 1, но содержание меди составляет 12 мас.%, полученные результаты приведены в таблицах 3 и 6.
Пример 3а. Аналогично примеру 3, но реакцию проводят при температуре 300°С, результаты приведены в таблице 3.
Пример 3б. Аналогично примеру 3, но реакцию проводят при температуре 370°С, результаты приведены в таблице 3.
Пример 4.
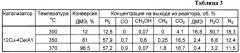
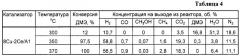
Аналогично примеру 2, но содержание церия составляет 2 мас.%, полученные результаты приведены в таблицах 4 и 6.
Пример 4а. Аналогично примеру 4, но реакцию проводят при температуре 300°С, результаты приведены в таблице 4.
Пример 4б. Аналогично примеру 4, но реакцию проводят при температуре 370°С, результаты приведены в таблице 4.
Пример 5.
Аналогично примеру 1, но содержание меди составляет 6%, церия составляет 6%. Полученные результаты приведены в таблицах 5 и 6.
Пример 5а. Аналогично примеру 5, но реакцию проводят при температуре 300°С, результаты приведены в таблице 5.
Пример 5б. Аналогично примеру 5, но реакцию проводят при температуре 370°С, результаты приведены в таблице 5.
Приведенные примеры демонстрируют высокую активность, селективность и стабильность работы предлагаемых катализаторов в процессе паровой конверсии диметилового эфира в газовую смесь, обогащенную по водороду.
Использование предлагаемых катализаторов позволяет увеличить производительность по водороду в 8-10 раз по сравнению с известным и получить водородсодержащий газ с низким содержанием оксида углерода при соотношении водяной пар/ДМЭ, равном стехиометрическому (Н2О/ДМЭ=3), что имеет важное технологическое значение.
1. Бифункциональный катализатор для получения обогащенной по водороду газовой смеси взаимодействием диметилового эфира и паров воды, содержащий на своей поверхности центры гидратации диметилового эфира и паровой конверсии метанола и включающий в свой состав оксид меди, нанесенный на оксид алюминия, отличающийся тем, что катализатор содержит медно-цериевый оксид, нанесенный на оксид алюминия.
2. Катализатор по п.1, отличающийся тем, что содержание медно-цериевого оксида составляет 1-20 мас.%, остальное оксид алюминия.
3. Катализатор по любому из пп.1 и 2, отличающийся тем, что весовое соотношение меди к церию в медно-цериевом оксиде равно 1:1-4:1.
4. Способ получения обогащенной по водороду газовой смеси взаимодействием диметилового эфира и паров воды в присутствии бифункционального катализатора, содержащего на поверхности центры гидратации ДМЭ и паровой конверсии метанола и включающего в свой состав оксид меди, нанесенный на оксид алюминия, отличающийся тем, что в качестве катализатора используют медно-цериевый оксид, нанесенный на оксид алюминия.
5. Способ по п.4, отличающийся тем, что реакцию осуществляют при температуре 200-400°С, предпочтительно 300-370°С, давлении 1-100 атм, предпочтительно 1 атм, и мольном отношении вода/диметиловый эфир, равном 2-10, предпочтительно, 3.