Фармацевтические соли ребоксетина
Иллюстрации
Показать всеИзобретение относится к новым кристаллическим водорастворимым солям 2S,3S-энантиомера 2-[α-(2-этоксифенокси)бензил]-морфолина, которые являются его фумаратной и сукцинатной солями, к способу их получения, их применению для приготовления фармацевтической композиции, обладающей свойством селективного ингибитора обратного захвата норэпинефрина, и к фармацевтической композиции, их содержащей. 4 н. и 3 з.п. ф-лы, 6 табл., 5 ил.
Реферат
Область изобретения
Данное изобретение относится к новым кристаллическим водорастворимым солям 2S,3S-энантиомера ребоксетина, которые представляют собой его фумаратную и сукцинатную соли, к способу их получения, их использованию в терапии и к фармацевтическим композициям, их содержащим.
Предпосылки создания изобретения
О ребоксетине, 2-[a-(2-этоксифенокси)бензил]морфолине, впервые сообщено в GB 2014981В, в котором описано его применение для лечения депрессии. Ребоксетин является селективным ингибитором обратного захвата норэпинефрина и является безопасным лекарственным средством и превосходным терапевтическим средством при тех заболеваниях у млекопитающих, включая людей, при которых необходимо селективное подавление обратного захвата норэпинефрина. Фактически он обладает немногими, если они вообще присутствуют, физиологическими эффектами, кроме действия на превращение норэпинефрина, и поэтому свободен от побочных эффектов и нежелательных действий. В GB 2176407В представлены отдельные 2R,3R- и 2S,3S-энантиомеры ребоксетина. 2S,3S-энантиомер ребоксетина, здесь далее называемый SS-ребоксетином, как было обнаружено, обладает селективным действием подавления обратного захвата норэпинефрина, значительно более высоким, чем рацемат ребоксетина.
Существует несколько патентных документов, в которых описаны новые способы применения ребоксетина, например, US 6391876, US 6046193, US 6184222, US 6028070 и WO 02/36125. Однако отдельно фумаратная и сукцинатная соли SS-ребоксетина никогда ранее не были описаны. Мезилатная соль ребоксетина присутствует на рынке в виде рацемата и предпочтительно применяется в виде твердых лекарственных форм. Подобным же образом, мезилат S,S-ребоксетина находится на стадии разработки в отношении применения у млекопитающих в виде твердых лекарственных форм, которые, большей частью, подходят для введения пациентам, нуждающимся в селективном подавлении обратного захвата норэпинефрина. Однако соединение мезилат SS-ребоксетина проявляет плохие физико-химические характеристики и нестабильность из-за своей гигроскопичности.
Поглощение влаги имеет большое значение для порошков фармацевтических препаратов. Влага, как было показано, оказывает значительное влияние, например, на физические, химические и производственные свойства лекарственных веществ, наполнителей и препаратов. Это свойство является также определяющим фактором в принятии решений, связанных с упаковкой, хранением, переработкой и сроком хранения, и для успешной разработки необходимо полное понимание гигроскопических свойств.
Например, превращение из безводного состояния в форму гидрата можно наблюдать, когда относительная влажность превышает критический уровень и содержание влаги в твердом веществе быстро повышается. Это оказывает сильное влияние не только на физико-фармацевтические свойства лекарственного вещества самого по себе, но также на его биофармацевтические перспективы. Кроме того, хорошо известно, что гидратные формы обычно склонны быть менее растворимыми по отношению к гомологичной безводной форме, с потенциальным вредным действием также на характеристики скорости растворения активного соединения самого по себе и на профиль абсорбции через желудочно-кишечный тракт. Таким же образом в присутствии относительной влажности можно наблюдать превращение кристаллической формы в аморфную форму с потенциальным ущербом в отношении физической стабильности (активное лекарственное вещество может, например, расплываться по мере поглощения влаги) или химической стабильности, фактически аморфная структура, будучи термодинамически активированной, более склонна к химическому разложению и к химическому взаимодействию с другими химическими веществами. Таким образом, действие и эффективность как препарата, так и активного ингредиента могут значительно изменяться.
В частности, что касается S,S-ребоксетина, было обнаружено, что безводная мезилатная соль является сама по себе термодинамически нестабильной и склонна трансформироваться в ходе старения в гидратную форму. Даже более того, безводная форма имеет склонность терять кристаллическую структуру при действии окружающей среды с высокой относительной влажностью, трансформируясь, таким образом, в химически менее стабильную аморфную форму.
Соответственно, существует потребность в терапии в водорастворимой соли S,S-ребоксетина, обладающей низкой гигроскопичностью и хорошими и воспроизводимыми биофармацевтическими свойствами, дающими возможность безопасного и эффективного перорального введения.
Представленная выше техническая проблема была решена с помощью данного изобретения путем получения двух новых солей S,S-ребоксетина, обладающих улучшенными физико-химическими свойствами. Фактически, новые соли являются кристаллическими, малогигроскопичными, быстрорастворимыми твердыми веществами с высокой растворимостью в воде и, кроме того, являются по существу более стабильными, чем мезилатная соль. Они, таким образом, обладают преимуществами, важными для работы с ними, хранения и изготовления препаратов и т.д., в дополнение к наличию всех других преимуществ, в частности терапевтически полезных свойств, проявляемых мезилатной солью.
Описание изобретения
Первый объект данного изобретения относится к получению нового кристаллического вещества, водорастворимой соли 2S,3S-энантиомера 2-[a-(2-этоксифенокси)бензил]морфолина, которая является его фумаратной и его сукцинатной солью.
2S,3S-энантиомер 2-[a-(2-этоксифенокси)бензил]морфолина здесь далее называется S,S-ребоксетином.
Фумаратная и сукцинатная соли S,S-ребоксетина могут быть получены известными аналогичными методами посредством стехиометрического добавления водных растворов противоиона к свободному основанию, растворенному в подходящем растворителе. Такой растворитель является предпочтительно органическим, в частности, безводным растворителем, выбранным, предпочтительно, из метанола, этанола, диоксана и диметилформамида. Если необходимо, может быть благоприятным осаждение полученной соли добавлением безводного неполярного растворителя, например диэтилового эфира, н-гексана или циклогексана.
Свободное основание S,S-ребоксетина может быть получено из соответствующей мезилатной соли соответствующими методами. Мезилатная соль S,S-ребоксетина может быть получена, как описано в GB 2167407В.
В соответствии с предпочтительным признаком данного изобретения фумаратная и сукцинатная соли S,S-ребоксетина могут быть получены путем реакции свободного основания S,S-ребоксетина с фумаровой кислотой или янтарной кислотой, соответственно, в подходящем низшем алканоле, предпочтительно этаноле, с последующим регулируемым процессом кристаллизации. Низший алканол является, например, С1-С4 алканолом, предпочтительно этанолом.
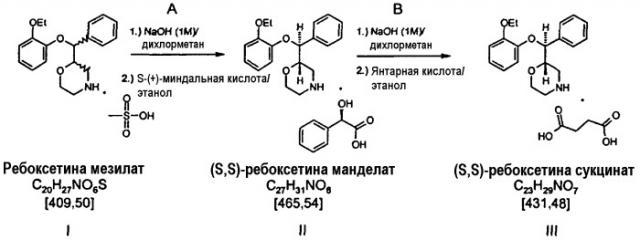
Свободное основание S,S-ребоксетина, в свою очередь, может быть получено реакцией манделата S,S-ребоксетина с подходящим реактивом-основанием, например гидроксидом натрия. Манделат S,S-ребоксетина, в свою очередь, может быть получен путем реакции свободного основания ребоксетина с (S)-(+)-миндальной кислотой в подходящем низшем алканоле с последующим регулируемым процессом кристаллизации. Свободное основание ребоксетина может быть получено реакцией мезилата ребоксетина с подходящим реактивом-основанием, например гидроксидом натрия.
В качестве примера такого предпочтительного варианта, который является дополнительным объектом данного изобретения, может быть приведено следующее:
Фумаратная и сукцинатная соли ребоксетина, полученные таким образом, имеют кристаллическое строение.
Промежуточное соединение, манделат S,S-ребоксетина, является новым соединением и еще одним объектом данного изобретения.
Объектом данного изобретения являются также метаболиты, предшественники метаболитов (известные также, как пролекарства) и гидратные формы фумаратной и сукцинатной солей S,S-ребоксетина.
Еще одним объектом данного изобретения является получение фармацевтической композиции, содержащей соль S,S-ребоксетина, которая является его фумаратной солью или его сукцинатной солью, в качестве активного ингредиента и фармацевтически приемлемый наполнитель и/или носитель.
Фармацевтическая композиция может быть изготовлена в соответствии с известным методом в области получения любой из известных фармацевтических форм, известных специалистам, для введения млекопитающему, включая людей. Например, фармацевтическая композиция, содержащая соединение данного изобретения в качестве активного ингредиента и подходящий носитель и/или наполнитель, может быть изготовлена, как известно, по GB 2014981В.
Дополнительным объектом данного изобретения является получение соли S,S-ребоксетина, которая представляет собой его фумаратную или сукцинатную соль, для использования в качестве лекарственного средства, в частности, как селективного ингибитора обратного захвата норэпинефрина.
Еще одним объектом данного изобретения является обеспечение применения соли S,S-ребоксетина, которая представляет собой его фумаратную или сукцинатную соль, для производства фармацевтической композиции для использования в лечении млекопитающего, включая человека, страдающего болезненным состоянием, поддающегося лечению селективным подавлением обратного захвата норэпинефрина.
Еще одним объектом данного изобретения является обеспечение способа лечения млекопитающего, включая человека, нуждающегося в селективном подавлении обратного захвата норэпинефрина, включающего введение указанному млекопитающему терапевтически эффективного количества соли S,S-ребоксетина, которая является его фумаратной солью или сукцинатной солью.
Соответственно, новые соли S,S-ребоксетина данного изобретения или отдельно, или в сочетании с другими терапевтическими средствами пригодны для лечения млекопитающего, включая людей, страдающих болезненным состоянием, поддающимся лечению путем селективного подавления обратного захвата норэпинефрина.
Термин "болезненное состояние, поддающееся лечению" означает, что лечение в соответствии с данным изобретением обеспечивает ремиссию болезненного состояния или, по меньшей мере, условия и качество жизни млекопитающего, находящегося на лечении, улучшаются.
Примерами таких болезненных состояний являются, в частности, расстройства нервной системы, выбираемые из группы, состоящей из связанных с привыканием расстройств (включая расстройства, связанные с алкоголем, никотином и другими психоактивными веществами) и синдрома отмены, расстройств, связанных с адаптацией (включая депрессивное состояние, беспокойство, смешанное состояние депрессии и беспокойства, нарушение поведения и смешанное нарушение поведения и настроения), связанных с возрастом расстройств обучаемости и умственных (включая болезнь Альцгеймера), нервной анорексии, апатии, расстройств с недостаточностью внимания (или других расстройств познавательной способности), связанных с общим медицинским состоянием, расстройств с дефицитом внимания и гиперактивностью (ADHD), биполярного расстройства, нейрогенной булимии, синдрома хронической усталости, хронического или острого стресса, хронической боли, невропатической боли, невралгий, включая постгерпетическую невралгию, поведенческих нарушений, циклотимического расстройства, депрессии (включая стойкую депрессию, юношескую депрессию и малую (minor) депрессию), дистимического расстройства, фибромиалгии и других соматоформных расстройств (включая расстройство с соматизацией, конверсионное расстройство, расстройство с болями, гипохондриаз, дисморфное расстройство организма, недифференцируемое соматоформное расстройство и соматоформу NOS), расстройства с генерализованной тревогой (GAD), несдержанности (т.е. несдержанность в результате стресса, генуинная несдержанность в результате стресса и смешанная несдержанность), расстройств дыхания, интоксикационных расстройств (хронический алкоголизм), мании, мигреневой головной боли, ожирения (т.е. снижение веса у пациентов с ожирением и избыточным весом), заболеваний с навязчивым неврозом и расстройств родственного спектра, расстройства с оппозиционностью, непокорностью, расстройства с паническим настроением, периферической нейропатии, диабетической нейропатии, расстройства посттравматического стресса, предменструального дисфорического расстройства (т.е. предменструального синдрома и дисфорического расстройства поздней лютеиновой фазы), психотических расстройств (включая шизофрению, шизоаффективные и шизофрениформные расстройства), сезонного аффективного расстройства, нарушений сна (таких как нарколепсия и энурез), социальных фобий (включая расстройство с социальным беспокойством), специфических заболеваний развития, синдрома "истощения" селективного подавления обратного захвата серотонина (СПЗС) (т.е. состояние пациента, когда у него не сохраняется удовлетворительная реакция на терапию СПЗС после первоначального периода удовлетворительной реакции), и TIC расстройства (например, болезнь Туретта). Как указано выше, новые соли S,S-ребоксетина данного изобретения можно использовать также в сочетании с другими терапевтическими средствами, например, с пиндололом, для быстрого начала действия антидепрессанта, с детролом при несдержанности и с нейролептиком, например типичным или атипичным антипсихотиком, при лечении шизофрении.
Эффективная доза фумарата S,S-ребоксетина или сукцинатной соли S,S-ребоксетина может меняться в соответствии с заболеванием, тяжестью расстройства и состоянием пациента, которого нужно лечить. Поэтому оптимальную дозу для каждого пациента, как всегда, будет устанавливать врач. Как бы то ни было, интервал эффективной дозировки может составлять от примерно 0,5 мг/сутки до примерно 20 мг/сутки, предпочтительно, от примерно 1 до примерно 15 мг/сутки (в расчете на свободное основание), в виде однократной дозы или в виде множества дробных доз в сутки.
Фумарат S,S-ребоксетина или сукцинат S,S-ребоксетина легко всасываются при пероральном приеме, поэтому предпочтительно принимать их перорально. Во всяком случае, их можно вводить любым другим путем, например парентеральным, ректальным, назальным путем или местным применением.
Следующие примеры иллюстрируют изобретение.
Пример 1
Получение сукцинатной соли S,S-энантиомера ребоксетина
Сукцинатную соль S,S-ребоксетина синтезировали добавлением стехиометрического количества янтарной кислоты к этанольному раствору свободного основания.
Добавляли 16 мл метанольного раствора, содержащего 2,5 г янтарной кислоты, к 4,1 г свободного основания (желто-оранжевое масло), растворенного в 75 мл абсолютного этанола. Затем раствор нагревали при перемешивании при 40°С в течение примерно 20 минут. Раствор становился бесцветным и белым, наблюдался тонкий осадок. Выход продукта кристаллизации затем увеличивали охлаждением взвеси при -30°С, чтобы облегчить образование соли.
Твердое вещество затем отделяли фильтрованием в вакууме и сушили примерно 8 часов в вакууме при 40°С. Получали сукцинатную соль S,S-ребоксетина в условиях, описанных здесь.
Пример 2
Получение фумаратной соли S,S-энантиомера ребоксетина
Фумаратную соль S,S-ребоксетина синтезировали посредством той же самой стехиометрической методики кристаллизации, описанной выше.
1,6 г фумаровой кислоты, суспендированной в 10 мл абсолютного этанола, добавляли к 4,1 г свободного основания, растворенного в 75 мл абсолютного этанола.
Затем раствор нагревали при перемешивании при 40°С в течение нескольких минут. Сразу же наблюдалось образование бело-розовых сферических агломератов. Выход продукта кристаллизации затем увеличивали охлаждением густой суспензии при -30°С, чтобы облегчить образование соли. Твердое вещество затем отделяли фильтрованием в вакууме и сушили примерно 8 часов в вакууме при 40°С. Посредством представленной процедуры получали фумаратную соль S,S-ребоксетина.
Пример 3
Получение сукцинатной соли S,S-энантиомера ребоксетина
Стадия А: Свободное основание из мезилата ребоксетина с водным раствором гидроксида натрия в дихлорметановой фазе. Выпаривают дихлорметан из раствора свободного основания ребоксетина и добавляют этанол. Растворяют 1,1 эквивалента (S)-(+)-миндальной кислоты в этаноле. Смешивают растворы свободного основания и кислоты с образованием осадка манделата (S,S)-ребоксетина, следуя контролируемому процессу кристаллизации. Твердые вещества отделяют фильтрованием и сушат. Повышают хиральную чистоту (S,S)-ребоксетина путем дефлегмации и перекристаллизации в этаноле. Снова выделяют твердые вещества фильтрованием и сушкой.
Стадия В: Свободное основание из манделата (S,S)-ребоксетина с водным раствором гидроксида натрия в дихлорметановой фазе. Выпаривают дихлорметан из раствора свободного основания ребоксетина и добавляют этанол. Растворяют 1,0 эквивалента янтарной кислоты в этаноле. Смешивают растворы свободного основания и кислоты с образованием осадка сукцината (S,S)-ребоксетина, следуя процессу регулируемой кристаллизации. Выделяют твердые вещества фильтрованием и сушкой.
Результаты анализов
Рентгеновская порошковая дифрактометрия (РПД)
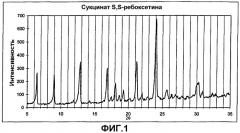
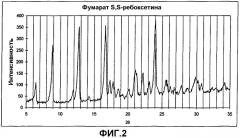
Соли фумарат S,S-ребоксетина и сукцинат S,S-ребоксетина характеризовали рентгеновской порошковой дифрактометрией (РПД) следующим образом.
Картину диффракции рентгеновских лучей получали, используя аппарат Siemens D-500, облучая образцы порошка CuKa графитовым-монохроматическим (40 кВ, 40 мА) источником между 5° и 35° (2) при комнатной температуре. Сканирование производили с шагом 0,05° и время определения значения составляло 7 секунд на шаг.
Основные пики рентгеновской дифракции сукцинатной и фумаратной солей представлены ниже и сведены в следующую таблицу I (сукцинатная соль) и таблицу II (фумаратная соль).
Значимые спектры представлены на фиг.1 и 2.
| Таблица I | |
| Угол (°2) | Относительная интенсивность |
| 6,45 | 39,3 |
| 9,00 | 37,9 |
| 12,85 | 51,5 |
| 16,85 | 44,7 |
| 18,10 | 27,7 |
| 19,30 | 19,8 |
| 21,20 | 51,9 |
| 22,05 | 16,9 |
| 24,05 | 100,0 |
| 25,70 | 20,1 |
| 30,10 | 27,7 |
| 30,30 | 29,0 |
| 30,90 | 18,9 |
| Таблица II | |
| Угол (°2) | Относительная интенсивность |
| 6,40 | 28,9 |
| 8,90 | 71,9 |
| 12,75 | 92,1 |
| 16,65 | 94,0 |
| 17,40 | 31,5 |
| 17,85 | 30,2 |
| 21,30 | 39,9 |
| 22,25 | 40,1 |
| 23,20 | 29,9 |
| 24,05 | 100 |
| 25,60 | 32,0 |
| 25,70 | 31,7 |
| 29,85 | 35,4 |
Дифференциальная сканнирующая калориметрия (ДСК)
Анализы ДСК осуществляли с помощью аппарата Perkin-Elmer DSC-7. В алюминиевые кюветы для ДСК загружали примерно 2 мг образца. Интервал температур анализа находился между 30 и 210°С. Образцы анализировали в потоке азота (для исключения окислительного и пиролитического эффектов) при скорости нагревания 10°С/мин.
Для сукцинатной соли наблюдаемая эндотерма плавления составляла примерно 148°С [теплота расплавления (Нf) примерно 120 Дж/г]. Эндотерма плавления фумаратной соли присутствовала при примерно 171°С [теплота расплавления (Нf) примерно 100 Дж/г].
Данные по стабильности
Проводили контроль твердого состояния сукцинатной и фумаратной солей после программы ускоренного определения стабильности. Образцы хранили в течение 2 недель при 65°С в стеклянных сосудах для ВЭЖХ и затем проводили контроль посредством ДСК.
Никаких изменений в твердом состоянии не наблюдалось для обоих образцов.
Растворимость
Определение растворимости в воде сукцинатной и фумаратной солей S,S-ребоксетина выполняли посредством следующей процедуры: избыток твердого вещества (чтобы иметь насыщенные растворы) добавляли в сосуд к 1,5 мл воды. Жидкость в сосудах перемешивали, механически взбалтывая при 37°С. Через соответствующее время (т.е. через 1 час) отбирали образцы и оценивали растворимость путем специфического исследования ВЭЖХ.
Результаты здесь ниже сведены в таблицу III.
| Таблица III | |||
| Образец | Растворимость в воде (мг/мл) | ||
| 1 час перемешивания | 2 часа перемешивания | 24 часа перемешивания | |
| Сукцинатная соль | 30 | 30 | 35 |
| Фумаратная соль | 9 | 9 | 9 |
Динамическая гравиметрия сорбции влаги (ДГСВ; DMSG)
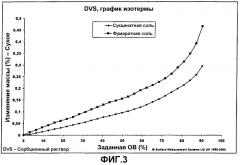
Поглощение воды сукцинатной и фумаратной солями S,S-ребоксетина исследовали, подвергая образец таких солей испытанию на гигроскопичность с помощью DVS 1000 (SMS) в соответствии с принципом динамической гравиметрии сорбции влаги (ДГСВ). Аппарат представляет собой "контролируемые атмосферные микровесы", где взвешиваемый образец подвергается воздействию относительной влажности (ОВ) с программируемым изменением при постоянной и контролируемой температуре. Измеряемые параметры (вес, время и ОВ) регистрировали на рабочих листах Excel, позволявших получать кривые гигроскопичности на протяжении испытуемого интервала влажности. Многочисленные циклы сорбции/десорбции между 0% и 90% ОВ выполняли при 25°С. Постепенные изменения ОВ были равны 10%; их осуществляли с помощью программного обеспечения с уравновешиванием веса образца. Этот режим был определен при постоянной скорости изменения процента веса 0,005%/мин (среднее по 5 минутам исследования). Результаты эксперимента регистрировали в DVS протоколах изотермы и на кривых изотермы.
Поглощение воды сукцинатной и фумаратной солями S,S-ребоксетина здесь ниже сведено в следующей таблице IV.
| Таблица IV | ||
| Относительная влажность (%) | Сукцинатная соль Поглощение воды, % | Фумаратная соль Поглощение воды, % |
| 20 | 0,03 | 0,06 |
| 35 | 0,06 | 0,11 |
| 50 | 0,10 | 0,16 |
| 65 | 0,14 | 0,21 |
| 80 | 0,21 | 0,31 |
| 90 | 0,29 | 0,47 |
Профили сорбции двух солей показаны на фиг.3. Наблюдаемое поглощение воды является, как бы то ни было, обратимым, не изменяя, таким образом, химических, физико-химических свойств и характеристик твердого состояния как фумаратной, так и сукцинатной солей.
В целях сравнения производилось также определение характеристик мезилата S,S-ребоксетина с помощью описанных выше методик.
Дифференциальная сканирующая калориметрия (ДСК)
Температура плавления, определяемая путем ДСК анализов, с измерением эндотермической характеристики, относительно плавления образца, составляла примерно 106°С.
Термогравиметрический анализ (ТГА)
Содержание летучих веществ, измеряемое посредством термогравиметрического анализа (ТГА), было значимым: фактически потерю веса, равную примерно 2%, определяли при нагревании, демонстрирующем соответствующую термическую характеристику. Хотя для фумаратной и сукцинатной солей S,S-ребоксетина была определена незначительная потеря веса.
Динамическая гравиметрия сорбции влаги (ДГСВ; DMSG)
Во время анализов DVS, подобных описанным ранее, данное соединение показало значимую тенденцию к поглощению влаги. Количество воды, поглощаемое образцом после стадии DVS сорбции, только частично устранялось путем снижения относительной влажности, и при ДГСВ анализе испытуемого образца наблюдалась модификация твердого состояния. Полученные результаты сведены в таблице V, представляющей поглощение воды, выраженное в процентах изменения массы, и представлены на фиг.4.
| Таблица V | ||
| Относительная влажность (%) | Цикл сорбции Содержание воды, % | Цикл десорбции Содержание воды, % |
| 0 | 0,0 | 4,3 |
| 20 | 0,5 | 4,5 |
| 35 | 0,6 | 4,6 |
| 50 | 0,7 | 4,6 |
| 65 | 0,9 | 4,6 |
| 80 | 4,5 | 4,7 |
| 90 | 8,7 | 8,7 |
Представленные выше результаты сравнительных испытаний, полученные с помощью основных аналитических методик для характеристики сукцинатной, фумаратной и мезилатной солей S,S-ребоксетина, обобщены здесь ниже.
Динамическая гравиметрия сорбции влаги
Испытания гигроскопичности осуществляли с помощью DVS 1000 (SMS) методом динамической гравиметрии сорбции влаги (ДГСВ), представленным ранее, показывают, что мезилатная соль имеет склонность адсорбировать высокое количество воды (до 9% при 90% ОВ), тогда как поглощение новыми сукцинатной и фумаратной солями составляет ниже 0,5%. Кроме того, мезилатная соль сохраняет примерно половину определяемого поглощения (примерно 4%), также после повторного уравновешивания и проявляет изменение в структуре твердого вещества (потерю кристалличности, наблюдаемой при ДСК).
Сравнение поведения разных солей в присутствии влаги может быть обобщено, как представлено здесь ниже, в таблице VI (значимые предварительные данные показаны выше в таблицах 3 и 4 и на фиг.3 и 4).
| Таблица VI | |||
| Соль | Сукцинатная соль | Фумаратная соль | Мезилатная соль |
| Эффекты поглощения влаги | Обратимое поглощение воды, зависимое от относительной влажности окружающей среды.Нет изменений в кристаллической форме (фиг.3) | Обратимое поглощение воды, зависимое от относительной влажности окружающей среды.Нет изменений в кристаллической форме (фиг.3) | Необратимое изменение кристаллов из-за поглощения воды.Сохранение воды, даже когда лекарственное вещество снова выдерживают при низкой влажности (фиг.4) |
Дифференциальная сканирующая калориметрия (ДСК)
Анализы ДСК осуществляли, как описано выше, также на образцах, восстановленных после испытаний DVS, осуществленных по методу ДГСВ. Как показано ниже, на фиг.5, профили ДСК сукцинатной и фумаратной солей S,S-ребоксетина были неизменными после уравновешивания при высокой влажности в соответствии с методом испытания DVS (максимальная относительная влажность, равная 90% при 25°С и уравновешивание до 0,005%/мин или не более, чем 360 минут).
С другой стороны, мезилатная соль подвергается полной деструктуризации, проявляющеийся исчезновением главной температурной характеристики (дегидратации при примерно 50°С и плавления при примерно 105°С).
Из приведенных выше сравниваемых данных специалисту должно быть ясно, что новые соли данного изобретения являются улучшенным и ценным новым средством для использования в терапии.
1. Фумаратная или сукцинатная соль 2S,3S-энантиомера 2-[α-(2-этоксифенокси)бензил]-морфолина.
2. Соль по п.1, которая является фумаратной солью.
3. Соль по п.1, которая является сукцинатной солью.
4. Соль по п.1, обладающая свойством селективного ингибитора обратного захвата норэпинефрина.
5. Фармацевтическая композиция, обладающая свойством селективного ингибитора обратного захвата норэпинефрина, содержащая соль по п.1 в качестве активного ингредиента и фармацевтически приемлемый наполнитель и/или носитель.
6. Применение соли по п.1 для приготовления фармацевтической композиции, обладающей свойством селективного ингибитора обратного захвата норэпинефрина.
7. Способ получения соли 2S,3S-энантиомера 2-[α-(2-этоксифенокси)бензил]морфолина, которая является его фумаратной солью или сукцинатной солью, который включает взаимодействие 2-[α-(2-этоксифенокси)бензил]морфолина с (S)-(+)-миндальной кислотой с получением таким образом манделата 2S,3S-2-[α-(2-этоксифенокси)бензил]морфолина; взаимодействия манделата 2S,3S-2-[α-(2-этоксифенокси)бензил]морфолина с подходящим реагентом-основанием с получением таким образом соответствующего свободного основания и взаимодействие 2S,3S-2-[α-(2-этоксифенокси)бензил]морфолина с фумаровой кислотой или янтарной кислотой соответственно с последующим контролируемым процессом кристаллизации.