Комбинации лекарственных средств (например, хлорпромазина и пентамидина) для лечения неопластических нарушений
Иллюстрации
Показать всеИзобретение относится к медицине, к лечению неопластических нарушений, таких как рак. Предложена группа изобретений: варианты способа лечения пациента, имеющего рак, предусматривающие введение пациенту хлорпромазина и пентамидина одновременно или последовательно с интервалом в пределах 14 дней в количествах, достаточных для ингибирования роста указанного рака, или в виде фармацевтической композиции, содержащей указанные средства в количествах, которые вместе уменьшают пролиферацию клеток указанного рака, а также сама фармацевтическая композиция для указанного лечения и фармацевтическая упаковка. Предложенная комбинированная терапия с помощью указанных средств, каждое из которых само по себе не имеет антипролиферативной активности, позволяет получить синергический антипролиферативный эффект при отсутствии токсичности в отношении нормальных клеток. 4 н. и 13 з.п. ф-лы, 1 табл.
Реферат
Изобретение относится к лечению неопластических нарушений, таких как рак.
Рак является заболеванием, характеризующимся неконтролируемым ростом атипичных клеток. Атипичные клетки не могут уже выполнять функцию нормальных клеток и они вытесняют и разрушают здоровую ткань.
Рак легкого является наиболее распространенной, связанной с раком причиной смерти среди мужчин и женщин. Он является вторым наиболее часто встречающимся раком среди мужчин и женщин; оценивается, что будет более 164000 новых случаев рака легкого в США только в 2000 году. Хотя скорость появления случаев рака легкого снижается среди мужчин в США, она продолжает увеличиваться среди женщин. Рак легкого может быть летальным; согласно Американской пульмонологической ассоциации, по приблизительной оценке ожидается, что 156900 американцев умрут от рака легкого в 2000 году.
Раки, которые начинаются в легких, делят на два основных типа, немелкоклеточный рак легкого и мелкоклеточный рак легкого, в зависимости от того, как эти клетки видны под микроскопом. Немелкоклеточный рак легкого (плоскоклеточный рак, аденокарцинома и крупноклеточная карцинома) обычно распространяется в другие органы более медленно, чем мелкоклеточный рак легкого. Мелкоклеточный рак легкого является менее обычном типом, будучи ответственным за приблизительно 20% всех случаев рака легких.
Другие раки включают рак головного мозга, рак молочной железы, цервикальный рак, рак ободочной кишки, рак желудка, рак почки, лейкоз, рак печени, лимфому, рак яичников, рак поджелудочной железы, рак предстательной железы, ректальный рак, саркому, рак кожи, тестикулярный рак и рак матки. Эти раки, подобно раку легких, лечат иногда химиотерапией.
Химиотерапевтические лекарственные средства, используемые в настоящее время или находящиеся в клинических испытаниях, включают паклитаксел, доцетаксел, тамоксифен, винорелбин, гемцитабин, цисплатин, этопозид, топотекан, иринотекан, анастрозол, ритуксимаб, трастузумаб, флударабин, циклофосфамид, гентузумаб, карбоплатин, интерферон и доксорубицин. Наиболее часто используемым антираковым агентом является паклитаксел, который используют отдельно или в комбинации с другими химиотерапевтическими лекарственными средствами, такими как 5-ФУ, доксорубицин, винорелбин, цитоксан и цисплатин.
Сущность изобретения
Авторы данного изобретения обнаружили, что комбинация антипсихотического лекарственного средства хлорпромазина и лекарственного средства против простейших пентамидина проявляет существенную антипролиферативную активность против раковых клеток. Структурные и функциональные аналоги каждого из этих соединений известны, и любой из этих аналогов может быть использован в антипролиферативной комбинации данного изобретения. Известны также метаболиты хлорпромазина и пентамидина. Многие из этих метаболитов имеют общие одну или более биологических активностей с исходным соединением и, следовательно, могут быть также использованы в антипролиферативной комбинации данного изобретения. Таким образом, данное изобретение описывает способ лечения пациента, имеющего рак или другую неоплазму, введением этому пациенту хлорпромазина и пентамидина одновременно или последовательно с интервалом в пределах 14 дней в количествах, достаточных для ингибирования роста данной неоплазмы.
Предпочтительно, эти два соединения вводят с интервалом в пределах 10 дней, более предпочтительно с интервалом в пределах пяти дней и наиболее предпочтительно с интервалом в пределах двадцати четырех часов или даже одновременно. Раком, подвергаемым лечению в соответствии с любым из способов данного изобретения, описанных ниже, может быть рак легких (плоскоклеточная карцинома, аденокарцинома или крупноклеточная карцинома), рак головного мозга, рак молочной железы, цервикальный рак, рак ободочной кишки, рак желудка, рак почки, лейкоз, рак печени, лимфома, рак яичников, рак поджелудочной железы, рак предстательной железы, ректальный рак, саркома, рак кожи, тестикулярный рак или рак матки.
В родственном аспекте данное изобретение описывает также способ лечения пациента, имеющего неоплазму, такую как рак. В этом способе пациенту вводят (а) первое соединение, выбранное из прохлорперазина, перфеназина, мепазина, метотримепразина, ацепромазина, тиопропазата, перазина, пропиомазина, путаперазина, тиэтилперазина, метопромазина, хлорфенетазина, циамемазина, перфеназина, энантата, норхлорпромазина, трифторперазина, тиоридазина (или соли любого из описанных выше лекарственных средств) и антагонистов допамина D2 (например, сульприда, пимозида, спиперона, этопропазина, клебоприда, бупропиона и галоперидола); и (b) второе соединение, выбранное из пропамидина, бутамидина, гептамидина, нонамидина, стилбамидина, гидроксистилбамидина, диминазена, бензамидина, 4,4'-(пентаметилендиокси)ди-, дигидрохлорида, фенамидина, дибромпропамидина, 1,3-бис(4-амидино-2-метоксифенокси)пропана, фенамидина и амикарбалида (или соли любого из описанных выше лекарственных средств). Альтернативно, второе соединение может быть функциональным аналогом пентамидина, таким как нетропсин, дистамицин, блеомицин, актиномицин или даунорубицин. Первое и второе соединения предпочтительно вводят одновременно или последовательно, с интервалом в пределах 14 дней и в количествах, достаточных для ингибирования роста неоплазмы.
В другом родственном аспекте данное изобретение описывает также способ лечения пациента, имеющего неоплазму, такую как рак, введением следующих соединений:
а) первого соединения, имеющего формулу (I):
где R2 выбран из группы, состоящей из:
R10 выбран из группы, состоящей из:
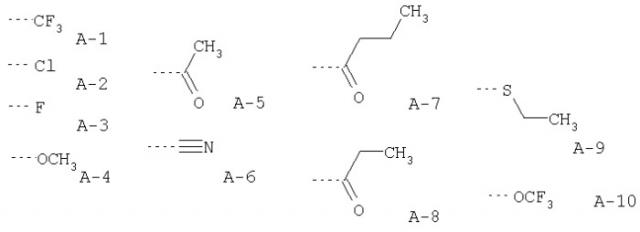
каждый из R1, R3, R4, R5, R6, R7, R8 и R9 обозначает, независимо, Н, F, OH, OCF3 или ОСН3; и W выбран из группы, состоящей из:
и
b) второго соединения, имеющего формулу (II):
где каждый из Y и Z обозначает, независимо, О или N; каждый из R11 и R12 обозначает, независимо, Н, ОН, Cl, Br, OCH3, OCF3, NO2 или NH2; n равно целому числу между 2 и 6, включительно; и каждый из R13 и R14 находится, независимо, в мета- или параположении и выбран из группы, состоящей из:
где первое и второе соединения вводят одновременно или в пределах 14 дней одно от другого в количествах, достаточных для ингибирования роста неоплазмы.
В любом из предыдущих способов лечения каждое соединение, которое является частью комбинации, вводят предпочтительно пациенту в виде части фармацевтической композиции, которая также включает фармацевтически приемлемый носитель. Хлорпромазин предпочтительно вводят в дозе от 10 до 2500 миллиграммов, а пентамидин предпочтительно вводят в дозе от 1 до 1000 миллиграммов. Предпочтительные способы введения включают внутривенное, внутримышечное введение, введение ингаляцией и пероральное введение.
Антипролиферативные комбинации данного изобретения могут быть частью фармацевтической упаковки. Предпочтительно, хлорпромазин и пентамидин готовят вместе или раздельно и в отдельных дозированных количествах.
Специалистам в данной области должно быть понятно, что эти соединения применимы также при приготовлении в форме их солей. Например, как описано здесь, изетионатная соль пентамидина проявляет синергическую антипролиферативную активность при объединении с хлорпромазином. Другие соли пентамидина включают в себя соль платины, дигидрохлоридную соль и диметансульфонатную соль (см., например, Mongiardo et al., Lancet 2: 108, 1989). Подобным образом, соли хлорпромазина включают, например, гидрохлоридные соли и малеатные соли.
Данное изобретение описывает также способы для идентификации соединений, применимых для лечения пациента, имеющего неоплазму. Этот способ предусматривает стадии контактирования раковых клеток in vitro с (i) пентамидином или хлорпромазином и (ii) соединением-кандидатом и определение, растут ли раковые клетки более медленно, чем (а) раковые клетки, контактируемые с хлорпромазином или пентамидином, но не контактируемые с соединением-кандидатом, и (b) раковые клетки, контактируемые с соединением-кандидатом, но не с хлорпромазином или пентамидином. Соединение-кандидат, которое при объединении с хлорпромазином или пентамидином уменьшает пролиферацию клеток, но в отсутствие хлорпромазина или пентамидина не уменьшает, применимо для лечения пациента, имеющего неоплазму.
Комбинированная терапия может быть обеспечена, где бы ни выполнялась химиотерапия: дома, в офисе доктора, в клинике, амбулаторном отделении больницы или в больнице. Лечение обычно начинается в больнице, так что доктор может наблюдать эффекты терапии непосредственно и производить любые коррекции, которые необходимы. Продолжительность этой комбинированной терапии зависит от типа подлежащего лечению рака, возраста и состояния пациента, стадии и типа заболевания пациента и от того, как организм пациента отвечает на это лечение. Введение лекарственного средства может производиться при различных интервалах (например, один раз в день, один раз в неделю или один раз в месяц) и введение каждого агента может определяться индивидуально. Комбинированная терапия может предоставляться время от времени, в виде циклов, которые включают в себя периоды отдыха, так что организм имеет шанс образовать новые клетки и вновь приобрести его силу.
В зависимости от типа рака и стадии его развития эта комбинированная терапия может быть использована для лечения рака, для замедления распространения рака, для замедления роста рака, для уничтожения или остановки раковых клеток, которые могут распространяться в другие части тела из первоначальной опухоли, для ослабления симптомов, вызываемых раком, или для предотвращения рака в первой фазе. Комбинированная терапия может также помогать людям жить более спокойно посредством элиминации раковых клеток, которые вызывают боль или дискомфорт.
Другие признаки и преимущества данного изобретения будут очевидными из следующего далее подробного описания и из формулы изобретения.
Подробное описание изобретения
Авторы данного изобретения обнаружили, что комбинация антипсихотического лекарственного средства хлорпромазина и лекарственного средства против простейших пентамидина проявляет существенную антипролиферативную активность против раковых клеток. Концентрации, которые проявляют максимальную антипролиферативную активность против раковых клеток, не были токсичными для нормальных клеток. Таким образом, эта лекарственная комбинация применима для лечения рака и других неоплазм.
На основе известных свойств, которые являются общими между хлорпромазином и его аналогами или метаболитами и между пентамидином и его аналогами и метаболитами, является вероятным, что структурно родственные соединения могут заменять хлорпромазин и/или пентамидин в антипролиферативных комбинациях данного изобретения. Информация в отношении каждого из этих лекарственных средств и его аналогов и метаболитов обеспечена ниже.
Фенотиазины
Фенотиазины, которые применимы в антипролиферативной комбинации данного изобретения, являются соединениями, имеющими общую формулу (I):
где R2 выбран из группы, состоящей из:
каждый из R1, R3, R4, R5, R6, R7, R8 и R9 обозначает, независимо, Н, OH, F, OCF3 или ОСН3; и W выбран из группы, состоящей из:
и R10 выбран из группы, состоящей из:
В предпочтительных соединениях R2 обозначает Cl; каждый из R1, R3, R4, R5, R6, R7, R8 и R9 обозначает Н или F. Более предпочтительно каждый из R1, R4, R5, R6 и R9 обозначает Н.
Наиболее часто рекомендуемым членом семейства фенотиазинов является хлорпромазин, который имеет структуру:
Хлорпромазин доступен в настоящее время в следующих формах: таблетках, капсулах, суппозиториях, пероральных концентратах и сиропах и формах для инъекции.
Фенотиазины, считающиеся аналогами хлорпромазина, включают флуфеназин, прохлорперазин, тиоридазин и трифлуоперазин. Многие из них имеют общую с хлорпромазином антипсихотическую или противорвотную активность.
Считается, что фенотиазины индуцируют их антипсихотические и противорвотные действия посредством взаимодействия с центральными допаминергическими путями в мезолимбической и медуллярной областях хеморецепторной триггерной зоны головного мозга. Экстрапирамидальные побочные эффекты являются результатом взаимодействий с допаминергическими путями в базальных ядрах. Несмотря на то, что их часто называют блокаторами допамина, точный механизм допаминергического вмешательства, ответственного за антипсихотическую активность этих лекарственных средств, не был определен. Хлорпромазин имеет сильную альфа-адренергическую блокирующую активность и может вызывать ортостатическую гипотензию. Хлорпромазин имеет также умеренную антихолинергическую активность, проявляющуюся в виде случающихся время от времени сухости во рту, затуманенного зрения, задержки мочи и запора. Хлорпромазин увеличивает секрецию пролактина вследствие его блокирующего рецептор допамина действия в гипофизе и гипоталамусе.
Хлорпромазин легко абсорбируется из желудочно-кишечного тракта. Его биодоступность варьируется в зависимости от значительной метаболизации первого прохождения печенью. Жидкие концентраты могут быть более биодоступными, чем таблетки. Пища, по-видимому, не влияет постоянным образом на биодоступность. Внутримышечное введение (i.m.) позволяет пренебречь большей частью эффекта первого прохождения, и достигаются более высокие концентрации в плазме. Появление действия после внутримышечного введения происходит обычно через 15-30 минут, а после перорального введения - после 30-60 минут. Вводимый ректально хлорпромазин обычно требует больше времени для проявления действия, чем перорально вводимый хлорпромазин.
Метаболиты хлорпромазина
Поскольку хлорпромазин подвергается интенсивному метаболическому превращению в ряд метаболитов, которые могут быть терапевтически активными, эти метаболиты могут заменять хлорпромазин в антипролиферативной комбинации данного изобретения. Метаболизм хлорпромазина дает, например, окислительное N-деметилирование с образованием соответствующего первичного и вторичного амина, ароматическое окисление с образованием фенола, N-окисление с образованием N-оксида, S-окисление с образованием сульфоксида или сульфона, окислительное дезаминирование аминопропильной боковой цепи с образованием ядра фенотиазина и глюкуронидирование фенольных гидроксигрупп и третичной аминогруппы с образованием четвертичного глюкуронида аммония.
В других примерах метаболитов хлорпромазина, применимых в антипролиферативной комбинации данного изобретения, каждое из положений 3, 7 и 8 фенотиазина может быть независимо замещено гидроксильной или метоксильной частью молекулы.
Пентамидин
Пентамидин используется в настоящее время для лечения инфекций Pneumocystis carnii, Leishmania donovani, Trypanosoma brucei, T. gambiense и T. rhodesiense. Структура пентамида является следующей:
Он может быть приготовлен в форме для инъекции или ингаляции. Для инъекции пентамидин упаковывают в виде непирогенного лиофилизированного продукта. После воссоздания его вводят внутримышечной или внутривенной инъекцией.
Пентамидина изетионат является белым кристаллическим порошком, растворимым в воде и глицерине и нерастворимым в эфире, ацетоне и хлороформе. Его химическое название ди(β-гидроксиэтансульфонат) 4,4'-диаминодифеноксипентана. Он имеет молекулярную формулу С23Н36N4O10S2 и молекулярную массу 592,68.
Способ действия пентамида не выяснен полностью. Исследования in vitro с использованием тканей млекопитающих и простейшего Crithidia oncopelti показывают, что это лекарственное средство действует на ядерный метаболизм, ингибируя синтез ДНК, РНК, фосфолипидов и белков.
Мало известно о фармакокинетике этого лекарственного средства. У семи пациентов, принимающих ежедневно в.м. дозы пентамидина 4 мг/кг в течение 10-12 дней, концентрации в плазме были между 0,3 и 0,5 мкг/мл. Пациенты продолжали экскретировать уменьшающиеся количества пентамидина в моче до шести-восьми недель после прекращения введения.
Распределение пентамидина в ткани исследовали на мышах, которым вводили одну внутрибрюшинную инъекцию пентамидина в дозе 10 мг/кг. Концентрация в почках была наивысшей, затем следовала концентрация в печени. У мышей пентамидин экскретировался неизмененным, прежде всего через почки с некоторым выделением в фекалиях. Соотношение количеств, экскретируемых в моче и фекалиях (4:1), было постоянным на протяжении периода исследования.
Аналоги пентамидина
Ароматические диамидиносоединения могут заменять пентамидин в антипролиферативной комбинации данного изобретения. Ароматические диамидиносоединения, такие как пропамидин, бутамидин, гептамидин и нонамидин, имеют общие свойства с пентамидином, состоящие в том, что они проявляют антипатогенные или ДНК-связывающие свойства. Другие аналоги (например, стилбамидин и индольные аналоги стилбамидина, гидроксистилбамидин, диминазен, бензамидин, 4,4'-(пентаметилендиокси)ди-, дигидрохлорид, фенамидин, дибромпропамидин, 1,3-бис(4-амидино-2-метоксифенокси)пропан (DAMP), нетропсин, дистамицин, фенамидин, амикарбалид, блеомицин, актиномицин и даунорубицин) также проявляют свойства, сходные со свойствами пентамидина. Вероятно, эти соединения будут иметь антипролиферативную активность при введении в комбинации с хлорпромазином (или аналогом или метаболитом хлорпромазина).
Предпочтительные аналоги описываются, например, формулой (II).
где каждый из Y и Z обозначает, независимо, О или N; каждый из R11 и R12 обозначает, независимо, Н, ОН, Cl, Br, OCH3, OCF3, NO2 или NH2; n равно целому числу от 2 до 6, включительно; и каждый из R13 и R14 находится, независимо, в мета- или параположении и выбран из группы, состоящей из:
Другие аналоги включают в себя стилбамидин (G-1) и гидроксистилбамидин (G-2) и их индольные аналоги (например, G-3).
Каждая амидиновая часть молекулы может быть заменена одним из радикалов, изображенных в виде D-2, D-3, D-4 или D-5 выше. Как это имеет место для фенотиазинов и пентамидина, соли стилбамидина и его родственных соединений также применимы в способе данного изобретения. Предпочтительные соли включают в себя, например, дигидрохлоридные и метансульфонатные соли.
Метаболиты пентамидина
Метаболиты пентамидина также применимы в антипролиферативной комбинации данного изобретения. Пентамидин быстро метаболизируется в организме до по меньшей мере семи первичных метаболитов. Некоторые из этих метаболитов имеют одну или более активностей, общих с пентамидином. Вероятно, эти соединения будут проявлять антипролиферативную активность при введении в комбинации с хлорпромазином или его аналогом.
Семь метаболитов пентамидина показаны ниже.
Терапия
Комбинации соединений данного изобретения применимы для лечения неоплазм. Комбинированная терапия может проводиться отдельно или вместе с другой терапией (например, хирургией, облучением, химиотерапией, биологической терапией). Кроме того, лицо, имеющее более высокий риск развития неоплазмы (например, лицо, генетически предрасположенное к этому, или лицо, которое имело неоплазму ранее), может получать профилактическое лечение для ингибирования или задержки образования неоплазмы.
Доза введения и частота введения каждого компонента могут контролироваться независимо. Например, одно соединение может вводиться перорально три раза в день, тогда как другое соединение может вводиться внутримышечно один раз в день. Соединения могут быть также приготовлены вместе, так что одно введение доставляет оба компонента. Формы и дозы описаны ниже.
Приготовление фармацевтических композиций
Введение каждого соединения комбинации может выполняться любым подходящим способом, который приводит к концентрации этого соединения, которая, при объединении с другим компонентом, является специфически антинеопластической при достижении участка-мишени. Это соединение может содержаться в любом подходящем количестве в любом подходящем веществе-носителе и обычно присутствует в количестве 1-95% по весу от общего веса композиции. Композиция может быть представлена в дозированной форме, которая пригодна для перорального, парентерального (например, внутривенного, внутримышечного), ректального, кожного, назального, вагинального, использующего ингаляцию, кожного (пластырь) или глазного пути введения. Таким образом, эта композиция может быть, например, в форме таблеток, капсул, пилюль, порошков, гранулятов, суспензий, эмульсий, растворов, гелей, в том числе гидрогелей, паст, мазей, кремов, пластырей, дренирующих салфеток, устройств для доставки, суппозиториев, клизм, инъекционных растворов, имплантатов, спреев или аэрозолей. Фармацевтические композиции могут быть приготовлены в соответствии с общепринятой фармацевтической практикой (см., например, Remington: The Science and Practice of Pharmacy, (19th ed.) ed. A.R.Gennaro, 1995, Mack Publishing Company, Easton, PA. и Encyclopedia of Pharmaceutical Technology, eds. J. Swarbrick and J.C.Boylan, 1988-1999, Marcel Dekker, New York.
Фармацевтические композиции согласно данному изобретению могут быть приготовлены для высвобождения активного соединения по существу сразу же при введении или при любом заранее заданном времени или периоде времени после введения. Последние типы композиций известны обычно как формы регулируемого высвобождения, которые включают: (i) формы, которые создают по существу постоянную концентрацию лекарственного средства в организме на протяжении пролонгированного периода времени; (ii) формы, которые после заданного лаг-периода времени создают по существу постоянную концентрацию лекарственного средства в организме на протяжении пролонгированного периода времени; (iii) формы, которые поддерживают действие лекарственного средства во время заданного периода времени посредством поддержания относительно постоянного, эффективного уровня лекарственного средства в организме с одновременной минимизацией нежелательных побочных эффектов, связанных с колебаниями уровня в плазме активного лекарственного вещества (кинетическая картина "зубцов пилы"); (iv) формы, которые локализуют действие лекарственного средства, например, пространственным помещением композиции регулируемого высвобождения рядом с больными тканью или органом или в них; и (v) формы, которые нацеливают действие лекарственного средства с использованием носителей или химических производных для доставки лекарственного средства в конкретный тип клетка-мишень.
Введение соединений в виде формы регулируемого высвобождения (формы пролонгированного действия) является особенно предпочтительным в случаях, в которых соединение, либо отдельно, либо в комбинации, имеет (i) узкий терапевтический индекс (т.е. разница между концентрацией в плазме, приводящей к вредным побочным эффектам или токсическим реакциям, и концентрацией в плазме, приводящей к терапевтическому эффекту, является маленькой; обычно терапевтический индекс, TI, определяется отношением медианы летальной дозы (LD50) к медиане эффективной дозы (ED50)); (ii) узкое окно абсорбции в желудочно-кишечном тракте; или (iii) очень короткий полупериод существования в организме, так что требуется частое введение доз на протяжении дня для поддержания уровня в плазме на терапевтическом уровне.
Любая из стратегий может быть применима для получения формы регулируемого высвобождения, в которой скорость высвобождения превышает скорость метаболизма рассматриваемого соединения. В одном примере регулируемое высвобождение получают подходящим выбором различных параметров и ингредиентов формы, в том числе, например, различных типов композиций регулируемого высвобождения и покрытий. Таким образом, лекарственное вещество готовят с подходящими наполнителями в виде фармацевтической композиции, которая при введении в организм высвобождает активное вещество регулируемым образом. Примеры включают композиции разовых или многоединичных таблеток или капсул, масляные растворы, суспензии, эмульсии, микрокапсулы, микросферы, наночастицы, пластыри и липосомы.
Твердые дозированные лекарственные формы для перорального применения
Формы для перорального применения включают таблетки, содержащие активный ингредиент (ингредиенты) в смеси с нетоксичными фармацевтически приемлемыми наполнителями. Эти наполнители могут быть, например, инертными разбавителями или наполнителями (такими как, например, сахароза, сорбит, сахар, маннит, микрокристаллическая целлюлоза, крахмалы, в том числе картофельный крахмал, карбонат кальция, хлорид натрия, лактоза, фосфат кальция, сульфат кальция или фосфат натрия); гранулирующими или дезинтегрирующими агентами (такими, как, например, производные целлюлозы, в том числе микрокристаллическая целлюлоза, крахмалы, в том числе картофельный крахмал, натрийкроскармеллоза, альгинаты или альгиновая кислота); связывающими агентами (такими, как, например, сахароза, глюкоза, сорбит, аравийская камедь, альгиновая кислота, альгинат натрия, желатин, крахмал, предварительно желатинированный крахмал, микрокристаллическая целлюлоза, алюмосиликат магния, натрийкарбоксиметилцеллюлоза, метилцеллюлоза, гидроксипропилметилцеллюлоза, этилцеллюлоза, поливинилпирролидон или полиэтиленгликоль); и смазывающими агентами, скользящими агентами и антиадгезивами (такими, как, например, стеарат магния, стеарат цинка, стеариновая кислота, диоксиды кремния, гидрогенизированные растительные масла или тальк). Другими фармацевтически приемлемыми наполнителями могут быть красители, улучшающие вкус и запах агенты, пластификаторы, увлажнители, буферные агенты и т.п.
Таблетки могут не иметь покрытий, или они могут быть покрыты с использованием известных способов, необязательно для задержки дезинтеграции и абсорбции в желудочно-кишечном тракте и для обеспечения тем самым пролонгированного действия на протяжении длительного периода времени. Покрытие может быть приспособлено для высвобождения активного лекарственного вещества заданным образом (например, для достижения регулируемого высвобождения лекарственной формы), или оно может быть приспособлено для задержки высвобождения до того момента, когда активное лекарственное вещество пройдет через желудок (энтеросолюбильное покрытие). Покрытием может быть сахарное покрытие, пленочное покрытие (например, на основе гидроксипропилметилцеллюлозы, метилцеллюлозы, метилгидроксиэтилцеллюлозы, гидроксипропилцеллюлозы, карбоксиметилцеллюлозы, акрилатных сополимеров, полиэтиленгликолей и/или поливинилпирролидона), или энтеросолюбильное покрытие (например, на основе сополимера метакриловой кислоты, ацетата-фталата целлюлозы, фталата гидроксипропилметилцеллюлозы, ацетата-сукцината гидроксипропилметилцеллюлозы, фталата поливинилацетата, шеллака и/или этилцеллюлозы). Кроме того, может быть использован такой материал для задержки высвобождения, как глицерилмоностеарат или глицерилдистеарат.
Композиции твердых таблеток могут включать покрытие, адаптированное для защиты композиции от нежелательных химических изменений (например, химической деградации до высвобождения активного лекарственного вещества). Это покрытие может наноситься на твердую дозированную лекарственную форму так, как описано в Encyclopedia of Pharmaceutical Technology, supra.
Два лекарственных средства могут быть смешаны друг с другом в таблетке, или они могут быть разделены. В одном примере первое лекарственное средство содержится внутри таблетки, а второе лекарственное средство находится снаружи, так что существенная часть второго лекарственного средства высвобождается до высвобождения первого лекарственного средства.
Формы для перорального применения могут быть представлены в виде жевательных таблеток или в виде твердых желатиновых капсул, где активный ингредиент смешан с инертным твердым разбавителем (таким как, например, картофельный крахмал, лактоза, микрокристаллическая целлюлоза, карбонат кальция, фосфат кальция или каолин) или в виде мягких желатиновых капсул, где активный ингредиент смешан с водой или масляной средой, например арахисовым маслом, жидким парафином или оливковым маслом. Порошки или грануляты могут быть приготовлены с использованием вышеупомянутых ингредиентов для таблеток и капсул общепринятым образом, например, с использованием смесителя, аппарата с псевдоожиженным слоем или распылительного оборудования для сушки.
Пероральные дозированные лекарственные формы для регулируемого высвобождения
Композиции регулируемого высвобождения для перорального применения могут быть, например, сконструированы для высвобождения активного лекарственного вещества регуляцией растворения и/или диффузии активного лекарственного вещества.
Высвобождение с регулируемыми растворением или диффузией может быть достигнуто подходящим покрытием формы таблетки, капсулы, порошка или гранулята соединений или включением рассматриваемого соединения в подходящую матрицу (основу).
Покрытие для регулируемого высвобождения может включать одно или несколько веществ для покрытия, упомянутых выше, и/или шеллак, пчелиный воск, гликовоск, касторовый воск, карнаубский воск, стеариловый спирт, глицерилмоностеарат, глицерилдистеарат, глицеролпальмитостеарат, этилцеллюлозу, акриловые смолы, dl-полимолочную кислоту, ацетат-бутират целлюлозы, поливинилхлорид, поливинилацетат, винилпирролидон, полиэтилен, полиметакрилат, метилметакрилат, 2-гидроксиметакрилат, метакрилатные гидрогели, 1,3-бутиленгликоль, метакрилат этиленгликоля и/или полиэтиленгликоли. В форме с основой для регулируемого высвобождения материал основы может также включать гидратированную метилцеллюлозу, карнаубский воск и стеариловый спирт, карбопол 934, силикон, глицерилтристеарат, метилакрилат-метилметакрилат, поливинилхлорид, полиэтилен и/или галогенированный фторуглерод.
Композиция регулируемого высвобождения, содержащая одно или несколько соединений заявляемых комбинаций, может быть также в форме плавучей таблетки или капсулы (т.е. таблетки или капсулы, которая при пероральном введении плавает на поверхности содержимого желудка в течение определенного периода времени. Форма плавучей таблетки данного соединения (соединений) может быть приготовлена гранулированием смеси лекарственного средства (лекарственных средств) с наполнителями и 20-75% (масса/масса) гидроколлоидов, таких как гидроксиэтилцеллюлоза, гидроксипропилцеллюлоза и гидроксипропилметилцеллюлоза. Полученные гранулы могут быть затем спрессованы в таблетки. При контакте с желудочным соком эта таблетка образует по существу водонепроницаемый гелевый барьер вокруг ее поверхности. Этот гелевый барьер принимает участие в поддержании плотности менее 1, позволяя таблетке таким образом оставаться плавучей в желудочном соке.
Жидкости для перорального введения
Порошки, диспергируемые порошки или гранулы, пригодные для приготовления водной суспензии добавлением воды, являются удобными дозированными лекарственными формами для перорального введения. Форма в виде суспензии обеспечивает активный ингредиент в смеси с диспергирующим или увлажняющим агентом, суспендирующим агентом и одним или несколькими консервантами. Подходящими диспергирующими или увлажняющими агентами являются, например, природно встречающиеся фосфатиды (например, лецитин или продукты конденсации этиленоксида с жирной кислотой, длинноцепочечным алифатическим спиртом или неполным эфиром, полученным из жирных кислот) и гексит или ангидрид гексита (например, полиоксиэтиленстеарат, полиоксиэтиленсорбитмоноолеат, полиоксиэтиленсорбитанмоноолеат и т.п.). Подходящими суспендирующими агентами являются, например, натрий-карбоксиметилцеллюлоза, метилцеллюлоза, альгинат натрия и т.п.
Парентеральные композиции
Фармацевтическая композиция может также вводиться парентерально инъекцией, инфузией или имплантацией (внутривенно, внутримышечно, подкожно или т.п.) в виде дозированных лекарственных форм, композиций или посредством подходящих устройств доставки или имплантатов, содержащих традиционные нетоксичные фармацевтически приемлемые носители и адъюванты. Приготовление и получение препаратов таких композиций хорошо известно специалистам в области приготовления фармацевтических препаратов. Конкретные готовые формы могут быть найдены в Remington: The Science and Practice of Pharmacy, supra.
Композиции для парентерального применения могут быть представлены в унифицированных дозированных формах (например, в виде однодозовых ампул) или во флаконах, содержащих несколько доз, в которые может быть добавлен консервант (см. ниже). Композиция может быть в форме раствора, суспензии, эмульсии, инфузионного устройства или устройства доставки для имплантации или она может быть представлена в виде сухого порошка, который может быть воссоздан