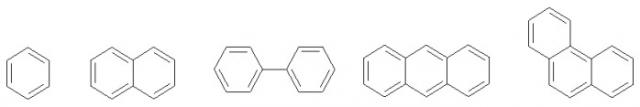
Способ получения l-аминокислот
Иллюстрации
Показать всеИзобретение относится к биотехнологии. Способ получения L-аминокислоты включает воздействие фенилаланиновой аммиак-лиазы, происходящей из растения, в присутствии аммиака, на производное акриловой кислоты, которое содержит ароматическое кольцо, которое содержит различные заместители и включает гетероатом, причем L-аминокислота представляет собой ароматическую L-аминокислоту. Заявленное изобретение позволяет получать ароматические L-аминокислоты с высокой степенью эффективности. 29 з.п. ф-лы, 6 табл., 3 ил.
Реферат
Перекрестные ссылки на другие заявки
Настоящая заявка подана в соответствии с 35 U.S.С.§111 (а) и имеет приоритет согласно 35 U.S.С.§119(е) (1) по датам подачи предварительных заявок 60/303,086 от 6 июля 2001 и 60/339,389 от 14 декабря 2001, согласно 35 U.S.С.§111 (b).
УРОВЕНЬ ТЕХНИКИ
Настоящее изобретение относится к способу получения оптически активных аминокислот, включающему присоединение аммиака к производному акриловой кислоты под действием растительного фермента с образованием соответствующей оптически активной аминокислоты. Оптически активные аминокислоты используются в качестве исходных веществ для получения лекарственных средств, агрохимикатов и других продуктов тонкого органического синтеза.
Было исследовано большое число способов получения оптически активных аминокислот, таких как методы органического синтеза с использованием асимметрических катализаторов и методы ферментативного производства с использованием специфических микроорганизмов.
Существует множество публикаций, таких как патент UK №1489468 и выложенный патент Японии №53-96388 (1978), в которых сообщается о способе получения оптически активного фенилаланина путем оптической селекции, в котором коричную кислоту подвергают воздействию фенилаланиновой аммиак-лиазы, выделенной из микроорганизма, или самого микроорганизма, обладающего ферментативной активностью. В данном способе используется реакция присоединения аминогруппы к α-углероду коричной кислоты под действием фермента при высокой концентрации аммиака, что позволяет получить L-фенилаланин с высокой степенью оптической чистоты.
В качестве способа получения оптически активного производного L-фенилаланина, содержащего заместитель в составе своей фенильной группы, можно рассматривать способы введения заместителя в фенильную группу с использованием разнообразных видов реакций модификации L-фенилаланина. Однако при использовании этих способов неизбежно уменьшение выхода из-за протекания побочных реакций в других частях молекулы помимо фенильной группы и снижение оптической чистоты вследствие рацемизации, происходящей под действием чрезвычайно жестких условий реакции. Кроме того, сложно обеспечить специфичность введения заместителя в определенное положение фенильной группы, что приводит к низким выходам или затрудняет выделение и очистку продукта. Таким образом, данный способ не подходит для практического применения.
В данной заявке рассматривается другой способ, в котором производное коричной кислоты, содержащее замещенную фенильную группу, в которую был предварительно введен требуемый заместитель, подвергают воздействию описанной выше фенилаланиновой аммиак-лиазы. Поскольку в данном способе ферментативная реакция протекает в мягких условиях, он обеспечивает отсутствие нежелательных эффектов, обусловленных побочными реакциями с участием фенильной группы и заместителей в ее составе, и поэтому следует ожидать, что данным способом можно получить оптически активное производное L-фенилаланина с высокой степенью чистоты.
Однако, поскольку субстратная специфичность фенилаланиновой аммиак-лиазы, выделенной из микроорганизма, как правило, является очень строгой, в большинстве случаев реакционная способность этого фермента по отношению к замещенной фенильной группе значительно снижена по сравнению с исходной реакционной способностью преобразования коричной кислоты в L-фенилаланин, или практически отсутствует. Описано лишь небольшое число подобных методов, таких как способ получения оптически активного фторированного фенилаланина под действием вышеназванного фермента с использованием в качестве исходного вещества производного коричной кислоты, содержащего фторированную фенильную группу (выложенный патент Японии №63-148992 (1988)), или способ получения производного фенилаланина с использованием специфичного микроорганизма Rhodotorula (патент US 5981239). В этих способах ограничено число используемых соединений и их производительность не подходит для промышленного производства.
В целом известно, что фенилаланиновые аммиак-лиазы широко распространены в живой природе, в том числе в животных, растениях и микроорганизмах. Следует отметить, что примеры микроорганизмов, содержащих данный фермент, включают Rhodotorula rubra (выложенный патент Японии №61-043993 (1986), GB 1489468), Rhodosporidium toruloides (выложенный патент Японии №60-227670 (1985)), Cladosporidium cladosporioides (выложенный патент Японии №62-111687 (1987)) и т.д., и помимо этих примеров сообщалось также о многих других микроорганизмах.
Примеры растений, содержащих фенилаланиновую аммиак-лиазу, включают кресс-салат (Arabidopsis thaliana), чай [Camellia sinensis), нут (Cicer arietinum), лимон (Citrus limonis}, огурец (Cucumis sativus L.), морковь (Daucus carota), мурасаки (Lithospermum erythrorhizon), томат (Lycopersicon esculentum), табак (Nicotiana tabacum), рис (Oryza sativa), петрушку (Petrosellnum crispum, Petroselinum hortense), корабельную сосну (Pinus taeda), тополь (Populus kitakamlensis и т.д.}, вишню {Prunus avium), ежевику (Rubus idaeus), баклажан {Solanum tuberosum), стило {Stylosanthes humills), луговой клевер (Trifolium subterrane), виноград (Vitis vinifera), кустовую фасоль (Phaseolus vulqaris) и т.д.
Было много сообщений, касающихся структурного гена фенилаланиновой аммиак-лиазы, происходящей из растения, - pal (здесь и далее обозначаемого как "pal ген"). Так, примеры обнаруженных pal генов включают гены риса (Oryza sativa, Biochim. Biophys. Acta (1993), 1171(3), 321-322, Plant Mol. Biol. (1995), 29(3), 535-550), чая {Camellia sinensis, Theor. Appl. Genet. (1994), 89(6), 671-675), кресс-салата (Arabidopsis thaliana, Plant Mol. Biol. (1995), 27, 327-338), мурасаки (Lithospermum erythrorhizon, Biosci. Biotech. Biochem. (1997), 61(12), 1995-2003), томата (Lycopersicon esculentum, J. Biol. Chem. (1992), 267, 11824-11830), лугового клевера (Trifolium subterraneum, Gene (1994), 138(1-2), 87-92), гороха (Pisum sativum, Plant Mol. Biol. (1992), 20(1), 167-170, выложенная патентная заявка Японии (Kokai) №5-153978 (1993)), тополя (Populus trichocarpa, Plant Physiol. (1993), 102, 71-83), табака (Nicotiana tabacum, Plant Mol. Biol. (1996), 30, 711-722), сои (Glycinemax, DNASequence (1991), 1(5), 335-346), сладкого картофеля (Ipomoea batatas, Plant Physiol. (1989), 90(4), 1403-1407), пшеницы (Triticum aestivum), петрушки (Petroselinum crispurn), подсолнечника (Helianthus annuus), люцерны (Medicago saliva) и т.д., и число известных pal генов достигает более 40 видов, включая изомеры одного вида или частичные последовательности.
Фенилаланиновые аммиак-лиазы, происходящие из растений, имеют много взаимно консервативных последовательностей; их аминокислотные последовательности являются гомологичными по меньшей мере на 50% или более. Следовательно, можно предположить наличие большого сходства их функций и свойств.
Известно, что фенилаланиновая аммиак-лиаза, происходящая из растения, является первичным ферментом в пути синтеза фенилпропаноидов и изофлавоноидов в процессе вторичного метаболизма растения, а также ферментом, катализирующим реакцию на скорость определяющей стадии, т.е. реакцию дезаминирования фенилаланина. Поскольку считается, что этот фермент и его ген связаны с устойчивостью растений к стрессу, функции этого фермента были подробно изучены. Кроме этого, широко проводились как фундаментальные, так и прикладные исследования в области экспрессии pal гена в органах растений с целью обеспечения устойчивости растений к заболеваниям.
Несмотря на наличие множества исследовательских работ, указанных выше, что касается изучения данного фермента с точки зрения получения веществ, в отличие от таких же ферментов, выделенных из микроорганизмов, то попытки получать органические соединения, которые можно использовать как обычное промышленное сырье, не предпринимались, за исключением попытки увеличения содержания некоторых полезных веществ из ряда фенилпропаноидов или изофлавоноидов (Planta. (1979), 14(6), 369-376, Biochlm. Biophys. Ada. (1979), 563, 278-292). Излишне упоминать о том, что никогда не появлялись сообщения о попытках получения веществ с использованием обратной реакции, т.е. реакции аминирования. Прежде всего, не только данный фермент, но и другие ферменты, происходящие из растений, редко использовали для получения веществ, поскольку существует общепринятое мнение о том, что практическая применимость этих ферментов с точки зрения низкой стабильности, высокой субстратной специфичности и т.д. хуже, чем у ферментов, выделенных из микроорганизмов. Таким образом, если бы специалист в данной области стал разрабатывать способ получения производного L-фенилаланина, одного из органических соединений, аналогичных соединениям по настоящему изобретению, то наименее вероятно, что он стал бы использовать фермент, происходящий из растения, при условии, что существует фермент из других источников, обладающий такой же каталитической функцией.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Одной из целей настоящего изобретения является предложение нового удобного и эффективного способа получения L-аминокислоты с высокой степенью оптической чистоты. Более конкретно, одной из целей настоящего изобретения является предложение нового простого и эффективного способа получения L-аминокислоты с высокой степенью оптической чистоты с использованием в качестве исходного вещества производного акриловой кислоты, такого как производное коричной кислоты, содержащее заместитель в составе фенильной группы.
Авторы настоящего изобретения сконцентрировали свое внимание на широкой субстратной специфичности фенилаланиновой аммиак-лиазы, происходящей из растения, и исследовали активность данного фермента в отношении образования разнообразных аминокислот, которые используются в промышленности.
Сначала был проведен поиск аммиак-лиазы, обладающей высокой реакционной способностью по отношению к производному коричной кислоты, содержащему заместитель в составе фенильной группы, среди живой природы в целом, т.е. среди животных, растений и микроорганизмов.
В результате авторы настоящего изобретения обнаружили, что фенилаланиновые аммиак-лиазы, происходящие из растений, обладают намного более высокой активностью по образованию производных фенилаланина, чем такие же ферменты, выделенные из микроорганизмов, которые были известны ранее. Как указано выше, стадия образования фенилпропаноидов, изофлавоноидов или им подобных веществ в органах растений, в которой участвуют эти ферменты, была подробно исследована, но эти исследования касались образования производного коричной кислоты за счет реакции элиминирования, в процессе которой от фенилаланина отщепляется аминогруппа. Обратная реакция, т.е. возможность образования производного фенилаланина за счет присоединения аминогруппы к производному коричной кислоты под действием ферментов, происходящих из растений, не была изучена.
Кроме этого, авторы настоящего изобретения сконцентрировали свое внимание на широкой субстратной специфичности фенилаланиновой аммиак-лиазы, происходящей из растения, и исследовали активность данного фермента в отношении образования разнообразных видов использующихся в промышленности аминокислот, а также производных фенилаланина. В результате авторы настоящего изобретения обнаружили, что под действием данного фермента, использующего в качестве субстрата производное акриловой кислоты, структура которого включает ароматическое кольцо, которое может содержать заместители и включать гетероатом, образуется соответствующая L-аминокислота.
В результате дальнейших интенсивных исследований авторы настоящего изобретения обнаружили, что аминокислоту можно получать с чрезвычайно высокой эффективностью при использовании микроорганизма, проявляющего повышенную экспрессию pal гена, происходящего из растения, осуществив таким образом настоящее изобретение.
Способность фенилаланиновой аммиак-лиазы, происходящей из растения, катализировать реакцию, которая приводит к получению аминокислоты, с использованием в качестве субстрата производного акриловой кислоты, имеющего структуру, соответствующую приведенной выше общей формуле (1), не была известна ранее и является открытием авторов настоящего изобретения.
Кроме этого, способность фенилаланиновой аммиак-лиазы, происходящей из растения, катализировать реакцию, которая приводит к получению производного фенилаланина, с использованием в качестве субстрата производного коричной кислоты, содержащего различные заместители в составе фенильной группы, представленного приведенной выше общей формулой (3), также не была известна ранее и является открытием авторов настоящего изобретения.
Более того, способность фенилаланиновой аммиак-лиазы, происходящей из растения, катализировать реакцию, которая приводит к получению L-аминокислоты, с использованием в качестве субстрата производного акриловой кислоты, содержащего гетероциклический заместитель, представленного приведенной выше общей формулой (4) или (5), также не была известна ранее и является открытием авторов настоящего изобретения.
Следует отметить, что настоящее изобретение включает следующие аспекты [1]-[30]:
[1] Способ получения L-аминокислоты, который включает воздействие фенилаланиновой аммиак-лиазы, происходящей из растения, в присутствии аммиака на производное акриловой кислоты, представленное следующей общей формулой (1):
где
Z представляет собой ароматическое кольцо, которое может содержать гетероатом,
R представляет собой заместитель в составе указанного ароматического кольца, и
n представляет собой целое число, равное 0 или более, и если n равно 2 или более, все R могут быть одинаковыми или различными;
причем L-аминокислота представлена следующей общей формулой (2):
где
Z представляет собой ароматическое кольцо, которое может содержать гетероатом,
R представляет собой заместитель в составе указанного ароматического кольца,
n представляет собой целое число, равное 0 или более, и если n равно 2 или более, все R могут быть одинаковыми или различными.
[2] Способ получения L-аминокислоты согласно пункту
[1] выше, где Rn-Z- представлено следующей общей формулой (3):
где
R является заместителем в составе бензольного кольца и представляет собой цианогруппу, гидроксильную группу, карбоксильную группу, амидную группу, атом фтора, атом хлора, атом брома, аминогруппу, нитрогруппу, гидроксиметильную группу или алкильную или алкоксигруппу, содержащую от 1 до 6 атомов углерода, и
n представляет собой целое число, равное от 0 до 5, и, предпочтительно, целое число, равное от 1 до 5. Если n равно 2 или более, все R могут быть одинаковыми или различными.
[3] Способ получения L-аминокислоты согласно пункту [1] выше, где Rn-Z- представлено следующей общей формулой (4):
где
Х представляет собой S, О, NH или NR1,
R1 представляет собой алкильную группу, содержащую от 1 до 6 атомов углерода,
R является заместителем в составе гетероциклического кольца и представляет собой цианогруппу, гидроксильную группу, карбоксильную группу, амидную группу, атом фтора, атом хлора, атом брома, аминогруппу, нитрогруппу, гидроксиметильную группу или алкильную или алкоксигруппу, содержащую от 1 до 6 атомов углерода, и
n представляет собой целое число, равное от 0 до 3, и если n равно 2 или более, все R могут быть одинаковыми или различными.
[4] Способ получения L-аминокислоты согласно пункту [1] выше, где Rn-Z- представлено следующей общей формулой (5):
где
Х представляет собой S, О, NH или NR1,
R1 представляет собой алкильную группу, содержащую от 1 до 6 атомов углерода,
R является заместителем в составе гетероциклического кольца и представляет собой цианогруппу, гидроксильную группу, карбоксильную группу, амидную группу, атом фтора, атом хлора, атом брома, аминогруппу, нитрогруппу, гидроксиметильную группу или алкильную или алкоксигруппу, содержащую от 1 до 6 атомов углерода, и
n представляет собой целое число, равное от 0 до 3, и если n равно 2 или более, все R могут быть одинаковыми или различными.
[5] Способ получения L-аминокислоты согласно любому из пунктов [1]-[4] выше, включающий использование композиции, полученной путем обработки тканей растения, содержащих фенилаланиновую аммиак-лиазу.
[6] Способ получения L-аминокислоты согласно любому из пунктов [1]-[4] выше, включающий использование культуры клеток растения, содержащих фенилаланиновую аммиак-лиазу, и/или композиции, полученной путем ее обработки.
[7] Способ получения L-аминокислоты согласно любому из пунктов [1]-[4] выше, включающий обеспечение экспрессии в растении гена фенилаланиновой аммиак-лиазы, происходящего из растения, и использование трансформированных культур растения или продукта обработки культур растения.
[8] Способ получения L-аминокислоты согласно любому из пунктов [1]-[4] выше, включающий обеспечение экспрессии в микроорганизме гена фенилаланиновой аммиак-лиазы, происходящего из растения, и использование трансформированной культуры микроорганизма, продукта ее обработки, или фермента, полученного из этой культуры.
[9] Способ получения L-аминокислоты согласно пункту [7] или [8] выше, где ген фенилаланиновой аммиак-лиазы, происходящий из растения, представляет собой ген, кодирующий аминокислотную последовательность, имеющую 70% или более гомологии с аминокислотной последовательностью, выведенной из нуклеотидной последовательности ра12 гена, выделенного из Lithospermum erythrorhizon.
[10] Способ получения L-аминокислоты согласно пункту [7] или [8] выше, где ген фенилаланиновой аммиак-лиазы, происходящий из растения, представляет собой ген, кодирующий аминокислотную последовательность, имеющую 80% или более гомологии с аминокислотной последовательностью, выведенной из нуклеотидной последовательности раl2 гена, происходящего из Lithospermum erythrorhizon.
[11] Способ получения L-аминокислоты согласно любому из пунктов [1]-[8] выше, где растение, из которого происходит ген фенилаланиновой аммиак-лиазы, представляет собой Lithospermum и/или Camellia.
[12] Способ получения L-аминокислоты согласно любому из пунктов [8]-[11] выше, где микроорганизмом является бактерия, дрожжи и/или нитевидный грибок.
[13] Способ получения L-аминокислоты согласно пункту [12] выше, где бактерией является Escherichia coli.
[14] Способ получения L-аминокислоты согласно любому из пунктов [2] и [5]-[13] выше, где в приведенной выше общей формуле (3) по меньшей мере один из заместителей R представляет собой гидроксильную группу.
[15] Способ получения L-аминокислоты согласно любому из пунктов [2] и [5]-[13] выше, где в приведенной выше общей формуле (3) по меньшей мере один из заместителей R представляет собой цианогруппу.
[16] Способ получения L-аминокислоты согласно любому из пунктов [2] и [5]-[13] выше, где в приведенной выше общей формуле (3) по меньшей мере один из заместителей R представляет собой карбоксильную группу.
[17] Способ получения L-аминокислоты согласно любому из пунктов [2] и [5]-[13] выше, где в приведенной выше общей формуле (3) по меньшей мере один из заместителей R представляет собой амидную группу.
[18] Способ получения L-аминокислоты согласно любому из пунктов [2] и [5]-[13] выше, где в приведенной выше общей формуле (3) по меньшей мере один из заместителей R представляет собой галоген.
[19] Способ получения L-аминокислоты согласно любому из пунктов [2] и [5]-[13] выше, где в приведенной выше общей формуле (3) по меньшей мере один из заместителей R представляет собой аминогруппу.
[20] Способ получения L-аминокислоты согласно любому из пунктов [2] и [5]-[13] выше, где в приведенной выше общей формуле (3) по меньшей мере один из заместителей R представляет собой нитрогруппу.
[21] Способ получения L-аминокислоты согласно любому из пунктов [2] и [5]-[13] выше, где в приведенной выше общей формуле (3) по меньшей мере один из заместителей R представляет собой гидроксиметильную группу.
[22] Способ получения L-аминокислоты согласно любому из пунктов [2] и [5]-[13] выше, где в приведенной выше общей формуле (3) по меньшей мере один из заместителей R представляет собой алкильную группу, содержащую от 1 до 6 атомов углерода.
[23] Способ получения L-аминокислоты согласно любому из пунктов [1]-[13] выше, где R является одной из цианогруппы, гидроксильной группы, нитрогруппы и карбоксильной группы, и n равно 1.
[24] Способ получения L-аминокислоты согласно любому из пунктов [2] и [5]-[13] выше, где L-аминокислота представляет собой L-фенилаланин.
[25] Способ получения L-аминокислоты согласно любому из пунктов [3] и [5]-[13] выше, где в приведенной выше общей формуле (4) Х представляет собой О.
[26] Способ получения L-аминокислоты согласно любому из пунктов [3] и [5]-[13] выше, где в приведенной выше общей формуле (4) Х представляет собой S.
[27] Способ получения L-аминокислоты согласно любому из пунктов [3] и [5]-[13] выше, где в приведенной выше общей формуле (4) Х представляет собой NH.
[28] Способ получения L-аминокислоты согласно любому из пунктов [4]-[13] выше, где в приведенной выше общей формуле (5) Х представляет собой О.
[29] Способ получения L-аминокислоты согласно любому из пунктов [4]-[13] выше, где в приведенной выше общей формуле (5) Х представляет собой S.
[30] Способ получения L-аминокислоты согласно любому из пунктов [4]-[13] выше, где в приведенной выше общей формуле (5) Х представляет собой NH.
КРАТКОЕ ОПИСАНИЕ РИСУНКОВ
На ФИГ.1 показана конструкция экспрессионной плазмиды PAL Lithospermum erythrorhizon с изображением LePAL1 и LePAL2.
На ФИГ.2 показана конструкция экспрессионной плазмиды PAL Camellia sinensis с изображением CAMPAL.
На ФИГ.3 показан пример гомологии аминокислотных последовательностей PAL.
ПОДРОБНОЕ ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНЫХ ВОПЛОЩЕНИЙ
Настоящее изобретение будет далее описано подробно.
При помощи способа получения L-аминокислоты по настоящему изобретению можно просто получить оптически активную аминокислоту из производного акриловой кислоты, которое может содержать ароматическое кольцо, которое может содержать различные заместители и включать гетероатом, путем одностадийной ферментативной реакции.
Кроме этого, при помощи способа получения L-аминокислоты по настоящему изобретению можно просто получить оптически активную аминокислоту из производного акриловой кислоты, которое содержит бензольное кольцо, содержащее различные заместители, путем одностадийной ферментативной реакции.
Заблаговременно введенный в бензольное кольцо заместитель, например, цианогруппа, гидроксильная группа, карбоксильная группа, амидная группа, атом галогена, аминогруппа, нитрогруппа, гидроксиметильная группа или алкильная группа, содержащая от 1 до 6 атомов углерода, сохраняется до завершения реакции, не подвергаясь неблагоприятному воздействию в мягких условиях реакции, и соответствующее целевое производное L-фенилаланина может быть получено с хорошим выходом при степени превращения почти 100%.
Более того, при помощи способа получения L-аминокислоты по настоящему изобретению можно просто получить оптически активную аминокислоту, содержащую гетероциклическое кольцо в структуре боковой цепи, из производного акриловой кислоты, содержащего гетероциклическое кольцо в структуре боковой цепи, путем одностадийной ферментативной реакции.
Структура гетероциклического кольца, такого как фурильная группа, тиенильная группа, пиррольная группа или им подобные, в указанном выше производном акриловой кислоты сохраняется до завершения реакции, не подвергаясь неблагоприятному воздействию в мягких условиях реакции, и соответствующая целевая L-аминокислота может быть получена с хорошим выходом при степени превращения почти 100%.
Производное акриловой кислоты, содержащее различные заместители, используемое как исходное вещество для реакции по настоящему изобретению, можно легко получить способом, включающим так называемую реакцию Перкина, при которой альдегидную группу альдегидного производного, в которое вводят определенный заместитель, подвергают взаимодействию с уксусным ангидридом (см. Arch. Pharm. (Weinheim) (1994), 327 (10), 619-625 и т.д.); способом, включающим реакцию малоновой кислоты в присутствии пиперидина в пиридине в качестве растворителя (см. J. Chem. Soc. (1939), 357-360 и т.д.); и различных других усовершенствованных способов (см. Synth. Common. (1999), 29(4), 573-581 и т.д.).
Растения, обладающие активностью фенилаланиновой аммиак-лиазы, которые используются в настоящем изобретении, не ограничиваются каким-либо образом. Как упоминалось выше, конкретные примеры включают кресс-салат (Arabidopsis thaliana), чай (Camellia sinensis), нут (Cicer arietinum), лимон (Citrus limonis), огурец (Cucumis sativus L.), морковь (Daucus carota), мурасаки (Lithospermum erythrorhizon), томат (Lycopersicon esculentum), табак (Nicotiana tabacum), рис (Oryza sativa), петрушку (Petroselinum crispum, Petroselinum hortense), корабельную сосну (Pinus taeda], тополь (Populus kitakamiensis и т.д.), вишню (Prunus avium), ежевику (Rubus idaeus), баклажан (Solarium tuberosum), стило (Stylosanthes humilis), луговой клевер (Trifolium subterrane), виноград (Vitis vinifera), кустовую фасоль (Phaseolus vulgaris) и т.д., но данный фермент присутствует почти во всех растениях.
В одном воплощении настоящего изобретения используют фенилаланиновую аммиак-лиазу, происходящую из растения. Имеется ввиду, что в качестве катализатора реакции используют указанный выше фермент, который извлекают и очищают при помощи известных общепринятых способов извлечения ферментов из растений и их очистки, например, осаждения ацетоном, осаждения сульфатом аммония, различных разделительных колонок и т.д., используя экстракты тканей грунтовых растений. Что касается конкретных способов извлечения и очистки фенилаланиновой аммиак-лиазы из различных видов тканей растений, то можно сослаться на известные статьи J. Koukol et al. (J. Biol. Chem. (1961), 236(10), 2692-2698) и E.A.Havir et al. (Biochemistry (1973), 12, 1583-) и т.д.
В другом воплощении настоящего изобретения в реакции используют продукт обработки описанных выше тканей растения. Примеры продуктов обработки тканей растения, которые используют в реакции, включают продукт измельчения, продукт лиофилизации или экстракт тканей растения; продукт, полученный путем концентрации и экстракции ингредиента, катализирующего целевую реакцию, из экстракта; продукт, полученный путем иммобилизации продукта обработки, экстракта или экстрагированного ингредиента тканей растения на трудно растворимом носителе; и т.д.
Примеры подобных носителей для иммобилизации включают полиакриловую кислоту, полиметакриловую кислоту, полиакриламид, поливиниловый спирт, поли-N-винилформамид, полиаллиламин, полиэтиленимин, метилцеллюлозу, глюкоманнан, альгинат, каррагинан и (поперечно-сшитые) сополимеры этих соединений. Другими словами, можно отдельно или в форме смеси использовать соединение, из которого образуется не растворимое в воде твердое вещество, содержащее ингредиент экстракта растения.
В другом воплощении настоящего изобретения используют культуру клеток описанного выше растения. То есть клетки растений культивируют при помощи обычных способов получения культур клеток растений. Например, клетки растения культивируют в различных известных средах для культур клеток растений, таких как среда полного состава Murashige & Skoog, среда LS, среда М9 и среда Gamborg В-5, которые выбирают в зависимости от вида растения, в присутствии растительных гормонов, таких как индолуксусная кислота или кинетин, и затем полученную культуру клеток вводят в реакцию. В настоящее время также можно использовать среду и условия культивирования, которые были усовершенствованы с целью повышения активности фенилаланиновой аммиак-лиазы.
Например, известен ряд статей, таких как статья Yazaki et al., посвященных условиям культивирования и получения культур клеток, в которых индуцирована ферментативная активность Lithospermum erythrorhizon (Biosci. Biotech. Biochem. (1997), 61(12), 1995-2003); статья Klaus et al., в которой раскрывается взаимосвязь между описанной выше ферментативной активностью и условиями культивирования клеток Petroselinum hortense (Archiv. Biochem. Biophis. (1975), 66, 54-62); и т.д. Кроме этого, продукт измельчения, продукт лиофилизации или экстракт полученной таким образом культуры клеток растения; продукт, полученный путем концентрации и экстракции ингредиента, катализирующего целевую реакцию, из экстракта; продукт, полученный путем иммобилизации экстракта или экстрагированного ингредиента культуры клеток растения на трудно растворимом носителе и т.д., можно также вводить в реакцию.
В другом воплощении настоящего изобретения, pal ген, происходящий из растения, вводят в микроорганизм или растение таким образом, чтобы обеспечить его экспрессию, а также используют полученный трансформированный микроорганизм или трансформированное растение. Выбор организма-хозяина, используемого для экспрессии гена, не ограничивается особым образом, а лишь в такой степени, чтобы о выбранном организме было известно, что он способен к принятию и экспрессии чужеродного гена. Примеры таких организмов включают; бактерии, такие как Escherichia, Pseudomonas или Bacillus, дрожжи, такие как Saccharomyces или Schizosaccharomyces, и нитевидные грибы, такие как Aspergillus.
Используемый в настоящем изобретении pal ген может являться не только природным pal геном, присутствующим в окружающей среде, это также могут быть гены, имеющие аналогичные функции (кодирующие мутантные ферменты с такой же активностью). Примеры таких генов включают ра12 ген, выделенный из Lithospermum erythrorhizon (Database Accession No. D83076); pal ген, кодирующий аминокислотную последовательность, имеющую 70% или более гомологии с аминокислотной последовательностью, выведенной из нуклеотидной последовательности ра12 гена, происходящего из Lithospermum erythrorhizon; или, предпочтительно, pal ген, кодирующий аминокислотную последовательность, имеющую 80% или более гомологии с аминокислотной последовательностью, выведенной из нуклеотидной последовательности ра12 гена, происходящего из Lithospermum erythrorhizon. Как указано выше, фенилаланиновые аммиак-лиазы, происходящие из растений, имеют между собой много общих функций и свойств, таких как достаточно высокая степень гомологии последовательностей pal генов растений и их идентичные функции в тканях растения, и, таким образом, в настоящем способе получения от них можно ожидать получения эквивалентного эффекта.
Что касается способа выделения кДНК гена фермента из растения и получения трансформированного микроорганизма с использованием этого гена или способа отделения и сбора фермента из трансформированного микроорганизма, то на этот счет известно много сообщений, таких как статья Yazaki et al. относительно использования Lithospermum erythrorhizon (Biosci. Biotech. Biochem. (1997), 61(12), 1995-2003), статья W. Schuiz et al. относительно использования Petroselinum crispum (FEBS Letter (1989), 258(2), 335-338) и т.д.
Далее следует конкретное описание способа получения pal гена, способа получения экспрессирующих плазмид, способа введения этих плазмид в различные типы организмов и их экспрессии в этих организмах.
<Способ получения pal гена>
Происходящий из растения pal ген можно получить из кДНК библиотеки, полученной известным способом, с использованием в качестве зонда частичного фрагмента, соответствующего консервативной последовательности фенилаланиновой аммиак-лиазы. После выделения и очистки стандартной мРНК требуемую кДНК можно получить с помощью обратной транскриптазы, используя полученную мРНК в качестве матрицы. Однако в настоящее время достаточное количество кДНК можно легко получить ПЦР методом при помощи термоустойчивой обратной транскриптазы, с использованием в качестве матрицы тотальной РНК или мРНК. Полученную таким образом кДНК лигируют с подходящим плазмидным вектором, таким как pBR322 или pUC18, чтобы трансформировать Escherichia coli, используемую в качестве организма-хозяина.
Чтобы получить требуемый pal ген из кДНК библиотеки, полученной как описано выше, используют метод гибридизации колоний, где в качестве зонда используют олигодезоксинуклеотид, кодирующий консервативную последовательность фенилаланиновой аммиак-лиазы. Поскольку, как указано выше, во всех последовательностях фенилаланиновых аммиак-лиаз, происходящих из растений, имеются высокогомологичные последовательности, которые, предположительно, являются консервативными последовательностями, используемые в качестве зондов олигодезоксинуклеотиды можно получать путем выбора позиции в зависимости от цели.
Плазмиду получают из предполагаемого положительного трансформанта, полученного путем гибридизации с колониями. Затем плазмиду подвергают ПЦР с комбинацией подходящих праймеров, таким образом, чтобы подтвердить позицию и направление pal гена, который был вставлен в плазмиду. Первичные структуры многих pal генов, происходящих из растений, представлены в таких базах данных, как GenBank или EMBL. Следовательно, поскольку существует информация о структуре генов, можно также подтвердить правильность получения плазмиды и направление гена путем получения рестриктной карты.
<Способ получения экспрессирующей плазмиды и способ получения рекомбинантного микроорганизма, используемого в способе по изобретению>
В составе подходящего вектора (конкретные примеры которых будут описаны ниже) pal ген вводят в такие бактерии, как Escherichia coli, или такие микроорганизмы, как дрожжи, включая Saccaromyces cerevisiae, и экспрессируют в них таким образом, чтобы можно было получить рекомбинанты, обладающие способностью к образованию требуемых производных фенилаланина. В данном случае предпочтительным организмом-хозяином является бактерия, такая как Escherichia coli. Как описано ниже, образовавшееся производное фенилаланина можно выделить и очистить с помощью стандартных способов отделения продукта реакции микроорганизма из реакционной смеси.
В качестве способа получения плазмиды, содержащей чужеродный ген, а также методики или способа введения и экспрессии плазмиды в таком микроорганизме, как Escherichia coli, можно использовать стандартные методы, обычно используемые в области генной инженерии (см., например, "Vectors for cloning genes". Methods in Enzymology, 216, pp.469-631, 1992, Academic Press, и "Other bacterial systems". Methods in Enzymology, 204, pp.305-636, 1991, Academic Press).
В качестве способа введения чужеродного гена (группы pal генов) в Escherichia coli уже было разработано несколько эффективных методов, таких как Hanahan-метод или рубидиевый метод, которые могут быть использованы для этих введения генов (см., например, Sambrook J., Fritsch E.F., Maniatis Т., "Molecular cloning - A laboratory manual." Cold Spring Harbor Laboratory Press, 1989). Экспрессию чужеродного гена в Escherichia coli можно осуществить стандартным способом (см., например, упомянутый выше "Molecular cloning - A laboratory manual."), для Escherichia coli можно использовать вектор, содержащий lac промотор, или подобные векторы, такие как pUC, pBluescript и т.д. Используя вектор для Escherichia coli pBluescript II SK-, содержащий lac промотор, авторы настоящего изобретения вставили pal ген ниже последовательности lac промотора, а затем добились экспрессии гена в Escherichia coli.
В качестве способа введения pal гена в дрожжи, Saccharomyces cerevisiae, уже было разработано несколько методов, таких как литиевый метод, с помощью которого можно осуществить введение гена в дрожжи (см., например, "Biotechnology of Yeast" под редакцией Yuichi Akiyama и Bioindustry Association, опубликованное в Igaku Syuppan Center). Используя такой промотор, как PGK или GPD (GAP), а также терминатор, экспрессию чужеродного гена в дрожжах можно осуществить путем конструирования экспрессирующей кассеты, в которой чужеродный ген вставлен между промотором и терминатором для осуществления транскрипционного контроля, и вставления этой экспрессирующей кассеты в вектор S. cerevisiae, например YRp (мультикопийный вектор для дрожжей, содержащий в качестве точки начала репликации, последовательность ARS дрожжевой хромосомы), YEp (мультикопийный вектор для дрожжей, содержащий в качестве точки начала репликации 2 мкм дрожжевой ДНК), Yip (вектор для инкорпорации в дрожжевую хромосому, который не содержит никаких дрожжевых точек начала репликации) и т.д. (см. вышеупомянутое "New Biotechnology of Yeast" Igaku Syuppan Center и "Genetic Engineering for Production of Substances", Japan Society for Bioscience, Biotechnology and Agrochemistry, ABC Series, опубликованное Asakura Shoten).
<Способ культивирования рекомбинантного микроорганизма>
Культивирование трансформанта по настоящему изобретению можно осуществить при помощи стандартного способа культивирования микроорганизма-хозяина.
Источником углерода для культивирования трансформированного микроорганизма может быть вещество, которое микроорганизм может использовать в качестве источника углерода, и примеры таких источников углерода включают сахариды, такие как глюкоза, сахароза, фруктоза, а также черная патока; органические вещества, такие как этанол, уксусная кислота, лимонная кислота, янтарная кислота, молочная кислота, бензойная кислота, а также жирные кислоты или соли щелочных металлов этих кислот; алифатические углеводороды, такие как н-параф