Способ получения носового секрета для морфологического исследования
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к оториноларингологии, и может найти применение при лечении заболеваний верхних дыхательных путей, при диагностике патологических процессов или заболеваний слизистой оболочки полости носа и околоносовых пазух и для разработки новых методов исследования биологических жидкостей. Способ получения носового секрета для морфологического исследования включает забор носового секрета щеточкой с помощью нескольких легких движений в области носовой перегородки и нижней носовой раковины, в переднезаднем направлении, отступая 1-1,5 см от переднего края, в месте расположения мерцательного эпителия, смешивание его с 0,5 мл физиологического раствора хлорида натрия, центрифугирование в течение 15 минут при 900 g, нанесение надосадочной жидкости в объеме 2,0-2,5 мкл на поверхность стекла в виде капли и высушивание ее методом клиновидной или краевой дегидратации до получения структуры твердой фазы. Технический результат: получение носового секрета, пригодного для морфологического исследования методами клиновидной или краевой дегидратации. 2 з.п. ф-лы, 2 ил.
Реферат
Изобретение относится к медицине, а именно к оториноларингологии, и может найти применение при лечении заболеваний верхних дыхательных путей, при диагностике патологических процессов или заболеваний слизистой оболочки полости носа и околоносовых пазух, а также для разработки новых методов исследования биологических жидкостей.
Известно, что состав носового секрета является индикатором всех процессов, в том числе и патологических, которые протекают в слизистой оболочке верхних дыхательных путей.
В настоящее время в клинической практике исследование носового секрета на качественное и количественное содержание в нем различных органических и неорганических компонентов, а также его свойств с помощью биохимических, иммунологических, физических методов, цитологическое исследование его состава имеет большое диагностическое и прогностическое значение.
Однако получение носового секрета для исследования представляет собой достаточно сложную задачу, в первую очередь, в связи с тем, что он покрывает поверхность слизистой оболочки полости носа очень тонким слоем.
Известно, что секрет слизистой оболочки дыхательных путей имеет двухфазную структуру, состоящую из водянистого подслоя - золь (толщиной 7-10 мкм), известного как перицилиарный слой, в котором движутся реснички клеток мерцательного эпителия, и более поверхностного слоя - гель (толщиной 0,5-2 мкм), который расположен над ресничками и непосредственно контактирует с воздухом.
В настоящее время существует несколько способов получения носового секрета для его последующего исследования. К ним можно отнести получение носового секрета с помощью аспирации, с помощью смывов, абсорбцией пористым материалом. Недостатком аспирации является невозможность получить секрет при его небольшом количестве. При смывах большое разведение носового секрета затрудняет проведение исследований и делает их менее достоверными.
Известен способ получения носового секрета, включающий стимуляцию выделения секрета с помощью целлюлозной губки, вставленной в преддверие носа с последующей ее аспирацией [1].
Стимулирующие выделения носового секрета вещества могут быть различными, например перец, лук, чеснок. Однако все эти способы являются нефизиологичными, некомфортными, кроме того, получаемый для исследования секрет в этих случаях отличается по своему составу от такового в обычной ситуации.
Известен также способ забора носового секрета с помощью мазков - отпечатков для исследования цитологии носового секрета и изучения местного клеточного иммунитета слизистой оболочки полости носа [2].
Данным способом получают отпечатки со слизистой оболочки полости носа с помощью специально приготовленных и отшлифованных стекол. При этом предварительно обезжиренное стекло вводят в полость носа и прислоняют к слизистой оболочке носовой перегородки или носовой (нижней) раковины. Затем мазок высушивают и окрашивают по способу Паппенгейма. После высушивания отпечатки изучают под световым микроскопом и производят качественный и количественный анализ клеточного состава носового секрета.
Этот способ является простым в применении, однако он недостаточно информативен, так как позволяет исследовать только ту часть носового секрета, которая имеет клеточную структуру, при этом не учитывает взаимодействия клеточного состава секрета с его жидкой частью, и внеклеточная часть носового секрета остается вне зоны исследования.
Наиболее близким по технической сущности и достигаемому результату к предлагаемому способу является способ получения носового секрета, включающий забор носового секрета с поверхности слизистой оболочки полости носа с помощью инструментария, разведение полученного материала физиологическим раствором, центрифугирование и исследование надосадочной жидкости [3].
Данный способ позволяет получить для исследования все составные части носового секрета, однако забор материала осуществляют с помощью орошающего носовую полость физиологического раствора NaCl, помещенного в специальное устройство, собирая, таким образом, носовой смыв.
Устройство для орошения полости носа содержит жесткую трубку для подачи жидкости в полость носа и носовую оливу с двумя сквозными каналами. Подающая трубка установлена в одном из каналов и имеет изогнутый по радиусу рабочий конец, выступающий из оливы на 4-5 мм, а во втором канале оливы установлена отводящая трубка, выполненная из эластичного материала. Наличие оливы позволяет герметично обтурировить преддверие носа и исключить травматизацию слизистой оболочки.
По подающей трубке физиологический раствор NaCl (9 г/л) температуры 37,5°С в количестве 5,0-10 мл подают в общий носовой ход (голова больного наклонена на 45° вперед) и, омыв слизистую оболочку носа, он пассивно стекает в центрифужную пробирку. Полученный материал центрифугируют при температуре 4°С при 3000 g в течение 30 минут. Надосадок переносят в пластиковые пробирки однократного применения и замораживают при температуре -20°С, сохраняя до проведения обследования больного.
Недостатком данного способа является то, что необходимо использовать достаточно большой объем физиологического раствора, а именно 5 мл - 10 мл.
Это приводит к большому разведению получаемого состава носового секрета, что делает затруднительным исследование всех ингредиентов носового секрета, уменьшает точность и достоверность исследования. Такой объем физиологического раствора NaCl при смыве также нарушает естественное динамическое равновесие носового секрета вследствие воздействия на него молекул воды и ионов солей. Это делает сомнительной возможность исследования структурной организации носового секрета после его получения.
Недостатком известного способа также является то, что орошение слизистой оболочки полости носа струей физиологического раствора обеспечивает попадание в смыв преимущественно поверхностной части носового секрета и его содержимого, поскольку вязкие свойства носового секрета препятствуют смыву большей его части.
Следует также учитывать, что смыв производят с большой по площади поверхности, а именно от входа в нос до носоглотки. При этом потери материала неизбежны вследствие попадания его части в носоглотку, глотку, противоположную половину носа, в средний и верхний носовые ходы, а также вытекания из ноздри, после отсоединения из нее оливы.
Из вышесказанного ясно, что разработка новых способов получения носового секрета для последующего исследования представляет в настоящее время несомненную актуальность. При этом следует учитывать, что недостатком существующих в настоящее время методов исследования носового секрета является фрагментарность получаемой информации, так как определение качественного и количественного состава отдельных параметров носового секрета не дает представления о состоянии его в целом, как системы.
Общеизвестно, что носовой секрет представляет собой биологическую жидкость. Одним из самых перспективных направлений современной лабораторной диагностики считается изучение феноменов, происходящих при высушивании (драинге) биологических жидкостей. Комплексный системный подход к изучению этого процесса с позиций физико-химии, кристаллографии и принципов синергетики разработан и описан В.Н.Шабалиным и С.Н.Шатохиной [4].
На основании характера драинга можно объективно судить о химическом составе биологической жидкости (в том числе и о спектре макромолекул), а также об их интегральных поверхностно-активных, сорбционных и осмоактивных свойствах.
Понятие "функциональная морфология" является новым в биологии и медицине. Оно отражает морфологическое состояние молекулярных и надмолекулярных структур в момент выполнения ими функционального акта - взаимодействия с другими структурными элементами организма. Функциональная морфология биологических жидкостей - научное направление, отличающееся принципиальной новизной по своим теоретическим основам, методике исследования и виду получаемой информации.
Основным достоинством данного направления является получение оригинальных объективных и высоко значимых клинико-диагностических данных, позволяющих выявлять патологические отклонения на самых ранних этапах и контролировать самые небольшие изменения в динамике заболевания, что недоступно другим современным методам исследования.
Результаты, полученные с помощью технологии, применяемой в рамках этого направления, дают также более глубокое и точное представление о патогенезе различных заболеваний, а следовательно, способствуют совершенствованию терапевтических подходов.
Исключительно важное значение данного научного направления состоит и в том, что оно открывает возможность широкого мониторинга здоровья практически здорового контингента населения и является базой для всеобщей диспансеризации, выявления резервов здоровья человека и принятия своевременных мер по укреплению и предупреждению истощения этих резервов.
Высокая информативность методов морфологического анализа биологических жидкостей, уникальность получаемых данных, их простота и широкая доступность, экономичность и высокая диагностическая достоверность данных делает их самыми оптимальными для исследования полученного носового секрета.
Теоретической основой к исследованию функциональной морфологии биологических жидкостей явилось учение о самоорганизации и поведении сложных систем, разработанное школами нобелевского лауреата И.Пригожина и Г.Хакена.
За последнее десятилетие Шабалин В.Н. и Шатохина С.Н. установили, что при переходе в твердую фазу в процессе самоорганизации (дегидратация, замораживание) биологические жидкости структуризируются и приобретают устойчивые морфологические формы [5]. Этими авторами разработана методологическая основа исследования морфологических структур биологических жидкостей, а именно методы клиновидной и краевой дегидратации.
Любые, как физиологические, так и патологические процессы, протекающие в живом организме, имеют в своей основе специфические особенности структуры белков и других органических молекул. В процессе самоорганизации при клиновидной или краевой дегидратации биологических жидкостей специфические структуры данных молекул формируют "мозаичные" структуры макроуровня, доступные для визуального анализа. В настоящее время выявлен ряд структурных маркеров, указывающих на определенный патологический процесс.
Известно, что организм человека состоит из устойчивых структур - клеток и высокодинамичных - биологических жидкостей. Эти системы являются взаимодополняющими. Если высокодинамичные структуры могут существовать без клеточных форм, то клеточные структуры не могут существовать без жидкостных сред, так как поступление питательных веществ и выброс продуктов жизнедеятельности клеток осуществляется путем обмена внутриклеточных и внеклеточных жидкостей организма.
Биологические жидкости представляют наиболее удобный для изучения динамики физиологических и патологических процессов организма объект. Это - сложные полидисперсные неклеточные структуры с неустойчивыми связями входящих в них компонентов: сыворотка крови, лимфа, ликвор, секреты эндокринных и экзокринных желез, внутриклеточная и внеклеточная жидкость.
По составу биологические жидкости являются лиотропными жидкими кристаллами. Это структурно упорядоченные растворы биологических молекул, в том числе - амфифильных, которыми являются липиды. Амфифильными называются молекулы, имеющие в своем составе растворимую в воде ионную и нерастворимую части, обладающие отчетливыми двулучепреломляющими свойствами кристаллов.
Биологические жидкости играют важную роль в жизнедеятельности организма, выполняя информационную, управленческую и исполнительную функции.
Самые незначительные изменения в процессе жизнедеятельности организма проявляются в изменении структурной упорядоченности лиотропных жидких кристаллов. Элементы биологических жидкостей моментально реагируют изменением своей структуры на любые воздействия внешнего и внутреннего характера, что позволяет следить за течением заболевания в процессе лечения и осуществлять оперативную коррекцию терапевтических программ.
Методы клиновидной и краевой дегидратации биологических жидкостей дают возможность получения интегрированной информации, заложенной в особенностях морфологической картины твердой фазы биологических жидкостей, так как дегидратированная биологическая жидкость представляет собой тонкую пленку и фактически является тонким "срезом" неклеточной ткани организма.
С помощью специального приема дегидратации капли биологической жидкости получают сухую пленку (фацию), которая представляет собой фиксированный тонкий срез исследуемой жидкости. Структура фации биологической жидкости является интегрированным образом всех имеющихся в ней многосложных молекулярных взаимосвязей, которые особым образом упорядочены и трансформированы на макроскопический уровень.
Таким образом, суть методов клиновидной и краевой дегидратации состоит в переводе биологической жидкости в твердое состояние, и этот переход из жидкого (высокодинамичного) состояния в твердое (устойчивое, фиксированное) состояние является фазовым переходом порядка одного качества в порядок другого качества [6].
Метод клиновидной дегидратации состоит в следующем: на обезжиренное предметное стекло, расположенное строго горизонтально, наносят каплю исследуемой жидкости в объеме 0,02 мл (20 мкл). При этом диаметр капли составляет 5-7 мм. Затем каплю высушивают при температуре 20-25°С и относительной влажности 65-70% при минимальной влажности окружающего воздуха. При высыхании капля должна быть неподвижной. Продолжительность периода высыхания (до момента анализа структуры) составляет 12-24 часа.
Клиновидная дегидратация обусловливает особые условия самоорганизации, в результате формируется сухая пленка (фация) со специфическими структурами, представляющими собой индивидуальные биологические параметры. Фация это структурный макропортрет, отражающий молекулярные взаимоотношения в биологической жидкости, а значит и протекающие в ней патофизиологические процессы.
В этом состоит наибольшая ценность метода клиновидной дегидратации для клинической диагностики. Ни один другой метод лабораторной диагностики не дает информации столь значительного объема и качества.
Принципы построения структур при использовании метода краевой дегидратации - иные. Испарение жидкости в капле, находящейся на предметном стекле, происходит из-под так называемой "аналитической ячейки", сформированной наложением на каплю покровного стекла. Испарение происходит через узкую щель между поверхностями стекол, то есть медленно - в течение 48-72 часов.
Если методом клиновидной дегидратации достигается быстрое (12-24 часа) формирование структур, а именно структуризация (системная самоорганизация), то при краевой дегидратации создаются условия для роста отдельных кристаллов, то есть кристаллизация (локальная организация).
Внешний их вид при микроскопии трактуется как текстура или морфотип. Исследования системной и локальной организации дегидратированной капли производят с помощью микроскопии.
Изучение динамики патологических процессов, происходящих в тканях организма при заболеваниях уха, горла, носа, с помощью новой диагностической технологии впервые было проведено в отделении оториноларингологии МОНИКИ им. М.Ф.Владимирского (руководитель отделения - проф. В.Г.Зенгер) и показало возможности использования этой технологии в диагностике заболеваний ЛОР-органов, в том числе на ранних стадиях, а также прогнозировании и исхода патологического процесса, оценке эффективности проводимой терапии.
Авторы исследовали такие биологические жидкости, как слюна, сыворотка крови, содержимое лакун миндалин и на основании исследования диагностировали холестеатомы среднего уха, прогнозировали течение хронического тонзиллита.
Однако в доступной литературе публикаций на тему исследования структур твердой фазы носового секрета, полученного методами клиновидной и краевой дегидратации нами обнаружено не было. Данные о структуре твердой фазы носового секрета как в норме, так и при патологии также отсутствуют.
Технический результат заявляемого решения заключается в разработке способа получения носового секрета для дальнейшего морфологического исследования его системной и локальной самоорганизации методами клиновидной и краевой дегидратации.
Этот результат достигается тем, что в способе получения носового секрета для морфологического исследования, включающем забор носового секрета с поверхности слизистой оболочки полости носа, центрифугирование смеси биологического материала с физиологическим раствором и исследование надосадочной жидкости, согласно изобретению носовой секрет собирают щеточкой, делая несколько легких движений в области носовой перегородки, нижней носовой раковины и дна полости носа, в переднезаднем направлении, отступя 1-1,5 см от переднего края, в месте расположения мерцательного эпителия, смешивают с 0,5 мл физиологического раствора хлорида натрия, центрифугируют в течение 15 минут со скоростью 900 g, a полученную надосадочную жидкость в объеме 2,0-2,5 мкл наносят на поверхность стекла в виде капли и высушивают ее методом клиновидной или краевой дегидратации до получения структуры твердой фазы. Для забора носового секрета используют щеточку в виде тонкой гибкой проволоки диаметром 0,8 мм и длиной 50 см с жестким капроновым ершиком диаметром 2,5 мм и длиной 10 мм на конце. При этом забор носового секрета производят трижды.
Наличие отличительных признаков, а именно забор носового секрета щеточкой посредством нескольких легких движений в области носовой перегородки и нижней носовой раковины, в переднезаднем направлении, отступя 1-1,5 см от переднего края, в месте расположения мерцательного эпителия, смешивание носового секрета с 0,5 мл физиологического раствора хлорида натрия, центрифугирование в течение 15 минут со скоростью 900 g, нанесение надосадочной жидкости на предметное стекло в виде капли объемом 2,0-2,5 мкл для исследования методами клиновидной и краевой дегидратации, выполнение щеточки в виде тонкой гибкой проволоки диаметром 0,8 мм и длиной 50 см с жестким капроновым ершиком диаметром 2,5 мм и длиной 10 мм на конце, а также выполнение забора носового секрета и перенос его в физиологический раствор трижды, свидетельствует о соответствии заявляемого технического решения критерию патентоспособности "новизна".
В предлагаемом способе носовой секрет "собирается" специальной щеточкой определенными отработанными движениями в естественном виде без разведения и обеспечивает получение материала в полном составе всех его составляющих и с минимальными потерями. Соскоб щеточкой позволяет получить для исследования весь слой эпителиального секрета конкретно из места его скопления, учитывая при этом особенности носового секрета (вязкость и исключительно малую толщину его слоев).
Способ предусматривает разведение носового секрета всего в 0,5 мл физиологического раствора NaCl, и это разведение выполняют уже после того, как носовой секрет собран, что значительно уменьшает влияние на динамику физико-химических процессов, протекающих в носовом секрете молекул воды и ионов солей, и делает возможным исследование структуризации носового секрета.
В связи с этим заявляемый способ получения носового секрета обеспечивает наличие всех составляющих носовой секрет ингредиентов с наименьшими их потерями, что значительно повышает точность и достоверность получаемых результатов, а также возможность исследования структуризации носового секрета после его получения.
Вследствие этого наш метод позволяет получить носовой секрет в максимально приближенном к его нахождению в полости носа исследуемого объекта (больного или здорового человека) состоянии. Это дает возможности произвести анализ наиболее динамичных и неуловимых при получении секрета другими способами происходящих в нем процессов даже на молекулярном уровне.
Предлагаемый нами способ получения носового секрета для морфологического исследования методами клиновидной и краевой дегидратации позволяет в результате проведения исследования:
1. Изучить физиологические и патофизиологические механизмы самоорганизации и кристаллизации такой биологической жидкости, как носовой секрет, что даст возможность выявить патогенетические механизмы заболеваний верхних дыхательных путей (далее ВДП);
2. Выявить типичный для конкретного патологического процесса ВДП структурный морфотип твердой фазы носового секрета, что даст возможность разработать новые диагностические критерии для заболеваний верхних дыхательных путей;
3. Произвести объективную оценку прогноза патологического процесса ВДП, его динамики вследствие проводимой терапии, а также оценить эффективность действия применяемых лекарственных препаратов на основании анализа морфологических структур твердой фазы носового секрета.
Из вышесказанного следует, что технический результат достигается новой совокупностью существенных признаков, что свидетельствует о соответствии заявляемого технического решения критерию патентоспособности "изобретательский уровень".
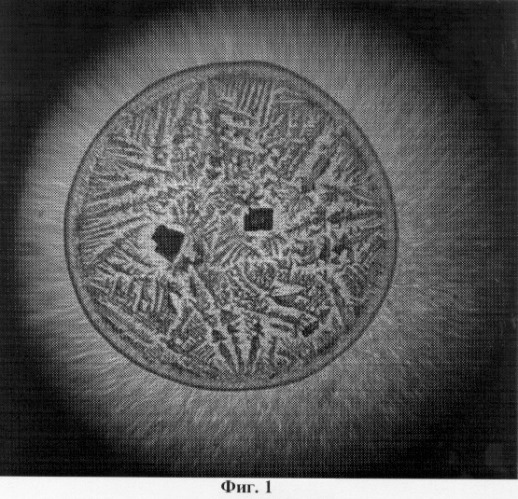
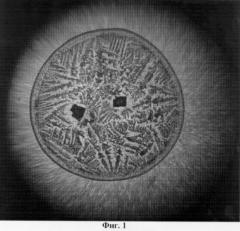
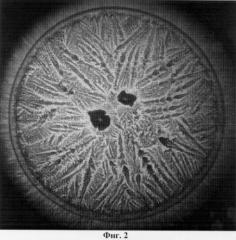
Изобретение поясняется чертежами, где: на фиг.1 представлен увеличенный вид твердой фазы носового секрета, полученный методом клиновидной дегидратации (пример 1); на фиг.2 представлен увеличенный вид твердой фазы носового секрета, полученный методом клиновидной дегидратации (пример 2).
Способ осуществляется следующим образом.
Специальным приспособлением - щеточкой для браш биопсии из бронхоскопического набора собирают секрет из преддверия носа. Приспособление представляет собой тонкую гибкую проволоку из никелевого сплава диаметром 0,8 мм и длиной 50 см с жесткой капроновой щеткой в виде ершика диаметром 2,5 мм и длиной 10 мм на конце. Носовой секрет собирают в месте его наибольшего скопления в области дна полости носа с помощью нескольких легких "вытирающих" движений, аналогичных производимым при уборке пыли.
Сразу после получения материал помещают в пробирку с физиологическим раствором NaCl в количестве 0,5 мл и взбалтывают с помощью размешивающих движений, перемещая слизь со щеточки в физиологический раствор. С целью получения достаточного для исследования количества материала носового секрета сбор и перенос его в пробирку производят трижды. Затем пробирку с жидкостью центрифугируют в течение 15 минут с частотой 900 g. После этого лабораторной пипеткой набирают 2,5 мкл надосадочной жидкости и наносят ее в виде капли на предметное стекло для дальнейшего исследования. Препараты рассматривают под микроскопом через 12-72 часов после приготовления.
Заявляемый способ подтверждается следующими конкретными примерами.
Пример 1. Рыбальченко Галина Евгеньевна, 41 год. Диагноз: Острый двусторонний гнойный гайморит. Дата обследования: 29 октября 2004 года. Материал - слизистое отделяемое из носа.
Щеточкой взята слизь из носа. Материал вместе со щеточкой помещен в микропробирку со 0,5 мл физиологического раствора NaCl. При помощи взбалтывания материал перенесен в раствор. Центрифугирование в лабораторной центрифуге в течение 15 минут, с частотой 900 g. Надосадочная жидкость с помощью лабораторной пипетки перенесена в виде капли на предметное стекло (клиновидная дегидратация). Всего 2 капли по 3-4 мкл. Высыхание в стандартных условиях в течение 24 часов. Произведен осмотр препаратов под микроскопом. Результаты зафиксированы в лабораторный журнал.
В центре препарата 2-3 четырехугольных кристалла, темных. Центральная зона занимает практически всю площадь в виде древовидных ветвей папоротника. Очень узкая краевая зона в виде аморфной структуры (фиг.1).
Таким образом, данный материал пригоден для морфологического исследования структур носового секрета.
Пример 2. Сопина Екатерина Владимировна, 30 лет. Диагноз: Острый двусторонний гнойный гайморит. Дата обследования: 29 октября 2004. Материал - слизистое отделяемое из носа.
Щеточкой взята слизь из носа. Материал вместе со щеточкой помещен в микропробирку с 0,5 мл физиологического раствора NaCl. При помощи взбалтывания материал перенесен в раствор. Центрифугирование в лабораторной центрифуге в течение 15 минут, с частотой 900 g. Надосадочная жидкость с помощью лабораторной пипетки перенесена в виде капли на предметное стекло (клиновидная дегидратация). Всего 2 капли по 3-4 мкл. Высыхание в стандартных условиях в течение 24 часов. Произведен осмотр препаратов под микроскопом. Результаты зафиксированы в лабораторный журнал.
В центре препарата также видны четырехугольные кристаллы. Центральная зона занимает практически всю площадь в виде древовидных ветвей папоротника. Краевая зона в виде аморфной структуры (фиг.2).
Таким образом, данный материал также пригоден для морфологического исследования структур носового секрета.
Способ прошел апробацию в ГУ "Санкт-Петербургский НИИ уха, горла, носа и речи МЗ РФ" в 2004 г.
Из вышесказанного следует, что предлагаемый способ обеспечивает технический результат, не вызывает затруднений, предполагает использование освоенных материалов и стандартного оборудования, что свидетельствует о соответствии заявляемого технического решения критерию патентоспособности "промышленная применимость".
Источники информации
1. Holt J.J., Kern E.B. A new method of collecting nasal secretions / Otolaryng. Head Neck Surg - 1986 - Vol.94, N3. - P.403-404.
2. Уразбаева А.Т. Носовые отпечатки и их роль в диагностике заболеваний носа и его придаточных полостей / Вопросы клинической оториноларингологии: Под ред. И.И.Потапова. - М., 1955. - С.40-57.
3. Хмельницкая Н.М. и соавторы. Методы получения и исследования экзокринных секретов для изучения некоторых параметров местного иммунитета / Клиническая и лабораторная диагностика - Медицина, 1997, №12, - С.43-44.
4. Шабалин В.Н., Шатохина С.Н. Морфология биологических жидкостей человека / М.: Хризостом, 2001. - С.304.
5. Шабалин В.Н., Шатохина С.Н. Аутогенные ритмы и самоорганизация биожидкостей / Бюллетень экспериментальной биологии и медицины. - М.: 1996, №10, - С.364-371.
6. Шатохина С.Н., Зенгер В.Г. Морфология жидких сред организма - новое направление оториноларингологии / Российская оториноларингология. - М.: 2004, №5, - С.188-191.
1. Способ получения носового секрета для морфологического исследования, включающий забор носового секрета с поверхности слизистой оболочки полости носа, центрифугирование смеси биологического материала с физиологическим раствором и исследование надосадочной жидкости, отличающийся тем, что носовой секрет собирают щеточкой, делая несколько легких движений в области носовой перегородки, нижней носовой раковины и дна полости носа, в переднезаднем направлении, отступя 1-1,5 см от переднего края, в месте расположения мерцательного эпителия, смешивают с 0,5 мл физиологического раствора хлорида натрия, центрифугируют в течение 15 мин со скоростью 900 g, а полученную надосадочную жидкость в объеме 2,0-2,5 мкл наносят на поверхность стекла в виде капли и высушивают ее методом клиновидной или краевой дегидратации до получения структуры твердой фазы.
2. Способ получения носового секрета для морфологического исследования по п.1, отличающийся тем, что используют щеточку в виде тонкой гибкой проволоки диаметром 0,8 мм и длиной 50 см с жестким капроновым ершиком диаметром 2,5 мм и длиной 10 мм на конце.
3. Способ получения носового секрета для морфологического исследования по п.1 или 2, отличающийся тем, что забор носового секрета производят трижды.