Ген гликопротеина (g-ген) российского референсного штамма зл-4 вируса весенней виремии карпа и рекомбинантные плазмидные днк pcdna-g и pbacarpvax-g, экспрессирующие ген гликопротеина и обеспечивающие развитие защитного иммунитета у рыб против заражения вирусом весенней виремии карпа
Иллюстрации
Показать всеИзобретение относится к области биохимии и генной инженерии и может быть использовано в рыбоводстве. Определена нуклеотидная последовательность, кодирующая гликопротеин российского изолята ЗЛ-4. На основании данной последовательности сконструированы ДНК-плазмиды, обеспечивающие экспрессию гликопротеина российского изолята ЗЛ-4 в рыбах. ДНК-вакцина на основе указанных ДНК-плазмид обеспечивает развитие у рыб защитного иммунитета против последующего заражения изолятом ЗЛ-4 вируса весенней виремии карпа. Применение изобретения позволяет обеспечить защиту карпа российской аквакультуры от последующего заражения вирусом весенней виремии карпа. 3 н.п. ф-лы, 4 ил.
Реферат
Изобретение относится к биотехнологии, конкретно, к генетической инженерии, и представляет собой плазмиды pcDNA-G и pBACarpVAX-G, содержащие рекомбинантный полноразмерный ген гликопротеина (G-ген) российского референсного штамма ЗЛ-4 вируса весенней виремии карпа (ВВК, SVC) под контролем CMV-промотора или промотора β-актина карпа, соответственно. Предложенные рекомбинантные конструкции являются кандидатами на ДНК-вакцины против весенней виремии карпа (ВВК).
ВВК является остро протекающим контагиозным заболеванием рыб, наносящим значительный урон рыбоводству Европы и стран бывшего СССР. В последнее время ВВК была обнаружена также в США и Китае. Возбудитель заболевания, известный как вирус весенней виремии карпа (SVCV) или Rhabdovirus carpio, является рабдовирусом, предварительно отнесенным к роду Vesiculovirus [1]. Наиболее восприимчив к заболеванию карп (Cyprinus carp L.) - основной объект российской аквакультуры. При вспышке заболевания обычно погибает около 30-40% поголовья рыб, в тяжелых случаях гибель может достигать 70%. Помимо карпа в естественных условиях вирус может инфицировать белого и пестрого толстолобиков, белого амура, золотого карася, обыкновенного сома и щуку, а в искусственных условиях - и декоративные виды рыб семейства карповых [2].
В настоящее время не существует эффективных средств профилактики и терапии ВВК. Предпринимались попытки создания инактивированной и аттенуированной вакцины против заболевания [3-5]. Однако такие вакцины имеют известные недостатки, ограничивающие их широкое применение в рыбоводной практике.
В последнее десятилетие одним из приоритетных направлений в современной экспериментальной ветеринарии стала разработка так называемых ДНК-вакцин. Эти вакцины обладают рядом преимуществ по сравнению с традиционными вакцинами, что делает их привлекательными для аквакультуры. Они дешевы, термостабильны и просты в обращении, а однократная вакцинация способна индуцировать "развернутый" иммунный ответ с долговременной памятью [6]. Рекомбинантные технологии в настоящее время занимают доминирующее положение в работах по конструированию "идеальных" вакцин.
Иммунный ответ против рабдовирусов направлен преимущественно на поверхностный трансмембранный гликопротеин (G-белок) вириона. Нейтрализующие антитела и цитотоксические лимфоциты демонстрируют эксклюзивную специфичность к данному белку [7]. Поэтому рекомбинантная нуклеотидная последовательность, кодирующая вирусный гликопротеин, является наиболее подходящим кандидатом на роль иммуногенной основы для ДНК-вакцины против возбудителей семейства Rhabdoviridae.
Зарубежными исследователями получены обнадеживающие результаты в работах по созданию и изучению иммуногенных и протективных свойств ДНК-вакцинных препаратов против рабдовирусных болезней рыб. Основные исследования были проведены с ДНК-вакцинами против двух болезней лососевых рыб - инфекционного некроза гемопоэтической ткани и вирусной геморрагической септицемии. Показано, что из экспериментальных ДНК-вакцин для рыб наиболее эффективны конструкции, где экспрессия рекомбинантного вирусного белка проходит под контролем цитомегаловирусного (CMV) промотора. Однократная внутримышечная инъекция ДНК-вакцин на основе G-белка вирусов демонстрирует высокую эффективность индукции защитного иммунного ответа против соответствующего заболевания [6, 8, 9]. Препараты вакцин были эффективны при применении в различных концентрациях, на рыбах разных видов и возрастных групп. Было установлено их защитное действие против заражения гетерологичными рабдовирусами рыб [10, 11, прототип].
В типичном эксперименте 2 группы радужной форели по 25-30 экз. рыб в каждой, со средней массой тела 1 г вакцинируют однократно внутримышечной инъекцией 0,01-1 мкг плазмидной ДНК, и затем через 30 дней заражают летальной дозой вируса через воду или путем внутрибрюшинной инъекции. В течение последующих 3-4 недель смертность рыб в этих группах составляет 1-10%, тогда как в контрольных группах, получающих пустой плазмидный вектор или буфер, погибает свыше 90%. Исследования кинетики показали долговременность защитного иммунитета (даже через 2 года после вакцинации 0,1 мкг ДНК), который выявляется уже на 4-7 сутки после вакцинации [10,12].
Существует рекомбинантная плазмида pcDNA3-G, содержащая G-ген американского изолята вируса SVC, созданная в лаборатории Jo-Ann Leong, кафедра микробиологии Орегонского университета США. Данная конструкция была использована исследователями для изучения неспецифической резистентности лососевых рыб к вирусам инфекционного некроза гемопоэтической ткани и вирусной геморрагической септицемии [10]. Однако наличие в конструкции ДНК-вакцины цитомегаловирусного промотора может привести к трудностям при прохождении ее через разрешительные инстанции. В связи с этим в настоящее время в ряде лабораторий за рубежом изучается способность различных промоторов инициациировать экспрессию чужеродных генов в тканях рыб.
Существует рекомбинантная плазмида, несущая β-актиновый промотор карпа, с помощью которой было показано, что данный промотор обеспечивает экспрессию гена люциферазы на уровне, сравнимом с таковым для CMV-промотора. ДНК-вакцина против вирусной геморрагической септицемии, содержащая ген этого вируса под контролем β-актинового промотора карпа, обеспечивала развитие защитного иммунитета у вакцинированных радужных форелей, хотя для достижения необходимой защиты требовалось использование более высоких концентраций вакцины [13, прототип]. Предполагается, что использование этого промотора в конструкции ДНК-вакцины позволит упростить процедуру ее лицензирования.
Для получения максимального защитного эффекта от вакцинации необходимо использование оптимальной дозы препарата, совпадение времени заражения с пиком развивающегося иммунного ответа рыб, а также максимальная гомология антигенных свойств между вирусным изолятом, используемым для создания вакцины, и изолятом, наиболее распространенным в данном регионе.
В связи с вышеизложенным технической задачей изобретения является создание генно-инженерных конструкций, кодирующих гликопротеин вируса ВВК российского референсного штамма ЗЛ-4 и обеспечивающих защиту карпа от последующего заражения вирулентным штаммом этого патогена, т.е. являющихся кандидатами на ДНК-вакцины против ВВК в российской аквакультуре.
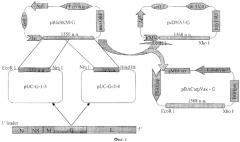
Поставленная задача решается путем установления нуклеотидной последовательности гена гликопротеина российского изолята ЗЛ-4 вируса ВВК. Для этого на первом этапе проводят клонирование двух фрагментов указанного гена, амплифицированных в полимеразной цепной реакции (ПЦР) с использованием кДНК данного гена, полученной путем обратной транскрипции на матрице геномной вирусной РНК. Встраивание проводят по стандартной методике в плазмидный вектор pUC18 (Фиг.1) [15]. Идентификацию рекомбинатных клонов осуществляют рестрикционным анализом и электрофорезом в агарозном геле. Секвенирование полученной последовательности ДНК клонированных фрагментов подтвердило, что они действительно кодируют гликопротеин вируса ВВК (Фиг.2). Опубликована последовательность G-гена только европейского референсного штамма Fijan данного вируса [14]. При сравнении с ним в последовательности G-гена российского штамма было обнаружено 9 замен нуклеотидов, три из которых значимые, приводящие к заменам аминокислот в молекуле кодируемого белка (Фиг.3). На втором этапе было проведено клонирование всей последовательности гена, через pBluKS(-) (для получения правильной ориентации последовательности гена) в плазмидные вектора pcDNA3.1. и pBACarpVAX, которые обеспечивают экспрессию гена и наработку гликопротеина в эукариотических клетках (Фиг.1).
Поставленная задача решается путем конструирования двух рекомбинантных плазмидных ДНК: pcDNA-G (6955 п.н.) и pBACarpVAX-G (5431 п.н.), несущих полноразмерный ген гликопротеина штамма ЗЛ-4 вируса ВВК и обеспечивающих его экспрессию в клетках рыб под контролем промотора CMV и промотора β-актина карпа, соответственно.
Рекомбинантная плазмидная ДНК pcDNA-G с молекулярной массой 46,1×106 Да обеспечивает экспрессию гликопротеина вируса ВВК в клетках рыб при внутримышечном введении в качестве ДНК-вакцины. Конструкция размером 6955 п.н. состоит из следующих элементов:
- EcoR I - Xho I векторного фрагмента ДНК плазмиды pcDNA 3.1.(+) размером 5405 п.н. [Invitrogen, США], содержащего CMV-промотор и последовательность BGH poly А, обеспечивающие экспрессию G-гена в клетках эукариот; Т7 промотор, обеспечивающий размножение целевой плазмиды в клетках бактерий E.coli;
- EcoR I - Xho I фрагмента размером 1550 п.н., содержащего полноразмерный ген гликопротеина изолята ЗЛ-4 вируса ВВК;
- генетического маркера: гена устойчивости к ампициллину;
- уникальных сайтов рестрикции: EcoR I (722), Kpn I (691), Xho I (2278), Xba I (2284).
Рекомбинантная плазмидная ДНК pBACarpVAX-G с молекулярной массой 36,1×106 Да обеспечивает экспрессию гена гликопротеина вируса ВВК в клетках рыб при внутримышечном введении в качестве ДНК-вакцины. Конструкция имеет размер 5431 п.н. и состоит из следующих элементов:
- EcoR I - XhoI векторного фрагмента ДНК плазмиды pBACarpVAX размером 3881 п.н. (производная от pVAX1 Invitrogen, США, предоставленная коллегами из Датского ветеринарного института), содержащего β-актиновый промотор карпа вместо CMV промотора в pVAX1 (замену промотора проводят по сайгам рестрикции Nru I - EcoR I) и последовательность BGH poly А, обеспечивающие экспрессию G-гена в клетках эукариот; Т7 промотор, pMB1 ori, обеспечивающие размножение целевой плазмиды в клетках бактерий E.coli;
- EcoRI - XhoI фрагмента размером 1550 п.н., содержащего полноразмерный ген гликопротеина вируса ВВК изолята ЗЛ-4;
- генетического маркера: гена устойчивости к канамицину;
- уникальных сайтов рестрикции: EcoR I (1615), Xho I (3257).
Вышеописанные генно-инженерные конструкции нарабатываются в препаративных количествах для вакцинации карпов внутримышечной инъекцией в дозе 1 мкг ДНК на грамм ихтиомассы. Защитный эффект вакцин оценивают по выживаемости рыб по сравнению с не вакцинированной контрольной группой рыб после заражения летальной дозой вируса ВВК спустя 10 недель после вакцинации.
Проведенные эксперименты показали, что ДНК-вакцина на основе плазмидной конструкции pcDNA-G обеспечивает выживаемость 82% опытных животных, а конструкция pBACarpVAX-G - 74% (Фиг.4).
ИЗ (RPS)=[1-(% смертности среди вакцинированных рыб/% смертности в контроле)]×100%
RPS (relative percent survival) или ИЗ (индекс защиты) для pcDNA-G и pBACarpVAX-G составил 71,5 и 57,3% по отношению к группам рыб, инъецированным соответствующими контрольными плазмидами, или 58 и 40% по отношению к группе, которой был введен раствор буфера
Изобретение иллюстрируется следующими графическими материалами.
Фиг.1. Схема создания конструкций pBACarpVAX-G и pcDNA-G, несущих ген гликопротеина российского референсного штамма ЗЛ-4 вируса ВВК.
Фиг.2. Нуклеотидная последовательность гена гликопротеина российского референсного штамма ЗЛ-4 вируса ВВК.
Фиг.3. Выровненные нуклеотидные последовательности генов гликопротеина референсных штаммов Fijan и ЗЛ-4 вируса ВВК.
Фиг.4. Выживаемость рыб, вакцинированных препаратами pBACarpVAX-G и pcDNA-G, экспрессирующими ген гликопротеина вируса ВВК.
Для лучшего понимания сущности изобретения ниже следуют примеры его осуществления.
Пример 1. Определение нуклеотидной последовательности гена гликопротеина российского референсного штамма ЗЛ-4 вируса ВВК
Выделение РНК из суспензии вируса проводят по методу Chomczynski and Sacchi [16]. Два фрагмента гена гликопротеина получают амплификацией в полимеразной цепной реакции кДНК, синтезированной на матрице геномной вирусной РНК, с использованием двух пар олигонуклеотидных праймеров. Синтез первой цепи кДНК на матрице вирусной РНК проводят при 42°С в течение 2 часов в следующей реакционной смеси: 0.02М Трис-HCl, рН 8.0, 0.1М KCl, 2 мМ MgCl2, 1 mM DTT, 0.5 мМ dNTP, по 15 мкг праймеров G1 или G2 и 25 ед. активности обратной транскриптазы M-MuLV. Реакцию останавливают прогреванием смеси при 95°С в течение 5 мин.
Для повышения эффективности клонирования гена гликопротеина SVCV была использована ПЦР-технология с применением синтетических праймеров. Поскольку размер G-гена вируса довольно большой (1530 п.н.), целесообразно вести амплификацию последовательности G-гена по частям. Для этого используют две пары праймеров, позволяющих вести амплификацию левой и правой частей гена по отдельности. Выбор праймеров для инициации реакции ОТ-ПЦР осуществляется на основе анализа нуклеотидной последовательности G-гена и межгенных районов штамма Fijan вируса ВВК:
Праймеры имеют сайты узнавания рестриктаз, что позволяет после амплификации вести клонирование фрагментов в векторную ДНК более эффективно по "липким" концам. ПЦР проводят в 0,5 ml пробирках (Bio Tip Germany). Состав реакционной смеси на 25 мкл:
dNTP 10 mM (СибЭнзим, Россия) - 2 мкл
Буфер 10-кратный (СибЭнзим, Россия) - 2 мкл
Праймеры - 50 рМ
DNA Polymerase (Taq pol) - 1 U (СибЭнзим, Россия)
Реакцию проводят на амплификаторе БИС 109 по следующей программе:
ПЦР-фрагменты G 1-3 (868 п.н.) и G 2-4 (879 п.н.) обрабатывают рестриктазами BamH I-Hind III и лигируют в стандартных условиях с плазмидой pUC18, гидролизованной рестриктазами BamH I-Hind III. Лигазной смесью трансформируют компетентные клетки E.coli JM103 и из белых клонов, выросших на среде с ампициллином, Xgal и IPTG выделяют плазмидную ДНК и подвергают рестрикционному анализу ферментами BstE II-Pvu II, BamH I-Hind III, Hae III. Соответствие последовательности нуклеотидов встройки в отобранной рекомбинантной плазмиде проверяют секвенированием.
Пример 2. Создание целевых конструкций pcDNA-G и pBACarpVAX-G
Для сборки полноразмерного гена и правильной ориентации последовательности гена проводят клонирование обоих фрагментов по сайтам рестрикции EcoR I-Nru I (из pUC-G-1-З) и Nru I-Hind III (из pUC-G-2-4) в плазмиду pBluKS(-). Полученную полноразмерную последовательность гена клонируют по липким концам EcoR I - XhoI в эукариотические экспрессирующие вектора pcDNA3.1. и pBACarpVAX (Фиг.1). Компетентные клетки E.coli JM103 трансформируют лигазной смесью и из клонов, выросших на среде с ампициллином (в случае с pcDNA-G) или канамицином (в случае с pBACarpVAX-G), выделяют плазмидную ДНК и подвергают рестрикционному анализу ферментами BstE II - Pvu II, EcoR I - Hind III, Hae III. Соответствие последовательности нуклеотидов встройки в отобранной рекомбинантной плазмиде проверяют секвенированием.
Пример 3. Исследование способности целевых генно-инженерных конструкций индуцировать протективный иммунный ответ вакцинированных карпов против заражения вирулентным штаммом вируса ВВК
Приготовление препаратов ДНК для вакцинации карпов
Клетки E.coli JM103, содержащие pcDNA-G или pBACarpVAX-G, выращивают следующим образом: отдельную колонию засевают в 250 мл среды YT, содержащей ампициллин (100 мкг/мл) или канамицин (50 мкг/мл) и инкубируют 16 ч при 37°С. Плазмидную ДНК выделяют стандартным щелочным методом [15].
Схема иммунизации и заражения карпов
В экспериментах используют годовиков карпа (Cyprinus caprio) со средней массой тела 20-30 г (по 30 рыб в группе), содержащихся в 90-литровых аквариумах с проточной аэрируемой водой при температуре около 8°С. Рыб инъецируют внутримышечно вышеперечисленными препаратами в дозе 1 мкг ДНК на грамм ихтиомассы. Через сутки температуру воды постепенно повышают до 13-15°С.
Спустя 10 недель рыбу заражают внутрибрюшинно вирулентным штаммом М2 вируса ВВК в дозе около 108 TCID50 на рыбу.
Проведенные эксперименты показали, что ДНК-вакцина на основе плазмидной конструкции pcDNA-G обеспечивает выживаемость 82% опытных животных, а на основе конструкции pBACarpVAX-G - 74% (Фиг.4).
Таким образом, созданные генно-инженерные конструкции при внутримышечном введении карпам обеспечивают развитие защитного иммунитета у рыб против заражения вирулентным штаммом вируса весенней виремии карпа. Предложенные рекомбинантные плазмидные ДНК могут быть использованы в качестве ДНК-вакцины против ВВК в отечественном рыбоводстве.
Список литературы
1. Stone D.M., Ahne W., Denham K.L., Dixon P.F., Liu C.T.-Y., Sheppar D.M., Taylor G.R., Way K. Nucleotide sequence analysis of the glycoprotein gene of putative spring viraemia of carp vims and pike fry rhabdovirus isolates reveals four genogroups. // Dis. Aquat. Org. - 2003. - V.53. - P.203-210.
2. Fijan N., Petrinec Z., Sulimanovic D., Zwillenberg L.O. Isolation of the causative agent from the acute form of infectious dropsy of carp. // Vet. Arch. Zagreb. - 1971. - 41. - P.125-138.
3. Fijan N., Petrinec Z. at al. Vaccination of carp against spring viraemia: comparison of intraperitoneal and peroral application of live virus to fish kept in ponds. // Bulletin de l'Office International des Épizootics. - 1977. - 87. - P.441-442.
4. Tesarcik J., Macura В., Rehulka J., Hrdonka M., Konasova V. Summarized results of pilot vaccination of carp against spring viremia in the Czech Socialist Republic. // Prace VURH Vodiany. - 1984. - 13. - P.68-74.
5. Kolbl O. Entwiklung eines Impfstoffes gegen die Fruhjahrsviramie der Karpfen (Spring viraemia of carp, SVC). // Feldversuchserfahrungen. Tierarztl. Umschau. - 1990. - 45. - P.624-629.
6. Heppell J., Davis H.L. Application of DNA vaccine technology to aquaculture. // Adv. Drug Delivery Reviews. - 2000. - V.43. - September. - P.29-43.
7. Coil J.M. The glycoprotein of rhabdoviruses. // Arch. Virol. - 1995. - 140. - P.827-851.
8. Anderson E.D., D.V. Mourich, S.C. Fahrenkrug, S. LaPatra, J. Shepherd, J.C. Leong. Genetic immunization of rainbow trout (Oncorhynchus mykiss) against infectious hematopoetic necrosis virus. // Molecular Marine Biology and Biotechnology. - 1995. - 5(2). - P.114-22.
9. Lorenzen N., Lorenzen E., Einer-Jensen K. et al. Protective immunity to VHS in rainbow trout following DNA vaccination. // Fish & Shellfish immunology. - 1998. - 8. - P.261-270.
10. Kim С.H., Johnson М.С., Drennan J.D., Simon В.E., Thomann E., Leong J. A. DNA vaccines encoding viral glycoproteins induce nonspecific immunity and Mx protein synthesis in fish. // Journal of Virology. - 2000. - Vol.74. - №.15. - P.7048-7054.
11. Lorenzen N., Lorenzen E., Einer-Jensen K. LaPatra S.E. Immunity induced shortly after DNA vaccination of rainbow trout against rhabdoviruses protects against heterologous virus but not against bacterial pathogens. // Dev. Biol. Stand. - 2002. - 26. - P.173-179.
12. LaPatra S.E., S.Corbeil, G.R.Jones, W.D.Shewmaker, N.Lorenzen, E.D.Anderson, G.Kurath. Protection of rainbow trout against infectious hemorrhagic septicemia virus four days after specific or semi-specific DNA vaccination. // Vaccine. - 2001. - 19. - P.4011-4019.
13. Rasmussen J.S., Einer-Jensen K.., Lorenzen E., Lorenzen N. Improvement of safety aspects of for a DNA vaccine against viral haemorrhagic septicemia virus in rainbow trout. // 3-rd International Symposium on Fish Vaccinology. Bergen, Norway. - 2003. - Abstract book. - P.95.
14. Bjorklund HV, Higman KH, Kurath G. The glycoprotein genes and gene junctions of the fish rhabdoviruses spring viremia of carp virus and hirame rhabdovirus: analysis of relationships with other rhabdoviruses. // Virus Res. 1996. - 1-2. - P.65-80.
15. Маниатис Т., Фрич Э., Сэмбрук Дж. Методы генетической инженерии. Молекулярное клонирование. М:. Мир. - 1984. - 479 с.
16. Chomczynski P., Sacchi N. Single-step method of RNA isolation by acid guanidium thiocyanate-phenol-chloroform extraction // Anal. Biochem. - 1987. V.162. - P.156-159.
1. Полинуклеотид, кодирующий поверхностный трансмембранный гликопротеин вируса весенней виремии карпа референсного для России изолята ЗЛ-4, по существу характеризующийся нуклеотидной последовательностью, представленной на фиг.2.
2. Рекомбинантная плазмидная ДНК pcDNA-G размером 6961 п.о. и молекулярной массой 46,1·106 дальтон, обеспечивающая развитие у рыб защитного иммунитета против заражения вирулентным изолятом вируса весенней виремии карпа российской аквакультуры в виде ДНК-вакцины при внутримышечном введении, включающая:
- EcoR I - Xho I фрагмент размером 1556 п.о., содержащий полинуклеотид, кодирующий поверхностный трансмембранный гликопротеин (G-ген) вируса весенней виремии карпа референсного для России изолята ЗЛ-4, охарактеризованный в п.1;
- EcoR I - Xho I векторный фрагмент ДНК плазмиды pcDNA 3.1.(+) размером 5405 п.о. [Invitrogen, США], содержащий CMV промотор и последовательность BGH poly А, обеспечивающие экспрессию G-гена в клетках эукариот; Т7 промотор и ген устойчивости к ампицилину, обеспечивающие селекцию и размножение целевой плазмиды в клетках Е.coli;
- уникальные сайты узнавания рестрикционными эндонуклеазами, имеющие следующие координаты: EcoR (722), Kpn I (691), Xho I (2278), Xbal(2284).
3. Рекомбинантная плазмидная ДНК pBACarpVax-G размером 5437 п.о. и молекулярной массой 36,1·106 дальтон, обеспечивающая развитие у рыб защитного иммунитета против заражения вирулентным изолятом вируса весенней виремии карпа российской аквакультуры в виде ДНК - вакцины при внутримышечном введении, включающая:
- EcoR I - Xho I фрагмент размером 1556 п.о., содержащий полинуклеотид, кодирующий поверхностный трансмембранный гликопротеин (G-ген) вируса весенней виремии карпа референсного для России изолята ЗЛ-4, охарактеризованный в п.1;
- EcoR I - Xho I векторный фрагмент ДНК плазмиды pBACarpVax размером 3881 п.о. [производная от pVax1 Invitrogen, США], содержащий β-актиновый промотор карпа по сайтам рестрикции Nru I - EcoR I и последовательность BGH poly А, обеспечивающие экспрессию G-гена в клетках эукариот; Т7 промотор, pMB1 ori и ген устойчивости к канамицину, обеспечивающие селекцию и размножение целевой плазмиды в клетках бактерий Е.coli;
- уникальные сайты узнавания рестрикционными эндонуклеазами:
EcoR I (1615), Xho I (3257).