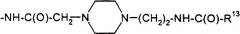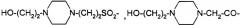Аналоги glp-1
Иллюстрации
Показать всеНастоящее изобретение относится к новым пептидным аналогам глюкагон-подобного пептида-1 и его фармацевтически приемлемым солям, которые применяют для лечения млекопитающих. 7 н. и 3 з.п. ф-лы, 1 табл.
Реферат
Предпосылки создания изобретения
Настоящее изобретение направлено на пептидные аналоги глюкагон-подобного пептида-1, его фармацевтически приемлемые соли, способы применения таких аналогов для лечения млекопитающих и фармацевтические композиции, применяющиеся для этого, включающие упомянутые аналоги.
Амид (GLP-1) глюкагон-подобного пептида-1 (7-36) синтезируется в L-клетках кишечника в течение тканеспецифичного посттрансляционного процессинга препроглюкагона, предшественника глюкагона (Varndell, J.M., et al., J. Histochem Cytochem, 1985:33:1080-6) и высвобождается в кровоток в ответ на прием пищи. Концентрация GLP-1 в плазме увеличивается от уровня, определяемого на голодный желудок, составляющего приблизительно 15 пмоль/л, до максимального послеобеденного уровня, составляющего 40 пмоль/л. Было продемонстрировано, что для данного увеличения концентрации глюкозы в плазме увеличение уровня инсулина в плазме приблизительно в три раза выше при пероральном введении глюкозы, чем при внутривенном (Kreymann, В., et al., Lancet 1987:2, 1300-4). Это связанное с питанием увеличение высвобождения инсулина, известное как эффект инкреции, является в основном гуморальным, и GLP-1 в настоящее время считается наиболее эффективным инкретином у людей. В добавление к инсулинотропному эффекту GLP-1 подавляет секрецию глюкагона, замедляет опорожнение желудка (Wettergren A., et al., Dig Dis Sci 1993:38:665-73) и может улучшать периферийное распределение глюкозы (D'Alessio, D.A. et al., J. Clin Invest 1994:93:2293-6).
В 1994 г. возможность терапевтического применения GLP-1 была предложена на основании наблюдения, что однократная подкожная доза (п/к)GLP-1 может полностью нормализовать послеобеденные уровни глюкозы у пациентов с инсулиннезависимым сахарным диабетом (NIDDM) (Gutniak, M.K., et al., Diabetes Care 1994:17:1039-44). Считалось, что данный эффект опосредуется как увеличением высвобождения инсулина, так и уменьшением секреции глюкагона. Кроме того, было показано, что внутривенное вливание GLP-1 замедляет послеобеденное опорожнение желудка у пациентов с NIDDM (Williams, В., et al., J. Clin Endo Metab 1996:81:327-32). В отличие от сульфонилмочевин инсулинотропное действие GLP-1 зависит от концентрации глюкозы в плазме (Holz, G.G. 4th, et al., Nature 1993:361:362-5). Так, прекращение GLP-1-опосредованного высвобождения инсулина при низкой концентрации глюкозы в плазме защищает от тяжелой гипогликемии. Данное сочетание активностей дает GLP-1 уникальные эффективные терапевтические преимущества по сравнению с другими агентами, использующимися в настоящее время для лечения NIDDM.
Многочисленные исследования показали, что, если GLP-1 давать здоровым субъектам, то он эффективно влияет на гликемические уровни, а также на концентрации инсулина и глюкагона (Orskov, C, Diabetologia 35:701-711, 1992; Holst, J.J., et al., Potential of GLP-1 in diabetes management in Glucagon III, Handbook of Experimental Pharmacology, Lefevbre PJ, Ed. Berlin, Springer Verlag, 1996, p.311-326), данные эффекты являются глюкозозависимыми (Kreymann, В., et al., Lancet ii: 1300-1304, 1987; Weir, G.C., et al., Diabetes 38:338-342, 1989). Более того, он также является эффективным для пациентов с диабетом (Gutniak, M., N. Engl J Med 226:1316-1322, 1992; Nathan, D.M., et al., Diabetes Care 15:270-276, 1992), нормализуя уровни глюкозы в крови у субъектов, страдающих диабетом типа 2 (Nauck, MA, et al., Diagbetologia 36:741-744, 1993), и улучшая гликемический контроль у пациентов типа 1 (Creutzfeldt, W.O., et al., Diabetes Care 19:580-586, 1996), что повышает возможность его применения в качестве терапевтического агента.
GLP-1 является, однако, метаболически нестабильным, имеет полупериод жизни в плазме (t1/2), составляющий только 1-2 мин in vivo. Экзогенно введенный GLP-1 тоже быстро разрушается (Deacon, C.F., et al., Diabetes 44:1126-1131, 1995). Такая метаболическая нестабильность ограничивает терапевтическую эффективность природного GLP-1. Следовательно, существует потребность в аналогах GLP-1, которые являются более активными, или метаболически более стабильными, чем природный GLP-1.
Краткое содержание изобретения
В одном аспекте настоящее изобретение направлено на соединение формулы (I)
(R2R3)-A7-A8-A9-A10-A11-A12-A13-A14-A15-A16-A17-A18-A19-A20-A21-A22-A23-A24-A25-A26-A27-A28-A29-A30-A31-A32-A33-A34-A35-A36-A37-A38-A39-R1,
(I)
где
A7 представляет собой L-His, Ura, Paa, Pta, Amp, Tma-His, дезамино-His, или удален;
A8 представляет собой Ala, D-Ala, Aib, Acc, N-Me-Ala, N-Me-D-Ala или N-Me-Gly;
A9 представляет собой Glu, N-Me-Glu, N-Me-Asp или Asp;
A10 представляет собой Gly, Acc, β-Ala или Aib;
A11 представляет собой Thr или Ser;
A12 представляет собой Phe, Acc, Aic, Aib, 3-Pal, 4-Pal, β-Nal, Cha, Trp или X1-Phe;
A13 представляет собой Thr или Ser;
A14 представляет собой Ser или Aib;
A15 представляет собой Asp или Glu;
A16 представляет собой Val, Acc, Aib, Leu, Ile, Tle, Nle, Abu, Ala или Cha;
A17 представляет собой Ser или Thr;
A18 представляет собой Ser или Thr;
A19 представляет собой Tyr, Cha, Phe, 3-Pal, 4-Pal, Acc, β-Nal или X1-Phe;
A20 представляет собой Leu, Acc, Aib, Nle, Ile, Cha, Tle, Val, Phe или X1-Phe;
A21 представляет собой Glu или Asp;
A22 представляет собой Gly, Acc, β-Ala, Glu или Aib;
A23 представляет собой Gln, Asp, Asn или Glu;
A24 представляет собой Ala, Aib, Val, Abu, Tle или Acc;
A25 представляет собой Ala, Aib, Val, Abu, Tle, Acc, Lys, Arg, hArg, Orn, HN-CH((CH2)n-N(R10R11))-C(O) или HN-CH((CH2)e-X3)-C(O);
A26 представляет собой Lys, Arg, hArg, Orn, HN-CH((CH2)n-N(R10R11))-C(O) или HN-CH((CH2)e-X3)-C(O);
A27 представляет собой Glu, Asp, Leu, Aib или Lys;
A28 представляет собой Phe, Pal, β-Nal, X1-Phe, Aic, Acc, Aib, Cha или Trp;
A29 представляет собой Ile, Acc, Aib, Leu, Nle, Cha, Tle, Val, Abu, Ala или Phe;
A30 представляет собой Ala, Aib или Acc;
A31 представляет собой Trp, β-Nal, 3-Pal, 4-Pal, Phe, Acc, Aib или Cha;
A32 представляет собой Leu, Acc, Aib, Nle, Ile, Cha, Tle, Phe, X1-Phe или Ala;
A33 представляет собой Val, Acc, Aib, Leu, Ile, Tle, Nle, Cha, Ala, Phe, Abu, Lys или X1-Phe;
A34 представляет собой Lys, Arg, hArg, Orn, HN-CH((CH2)n-N(R10R11))-C(O) или HN-CH((CH2)e-X3)-C(О);
A35 представляет собой Gly, β-Ala, D-Ala, Gaba, Ava, HN-(CH2)m-C(O), Aib, Acc или D-аминокислоту;
A36 представляет собой L- или D-Arg, D- или L-Lys, D- или L-hArg, D- или L-Orn, HN-CH((CH2)n-N(R10R11))-C(O), HN-CH((CH2)e-X3)-C(O) или удален;
A37 представляет собой Gly, β-Ala, Gaba, Ava, Aib, Acc, Ado, Arg, Asp, Aun, Aec, HN-(CH2)m-C(O), HN-CH((CH2)n-N(R10R1l))-C(O), D-аминокислоту или удален;
A38 представляет собой D- или L-Lys, D- или L-Arg, D- или L-hArg, D- или L-Orn, HN-CH((CH2)n-N(R10R11))-C(O), HN-CH((CH2)е-X3)-C(O), Ava, Ado, Aec, или удален;
A39 представляет собой D- или L-Lys, D- или L-Arg, HN-CH((CH2)n-N(R10R11))-C(O), Ava, Ado, или Aec;
X1 в каждом случае независимо выбирают из группы, состоящей из (C1-C6)алкила, OH и галогена;
R1 представляет собой OH, NH2, (C1-C30)алкокси или NH-X2-CH2-Z0, где X2 представляет собой (C1-C12)углеводородный фрагмент, а Z0 представляет собой H, OH, CO2H или CONH2;
X3 представляет собой ,
или -C(O)-NHR12, где X4 представляет собой, в каждом случае независимо, -C(O)-, -NH-C(O)- или -CH2-, и где f представляет собой, в каждом случае независимо, целое число от 1 до 29 включительно;
каждый из R2 и R3 независимо выбирают из группы, состоящей из H, (C1-C30)алкила, (С2-С30)алкенила, фенил(C1-C30)алкила, нафтил(C1-C30)алкила, гидрокси(C1-C30)алкила, гидрокси(C2-C30)алкенила, гидроксифенил(C1-C30)алкила и гидроксинафтил(C1-C30)алкила; или один из R2 и R3 представляет собой , (C1-C30)ацил, (C1-C30)алкилсульфонил, С(О)Х5, или ;
где Y представляет собой H, OH или NH2;
r равно числу от 0 до 4; q равно числу от 0 до 4;
и X5 представляет собой (C1-C30)алкил, (C2-C30)алкенил, фенил(C1-C30)алкил, нафтил(C1-C30)алкил, гидрокси(C1-C30)алкил, гидрокси(C2-C30)алкенил, гидроксифенил(C1-C30)алкил или гидроксинафтил(C1-C30)алкил;
e представляет собой, в каждом случае независимо, целое число от 1 до 4 включительно;
m представляет собой, в каждом случае независимо, целое число от 5 до 24 включительно;
n представляет собой, в каждом случае независимо, целое число от 1 до 5 включительно;
каждый из R10 и R11 представляет собой, в каждом случае независимо, H, (C1-C30)алкил, (C1-C30)ацил, (C1-C30)алкилсульфонил, -C((NH)(NH2)) или ; и
R12 и R13 каждый представляет собой, в каждом случае независимо, (C1-C30)алкил;
при условии, что:
если A7 представляет собой Ura, Paa или Pta, то R2 и R3 удалены;
если R10 представляет собой (C1-C30)ацил, (C1-C30)алкилсульфонил, -C((NH)(NH2)) или , то R11 представляет собой Н или (C1-C30)алкил;
(i) по меньшей мере одна аминокислота соединения формулы (I) отличается от соответствующей аминокислоты нативной последовательности hGLP-1(7-36, -37 или -38)NH2 или hGLP-1(7-36, -37 или -38)ОН;
(ii) соединение формулы (I) не является аналогом hGLP-1(7-36, -37 или -38)NH2 или hGLP-1(7-36, -37 или -38)ОН, где в единственной позиции произведено замещение на Ala;
(iii) соединение формулы (I) не является (Arg26,34, Lys38)hGLP-1(7-38)-E, (Lys26(Nε-алканоил))hGLP-1(7-36, -37 или -38)-Е, (Lys34(Nε-алканоил))hGLP-1(7-36, -37 или -38)-Е, (Lys26,34-бис(Nε-алканоил))hGLP-1(7-36, -37 или -38)-Е, (Arg26, Lys34(Nε-алканоил))hGLP-1(8-36, -37 или -38)-Е, (Arg26,34, Lys36(Nε-алканоил))hGLP-1(7-36, -37 или -38)-Е или (Arg26,34, Lys38(Nε-алканоил))hGLP-1(7-38)-Е, где Е представляет собой -ОН или -NH2;
(iv) соединение формулы (I) не является Z1-hGLP-1(7-36, -37 или -38)ОН, Z1-hGLP-1(7-36, -37 или -38)-NH2, где Z1 выбран из группы, состоящей из:
(а)(Arg26), (Arg34), (Arg26,34), (Lys36), (Arg26, Lys36), (Arg34, Lys36), (D-Lys36), (Arg38), (D-Arg36), (Arg26,34, Lys36) или (Arg26,36, Lys34);
(b) (Asp21);
(c) по меньшей мере одного из (Aib8), (D-Ala8) и (Asp9); и
(d) (Tyr7), (N-ацил-His7), (N-алкил-His7), (N-ацил-D-His7) или (N-алкил-D-His7);
(v) соединение формулы (I) не является сочетанием любых двух замещений, перечисленных в группах от (a) до (d); и
(vi) соединение формулы (I) не является (N-Me-Ala8)hGLP-1(8-36 или -37), (Glu15)hGLP-1(7-36 или -37), (Asp21)hGLP-1(7-36 или -37) или (Phe31)hGLP-1(7-36 или -37),
или его фармацевтически приемлемую соль.
К предпочтительной группе соединений, относящихся к упомянутому непосредственно выше соединению, относятся такие соединения, где А11 представляет собой Thr; А13 представляет собой Thr; А15 представляет собой Asp; А17 представляет собой Ser; А18 представляет собой Ser или Lys; А21 представляет собой Glu; А23 представляет собой Gln или Glu; А27 представляет собой Glu, Leu, Aib или Lys; и А31 представляет собой Trp, Phe или β-Nal; или их фармацевтически приемлемые соли.
К предпочтительной группе соединений, относящихся к упомянутой непосредственно выше группе соединений, относятся такие соединения, где А9 представляет собой Glu, N-Me-Glu или N-Me-Asp; А12 представляет собой Phe, Acc, β-Nal или Aic; А16 представляет собой Val, Acc или Aib; А19 представляет собой Tyr или β-Nal; А20 представляет собой Leu, Acc или Cha; А24 представляет собой Ala, Aib или Acc; A25 представляет собой Ala, Aib, Acc, Lys, Arg, hArg, Orn, HN-CH((CH2)n-N(R10R11))-C(O) или HN-CH((CH2)e-X3)-C(O); A28 представляет собой Phe или β-Nal; A29 представляет собой Ile или Acc; A30 представляет собой Ala или Aib; A32 представляет собой Leu, Acc или Cha; и A33 представляет собой Val, Lys или Acc; или их фармацевтически приемлемые соли.
К предпочтительной группе соединений, относящихся к упомянутой непосредственно выше группе соединений, относятся такие соединения, где A8 представляет собой Ala, D-Ala, Aib, A6c, A5c, N-Me-Ala, N-Me-D-Ala или N-Me-Gly; A10 представляет собой Gly; A12 представляет собой Phe, β-Nal, A6c или A5c; A16 представляет собой Val, A6c или A5c; A20 представляет собой Leu, A6c, A5c или Cha; A22 представляет собой Gly, β-Ala, Glu или Aib; A24 представляет собой Ala или Aib; A29 представляет собой Ile, A6c или A5c; A32 представляет собой Leu, A6c, A5c или Cha; A33 представляет собой Val, Lys, A6c или A5c; A35 представляет собой Aib, β-Ala, Ado, A6c, A5c, D-Arg или Gly; и A37 представляет собой Gly, Aib, β-Ala, Ado, D-Ala Ava, Asp, Aun, D-Asp, D-Arg, Aec, HN-CH((CH2)n-N(R10R11))-C(O) или удален; или их фармацевтически приемлемые соли.
К предпочтительной группе соединений, относящихся к упомянутой непосредственно выше группе соединений, относятся такие соединения, где X4 в каждом случае представляет собой -C(O)-; и R1 представляет собой OH или NH2; или их фармацевтически приемлемые соли.
К предпочтительной группе соединений, относящихся к упомянутой непосредственно выше группе соединений, относятся такие соединения или их фармацевтически приемлемые соли, где R2 представляет собой H и R3 представляет собой (C1-C30)алкил, (С2-С30)алкенил, (C1-C30)ацил, (C1-C30)алкилсульфонил,
или
.
Предпочтительным соединением формулы (I) является такое соединение, где A8 представляет собой Ala, D-Ala, Aib, A6c, A5c, N-Me-Ala, N-Me-D-Ala или N-Me-Gly; A10 представляет собой Gly; A12 представляет собой Phe, β-Nal A6c или A5c; A16 представляет собой Val, A6c или A5c; A20 представляет собой Leu, A6c, A5c или Cha; A22 представляет собой Gly, β-Ala, Glu или Aib; A24 представляет собой Ala или Aib; A29 представляет собой Ile, А6с или A5c; A32 представляет собой Leu, A6c, A5c или Cha; A33 представляет собой Val, Lys, A6c или A5c; A35 представляет собой Aib, β-Ala, Ado, A6c, A5c D-Arg или Gly; и A37 представляет собой Gly, Aib, β-Ala, Ado, D-Ala, Ava, Asp, Aun, D-Asp, D-Arg, Aec, HN-CH((CH2)n-N(R10R11))-C(O) или удален; X4 в каждом случае представляет собой -C(O)-; e в каждом случае независимо представляет собой 1 или 2; R1 представляет собой OH или NH2; R10 представляет собой (C1-C30)ацил, (C1-C30)алкилсульфонил или , и R11 представляет собой H; или его фармацевтически приемлемая соль.
Более предпочтительным из приведенных непосредственно выше соединений является такое, где R10 представляет собой (C4-С20)ацил, (C4-C20)алкилсульфонил или , или его фармацевтически приемлемая соль.
Более предпочтительным соединением формулы (I) является соединение формулы:
(Aib8,35)hGLP-1(7-36)NH2,
((Nα-HEPES-His)7, Aib8,35)hGLP-1(7-36)NH2,
((Nα-HEPA-His)7, Aib8,35)hGLP-1(7-36)NH2,
(Aib8, β-Ala35)hGLP-1(7-36)NH2,
(Aib8,35, Arg26,34, Lys36(Nε-тетрадеканоил))hGLP-1(7-36)NH2,
(Aib8,35, Arg26, Lys34(Nε-тетрадеканоил))hGLP-1(7-36)NH2,
(Aib8,35,37, Arg26,34, Lys38(Nε-тетрадеканоил))hGLP-1(7-38)NH2,
(Aib8,35, Arg26,34, Lys36(Nε-деканоил))hGLP-1(7-36)NH2,
(Aib8,35, Arg26,34, Lys36(Nε-додекансульфонил))hGLP-1(7-36)NH2,
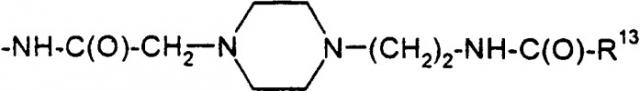
(Aib8,35, Arg26,34, Lys36(Nε-(2-(4-тетрадецил-1-пиперазин)цетил)))hGLP-1(7-36)NH2,
(Aib8,35, Arg26,34, Asp36(1-(4-тетрадецил-пиперазин)))hGLP-1(7-36)NH2,
(Aib8,35, Arg26,34, Asp36(1-тетрадециламино))hGLP-1(7-36)NH2,
(Aib8,35, Arg26,34, Lys36(Nε-тетрадеканоил),β-Ala37)hGLP-1(7-37)-OH или
(Aib8,35, Arg26,34, Lys36(Nε-тетрадеканоил))hGLP-1(7-36)-OH,
или его фармацевтически приемлемая соль.
Более предпочтительным из приведенной непосредственно выше группы соединений является соединение формулы:
(Aib8,35)hGLP-1(7-36)NH2,
(Aib8, β-Ala35)hGLP-1(7-36)NH2,
(Aib8,35, Arg26, Lys34(Nε-тетрадеканоил))hGLP-1(7-36)NH2,
(Aib8,35,37, Arg26,34, Lys38(Nε-тетрадеканоил))hGLP-1(7-38)NH2,
(Aib8,35, Arg26,34, Lys36(Nε-деканоил))hGLP-1(7-36)NH2 или
(Aib8,35, Arg26,34, Lys36(Nε-тетрадеканоил),β-Ala37)hGLP-1(7-37)OH
или его фармацевтически приемлемая соль.
Другим более предпочтительным соединением формулы (I) является соединение формулы:
(Aib8,35, A6c32)hGLP-1(7-36)NH2;
(Aib8,35, Glu23)hGLP-1(7-36)NH2;
(Aib8,24,35)hGLP-1(7-36)NH2;
(Aib8,35, Glu23, A6c32)hGLP-1(7-36)NH2;
(Aib8, Glu23, β-Ala35)hGLP-1(7-36)NH2;
(Aib8,35, Arg26,34)hGLP-1(7-36)NH2;
(Aib8,35, Arg26,34, Lys36(Nε-октаноил))hGLP-1(7-36)NH2;
(Aib8,35, Arg26,34, Lys36(Nε-деканоил))hGLP-1(7-36)OH;
(Aib8,35, Lys25, Arg26,34, Lys36(Nε-деканоил))hGLP-1(7-36)OH;
(Aib8, Arg26,34, β-Ala35, Lys36(Nε-Aec-деканоил))hGLP-1(7-36)NH2;
(Aib8,35, Arg26,34, Ava37, Ado38)hGLP-1(7-38)NH2;
(Aib8,35, Arg26,34, Asp37, Ava38, Ado39)hGLP-1(7-39)NH2;
(Aib8,35, Arg26,34, Aun37)hGLP-1(7-37)NH2;
(Aib8,17,35)hGLP-1(7-36)NH2;
(Aib8, Arg26,34, β-Ala35, D-Asp37, Ava38, Aun39)hGLP-1(7-39)NH2;
(Gly8, β-Ala35)hGLP-1(7-36)NH2;
(Ser8, β-Ala35)hGLP-1(7-36)NH2;
(Aib8, Glu22,23, β-Ala35)hGLP-1(7-36)NH2;
(Gly8, Aib35)hGLP-1(7-36)NH2;
(Aib8, Lys18, β-Ala35)hGLP-1(7-36)NH2;
(Aib8, Leu27, β-Ala35)hGLP-1(7-36)NH2;
(Aib8, Lys33, β-Ala35)hGLP-1(7-36)NH2;
(Aib8, Lys18, Leu27, β-Ala35)hGLP-1(7-36)NH2;
(Aib8, D-Arg36)hGLP-1(7-36)NH2;
(Aib8, β-Ala35, D-Arg37)hGLP-1(7-37)NH2;
(Aib8,27, β-Ala35)hGLP-1(7-36)NH2;
(Aib8,27, β-Ala35,37, Arg38)hGLP-1(7-38)NH2;
(Aib8,27, β-Ala35,37, Arg38,39)hGLP-1(7-39)NH2;
(Aib8, Lys18,27, β-Ala35 )hGLP-1(7-36)NH2;
(Aib8, Lys27, β-Ala35)hGLP-1(7-36)NH2;
(Aib8, β-Ala35, Arg38)hGLP-1(7-38)NH2;
(Aib8, Arg26,34, β-Ala35)hGLP-1(7-36)NH2;
(Aib8, D-Arg35)hGLP-1(7-36)NH2;
(Aib8, β-Ala35, Arg37)hGLP-1(7-37)NH2;
(Aib8, Phe31, β-Ala35)hGLP-1(7-36)NH2;
(Aib8,35, Phe31)hGLP-1(7-36)NH2;
(Aib8,35, Nal31)hGLP-1(7-36)NH2;
(Aib8,35, Nal28,31)hGLP-1(7-36)NH2;
(Aib8,35, Arg26,34, Nal31)hGLP-1(7-36)NH2;
(Aib8,35, Arg26,34, Phe31)hGLP-1(7-36)NH2;
(Aib8,35, Nal19,31)hGLP-1(7-36)NH2;
(Aib8,35, Nal12,31)hGLP-1(7-36)NH2;
(Aib8,35, Lys36(Nε-деканоил))hGLP-1(7-36)NH2;
(Aib8,35, Arg34, Lys26(Nε-деканоил))hGLP-1(7-36)NH2;
(Aib8,35, Arg26,34, Lys36(Nε-додеканоил))hGLP-1(7-36)NH2;
(Aib8, B-Ala35, Ser37(O-деканоил))hGLP1(7-37)-NH2;
(Aib8,27, β-Ala35,37, Arg38, Lys39(Nε-октаноил))hGLP-1(7-39)NH2;
(Aib8, Arg26,34, β-Ala35, Lys37(Nε-октаноил))hGLP-1(7-37)NH2;
(Aib8, Arg26,34, β-Ala35, Lys37(Nε-деканоил))hGLP-1(7-37)NH2; или
(Aib8, Arg28,34, β-Ala35, Lys37(Nε-тетрадеканоил))hGLP-1(7-37)NH2;
или его фармацевтически приемлемая соль.
Другим более предпочтительным соединением формулы (I) является каждое из соединений, которые отдельно пронумерованы в данном документе ниже в разделе Примеры настоящего описания, или его фармацевтически приемлемая соль.
В другом аспекте настоящее изобретение предоставляет фармацевтическую композицию, включающую эффективное количество соединения формулы (I) или его фармацевтически приемлемой соли, как определено в данном документе выше, и фармацевтически приемлемый носитель или разбавитель.
В следующем аспекте настоящее изобретение предоставляет способ индуцирования агонистического эффекта по отношению к рецептору GLP-1 у субъекта, нуждающегося в этом, который включает введение упомянутому субъекту эффективного количества соединения формулы (I), как определено в данном документе выше, или его фармацевтически приемлемой соли.
В дальнейшем аспекте настоящее изобретение предоставляет способ лечения заболевания, выбранного из группы, включающей диабет типа I, диабет типа II, ожирение, глюкагономы, секреторные нарушения дыхательных путей, метаболические нарушения, артрит, остеопороз, заболевания центральной нервной системы, рестеноз, нейродегенеративные заболевания, почечную недостаточность, застойную сердечную недостаточность, нефротический синдром, цирроз, легочный отек, гипертонию и заболевания, при которых желательно уменьшение потребления пищи, у субъекта, нуждающегося в этом, который включает введение упомянутому субъекту эффективного количества соединения формулы (I), как определено в данном документе выше, или его фармацевтически приемлемой соли. Предпочтительным вариантом упомянутого непосредственно выше способа является такой способ, где подлежащим лечению заболеванием является диабет типа I или II.
За исключением N-концевой аминокислоты, все аббревиатуры (например, Ala) аминокислот в данном описании относятся к структуре -NH-CH(R)-CO-, где R обозначает боковую цепь аминокислоты (например, CH3 для Ala). Для N-концевой аминокислоты аббревиатура относится к структуре (R2R3)-N-CH(R)-CO-, где R обозначает боковую цепь аминокислоты, а R2 и R3 являются такими, как определены выше, за исключением случая, когда A7 представляет собой Ura, Paa или Pta, в данном случае R2 и R3 не присутствуют, так как Ura, Paa и Pta рассматриваются в данном документе как дез-амино аминокислоты. Amp, β-Nal, Nle, Cha, 3-Pal, 4-Pal и Aib являются аббревиатурами следующих α-аминокислот: 4-амино-фенилаланина, β-(2-нафтил)аланина, норлейцина, циклогексилаланина, β-(3-пиридинил)аланина, β-(4-пиридинил)аланина и α-аминоизомаслянной кислоты соответственно. Обозначения других аминокислот: Ura обозначает уроканиновую кислоту; Pta обозначает (4-пиридилтио)уксусную кислоту; Paa обозначает транс-3-(3-пиридил)акриловую кислоту; Tma-His обозначает N,N-тетраметиламидино-гистидин; N-Me-Ala обозначает N-метил-аланин; N-Me-Gly обозначает N-метил-глицин; N-Me-Glu обозначает N-метил-глутаминовую кислоту; Tie обозначает трет-бутилглицин; Abu обозначает α-аминомасляную кислоту; Tba обозначает трет-бутилаланин; Orn обозначает орнитин; Aib обозначает α-аминоизомасляную кислоту; β-Ala обозначает β-аланин; Gaba обозначает γ-аминомасляную кислоту; Ava обозначает 5-аминовалериановую кислоту; Ado обозначает 12-аминододекановую кислоту, Aic обозначает 2-аминоиндан-2-карбоновую кислоту; Aun обозначает 11-аминоундекановую кислоту; и Aec обозначает 4-(2-аминоэтил)-1-карбоксиметилпиперазин, представленный структурой: .
Под Acc подразумевается аминокислота, выбранная из группы, состоящей из 1-амино-1-циклопропанкарбоновой кислоты (A3c); 1-амино-1-циклобутанкарбоновой кислоты (A4c); 1-амино-1-циклопентанкарбоновой кислоты (A5c); 1-амино-1-циклогексанкарбоновой кислоты (A6c); 1-амино-1-циклогептанкарбоновой кислоты (A7c); 1-амино-1-циклооктанкарбоновой кислоты (A8c); и 1-амино-1-циклононанкарбоновой кислоты (A9c). В приведенной выше формуле гидроксиалкил, гидроксифенилалкил и гидроксинафтилалкил могут содержать 1-4 гидроксильных заместителей. COX5 относится к -C=O·X5. Примеры -C=O·X5 включают, не ограничиваясь ими, ацетил и фенилпропионил.
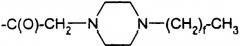
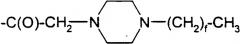
Соединения, обозначаемые Lys(Nε-алканоил), представлены следующей структурой:
.
Соединения, обозначаемые Lys(Nε-алкилсульфонил), представлены следующей структурой:
.
Соединения, обозначаемые Lys(Nε-(2-(4-алкил-1-пиперазин)-ацетил)), представлены следующей структурой: .
Соединения, обозначаемые Asp(1-(4-алкил-пиперазин)), представлены следующей структурой:
.
Соединения, обозначаемые Asp(1-алкиламино), представлены следующей структурой:
.
Соединения, обозначаемые Lys(Nε-Аес-алканоил), представлены следующей структурой: .
Переменная n в вышеприведенных структурах равна 1-30. Соединения, обозначаемые Lys(Nε-Асе-алканоил), представлены структурой
.
Полные названия, соответствующие другим аббревиатурам, использующимся в данном документе, являются следующими: Boc обозначает т-бутилоксикарбонил, HF обозначает фтористый водород, Fm обозначает формил, Xan обозначает ксантил, Bzl обозначает бензил, Tos обозначает тозил, DNP обозначает 2,4-динитрофенил, DMF обозначает диметилформамид, DCM обозначает дихлорметан, HBTU обозначает гексафторфосфат 2-(1H-бензотриазол-1-ил)-1,1,3,3-тетраметилурония, DIEA обозначает диизопропилэтиламин, HOAc обозначает уксусную кислоту, TFA обозначает трифторуксусную кислоту, 2CIZ обозначает 2-хлорбензилоксикарбонил, 2BrZ обозначает 2-бромбензилоксикарбонил, OcHex обозначает O-циклогексил, Fmoc обозначает 9-флуоренилметоксикарбонил, HOBt обозначает N-гидроксибензотриазол и РАМ смола обозначает смолу 4-гидроксиметилфенилацетамидометил.
Термин "галоген" охватывает фтор, хлор, бром и иод.
Термин "(C1-C30)углеводородный фрагмент" охватывает алкил, алкенил и алкинил, но в случае алкенила и алкинила имеет место С2-С30.
Пептид данного изобретения также обозначают здесь в другом формате, например, (A5c8)hGLP-1(7-36)NH2, с замещенными аминокислотами природной последовательности в первых круглых скобках (например, A5c8 для Ala8 в hGLP-1). Аббревиатура GLP-1 обозначает глюкагон-подобный пептид-1; hGLP-1 обозначает человеческий глюкагон-подобный пептид-1. Числа в круглых скобках относятся к числу аминокислот, присутствующих в пептиде (например, hGLP-1(7-36) обозначает аминокислоты от 7 до 36 в пептидной последовательности человеческого GLP-1). Последовательность hGLP-1(7-37) приведена в Mojsov, S., Int. J. Peptide Protein Res,. 40, 1992, pp. 333-342. Обозначение "NH2" в hGLP-1(7-36)NH2 означает, что C-конец пептида является амидированным. hGLP-1(7-36) означает, что C-конец является свободной кислотой. В hGLP-1(7-38) остатки в положениях 37 и 38 представляют собой Gly и Arg соответственно.
Подробное описание
Пептиды данного изобретения могут быть получены с помощью стандартного твердофазного пептидного синтеза. См., например, Stewart, J.M., et al., Solid Phase Synthesis (Pierce Chemical Co., 2d ed. 1984). Заместители R2 и R3 приведенной выше общей формулы могут быть присоединены к свободной аминогруппе N-концевой аминокислоты с помощью стандартных методов, известных в данной области. Например, алкильные группы, такие как (С1-С30)алкил, могут быть присоединены с помощью восстановительного алкилирования. Гидроксиалкильные группы, такие как (C1-C30)гидроксиалкил, могут быть также присоединены с помощью восстановительного алкилирования, где свободная гидроксильная группа защищена т-бутиловым эфиром. Ацильные группы, такие как СОЕ1, могут быть присоединены путем конденсации свободной кислоты, например E1COOH со свободной аминогруппой N-концевой аминокислоты, путем смешивания готовой смолы с 3 молярными эквивалентами как свободной кислоты, так и диизопропилкарбодиимида, в метиленхлориде в течение одного часа. Если свободная кислота содержит свободную гидроксильную группу, например п-гидроксифенилпропионовая кислота, то конденсацию нужно проводить с 3 дополнительными молярными эквивалентами HOBT.
Если R1 представляет собой NH-X2-CH2-CONH2, (т.e. Z0=CONH2), синтез пептида начинают с BocHN-X2-CH2-COOH, которую присоединяют к смоле MBHA. Если R1 представляет собой NH-X2-CH2-COOH (т.e. Z0=COOH), синтез пептида начинают с Boc-HN-X2-CH2-COOH, которую присоединяют к смоле РАМ. Для данной конкретной стадии используют 4 молярных эквивалента Boc-HN-X2-COOH, HBTU и HOBt, и 10 молярных эквивалентов DIEA. Время конденсации составляет приблизительно 8 часов.
Защищенную аминокислоту 1-(N-трет-бутоксикарбониламино)-1-циклогексанкарбоновую кислоту (Boc-A6c-OH) синтезируют следующим образом. 19,1г (0,133 моль) 1-амино-1-циклогексанкарбоновой кислоты (Acros Organics, Fisher Scientific, Pittsburgh, PA) растворяют в 200 мл диоксана и 100 мл воды. Добавляют 67 мл 2н NaOH. Раствор охлаждают на бане, содержащей воду со льдом. К этому раствору добавляют 32,0 г (0,147моль) ди-трет-бутилдикарбоната. Реакционную смесь перемешивают в течение ночи при комнатной температуре. Затем диоксан удаляют при пониженном давлении. К оставшемуся водному раствору добавляют 200 мл этилацетата. Смесь охлаждают на бане, содержащей воду со льдом. рН водного слоя доводят приблизительно до 3, добавляя 4н. HCl. Органический слой отделяют. Водный слой экстрагируют этилацетатом (1х100мл). Два органических слоя объединяют и промывают водой (2х150 мл), сушат над безводным MgSO4, фильтруют и концентрируют досуха при пониженном давлении. Остаток перекристаллизовывают в смеси этилацетат/гексаны. Получают 9,2 г чистого продукта, выход 29%.
Boc-A5c-OH синтезируют аналогично Boc-A6c-OH. Другие защищенные аминокислоты Acc могут быть получены средним специалистом в данной области аналогичным способом с помощью приведенных в данном документе инструкций.
При синтезе аналога GLP-1 данного изобретения, содержащего A5c, A6c 10 и/или Aib, время конденсации составляет 2 ч для данных остатков и остатков, следующих непосредственно за ними. Для синтеза (Tma-His7)hGLP-1(7-36)NH2 используют HBTU (2 ммоль) и DIEA (1,0 мл) в 4 мл DMF для взаимодействия с N-концевой свободной амногруппой пептида-смолы в последней реакции конденсации; время конденсации составляет приблизительно 2 часа.
Заместители R2 и R3 вышеприведенной общей формулы могут быть присоединены к свободной аминогруппе N-концевой аминокислоты с помощью стандартных методов, известных в данной области. Например, алкильные группы, такие как (С1-С30)алкил, могут быть присоединены с помощью восстановительного алкилирования. Гидроксиалкильные группы, такие как (C1-C30)гидроксиалкил, могут быть также присоединены с помощью восстановительного алкилирования, где свободная гидроксильная группа защищена т-бутиловым эфиром. Ацильные группы, например СОХ1, могут быть присоединены путем конденсации свободной кислоты, например Х1COOH со свободной аминогруппой N-концевой аминокислоты, путем смешивания готовой смолы с 3 молярными эквивалентами как свободной кислоты, так и диизопропилкарбодиимида, в метиленхлориде в течение одного часа. Если свободная кислота содержит свободную гидроксильную группу, например п-гидроксифенилпропионовая кислота, то конденсацию нужно проводить с 3 дополнительными молярными эквивалентами HOBT.
Соединение настоящего изобретения можно анализировать на активность как GLP-1 связывающее соединение в соответствии со следующей процедурой.
Клеточная культура:
Клетки крысиной инсулиномы RIN 5F (ATCC # CRL-2058, Американская коллекция типов культур, Manassas, VA), экспрессирующие рецептор GLP-1, культивируют в модифицированной по Дульбекко среде Игла (DMEM), содержащей 10% фетальную телячью сыворотку, и выдерживают при приблизительно 37°C во влажной атмосфере 5% СО2/95% воздух.
Связывание радиоактивно меченого лиганда:
Для изучения связывания радиоактивно меченого лиганда получают мембраны путем гомогенизации клеток RIN в 20 мл охлажденного во льду 50 мМ Трис-HCl с помощью Brinkman Polytron (Westbury, NY) (настройка 6, 15 сек). Гомогенаты дважды промывают с помощью центрифугирования (39000 g/10 мин), и конечные осадки ресуспендируют в 50 мМ Трис-HCl, содержащем 2,5 мМ MgCl2, 0,1 мг/мл бацитрацина (Sigma Chemical, St. Louis, MO), и 0,1% BSA. Для анализа аликвоты (0,4 мл) инкубируют с 0,05 нМ (125I)GLP-1(7-36) (˜2200 Ки/ммоль, New England Nuclear, Boston, MA), в присутствии или отсутствие 0,05 мл немеченных конкурирующих тестируемых пептидов. После 100 мин инкубации (25°C), связанный (125I)GLP-1(7-36) отделяют от свободного путем быстрой фильтрации через GF/C фильтры (Brandel, Gaithersburg, MD), которые были предварительно смочены в 0,5% полиэтиленимине. Затем фильтры промывают три раза аликвотами объемом 5 мл охлажденного во льду 50 мМ Трис-HCl, и связанную радиоактивность, задержанную на фильтре, считают с помощью гамма-спектрометрии (Wallac LKB, Gaithersburg, MD). Специфичное связывание определяют как разность общего связанного (125I)GLP-1(7-36) и связанного в присутствии 1000 нМ GLP1(7-36) (Bachem, Torrence, CA).
Пептиды данного изобретения могут быть предоставлены в виде фармацевтически приемлемых солей. Примеры таких солей включают, не ограничиваясь ими, соли, образованные органическими кислотами (например, уксусной, молочной, малеиновой, лимонной, яблочной, аскорбиновой, янтарной, бензойной, метансульфоновой, толуолсульфоновой или памоевой кислотой), неорганическими кислотами (например, хлористоводородной кислотой, серной кислотой или фосфорной кислотой), и полимерными кислотами (например, танниновой кислотой, карбоксиметилцеллюлозой, полимолочной, полигликолевой, или сополимерами полимолочной-гликолевой кислот). Типичный метод получения соли пептида настоящего изобретения является хорошо известным в данной области и может сопровождаться стандартными методами солевого обмена. Соответственно соль TFA и пептида настоящего изобретения (соль TFA получают в результате очистки пептида с помощью препаративной ВЭЖХ, с элюированием буферными растворами, содержащими TFA) может быть превращена в другую соль, такую как соль уксусной кислоты, путем растворения пептида в небольшом количестве 0,25н. водного раствора уксусной кислоты. Полученный раствор наносят на колонку для полупрепаративной ВЭЖХ (Zorbax, 300 SB, C-8). Вещество с колонки элюируют (1) 0,1н. водным раствором ацетата аммония в течение 0,5 ч, (2) 0,25н. водным раствором уксусной кислоты в течение 0,5 ч и (3) в линейном градиенте (от 20% до 100% раствора В в течение 30 мин) при скорости потока 4 мл/мин (раствор A представляет собой 0,25н. водный раствор уксусной кислоты; раствор В представляет собой 0,25н. раствор уксусной кислоты в смеси ацетонитрил/вода, 80:20). Фракции, содержащие пептид, собирают и лиофилизируют досуха.
Как хорошо известно специалистам в данной области, известные и возможные применения GLP-1 являются разнообразными и многочисленными (см., Todd, J.F., et al., Clinical Science, 1998, 95, pp.325-329; и Todd, J.F. et al., European Journal of Clinical Investigation, 1997, 27, pp.533-536). Таким образом, введение соединений данного изобретения с целью получения агонистического эффекта может иметь такие же эффекты и применения, как сам GLP-1. Данные разнообразные применения GLP-1 могут быть суммированы следующим образом, для лечения: диабета типа I, диабета типа II, ожирения, глюкагономы, секреторных нарушений дыхательных путей, метаболических нарушений, артрита, остеопороза, заболеваний центральной нервной системы, рестеноза, нейродегенеративных заболеваний, почечной недостаточности, застойной сердечной недостаточности, нефротического синдрома, цирроза, легочного отека, гипертонии и заболеваний, при которых желательно уменьшение потребления пищи. Аналоги GLP-1 настоящего изобретения, которые вызывают антагонистический эффект у субъекта, могут использоваться для лечения следующих заболеваний: гипогликемии и синдрома малабсорбции, связанного с гастроэктомией или резекцией тонкого кишечника.
Соответственно в объем настоящего изобретения входят фармацевтические композиции, включающие, в качестве активного ингредиента, по меньшей мере одно из соединений формулы (I) в сочетании с фармацевтически приемлемым носителем.
Доза активного ингредиента в композициях данного изобретения может варьировать; однако, необходимо, чтобы количество активного ингредиента было таким, чтобы получить подходящую дозированную форму. Выбранная доза зависит от желаемого терапевтичес