6-фосфоглюконолактоназа из escherichia coli, фрагмент днк, бактерия, принадлежащая к роду escherichia - продуцент l-аминокислоты и способ получения l-аминокислоты
Иллюстрации
Показать всеИзобретение относится к биотехнологии, L-аминокислоты, такие как L-триптофан, L-фенилаланин, L-тирозин и L-гистидин получают культивированием бактерии рода Escherichia, модифицированной таким образом, что активность 6-фосфоглюконолактоназы в ней повышена. Заявленное изобретение позволяет получать указанные аминокислоты с высокой степенью эффективности. 4 н. и 11 з.п. ф-лы, 5 табл., 8 ил.
Реферат
Область техники.
Настоящее изобретение относится к биотехнологии, конкретно к гену, полученному из бактерии Escherichia coli, кодирующему 6-фосфоглюконолактоназу, и к способу получения L-аминокислот методом ферментации. Указанный ген способствует увеличению продукции L-аминокислот, а именно ароматических L-аминокислот, таких как L-триптофан, L-фенилаланин и L-тирозин.
Предшествующий уровень техники.
Пентозофосфатный путь (РРР) является важной частью центрального метаболизма у большинства организмов. В окислительной ветви пентозофосфатного пути происходит синтез НАДФ-Н, а фосфорилированные карбогидраты - промежуточные соединения неокислительной ветви пентозофосфатного пути, являются предшественниками пути биосинтеза нуклеотидов (рибозо-5-фосфат), ароматических аминокислот и витаминов (эритрозо-5-фосфат). Эритрозо-4-фосфат (Е4р) является основным предшественником общего пути биосинтеза ароматических L-кислот. Таким образом, оптимизация специфических путей биосинтеза фосфоенолпирувата (PEP) и Е4р может положительно повлиять на продукцию ароматических L-аминокислот.
Окислительная ветвь пентозофосфатного цикла включает в себя три реакции. Первая и третья реакции катализируются хорошо изученными ферментами глюкозо-6-фосфатдегидрогеназой (ЕС 1.1.1.49) и глюконат-6-фосфатдегидрогеназой (ЕС 1.1.1.44), которые кодируются генами zwf и gnd соответственно. Вторая реакция - это реакция гидролиза 6-фосфоглюконолактона с образованием 6-фосфоглюконата (Escherichia coli and Salmonella, Second Edition, Editor in Chief: F.C.Neidhardt, ASM Press, Washington D.C., 1996). Фермент, который катализирует эту реакцию, был обнаружен во многих организмах, включая, например, человека (Collard, F., et al, FEBS Lett., 459:2, 223-6 (1999)), Trypanosoma brucei (Duffieux, F., et al, J. Biol. Chem., 275:36, 27559-65 (2000)), Plasmodium berghei (Clarke, J.L., et al, Eur. J. Biochem., 268:7, 2013-9 (2001)), Pseudomonas aeroginosa (Hager P.W. et al, J. Bacteriol., 182:14, 3934-41 (2000)), Pseudomonas putida (Petruschka, L., et al, FEMS Microbiol. Lett., 215:1, 89-95 (2002)), хотя также известно, что указанная реакция может протекать спонтанно.
δ-6-Фосфоглюконолактон, один из продуктов реакции, катализируемой глюкозо-6-фосфатдегидрогеназой, способен образовывать изомер γ-6-фосфоглюконолактон путем внутримолекулярной перегруппировки. Только δ-6-фосфоглюконолактон может спонтанно гидролизоваться с образованием 6-фосфоглюконата, и абсолютно такую же реакцию катализируют известные ферменты 6-фосфоглюконолактоназы (ЕС 3.1.1.31) (Miclet E. et al., J Biol Chem., 276:37, 34840-46 (2001)). Ген pgl из E.coli, гипотетически presumably кодирующий 6-фосфоглюконолактоназу, был картирован на хромосоме E. coli между att-λ и геном chlD (в современных базах данных - ген modC). Мутанты E.coli (pgl-) имеют фенотип "maltose-blue" - колонии синего цвета на среде с мальтозой (Kupor, S.R. and Fraenkel, D.G., J. Bacteriol., 100:3, 1296-1301 (1969)), являющийся отличительной чертой штаммов, накапливающих мальтодекстрин (Adhya S. and Schwartz M., J Bacteriol, 108:2, 621-626 (1971)).
Но в настоящее время, неизвестны ни нуклеотидная последовательность, ни точное местоположение гена pgl на хромосоме E.coli. Из E.coli не были выделены ферменты, обладающие активностью 6-фосфоглюконолактоназы, также не существует публикаций, связывающих увеличение активности 6-фосфоглюконолактоназы в клетке бактерии - продуцента L-аминокислот с повышением продукции L-аминокислот указанной бактерией.
Описание изобретения.
Целью настоящего изобретения является предоставление
6-фосфоглюконолоктоназы из E.coli, для повышения продукции ароматических L-аминокислот штаммами-продуцентами, а также способ получения ароматических L-аминокислот указанными штаммами.
Данная цель была достигнута путем идентификации того факта, что открытая рамка считывания (ORF) ybhE в штамме E. coli К-12 кодирует 6-фосфоглюконолактоназу и усиление экспрессии ybhE ORF (pgl гена) способно повысить продукцию L-триптофана соответствующими штаммами-продуцентами L-триптофана. Таким образом было совершено настоящее изобретение.
Целью настоящего изобретения является предоставление 6-фосфоглюконолактоназы, выбранной из группы, состоящей из следующих белков:
(A) белок, включающий последовательность аминокислот, приведенную в списке последовательностей под номером 2 (SEQ ID NO:2); и
(B) белок, включающий последовательность аминокислот, содержащую делеции, замены, вставки или добавление одной или нескольких аминокислот в последовательности аминокислот, приведенной в списке последовательностей под номером 2 (SEQ ID NO:2), который обладает как минимум 70% гомологией по отношению к аминокислотной последовательности, приведенной под номером 2 (SEQ ID NO:2), и который обладает активностью 6-фосфоглюконолактоназы.
Далее по тексту белки, описанные в пунктах (А) или (В), называются "белки согласно настоящему изобретению".
Также целью настоящего изобретения является предоставление ДНК, кодирующей описанную выше 6-фосфоглюконолактоназу.
Также целью настоящего изобретения является предоставление бактерии-продуцента L-аминокислоты, при этом указанная бактерия модифицирована таким образом, что активность 6-фосфоглюконолактоназы повышена.
Также целью настоящего изобретения является предоставление описанной выше бактерии, при этом указанная бактерия принадлежит к семейству Enterobacteriaceae, и к роду, выбранному из группы родов Escherichia, Erwinia, Providencia и Serratia.
Также целью настоящего изобретения является предоставление описанной выше бактерии, в которой активность 6-фосфоглюконолактоназы повышена путем модификации нуклеотидной последовательности контролирующей экспрессию гена 6-фосфоглюконолактоназы в хромосоме указанной бактерии, таким образом, что экспрессия указанного гена усиливается.
Также целью настоящего изобретения является предоставление описанной выше бактерии, в которой природный промотор описанного выше гена заменен на более сильный промотор.
Также целью настоящего изобретения является предоставление описанной выше бактерии, в которой ген 6-фосфоглюконолактоназы получен из бактерии, принадлежащей к роду Escherichia.
Также целью настоящего изобретения является предоставление описанной выше бактерии-продуцента L-аминокислот, в которой ген, кодирующий 6-фосфоглюконолактоназу, выбран из группы, состоящей из:
(a) ДНК, включающей последовательность нуклеотидов с 1 по 996, приведенной в списке последовательностей под номером 1 (SEQ ID NO:1); или
(b) ДНК, которая гибридизуется в жестких условиях с последовательностью нуклеотидов с 1 по 996, приведенной в списке последовательностей под номером 1 (SEQ ID NO:1), или с зондом, приготовленным на основании указанной последовательности нуклеотидов, и кодирует белок, обладающий активностью 6-фосфоглюконолактоназы.
Также целью настоящего изобретения является предоставление описанной выше бактерии, где жесткими условиями являются условия, при которых отмывка осуществляется при 60°С в течение 15 минут, а концентрация соли соответствует 1×SSC и 0.1% SDS.
Также целью настоящего изобретения является предоставление описанной выше бактерии, где бактерия модифицирована таким образом, что экспрессия открытой рамки считывания ybhE усилена.
Также целью настоящего изобретения является предоставление описанной выше бактерии, где L-аминокислота - это ароматическая L-аминокислота, выбранная из группы аминокислот, состоящей из L-триптофана, L-фенилаланина и L-тирозина.
Также целью настоящего изобретения является предоставление способа продукции ароматических L-аминокислот, включающего в себя выращивание описанной выше бактерии и выделение из культуральной жидкости накопленной в ней L-аминокислоты.
Также целью настоящего изобретения является предоставление описанного выше способа, в котором L-аминокислоты - это ароматические аминокислоты, выбранные из группы, состоящей из L-триптофана, L-фенилаланина и L-тирозина.
Также целью настоящего изобретения является предоставление описанного выше способа, в котором в указанной бактерии экспрессия генов путей биосинтеза ароматических аминокислот усилена.
Описанный способ получения L-аминокислот включает в себя способ получения L-триптофана с использованием бактерии-продуцента L-триптофана, в которой активность белка согласно настоящему изобретению повышена. Также описанный способ получения L-аминокислот включает в себя способ получения L-фенилаланина с использованием бактерии-продуцента L-фенилалнина, в которой активность белка согласно настоящему изобретению повышена. Также описанный способ получения L-аминокислот включает в себя способ получения L-тирозина с использованием бактерии-продуцента L-тирозина, в которой активность белка согласно настоящему изобретению повышена.
Краткое описание чертежей
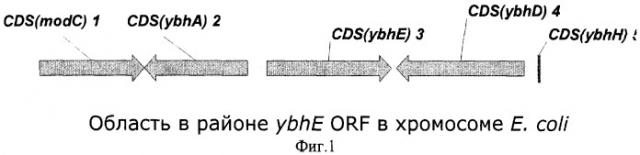
На Фиг.1 показана структура природного фрагмента бактериальной ДНК вокруг открытой рамки считывания (ORF) ybhE.
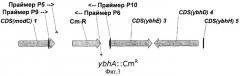
На Фиг.2 показана структура фрагмента бактериальной ДНК с делегированной ybhE ORF.
На Фиг.3 показана структура фрагмента бактериальной ДНК с делегированной ybhA ORF.
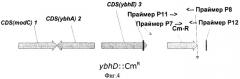
На Фиг.4 показана структура фрагмента бактериальной ДНК с делегированной ybhD ORF.
На Фиг.5 показана структура фрагмента бактериальной ДНК с делегированным геном pgi.
На Фиг.6 показана структура фрагмента бактериальной ДНК с делетированным опероном zwf-edd-eda.
На Фиг.7 показана структура фрагмента бактериальной ДНК с искусственным промоторным регионом (Рtac*) перед геном pgl (ybhE ORF).
На Фиг.8 показаны разделение в геле белка (His)6-YbhE и его очистка в геле. А. Грубый экстракт клеток штамма BL21(DE3)[pET-HTybhE]. Дорожки 1, 2, 9 - белковый маркер молекулярного веса; дорожки 4, 3 - общий белок из штаммов после индукции с помощью IPTG и без нее; дорожки 6, 5 - растворимая фракция из штаммов после индукции с помощью IPTG и без нее; дорожки 8, 7, - нерастворимая фракция из штаммов после индукции с помощью IPTG и без нее. В. Дорожка 1 - общий белок из штамма BL21(DE3)[pET-HTybhE], дорожки 2, 3, 4, 6 - повышающиеся концентрации очищенного белка (His)6-YbhE; дорожка 5 - белковый маркер молекулярного веса.
Наилучший способ осуществления изобретения.
Согласно настоящему изобретению 6-фосфоглюконолактоназа - это фермент, полученный из бактерии, принадлежащий к роду Escherichia и обладающий активностью 6-фосфоглюконолактоназы. Термин "активность 6-фосфоглюконолактоназы" обозначает активность, каталитизирующую реакцию гидролиза 6-фосфоглюконолактона до 6-фосфоглюконата. Активность 6-фосфоглюконолактоназы может быть измерена с помощью метода, описанного, например, у Kupor, S.R. и Fraenkel, D.G. (J. Bacteriol, 100:3, 1296-1301 (1969)).
Примером 6-фосфоглюконолактоназы, полученной из бактерии, принадлежащей к роду Escherichia является белок, выбранный из группы, состоящей из следующих белков:
(A) белок, включающий последовательность аминокислот, приведенную в списке последовательностей под номером 2 (SEQ ID NO:2); и
(B) белок, включающий последовательность аминокислот, содержащую делеции, замены, вставки или добавление одной или нескольких аминокислот в последовательность аминокислот, приведенную в списке последовательностей под номером 2 (SEQ ID NO:2), которая обладает как минимум 70% гомологией по отношению к аминокислотной последовательности, приведенной под номером 2 (SEQ ID NO:2), и который обладает активностью 6-фосфоглюконолактоназы.
В качестве гена, кодирующего 6-фосфоглюконолактоназу из Escherichia coli (ЕС 3.1.1.31), заявляется ген pgl, включающий в себя открытую рамку считывания ybhE ORF (номера нуклеотидов с 797809 по 798804 в последовательности с инвентарным номером NC_000913.1 в GenBank; gi:16128735). Открытая рамка считывания ybhE расположена в хромосоме штамма Е.coli К 12 между открытыми рамками считывания (ORF) ybhA и ybhD.
Таким образом, ген pgl может быть получен с помощью ПЦР (полимеразной цепной реакции; по White, T.J. et al., Trends Genet., 5, 185 (1989)) с использованием праймеров, синтезированных на основе нуклеотидной последовательности указанного гена.
Примером гена pgl из Escherichia coli является ДНК, выбранная из группы, состоящей из:
(a) ДНК, которая включает последовательность нуклеотидов с 1 по 996, приведенной в списке последовательностей под номером 1 (SEQ ID NO:1); или
(b) ДНК, которая гибридизуется в жестких условиях с последовательностью нуклеотидов с 1 по 996, приведенной в списке последовательностей под номером 1 (SEQ ID NO:1), или с зондом, приготовленным на основании указанной последовательности нуклеотидов, и кодирует белок, обладающий активностью 6-фосфоглюконолактоназы.
ДНК, кодирующая белки согласно настоящему изобретению, включает в себя ДНК, кодирующую белок, содержащий делеции, замены, вставки или добавления одной или нескольких аминокислот в одной или нескольких положениях в белке (А) при условии, что указанный белок не теряет своей активности. Несмотря на то, что количество "нескольких" аминокислот может быть различным в зависимости от положения и типа аминокислотного остатка в трехмерной структуре указанного белка, это количество может варьировать от 2 до 30, предпочтительно от 2 до 20 и более предпочтительно от 2 до 10 аминокислотных остатков для белка (А). Белок согласно настоящему изобретению, содержащий описанные выше делеции, замены, вставки или добавления одной или нескольких аминокислот, должен иметь как минимум 70%-ную гомологию к белку, представленному в списке последовательностей под номером 2 (SEQ ID NO:2). Процент гомологии измеряется с помощью сравнения изучаемой последовательности с приведенной в списке последовательностей под номером 2 (SEQ ID NO:2) по всей длине последовательности и определения количества подобных аминокислотных остатков. Белок согласно настоящему изобретению должен иметь как минимум 70%-ную гомологию к белку, представленному в списке последовательностей под номером 2 (SEQ ID NO:2), более предпочтительна гомология как минимум в 80%, еще более предпочтительна гомология как минимум в 90% и наиболее предпочтительна гомология как минимум в 95% к белку, представленному в списке последовательностей под номером 2 (SEQ ID NO:2).
Процент гомологии белка или ДНК также может быть оценен с помощью известных расчетных методов, таких как BLAST, FASTA или CrustalW. BLAST (Basic Local Alignment Search Tool) является эвристическим поисковым алгоритмом, использованным в программных продуктах blastp, blastn, blastx, megablast, tbiastn, и tbiastx; указанные программы приписывают величины значимости в результате поиска с использованием статистических методов, разработанных Karlin, Samuel и Stephen F. Altschul ("Methods for assessing the statistical significance of molecular sequence features by using general scoring schemes". Proc. Natl. Acad. Sci. USA, 1990, 87:2264-68; "Applications and statistics for multiple high-scoring segments in molecular sequences". Proc. Natl. Acad. Sci. USA, 1993, 90:5873-7). Метод поиска FASTA описан W.R.Pearson ("Rapid and Sensitive Sequence Comparison with FASTP and FASTA", Methods in Enzymology, 1990 183:63-98). Метод ClustalW описан Thompson J.D., Higgins D.G. и Gibson T.J. ("CLUSTAL W: improving the sensitivity of progressive multiple sequence alignment through sequence weighting, position-specific gap penalties and weight matrix choice", Nucleic Acids Res. 1994, 22:4673-4680).
Для того чтобы сохранялась активность белка, замены, делеции, вставки или добавки одного или нескольких аминокислотных остатков в указанном белке должны являться консервативной мутацией(ями). Пример консервативной мутации - это консервативная замена. Примеры консервативных замен включают замену Ala на Ser или Thr, замену Arg на Gln, His или Lys, замену Asn на Glu, Gln, Lys, His или Asp, замену Asp на Asn, Glu или Gln, замену Cys на Ser или Ala, замену Gln на Asn, Glu, Lys, His, Asp или Arg, замену Glu на Asn, Gln, Lys или Asp, замену Gly на Pro, замену His на Asn, Lys, Gln, Arg или Tyr, замену Ile на Leu, Met, Val или Phe, замену Leu на Ile, Met, Val или Phe, замену Lys на Asn, Glu, Gln, His или Arg, замену Met на Ile, Leu, Val или Phe, замену Phe на Trp, Tyr, Met, Ile или Leu, замену Ser на Thr или Ala, замену Thr на Ser или Ala, замену Trp на Phe или Tyr, замену Tyr на His, Phe или Trp, и замену Val на Met, Ile или Leu.
ДНК, кодирующая практически такие же белки, как белок, описанный в пункте (А), может быть получена, например, путем модификации нуклеотидной последовательности ДНК, кодирующей белок, описанный в пункте (А), например, с помощью метода сайт-направленного мутагенеза, таким образом, что один или несколько аминокислотных остатков могут быть делегированы, заменены, вставлены или добавлены. ДНК, модифицированная, как описано выше, может быть получена традиционными известными методами обработки с целью получения мутаций. Такие методы включают обработку ДНК, кодирующей белок согласно настоящему изобретению, гидроксиламином или обработку бактерии, содержащей указанную ДНК, с помощью УФ-излучения или реагентом, таким как N-метил-N'-нитро-N-нитрозогуанидин или азотистая кислота.
ДНК, кодирующая белки согласно настоящему изобретению, включает также ДНК, которая может быть получена из различных штаммов и вариантов бактерий, принадлежащих к роду Escherichia ввиду природного разнообразия. ДНК, кодирующая такие белки, может быть получена путем выделения ДНК, которая гибридизуется геном pgl или его частью в жестких условиях, и кодирует белок, обладающий активностью 6-фосфоглюконолактоназы. Термин "жесткие условия", упомянутый здесь, означает условия, при которых образуются так называемые специфические гибриды, а неспецифические - не образуются. Трудно четко описать такие условия в каких-либо численных выражениях. Например, к жестким условиям относятся условия, при которых гибридизуются ДНК, обладающие высокой степенью гомологии, к примеру ДНК, обладающие гомологией не менее 70%, предпочтительно не менее 80%, более предпочтительно не менее 90%, более предпочтительно не менее 95%, друг относительно друга. С другой стороны, примером жестких условий являются условия, при которых ДНК гибридизуются друг с другом, при концентрации солей, соответствующей стандартным условиям отмывки при гибридизации по Саузерну, например, 1×SSC, 0.1% SDS, предпочтительно 0.1×SSC, 0.1% SDS при 60°С. Продолжительность отмывки зависит от вида фильтра, используемого для блоттинга и, как правило, рекомендована изготовителем. Например, рекомендованная продолжительность отмывки нейлонового фильтра HybondTM N+(Amersham) в жестких условиях составляет 15 минут. Предпочтительно, чтобы отмывка производилась два или три раза.
В качестве зонда для ДНК, кодирующей описанные выше белки, и которая гибридизуется с геном pgl, может быть использована часть нуклеотидной последовательности под номером 1. Зонд подобного рода может быть получен в результате ПЦР с использованием в качестве праймеров олигонуклеотидов, полученных на основе нуклеотидной последовательности под номером 1, и фрагмента ДНК, содержащего нуклеотидную последовательность под номером 1, в качестве матрицы. В случае когда в качестве зонда используется фрагмент ДНК длиной около 300 пар оснований, условия отмывки при гибридизации соответствуют, например, 50°С, 2×SSC и 0.1% SDS.
Трансформация бактерии с помощью ДНК, кодирующей белок, означает введение указанной ДНК в клетку бактерии, например, традиционными методами для увеличения экспрессии указанного гена, кодирующего белок согласно настоящему изобретению, и увеличения активности указанного белка в клетке бактерии.
Бактерия согласно настоящему изобретению - это бактерия, принадлежащая к роду Escherichia, - продуцент L-аминокислот, обладающая повышенной активностью белка, что приводит к увеличению продукции целевой L-аминокислоты. Предпочтительно, бактерией согласно настоящему изобретению является бактерия, принадлежащая к роду Escherichia, - продуцент ароматической L-аминокислоты, обладающая повышенной активностью белка согласно настоящему изобретению. Более предпочтительно, бактерией согласно настоящему изобретению является бактерия, принадлежащая к роду Escherichia, - продуцент ароматических L-аминокислот, такая как бактерия-продуцент L-триптофана, модифицированная таким образом, что активность 6-фосфоглюконолактоназы повышена. Еще более предпочтительно, если бактерия согласно настоящему изобретению содержит ДНК с геном pgl (ybhE ORF), при этом последовательность контроля экспрессии указанного гена в хромосоме этой бактерии модифицирована таким образом, что способность этой бактерии к продукции L-триптофана усилена.
Термин "бактерия - продуцент L-аминокислоты" означает бактерию, обладающую способностью к накоплению этой L-аминокислоты в питательной среде, в условиях, когда бактерия согласно настоящему изобретению выращивается в указанной питательной среде. Способность к продукции L-аминокислоты может быть придана или улучшена путем селекции. Используемый здесь термин "бактерия-продуцент L-аминокислоты" также означает бактерию, которая способна к продукции L-аминокислоты и вызывает накопление L-аминокислоты в питательной среде в количествах больших, чем природный или родительский штамм, и, предпочтительно, означает, что микроорганизм способен производить и накапливать в ферментационной среде целевую L-аминокислоту в концентрациях не менее чем 0.5 г/л, более предпочтительно - не менее 1.0 г/л.
L-аминокислоты включают в себя: L-аланин, L-аргинин, L-аспарагин, L-аспарагиновую кислоту, L-цистеин (цистин), L-глутаминовую кислоту, L-глутамин, L-глицин, L-гистидин, L-изолейцин, L-лейцин, L-лизин, L-метионин, L-фенилаланин, L-пролин, L-серин, L-треонин, L-триптофан, L-тирозин и L-валин, и, предпочтительно, включают в себя ароматические L-аминокислоты, такие как L-триптофан, L-фенилаланин и L-тирозин.
Семейство Enterobacteriaceae включает в себя бактерий, принадлежащих к роду Escherichia, Erwinia, Providencia и Serratia. Род Escherichia предпочтителен. Термин "бактерия, принадлежащая к роду Escherichia" означает, что бактерия относится к роду Escherichia в соответствии с классификацией, известной специалисту в области микробиологии. В качестве примера микроорганизма, принадлежащего к роду Escherichia, использованного в настоящем изобретении, может быть упомянута бактерия Escherichia coli (E.coli).
Термин "модифицирована таким образом, что активность 6-фосфоглюконолактоназы увеличена" означает то, что удельная активность становится выше, чем у немодифицированного штамма, например природного штамма. Например, в случае когда количество молекул 6-фосфоглюконолактоназы в клетке увеличено, когда специфическая активность у молекулы 6-фосфоглюконолактоназы увеличена и так далее. Кроме того, в качестве природного штамма, который может служить объектом для сравнения, может быть упомянут штамм Escherichia coli К-12. В результате увеличения внутриклеточной активности 6-фосфоглюконолактоназы наблюдается эффект увеличения количества накопленной L-аминокислоты.
Увеличение активности 6-фосфоглюконолактоназы в клетке бактерии может быть достигнуто путем увеличения экспрессируемого количества гена, кодирующего 6-фосфоглюконолактоназу. Примером гена, кодирующего 6-фосфоглюконолактоназу, может являться ген, выделенный из бактерий, принадлежащих к роду Escherichia.
Бактерия согласно настоящему изобретению включает в себя бактерию, в которой активность белка согласно настоящему изобретению повышена путем замены последовательности, контролирующей экспрессию ДНК, кодирующей белок, описанный в пункте (А) или (В) в хромосоме бактерии, на более сильную. Усиление экспрессии гена может быть достигнуто помещением ДНК согласно настоящему изобретению под контроль более сильного промотора взамен природного. Термин "природный промотор" означает фрагмент ДНК в природном организме, расположенный перед открытой рамкой считывания (ORF) гена и способствующий транскрипции этого гена. Сила промотора определяется частотой акта начала синтеза РНК. Методы оценки силы промотора и примеры сильных промоторов описаны у Deuschle, U., Kammerer, W., Gentz, R., Bujard, H. (Promoters in Escherichia coli: a hierarchy of in vivo strength indicates alternate structures. EMBO J., 1986, 5, 2987-2994).
Усиление трансляции может быть достигнуто с помощью введения в ДНК согласно настоящему изобретению более эффективного сайта связывания рибосомы (Ribosome Binding Site - RBS) взамен природной последовательности RBS. Последовательность RBS - это область, расположенная перед старт-кодоном мРНК, которая взаимодействует с 16S РНК рибосомы (Shine J. and Dalgarno L., Proc. Natl. Acad. Sci. USA, 1974, 71, 4, 1342-6). Термин "природная последовательность RBS" означает последовательность RBS в природном организме. В качестве примера эффективной последовательности RBS можно привести последовательность RBS гена 10 из фага Т7 (Olins P.O. et al, Gene, 1988, 73, 227-235).
Методами получения хромосомной ДНК, гибридизации, ПЦР, получения плазмидной ДНК, разрезания и лигирования ДНК, трансформации, выбора олигонуклеотидов в качестве праймеров и подобные им могут быть обычные методы, хорошо известные специалисту в данной области. Эти методы описаны, например, в книге Sambrook, J., and Russell D., "Molecular Cloning A Laboratory Manual, Third Edition", Cold Spring Harbor Laboratory Press (2001) и подобным ей.
Бактерия согласно настоящему изобретению может быть получена путем введения вышеуказанных ДНК в бактерию, уже обладающую способностью к продукции L-аминокислот. С другой стороны, бактерия согласно настоящему изобретению может быть получена путем придания бактерии, уже содержащей указанные ДНК, способности к продукции L-аминокислот.
В качестве родительского штамма, в котором активность белка согласно настоящему изобретению будет повышена, могут быть использованы штаммы, принадлежащие к роду Escherichia, - продуценты L-триптофана, такие как штаммы Е.coli JP4735/pMU3028 (DSM10122) и JP6015/pMU91 (DSM10123), дефицитные по триптофанил-тРНК синтетазе, кодируемой мутантным геном trpS (патент США 5756345); штамм Е.coli SV164 (pGH5) с аллелем гена serA, кодирующим фермент со снятым ингибированием серином по принципу обратной связи (патент США 6180373); штаммы Е.coli AGX17 (pGX44) (NRRL В-12263) и AGX6 (pGX50) aroP (NRRL В-12264) дефицитные по ферменту триптофаназе (патент США 4371614); штамм Е.coli AGX17/pGX50, pACKG4-pps, в котором усилена способность к продукции фосфоенолпирувата (WO 9708333, патент США 6319696) и подобные им.
В качестве родительского штамма, в котором активность белка согласно настоящему изобретению будет повышена, могут быть использованы штаммы, принадлежащие к роду Escherichia, - продуценты L-фенилаланина, такие как штамм AJ12739 (tyrA::Tn10, tyrR) (ВКПМ В-8197); штамм HW1089 (АТСС инвентарный номер 55371), содержащий ген pheA34 (патент США 5354672); мутантный штамм MWEC101-b (патент Южной Кореи 8903681); штаммы NRRL В-12141, NRRL В-12145, NRRL В-12146 и NRRL B-12147 (патент США 4407952) и подобные им. Также в качестве родительского штамма для последующего повышения в нем активности белка согласно настоящему изобретению, могут быть использованы бактерии-продуценты L-фенилаланина, принадлежащие к роду Escherichia, штаммы Е.coli К-12 [W3110 (tyrA)/pPHAB (FERM BP-3566), Е.coli К-12 [W3110 (tyrA)/pPHAD] (FERM BP-12659), E. coli K-12 [W3110 (tyrA)/pPHATerm] (FERM BP-12662) и E. coli K-12 [W3110 (tyrA)/pBR-aroG4, pACMAB], называемый также AJ 12604 (FERM BP-3579) (Европейский патент 488424 B1).
Авторами настоящего изобретения ранее было показано, что ген yddG, кодирующий мембранный белок, не участвующий в путях биосинтеза ни одной из L-аминокислот, в случаях когда аллель природного гена амплифицирован на многокопийном векторе, сообщает микроорганизмам устойчивость к L-фенилаланину и нескольким аналогам аминокислот. Кроме того, ген yddG может повысить продукцию L-фенилаланина или L-триптофана, в случаях когда дополнительные копии этого гена введены в клетки соответствующего штамма-продуцента (патентная заявка РФ 2002121670, WO 03044192). Следовательно, желательно, чтобы бактерия-продуцент L-триптофана была в дальнейшем модифицирована с целью усиления экспрессии открытой рамки считывания yddG.
Гены, важные для биосинтеза L-триптофана, включают в себя гены оперона trpEDCBA, гены, общие для биосинтеза всех ароматических аминокислот - такие как aroF, aroG, aroH, aroB, aroD, aroE, aroK, aroL, aroA и aroC, гены биосинтеза L-серина, такие как serA, serB и serC, и подобные им.
В качестве родительского штамма, в котором активность белка согласно настоящему изобретению будет повышена, могут быть использованы штаммы, принадлежащие к роду Escherichia, - продуценты L-тирозина, такие как штаммы Е.coli, в которых повышена способность к продукции фосфоенолпирувата или повышена активность ферментов общего пути биосинтеза ароматических аминокислот (Европейская патентная заявка ЕР 0877090).
Способ получения L-аминокислоты согласно настоящему изобретению включает стадии выращивания бактерии согласно настоящему изобретению в питательной среде с целью продукции и накопления L-аминокислоты в питательной среде, выделения L-аминокислоты из культуральной жидкости. Также способ согласно настоящему изобретению включает в себя способ получения L-триптофана и включает стадии выращивания бактерии согласно настоящему изобретению в питательной среде с целью продукции и накопления L-триптофана в питательной среде, выделения L-триптофана из культуральной жидкости. Также способ согласно настоящему изобретению включает в себя способ получения L-фенилалнина, и включает стадии выращивания бактерии согласно настоящему изобретению в питательной среде с целью продукции и накопления L-фенилалнина в питательной среде, выделения L-фенилалнина из культуральной жидкости. Также способ согласно настоящему изобретению включает в себя способ получения L-тирозина и включает стадии выращивания бактерии согласно настоящему изобретению в питательной среде с целью продукции и накопления L-тирозина в питательной среде, выделения L-тирозина из культуральной жидкости.
Согласно настоящему изобретению выращивание, выделение и очистка L-аминокислот, предпочтительно ароматических аминокислот, таких как L-триптофан, L-фенилалнин или L-триптофан, из культуральной или подобной ей жидкости может быть осуществлена способом, подобным традиционным способам ферментации, в которых аминокислота продуцируется с использованием микроорганизма.
Питательная среда, используемая для выращивания, может быть как синтетической, так и натуральной, при условии, что указанная среда содержит источники углерода, азота, минеральные добавки и, если необходимо, соответствующее количество питательных добавок, необходимых для роста микроорганизмов. К источникам углерода относятся различные углеводы, такие как глюкоза и сахароза, а также различные органические кислоты. В зависимости от характера ассимиляции, используемого микроорганизмом, могут использоваться спирты, такие как этанол и глицерин. В качестве источника азота могут использоваться различные неорганические соли аммония, такие как аммиак и сульфат аммония, другие соединения азота, такие как амины, природные источники азота, такие как пептон, гидролизат соевых бобов, ферментолизат микроорганизмов. В качестве минеральных добавок могут использоваться фосфат калия, сульфат магния, хлорид натрия, сульфат железа, сульфат марганца, хлорид кальция и подобные им соединения. Некоторые питательные добавки могут быть, при необходимости, добавлены в питательную среду. Например, если микроорганизму для роста необходим тирозин (ауксотрофия по тирозину), соответствующее количество тирозина может быть добавлено в питательную среду для выращивания.
Выращивание осуществляется предпочтительно в аэробных условиях, таких как перемешивание культуральной жидкости на качалке, взбалтывание с аэрацией, при температуре в пределах от 20 до 42°С, предпочтительно в пределах от 37 до 40°С. рН среды поддерживают в пределах от 5 до 9, предпочтительно от 6.5 до 7.2. рН среды может регулироваться аммиаком, карбонатом кальция, различными кислотами, основаниями и буферными растворами. Обычно, выращивание в течение от 1 до 5 дней приводит к накоплению целевой L-аминокислоты в культуральной жидкости.
После выращивания твердые остатки, такие как клетки, могут быть удалены из культуральной жидкости методом центрифугирования или фильтрацией через мембрану, а затем целевая L-аминокислота может быть выделена и очищена методами ионообменной хроматографии, концентрирования и кристаллизации.
Примеры
Более детально настоящее изобретение будет разъяснено ниже со ссылкой на следующие Примеры, не ограничивающие область применения настоящего изобретения.
Пример 1. Идентификация гена pgl из Е.coli и сравнение нуклеотидных последовательностей.
Kupor и Fraenkel картировали мутацию pgl между генами chlD (известный в настоящее время как modC) и bioA в хромосоме Е.coli (Kupor, S.R. and Fraenkel, D.G., J. Bacteriol., 100:3, 1296-1301 (1969)). Это соответствует 17.18 и 17.40 минутам генетической карты Е.coli. В этой области расположены восемь открытых рамок считывания, кодирующих белки с неизвестными функциями. Далее, Е.coli Stock Center Database определил мутацию pgl между минутами 17.20 и 17.22. Эти координаты достаточно точно соответствуют координатам открытой рамки считывания ybhE, расположенной между открытыми рамками считываниями ybhA и ybhD (Фиг.1).
Поиск с помощью программы BLAST показал, что белок YbhE имеет большое количество гомологов с неизвестными функциями в различных организмах, таких как Shigella flexmeri (98.8% схожести), Salmonella typhi (92,8% схожести), Yersinia pestis (68,4% схожести), несколько гомологов с известными функциями, например, домен гема Цитохрома D1 из Bacillus anthracis (28% идентичности), 3-карбоксимуконатциклаза из Pseudomonas fluorescens, предсказанная автоматическим компьютерным анализом (28% идентичности), муконатциклоизомераза из Trichosporon beigelii (26% идентичности), и один гомолог из Bacillus cereus, описанный в базах данных как 6-фосфоглюконатлактоназа под инвентарным номером NP_833107, но без ссылок на печатные экспериментальные работы.
Также с помощью программы NCBI Conserved Domain Search были обнаружены три перекрывающихся консервативных белковых домена. Два из них принадлежат к консервативному белковому семейству с неизвестной функцией, и один домен принадлежит к семейству 3-карбоксимуконатциклаз.
При поиске с помощью программы BLAST в пределах протеома Е.coli не были обнаружены гомологи описанных 6-фосфоглюконатлактоназ, например, из Pseudomonas putida.
Для того чтобы установить, является ли ORF, обозначаемая как ybhE в хромосоме Е.coli, геном pgl, кодирующим 6-фосфоглюконатлактоназу, было проведено последовательное разрушение открытых рамок считывания ybhA, ybhE и ybhD, и полученные мутанты были проверены на предмет фенотипа "maltose blue" (смотри ниже).
Пример 2. Деления открытой рамки считывания (ORF) ybhE. Замена ybhE ORF на фрагмент ДНК, содержащий ген устойчивости к хлорамфениколу (CmR).
Для делеции ybhE ORF в хромосому штамма Е.coli BW25113 [pKD46] взамен природной ybhE ORF был интегрирован фрагмент ДНК, содержащий маркер устойчивости к хлорамфениколу (CmR), кодируемый геном cat, способом, описанным у Datsenko K.A. и Wanner B.L. (Proc. Natl. Acad. Sci. USA, 2000, 97, 6640-6645). Этот способ также называют "интеграция с использованием Red-системы" и/или "интеграция за счет Red-системы". Нуклеотидная последовательность исходной природной области ybhE ORF и аминокислотная последовательность, кодируемая указанной ORF, представлены в списке последовательностей под номерами 1 и 2 соответственно (SEQ ID NO: 1 и 2). Штамм Escherichia coli BW25113, содержащий рекомбинантную плазмиду pKD46, может быть получен из Е.coli Genetic Stock Center, Yale University, New Haven, USA, инвентарный номер штамма - CGSC7630.
Фрагмент ДНК, содержащий маркер CmR, может быть получен с помощью ПЦР, при этом в качестве матрицы использовалась коммерчески доступная плазмида pACYC184 (инвентарный номер Х06403 в GenBank/EMBL, "Ферментас", Литва), а также праймеры Р1 (SEQ ID NO: 3) и Р2 (SEQ ID NO: 4). Праймер Р1 содержал 36 нуклеотидов, гомологичных 5'-концу рамки ybhE ORF и праймер Р2 содержал 36 нуклеотидов, гомологичных 3'-концу рамки ybhE ORF. Эти последовательности гена ybhE были включены в праймеры Р1 и Р2 для дальнейшей интеграции полученного фрагмента в хромосому.
ПЦР проводили с использованием амплификатора "TennoHybaid PCR Express". Реакционная смесь общим объемом 50 мкл содержала 5 мкл 10х буфера для ПЦР ("Ферментас", Литва) с добавлением MgCl2 до конечной концентрации в реакционной смеси 15 мМ, 200 мкМ каждого трифосфата dNTP, 25 пМ каждого из используемых праймеров и 1 ед Taq-полимеразы ("Ферментас", Литва). Примерно 5 нг плазмидной ДНК добавляли в реакционную смесь в качестве матрицы для ПЦР амплификации. Температурный профиль ПЦР был следующий: начальная стадия денатурации в течение 5 мин при 95°С с последующими 25 циклами денатурации при 95°С в течение 30 секунд, отжига при 55°С в течение 30 секунд, наращивания цепи при 72°С в течение 30 секунд; финальная стадия полимеризации при 72°С в течение 7 минут.
Затем амплифицированный фрагмент ДНК очищали электрофорезом в агарозном геле, выделяли из геля с помощью "GenElute Spin Columns" ("Sigma", USA) и высаживали этанолом. Нуклеотидная последовательность синтезированного фрагмента ДНК представлена в SEQ ID NO:5.
Полученный фрагмент ДНК, очищенный описанным выше способом, использовали для электропорации и интеграции с использованием Red-системы в бактериальную хромосому штамма Е.coli BW25113 [pKD46]. Рекомбинантная плазмида pKD46 (Datsenko, К.А., Wanner, B.L., Proc. Natl. Acad. Sci. USA, 2000, 97, 6640-6645) с термочувствительным репликоном использовалась как донор генов фага λ, ответственных за функционирование Red-системы рекомбинации.
Клетки BW25113 [pKD46] выращивали в течение ночи при 30°С в жидкой среде LB, содержащей ампициллин (100 мкг/мл), затем разбавляли в отношении 1:100 средой SOB (дрожжевой экстракт, 5 г/л; NaCl, 0.5 г/л; Триптон, 20 г/л, KCl, 2,5 мМ; MgCl2, 10 мМ), содержащей ампициллин (100 мкг/мл) и араби