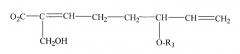Ингибирование nf- b композициями тритерпенов
Иллюстрации
Показать всеИзобретение относится к области биохимии. Сущность его заключается к разработке способа ингибирования воспаления путем обеспечения клетки монотерпеновыми композициями, которые ингибируют фактор NF-κB. Данные композиции могут также содержать часть в виде носителя, который делает монотерпеновую композицию проницаемой для мембран. Носитель может включать в себя тритерпеноидные части, сахара, липиды или даже дополнительные монотерпеноидные части. Композиция может включать дополнительные химические функциональные агенты. Технический результат - повышение эффективности лечения воспалительных состояний, в частности предраковых. 53 з.п. ф-лы, 55 табл., 62 ил.
Реферат
Известный уровень техники
В данной заявке заявлен приоритет предварительной заявки США с серийным номером 60/249710, зарегистрированной 17 ноября 2000 г., и предварительной заявки США с серийным номером 60/322859, зарегистрированной 17 сентября 2001 г., обе из которых специально включены здесь в качестве ссылки во всей своей полноте.
1. Область техники, к которой относится изобретение
Настоящее изобретение относится в целом к области медицины. Более конкретно, изобретение относится к способам ингибирования воспаления с применением композиций монотерпенов, которые тормозят NF-κB.
2. Описание области техники, к которой относится изобретение
Растения и животные, особенно морские животные, представляют собой ценные источники для идентификации новых биологически активных молекул. Одним из разнообразных классов молекул, которые были идентифицированы в растениях, является класс сапонинов. Сапонины представляют собой высокомолекулярные соединения, включающие в себя гликозиды с частью сахаров, присоединенной к тритерпену или стероидному агликону. Тритерпеновые сапонины представляют собой объект особенно большого интереса благодаря своим биологическим свойствам.
Исследовались фармакологические и биологические свойства тритерпеновых сапонинов из различных видов растений, включая фунгицидную, противовирусную, антимитогенную, спермицидную или контрацептивную, сердечно-сосудистую и противовоспалительную активности (Hostettmann et al., 1995). Сапонины, как известно, образуют комплексы с холестерином, связывая липиды плазмы, изменяя, таким образом, метаболизм холестерина (Oakenfull et al., 1983). Тритерпеновые гликозиды, добавленные в пищу также, как показано, снижают количество холестерина в крови и тканях экспериментальных животных (Cheeke, 1971). Обнаружено, что сапонины являются составляющими многих народных медицинских средств и некоторых сравнительно недавно разработанных растительных лекарств.
Тритерпенглицирретиновая кислота и ее определенные производные, как известно, имеют противоязвенное, противовоспалительное, антиаллергическое, антигепатитное и противовирусное действие. Например, определенные производные глицирретиновой кислоты могут предотвращать или заживлять язвы желудка (Doll et al., 1962).
К таким соединениям, известным в данной области техники, относятся карбеноксолон (патент США No. 3070623), эфирные производные глицирретиновой кислоты, имеющие заместители в 3'-положении (патент США No. 3070624), аминокислотные соли глицирретиновой кислоты (патентная публикация Японии JP-A-44-32798), амидные производные глицирретиновой кислоты (патент Бельгии No. 753773) и амидные производные 11-дезоксоглицирретиновой кислоты (патент Великобритании No. 134871). Показано, что глицирретиновая кислота ингибирует ферменты, вовлеченные в биосинтез лейкотриенов, включая активность 5-липоксигеназы, и, как предполагается, в результате этого ответственны за описанную противовоспалительную активность (Inoue et al., 1986).
Бетулиновая кислота, пентациклический тритерпен, как описано, является селективным ингибитором роста меланомной опухоли человека в моделях ксенотрансплантатов бестимусным голым мышам, и было показано, что она индуцирует цитотоксичность путем индукции апоптоза (Pisha et al., 1995). Тритерпеновый сапонин из китайского лекарственного растения семейства Cucurbitaceae проявлял противоопухолевую активность (Kong et al., 1993). Моногликозиды тритерпенов, как показано, проявляют сильную и избирательную цитотоксичность в отношении лейкозных клеток MOLT-4 человека (Kasiwada et al., 1992), а определенные тритерпеновые гликозиды семейства Iridaceae тормозили рост опухолей и увеличивали продолжительность жизни мышей с имплантированной асцитной карциномой Эрлиха (Nagamoto et al., 1988). Препарат сапонинов из растения Dolichos falcatus, которое принадлежит семейству Leguminosae, как описано, эффективен против клеток саркомы-37 in vitro и in vivo (Huang et al., 1982). Сапонин сои также из семейства Leguminosae, как показано, эффективен против ряда опухолей (Tomas-Barbaren et al., 1988). Гликозиды олеаноловой кислоты и гипсогенина, проявляющие гемолитическую и моллюскицидную активности, были выделены из земляных фруктовых стручков Swartzia madagascariensis (Leguminosae) (Borel and Hostettmann, 1987).
Генистеин, природно существующий изофлавоноид, выделенный из соевых продуктов, представляет собой ингибитор тирозинкиназы, который, как было показано, ингибирует пролиферацию эстроген-позитивных и эстроген-негативных линий клеток рака молочной железы (Akiyama et al., 1987). Инозитолгексафосфат (фитиновая кислота), который имеется в изобилии в царстве растений и который является природным диетическим ингредиентом зерновых и бобов, как показано, вызывает терминальную дифференцировку клеточной линии карциномы ободочной кишки. Фитиновая кислота проявляет также противоопухолевую активность в отношении экспериментального канцерогенеза ободочной кишки и молочной железы in vivo (Yang et al., 1995). Некоторые тритерпеновые агликоны также, как было продемонстрировано, имеют цитотоксические или цитостатические свойства, т.е. кора ствола растения Crossopteryx febrifuga (Rubiaceae), как показано, является цитостатической в отношении линии клеток Co-115 карциномы ободочной кишки человека в диапазоне нг/мл (Tomas-Barbaren et al., 1988).
В то время как в предшествующих сообщениях идентифицировались тритерпеновые соединения, которые имели любое из множества применений, на данном уровне техники все еще сохраняется большая потребность в идентификации новых биологически активных тритерпеновых соединений. Многие из этих соединений являются токсичными для нормальных клеток млекопитающих. Более того, биологическая активность идентифицированных ранее тритерпенов варьируется в широких пределах, и многие обладают ограниченной или варьирующей степенями эффективности при лечении любого такого состояния человека или млекопитающих. Огромное разнообразие различных тритерпенов, которые были идентифицированы, и огромный диапазон различий и непредсказуемости их биологической активности, наблюдаемой даже среди близкородственных тритерпеновых соединений, подчеркивает сложности, с которыми сталкиваются при получении тритерпенов, которые являются потенциальными терапевтическими агентами. Достижение трудной задачи идентификации новых тритерпенов с выгодными вариантами биологической активности может создать полностью новые пути лечения разнообразного набора болезней человека, для которых терапевтические возможности в настоящее время ограничены.
NF-κB представляет собой повсеместный транскрипционный фактор и регулирует транскрипцию ряда генов, вовлеченных в иммунные и воспалительные пути, таких как различные провоспалительные цитокины, молекулы адгезии и апоптоз, и таким образом представляет собой один из центральных регуляторов ответов организма на различные стрессогенные сигналы. Нарушение регуляции NF-κB вносит вклад в разнообразные патологические состояния, такие как септический шок, острое воспаление, репликация вирусов и некоторые виды рака.
Наиболее преобладающими и активными формами NF-κB являются димерные комплексы p50/relA (p50/p65). В нестимулированных клетках данные факторы удерживаются в цитоплазме в комплексе с ингибиторными белками (IκB), которые маскируют их сигнал ядерной транслокации. В ответ на внеклеточный сигнал, такой как воспалительные цитокины, митогены, бактериальные продукты или окислительный стресс, IκB подвергается фосфорилированию по специфическим сериновым остаткам, которые затем служат сигналом для присоединения к ним убиквитина и деградации по протеосомному пути. Деградация IκB позволяет свободному от ингибитора комплексу NF-κB транслоцироваться в ядро, связываться с ДНК и активировать транскрипцию специфических генов.
Из их роли в воспалении и канцерогенезе, а также в других иммунологических нарушениях, должно следовать, что модуляторы, негативно регулирующие NF-κB, должны иметь огромное терапевтическое применение. Более того, некоторые последующие эффекты, обусловленные ингибированием активности NF-κB, представляют собой снижение уровней экспрессии индуцибельной синтазы оксида азота (iNOS) и циклооксигеназы-2 (COX-2). Как iNOS, так и COX-2 играют определяющую роль в ответе тканей на воспаление, повреждение и канцерогенез. Таким образом, на данном уровне техники существует потребность в регуляторах NF-κB, а также iNOS и COX-2, так как эти соединения должны обеспечить противовоспалительные и хемопротекторные эффекты.
Краткое изложение существа изобретения
Настоящее изобретение преодолевает существующие недостатки на данном уровне техники и предлагает способы ингибирования воспаления с применением монотерпеновых композиций. В некоторых осуществлениях данные монотерпеновые композиции могут дополнительно включать в себя сахара и могут даже дополнительно включать в себя в виде части носитель, который может вносить монотерпеновые композиции в клетку, придавая мембране растворимость или проницаемость, или может придавать желаемые свойства композиции. Монотерпеновые композиции могут дополнительно включать в себя дополнительные химические заменители, такие как, но, конечно, не ограничиваясь этим, тритерпеновые гликозиды и/или другие монотерпены, и/или сахара.
Монотерпеновые композиции согласно изобретению могут быть получены почти из любого источника. Например, растения и морские животные являются богатым источником таких соединений. В некоторых осуществлениях монотерпеновые композиции могут быть выделены из стручков и корней Acacia victoriae (Benth.) (Leguminosae). В еще одних осуществлениях композиции могут быть даже синтезированы химически или ферментативно. Таким образом, могут быть применены химические способы синтеза, известные специалистам в данной области техники. В противоположном варианте могут быть использованы биохимические способы с применением ферментов, которые вовлечены в синтез монотерпеновых композиций. Ферменты, применяемые в данных путях, могут быть выделены из организма, например, растений, морских животных и т.д. или могут быть созданы генно-инженерным способом.
В изобретении предлагаются способы ингибирования воспаления, включающие в себя введение в клетку монотерпеновой композиции, которая ингибирует NF-κB. В некоторых осуществлениях NF-κB индуцируется TNF. В предпочтительных осуществлениях способа монотерпеновая композиция дополнительно включает в себя в виде части носитель. Часть носителя определяется здесь как часть, которая придает мембране растворимость, придает мембране проницаемость или обеспечивает внутриклеточную доступность для монотерпеновой композиции. Специалист в данной области техники должен знать, что может быть использована любая молекула, которая обеспечивает внутриклеточную доступность или клеточную проницаемость, и некоторые неограничивающие примеры части носителя включают в себя липид, липофильный белок, который может пересекать/переходить мембрану, тритерпеновый гликозид, тритерпеновый гликозид, дополнительно присоединенный к другим молекулам, таким как сахара, и/или другие монотерпеновые единицы.
В изобретении также предлагаются способы ингибирования воспаления, включающие в себя введение в клетку монотерпеновой композиции, которая ингибирует NF-κB, где монотерпен дополнительно присоединен к тритерпеновой части и/или к сахару, и/или ко второй монотерпеновой части. Специалист в данной области техники должен понимать, что описанные здесь композиции могут быть дополнительно замещены другими химическими функциональными частями.
Таким образом, монотерпен может дополнительно включать в себя тритерпеновую часть, присоединенную по меньшей мере к одной, предпочтительно - к двум, трем или более дополнительным монотерпеновым частям. Когда присутствует более одной монотерпеновой части, каждая их этих частей может быть присоединена (i) прямо к тритерпеновой части, (ii) к сахару или другой линкерной группе, которая присоединена к тритерпеновой части, или (iii) к монотерпеновой части, которая присоединена к тритерпеновой части напрямую или через сахар или другие линкерные группы. Линкерные группы включают в себя сахара, ацил, амид, алкокси, кетил, алкил, алкилен и другие сходные химические части, которые должны быть очевидны специалисту в данной области техники.
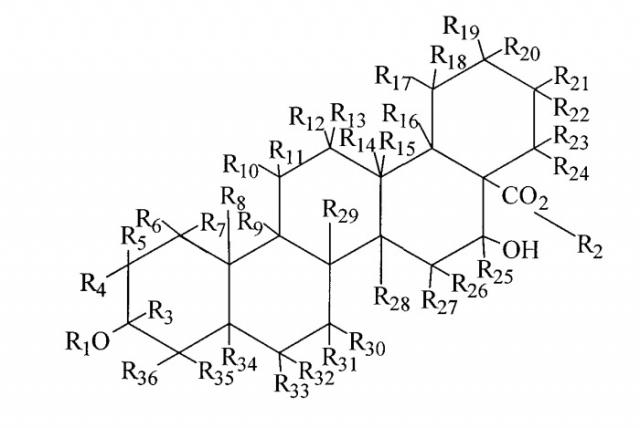
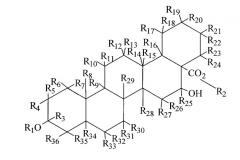
Тритерпеновая часть способа может включать в себя формулу:
или может быть ее изомером, где а) R1 и R2 выбраны из группы, состоящей из водорода, С1-С5-алкила, С1-С5-алкилена, С1-С5-алкилкарбонила, сахара, олигосахарида; b) где каждый из R3-R36 отдельно и независимо выбран из группы, состоящей из места ненасыщенной валентности, водорода, гидроксила, С1-С5-алкила, С1-С5-алкилена, С1-С5-алкилкарбонила, сахара, С1-С5-алкилового эфира и монотерпеновой группы, и с) по меньшей мере один из R3-R36 представляет собой монотерпеновую группу. Изомер может представлять собой оптический изомер, стереоизомер или цис-изомер, или транс-изомер.
В некоторых осуществлениях способа каждый из R1 и R2 включает в себя олигосахарид. В некоторых конкретных аспектах данного осуществления каждый из R1 и R2 включает в себя моносахарид, дисахарид, трисахарид или тетрасахарид. В других конкретных аспектах способа каждый из R1 и R2 включает в себя олигосахарид, включающий в себя сахара, которые отдельно и независимо выбраны из группы, состоящей из глюкозы, фукозы, рамнозы, арабинозы, ксилозы, хиновозы, мальтозы, глюкуроновой кислоты, рибозы, N-ацетилглюкозамина и галактозы. Еще в одном конкретном аспекте способа по меньшей мере один сахар метилирован.
В других осуществлениях способа R4 присоединен к тритерпеновой части через один из углеродов метилена, присоединенного к тритерпеновой части. В другом аспекте тритерпеновая часть дополнительно включает в себя по меньшей мере одну двойную связь.
В других осуществлениях способа тритерпеновая часть представляет собой сложный эфир акациевой кислоты, сложный эфир олеаноловой кислоты, сложный эфир бетулиновой кислоты, сложный эфир урзоловой кислоты, сложный эфир хиновиновой кислоты, сложный эфир помоловой кислоты, сложный эфир ротундовой кислоты, сложный эфир ротунгеновой кислоты, сложный эфир мадасиатовой кислоты, сложный эфир азиатовой кислоты, сложный эфир эускафиновой кислоты, сложный эфир торментиновой кислоты, сложный эфир мадекассиевой кислоты, сложный эфир лупеоловой кислоты, сложный эфир циликодисковой кислоты, сложный эфир молликовой кислоты, сложный эфир джессиковой кислоты, сложный эфир эхиноцистовой кислоты или сложный эфир энтагеновой кислоты или другую структурно сходную тритерпеноидную часть.
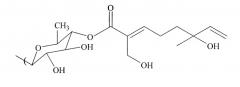
Монотерпеновая часть композиции, применяемая в способе, включает в себя формулу:
или представляет собой ее изомер, где
а) R3 выбран из группы, состоящей из водорода, гидроксила, С1-С5-алкила, С1-С5-алкилена, С1-С5-алкилкарбонила, сахара и монотерпеновой группы;
b) формула дополнительно включает в себя R4, где R4 выбран из группы, состоящей из водорода, гидроксила, С1-С5-алкила, С1-С5-алкилена, С1-С5-алкилкарбонила, сахара, С1-С5-алкилового сложного эфира и монотерпеновой группы.
Изомер может представлять собой либо цис-изомер, либо транс-изомер.
В других осуществлениях способа R3 представляет собой сахар. Сахар выбран из группы, состоящей из глюкозы, фукозы, рамнозы, арабинозы, ксилозы, хиновозы, мальтозы, глюкуроновой кислоты, рибозы, N-ацетилглюкозамина и галактозы. Композиция способа может дополнительно включать в себя другую монотерпеновую часть, присоединенную к сахару.
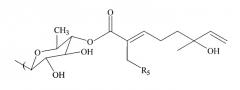
В других осуществлениях способа R3 имеет следующую формулу:
где R5 выбран из группы, состоящей из водорода, гидроксила, С1-С5-алкила, С1-С5-алкилена, С1-С5-алкилкарбонила, сахара, С1-С5-алкилового сложного эфира и монотерпеновой группы.
В некоторых осуществлениях R5 представляет собой водород или гидроксил. Изомер может быть стереоизомером или оптическим изомером.
В других осуществлениях способа R3 имеет следующую формулу:
В альтернативных осуществлениях R3 имеет следующую формулу:
В некоторых конкретных осуществлениях способа монотерпеновая композиция включает в себя формулу:
или ее изомер, где
а) R1 и R2 выбраны из группы, состоящей из водорода, С1-С5-алкила и олигосахарида;
b) R3 выбран из группы, состоящей из водорода, гидроксила, С1-С5-алкила, С1-С5-алкилена, С1-С5-алкилкарбонила, сахара и монотерпеновой группы;
с) формула дополнительно включает в себя R4, где R4 выбран из группы, состоящей из водорода, гидроксила, С1-С5-алкила, С1-С5-алкилена, С1-С5-алкилкарбонила, сахара, С1-С5-алкилового эфира и монотерпеновой группы, и где R4 может быть присоединен к тритерпеновой части или монотерпеновой части.
Изомер представляет собой стереоизомер или оптический изомер.
В других конкретных осуществлениях способа монотерпеновая композиция включает в себя формулу:
В других конкретных осуществлениях способа монотерпеновая композиция включает в себя формулу:
В других конкретных осуществлениях способа монотерпеновая композиция включает в себя формулу:
В других аспектах способа воспалительные ответы ингибируются, когда монотерпеновая композиция вводится в клетку в концентрации приблизительно от 0,5 до 2,0 мкг/мл.
Клетка находится у субъекта с воспалительным заболеванием. В предпочтительных аспектах субъект является человеком. В других аспектах субъект может быть животным других видов и может быть мышью или каким-либо другим животным-млекопитающим.
Воспалительное заболевание выбрано из группы, включающей в себя предраковое воспалительное заболевание, атеросклероз, ревматоидный артрит, остеоартрит, рассеянный склероз, болезнь Паркинсона и болезнь Альцгеймера.
Предраковое воспалительное заболевание может представлять собой эзофагит Барретта, воспалительное заболевание кишечника, хронический панкреатит, хронический простатит, семейный полипоз или лучевой кератоз. Часто данные предраковые состояния переходят в рак при отсутствии лечения. Таким образом, важна профилактика или лечение указанных предраковых состояний. Например, больные с определенными типами желудочно-пищеводного рефлюкса склонны к колоночной метаплазии нормальной сквамозной выстилки. Данное состояние, обозначаемое как эзофагит Барретта, имеется приблизительно у 10% больных с желудочно-пищеводным рефлюксом, и оно связано с наличием сужения, глубоких язв и последующим развитием аденокарциномы. Лучевой кератоз представляет собой предраковое состояние кожи, часто вызываемое действием солнечных лучей, и оно может вести к карциноме кожи. Воспалительные заболевания кишечника включают в себя состояния, подобные болезни Крона и язвенному колиту, которые могут приводить к раку ободочной кишки.
В определенных осуществлениях монотерпеновые композиции способа ингибируют фермент циклооксигеназу-2 (COX-2). В других осуществлениях монотерпеновые композиции способа ингибируют iNOS. Оба данных фермента являются нижележащими эффекторами NF-κB и вовлечены в разнообразные воспалительные и хемопревентивные ответы. Оба данных фермента индуцируются в ответ на различные цитокины, такие как интерферон гамма, митогены, микробные продукты, такие как липополисахариды и т.п. Например, монотерпеновые композиции согласно изобретению существенно снижают активацию NF-κB и экспрессию iNOS и COX-2 в ответ на провоспалительные агенты, такие как TNF и микробные продукты, такие как липополисахариды (LPS).
В других аспектах способа введение монотерпеновых композиций осуществляют локальным, местным или системным путями. Способ введения может быть путем инъекции, путем перорального употребления или путем местной аппликации. В других аспектах монотерпеновая композиция представляет собой фармацевтическую композицию в фармакологически приемлемой среде. Фармакологически приемлемая среда представляет собой буфер, растворитель, разбавитель, инертный носитель, масло, мазь или пригодный в пищу материал. Фармацевтическая композиция может дополнительно включать в себя направляющий агент. Направляющий агент может прямо доставлять фармацевтическую композицию к конкретному типу клеток, например к воспалительной клетке.
В данном описании или формуле изобретения термин "включающий в себя" может означать также "включающие в себя". Применяемый здесь термин "другой" может означать по меньшей мере второй или более.
Другие цели, характеристики и преимущества согласно изобретению станут ясными из последующего подробного описания. Должно быть понятно, однако, что подробное описание и конкретные примеры, представляя предпочтительные осуществления изобретения, даются только с целью иллюстрации, так как разнообразные вариации и модификации в пределах концепции и объема изобретения должны быть очевидными для специалистов в данной области техники из подробного описания.
Краткое описание чертежей
Следующие чертежи составляют часть настоящего описания и включены для дополнительной иллюстрации определенных аспектов согласно изобретению. Изобретение может быть лучше понято при ссылке на один или более из данных чертежей в сочетании с подробным описанием представленных здесь конкретных осуществлений.
Фиг. 1: Действие UA-BRF-004-DELEP-F001 на линии опухолевых клеток человека. На фиг. 1 представлено ингибирование роста линий клеток яичника (SK-OV-3, HEY, OVCAR-3), молочной железы (MDA-468), меланомы (A375-M, Hs294t) и эпидермоида человека (A431), обработанных сырым экстрактом стручковых растений.
Фиг. 2: Действие UA-BRF-004-DELEP-F023 (фракция 23) на трансформированные и нетрансформированные клеточные линии. На фиг. 2 представлена цитотоксичность, проявляемая фракцией 23, на линии клеток яичника (SK-OV-3, OCC1, HEY, OVCAR-3), Т-клеточного лейкоза (Jurkat), простаты (LNCaP), свежих опухолевых клеток яичника человека (FTC), фибробластов человека (FS) и эндотелиальных клеток (HUVEC). Была обнаружена только 15-17% цитотоксичность в отношении нетрансформированных клеток по сравнению с 50-95% цитотоксичностью в отношении опухолевых клеток.
Фиг. 3: Действие фракции 35 ("UA-BRF-004-DELEP-F035" или F035) на опухолевые клеточные линии человека. На фиг. 3 представлена цитотоксичность, проявляемая при обработке фракцией 35 линий клеток яичника человека (HEY, OVCAR-3, С-1, SK-OV-3), поджелудочной железы (PANC-1) и почек (769-P, 786-O, A498). IC50 для клеточных линий была заключена в диапазоне 1-6 мкг/мл.
Фиг. 4: Действие фракции 35 на лейкозные клеточные линии. На фиг. 4 показано, что фракция 35 проявляет сильную цитотоксичность в отношении клеток Jurkat (Т-клеточного лейкоза) с IC50 130 нг/мл и IC50 для клеток REH, KG-1 и NALM-6 (B-клеточного лейкоза) в диапазоне 1-3 мкг/мл.
Фиг. 5: Действие фракции 35 на пролиферацию эндотелиальных клеток. На фиг. 5 показано, что фракция 35 является сильным ингибитором пролиферации эндотелиальных клеток в присутствии или в отсутствие bFGF.
Фиг. 6: Действие фракции 35 на миграцию эндотелиальных клеток капилляров. На фиг. 6 показано отсутствие действия на миграцию эндотелиальных клеток капилляров, что предполагает отсутствие токсичности.
Фиг. 7: Представлена тонкослойная хроматография экстрактов сеянцев и наплывов. Дорожка 1, наплыв стебля, выращенный на среде BA-IAA; дорожка 2, наплыв корня, выращенный на среде BA-IAA; дорожка 3, наплыв гипокотиля; дорожка 4, сеянцы, обработанные метилжасмонатом (100 мкМ) на полутвердой среде; дорожка 5, контрольные сеянцы, растущие на полутвердой среде; дорожка 6, стандарт F023; дорожка 7, побег, выращенный на среде BA; дорожка 8, сеянцы, обработанные 50 мкМ метилжасмоната; дорожка 9, сеянцы, обработанные 100 мкМ метилжасмоната; дорожка 10, сеянцы, обработанные 200 мкМ метилжасмоната; дорожка 11, контрольные сеянцы; дорожка 12, стандарт F023.
Фиг. 8: Представлена фотография мыши SENCAR слева и мыши, полученной в результате скрещивания SENCAR и C57B1, справа. Обеих обрабатывали повторяющимися дозами 100 нмоль DMBA в течение 8 недель. К 15 неделям обе имели множественные папилломы, но мышь, полученная в результате скрещивания SENCAR и C57B1, имела меньшее количество папиллом и меньших размеров. Линия C57B1 является устойчивой к канцерогенезу и не дает опухолям развиться.
Фиг. 9A-F: Представлены срезы эпидермиса мышей, обработанных ацетоном, DMBA или DMBA + UA-BRF-004-DELEP-F035. Фиг. 9А: обработка ацетоном в течение 4 недель. Фиг. 9В: обработка ацетоном в течение 8 недель. Фиг. 9С: обработка DMBA в течение 4 недель. Фиг. 9D: обработка DMBA в течение 8 недель. Фиг. 9E: обработка DMBA + UA-BRF-004-DELEP-F035 в течение 4 недель. Фиг. 9F: обработка DMBA + UA-BRF-004-DELEP-F035 в течение 8 недель.
Фиг. 10A,B: Представлено антиоксидантное действие на ДНК UA-BRF-004-DELEP-F035 после 4 недель. Фиг. 10A: представлены антиоксидантные эффекты после обработки низкой концентрацией UA-BRF-004-DELEP-F035 (0,1 мг/0,2 мл). Фиг. 10B: представлены антиоксидантные эффекты после обработки высокой концентрацией UA-BRF-004-DELEP-F035 (0,3 мг/0,2 мл).
Фиг. 11A,B: Представлена толщина эпидермиса после 4-недельной обработки DMBA и UA-BRF-004-DELEP-F035. Фиг. 11A: представлено действие на толщину эпидермиса после обработки низкой концентрацией UA-BRF-004-DELEP-F035 (0,1 мг/0,2 мл). Фиг. 11B: представлено действие на толщину эпидермиса после обработки высокой концентрацией UA-BRF-004-DELEP-F035 (0,3 мг/0,2 мл).
Фиг. 12: Представлено процентное увеличение толщины эпидермиса через 4 недели после обработки DMBA при низкой (0,1 мг/0,2 мл) или высокой (0,3 мг/0,2 мл) концентрации UA-BRF-004-DELEP-F035.
Фиг. 13: Представлено процентное снижение папиллом через 8 недель обработки DMBA при низкой (0,1 мг/0,2 мл) или высокой (0,3 мг/0,2 мл) концентрации UA-BRF-004-DELEP-F035.
Фиг. 14: Представлена авторадиограмма реакции ПЦР, представляющая амплификацию мутации кодона 61 H-ras мыши.
Фиг. 15: Представлена первоначальная стратегия, применяемая для очистки и выделения биологически активных тритерпеновых соединений из Acacia victoriae.
Фиг. 16: Представлена общая улучшенная схема очистки, выделения и характеристики активных составляющих Acacia victoriae.
Фиг. 17A,B. Фиг. 17A: Представлен ВЭЖХ спектр ацетилированных сахаров, выделенных из гидролизованных активных составляющих, обнаруженных во фракции 94 ("UA-BRF-004Pod-DELEP-F094" или F094). Фиг. 17В: Представлен ВЭЖХ спектр ацетилированных сахаров, выделенных из гидролизованных активных составляющих, обнаруженных в F094.
Фиг. 18A-F. Фиг. 18A: Представлены ВЭЖХ спектры UA-BRF-004-DELEP-F035 и F035-B2. Фиг. 18B: Представлены ВЭЖХ спектры UA-BRF-004Pod-DELEP-F094. Фиг. 18C: Представлены ВЭЖХ спектры F140. Фиг. 18D: Представлены ВЭЖХ спектры F142. Фиг. 18E: Представлены ВЭЖХ спектры F144. Фиг. 18F: Представлены ВЭЖХ спектры F145.
Фиг. 19A,B: Анализ клеточного цикла клеток OVCAR-3 до и после обработки (48 час) фракцией 35. На фиг. показано, что наблюдается 8% увеличение числа клеток в фазе G1 и 10% снижение числа клеток в фазе S клеточного цикла после обработки фракцией 35, что отражает приостановку вхождения в фазу G1. Фиг. 19A: анализ клеточного цикла необработанных опухолевых клеток OVCAR-3. Фиг. 19B: анализ клеточного цикла опухолевых клеток OVCAR-3, обработанных фракцией 35.
Фиг. 20: EMSA, демонстрирующий заметное ингибирование NF-κB, активированного TNF, в результате экспозиции клеток с UA-BRF-004-DELEP-F035 и UA-BRF-004Pod-DELEP-F094. Применялась следующая обработка: дорожка 1, необработанные; дорожка 2, TNF (100 пМ); дорожка 3, UA-BRF-004-DELEP-F035 (1 мкг/мл); дорожка 4, TNF + F035 (1 мкг/мл); дорожка 5, F035 (2 мкг/мл); дорожка 6, TNF + F035 (2 мкг/мл); дорожка 7, F094 (1 мкг/мл); дорожка 8, TNF + F094 (1 мкг/мл); дорожка 9, F094 (2 мкг/мл); дорожка 10, TNF + F094 (2 мкг/мл).
Фиг. 21: Определение киназы липидов, демонстрирующее ингибирование PI3-киназы UA-BRF-004-DELEP-F035 и вортманнином.
Фиг. 22: Гель после ДДС-Na ПААГ-электрофореза, проанализированный с помощью иммуноблоттинга-ECL с применением антител, специфичных в отношении фосфата AKT и общего AKT. Последующая обработка клеток 1 и 2 мкг/мл UA-BRF-004-DELEP-F035 вызывала отчетливое ингибирование фосфорилирования AKT (активный AKT), которое было сходным с таковым после 2 часовой обработки клетки 1 мкМ вортманнином.
Фиг. 23: Раскрывает амплификацию PCRTM части гена rol B из четырех независимо трансформированных клонов корня. (Дорожки L-R, 1: маркеры в т.п.н., 2: позитивный контроль (ДНК плазмиды из штамма R1000), 3: негативный контроль (ДНК из нетрансформированного корня). 4-7: четыре независимо трансформированных клона корня. Обратить внимание на амплификацию фрагмента 645 п.н. в позитивном контроле и трансформированных корнях.
Фиг. 24: Структура эллиптозида A и эллиптозида E (Beutler, 1997).
Фиг. 25: Разделение ВЭЖХ составляющих в F094.
Фиг. 26: Разделение ВЭЖХ составляющих в F035.
Фиг. 27: Первое фракционирование с помощью полупрепаративной ВЭЖХ F094.
Фиг. 28: Второе фракционирование с помощью полупрепаративной ВЭЖХ F094.
Фиг. 29: Препаративное фракционирование F094.
Фиг. 30: Анализ препаративной фракции D.
Фиг. 31: Анализ препаративной фракции G/H.
Фиг. 32: Соединение G1 после второй очистки на колонке PFP.
Фиг. 33: Соединение G1 после окончательной очистки С-18.
Фиг. 34: Соединение D1 после очистки на колонке С-18 Waters.
Фиг. 35: Соединение D1 после окончательной очистки С-18-Aq.
Фиг. 36: Изображены соединения, получаемые после деградации соединения D1.
Фиг. 37: Изображены соединения, получаемые после деградации соединения G1.
Фиг. 38: Изображены соединения, получаемые после деградации соединения B1.
Фиг. 39: Структура тритерпенового гликозида D1.
Фиг. 40: Структура тритерпенового гликозида G1.
Фиг. 41: Структура тритерпенового гликозида B1.
Фиг. 42: Действие тритерпеновых гликозидов (F035) на линии раковых и нормальных клеток. F035 оценивалась на цитотоксичность с помощью процедур, описанных в примерах. Активность F035 определяли с помощью панели линий раковых и нормальных клеток. IC50 находилась в диапазоне 0,2-5,8 мкг/мл для раковых клеток. Не наблюдалось заметной цитотоксичности (IC50 от 15 мкг/мл до > 25 мкг/мл) для нормальных и иммортализированных клеточных линий.
Фиг. 43: Профиль цитотоксичности очищенных тритерпеновых гликозидов D1 и G1 на линиях клеток рака человека. Очищенные экстракты оценивали на их активность в отношении следующих линий клеток рака человека: Jurkat (Т-клеточного лейкоза), варианта С-2 Hey (яичников), 769-P (почек), MDA-MB-231, MDA-MB-453 (молочной железы). Результаты представлены как среднее + ср. кв. ошибка.
Фиг. 44: Действие очищенных соединений D1 и G1 и смеси тритерпеновых гликозидов (F035) на апоптоз: апоптоз измеряли с применением теста связывания аннексина V, в котором клетки окрашивали аннексином-V-ФИТЦ и для содержания ДНК иодидом пропидия (PI) и анализировали с помощью проточной цитометрии. Клетки инкубировали в течение 16 часов с 0,5-1,0 мкг/мл экстрактов. После 16-часовой обработки наблюдались три популяции клеток. Клетки, которые погибли или были на поздней стадии апоптоза (позитивные по аннексину-V-ФИТЦ и PI), клетки, подвергающиеся апоптозу (позитивные по аннексину-V-ФИТЦ и негативные по PI), и клетки, которые были жизнеспособными и не подвергающимися апоптозу (негативные по аннексину-V-ФИТЦ и по PI; нижний левый квадрат).
Фиг. 45 A,B: Ингибирование активности PI3-киназы и фосфорилирования AKT. Способность фосфорилировать фосфатидилинозитол (PI) измеряли для иммунопреципитатов белка p85 из клеточных лизатов. Авторадиограммы на активность киназы in vitro с разделением с помощью тонкослойной хроматографии для иммунопреципитатов р85 с применением клеток Jurkat. Фиг. 45B: ингибирование фосфорилирования AKT по Ser-473 и Thr-308 сырыми и чистыми тритерпеновыми гликозидами. Клетки Jurkat инкубировали с сырым (F035) и очищенным экстрактами D1 и G1 в течение 16 часов при 37°С. Клеточные лизаты разделяли на 9% ДДС-Na ПААГ-электрофорезе и анализировали с помощью иммуноблоттинг-ECL анализа с применением в качестве зондов антител против Ser-473, Thr-308 и против общего AKT.
Фиг. 46A-D. Ингибирование NF-κB, индуцированного TNF, и индукция iNOS тритерпеновыми гликозидами: клетки Jurkat экспонировали с различными концентрациями F035 (1-4 мкг/мл; фиг. 46А) и 2 мкг/мл чистых экстрактов (D1 и G1; фиг. 46В) в течение 16 часов и NF-κB активировали 100 пМ TNF в течение 15 мин при 37°С. ДНК-белковый комплекс разделяли на 7,5% неденатурирующих полиакриламидных гелях и полосы радиоактивности визуализировали и оценивали количественно с помощью PhophoImager. NOS индуцировали в U-937 (фиг. 46С) и клетках Jurkat (фиг. 46D), как описано в методах. Клеточные белки разделяли на ДДС-Na ПААГ-электрофорезе и анализировали с помощью иммуноблоттинг-ECL анализа с применением антител против iNOS.
Фиг. 47: Действие F035 и D1 на расщепление PARP в клетках Jurkat.
Фиг. 48: Действие z-vad fmk на индуцируемое F035 расщепление PARP в клетках Jurkat.
Фиг. 49: Действие F035, F094, D1 и G1 на активность каспазы в клетках Jurkat.
Фиг. 50: Действие F035 на высвобождение цитохромов из митохондрий клеток Jurkat.
Фиг. 51А и фиг. 51В: Действие F094 и монотерпенового/тритерпенового гликозида G1 на активацию NF-κB, индуцированную TNF. Клетки Jurkat (1 х 106/мл) обрабатывали 2 мкг/мл F094 (фиг. 51А) или монотерпеновым/тритерпеновым гликозидом G1 (фиг. 51В) в течение 1-16 часов при 37°С. В конце обработки клетки промывали, ресуспендировали в количестве 2 х 106/мл в полной среде и обрабатывали 1 нМ TNF в течение 15 мин при 37°С. Получали ядерный экстракт и исследовали его на активацию NF-κB, как описано в разделе примеров.
Фиг. 52А и фиг. 52В: Фиг. 52А. Дозозависимость ингибирования монотерпеновым/тритерпеновым гликозидом G1 активации NF-κB, индуцированной TNF. Клетки Jurkat (1 х 106/мл) обрабатывали различными концентрациями монотерпенового/тритерпенового гликозида G1 в течение 16 часов при 37°С. В конце обработки клетки промывали, ресуспендировали в количестве 2 х 106/мл в полной среде и обрабатывали 1 нМ TNF в течение 15 мин при 37°С. Получали ядерный экстракт и исследовали его на активацию NF-κB, как описано в разделе примеры. Фиг. 52В. Суперсдвиг и анализ специфичности NF-κB. Ядерный экстракт клеток, обработанных TNF, инкубировали в течение 15 мин с мутантным олигонуклеотидом NF-κB, немеченым олигонуклеотидом NF-κB, анти-р65 антителом и неиммунной сывороткой кролика. Затем оценивали активацию NF-κB, как описано в разделе примеров.
Фиг. 53А и фиг. 53В: Действие монотерпенового/тритерпенового гликозида G1 на индуцированные TNF IκBα (фиг. 53А) и ядерную транслокацию р65 (фиг. 53В). Клетки Jurkat обрабатывали монотерпеновым/тритерпеновым гликозидом G1 (2 мкг/мл, 16 часов), промывали и инкубировали с 1 нМ TNF в течение различных промежутков времени. Применяли цитоплазматический и ядерный экстракты данных клеток для исследования уровней IκBα и р65, соответственно, с помощью иммуноблоттинга, как описано в разделе примеров.
Фиг. 54А, фиг. 54В и фиг. 54С: фиг. 54А. Действие добавления in vitro монотерпенового/тритерпенового гликозида G1 на связывание NF-κB с ДНК. Экстракты стимулированных TNF клеток Jurkat обрабатывали различными концентрациями монотерпенового/тритерпенового гликозида G1 в течение 30 мин при 37°С и анализировали на связывание NF-κB с помощью ENSA. Фиг. 54В. Действие монотерпенового/тритерпенового гликозида G1 на индуцированную дезоксихолатом (DOC) активацию NF-κB. Цитоплазматические экстракты необработанных клеток обрабатывали DOC в присутствии или в отсутствие монотерпенового/тритерпенового гликозида G1 и затем анализировали на активацию NF-κB. Фиг. 54С. Действие DTT на индуцированное монотерпеновым/тритерпеновым гликозидом G1 ингибирование активации NF-κB.
Фиг. 55А и фиг. 55В: фиг. 55А. Действие монотерпенового/тритерпенового гликозида G1 на активность экспрессии гена люциферазы, зависимого от NF-κB. Клетки Jurkat трансфицировали pGL3-NF-κB с помощью электропорации. NF-κB активировали, применяя LPS (100 нг/мл), PMA (5 нг/мл) или TNF (1 нМ). Активность люциферазы определяли, применяя набор для определения люциферазы (Promega, Madison, WI), придерживаясь инструкций производителя. Фиг. 55В. Действие F094 и монотерпенового/тритерпенового гликозида G1 на индуцированную LPS экспрессию iNOS и COX-2. Клетки RAW 264.7, предварительно обработанные F094 и монотерпеновым/тритерпеновым гликозидом G1, обрабатывали LPS, как описано в методах. Экспрессию iNOS и COX-2 тестировали в цито