Способ экспериментальной терапии инфаркта миокарда
Иллюстрации
Показать всеНастоящее изобретение относится к медицине, в частности к экспериментальной кардиологии, и касается лечения инфаркта миокарда в эксперименте. Для этого животному подкожно вводят рекомбинантный человеческий гранулоцитарный колониестимулирующий фактор в дозе 100 мкг/кг веса, 1 раз в день в течение 5 дней. Способ обеспечивает эффективное восстановление функционально активной мышечной ткани в зоне поражения миокарда за счет оптимального выбора дозы и режима введения препарата экспериментальным животным. 1 табл., 2 ил.
Реферат
Изобретение относится к области медицины, конкретно к фармакологии, и касается способа лечения инфаркта миокарда.
Ишемическая болезнь сердца (ИБС) занимает основное место среди заболеваний сердечно-сосудистой системы. Как правило, результатом ИБС и ее острой формы - инфаркта миокарда (ИМ) - является развитие сердечной недостаточности (СН) [1].
Известны способы профилактики и лечения ИБС, инфаркта миокарда и СН, использующие широкий спектр лекарственных препаратов и немедикаментозных средств [2].
Недостатком данных способов является одновременное назначение большого количества лекарственных средств с разнонаправленными механизмами действия, сопровождаемое высокой ксенобиотической нагрузкой на организм, приводящей, в свою очередь, к нарушению функционирования систем жизнеобеспечения. Кроме того, несмотря на имеющийся арсенал применяемых при лечении указанных выше заболеваний средств и методов, зачастую не удается добиться не только излечения пациентов, но и достичь частичного восстановления ряда утерянных функций [3]. Такое положение дел связано с тем, что ни один из применяемых в практической кардиологии методов не устраняет основную причину возникновения СН - замещение при ИМ функционирующей ткани сердечной мышцы несократимой соединительной тканью.
Известны также способы экспериментальной клеточной и медикаментозной терапии инфаркта миокарда, направленные главным образом на восстановление кровеносных сосудов в зоне поражения и улучшения условий кровоснабжения сердечной мышцы. Они заключаются во введении в пограничную зону инфаркта выделенных из костного мозга и очищенных in vitro плюрипотентных стволовых клеток в комбинации с вазодилататорами [4].
Однако такой подход обладает рядом существенных недостатков: требует длительного времени для подготовки качественного трансплантационного материала, инвазивен и сопряжен с большой лекарственной и аппаратной нагрузкой на пациента.
Задачей, решаемой предлагаемым изобретением, является восстановление функционально активной мышечной ткани сердца после инфаркта миокарда при минимальной лекарственной и аппаратной нагрузке на организм пациента.
Способов медикаментозного лечения инфаркта миокарда с восстановлением функционально активной мышечной ткани не существует. Предлагаемый способ лечения инфаркта миокарда не имеет адекватных аналогов среди существующих методов и подходов, применяемых при лечении сердечной недостаточности.
Поставленная задача достигается техническим решением, заключающимся в подкожном введении лабораторным животным (крысы) препарата рекомбинантного человеческого гранулоцитарного колониестимулирующего фактора в дозе 100 мкг/кг 1 раз в день в течение 5 дней.
Новым в данном изобретении является использование препарата рекомбинантного человеческого гранулоцитарного колониестимулирующего фактора в дозе 100 мкг/кг 1 раз в день в течение 5 дней.
Полученные в последние годы сведения о свойствах и закономерностях жизнедеятельности мультипотентных клеток-предшественников организма открыли возможность развития новой стратегии лечения многих заболеваний - с помощью стволовых клеток [5]. При этом, согласно имеющимся представлениям, не вызывает сомнения возможность мобилизации собственных механизмов "глубокого резерва" - костномозговых и регионарных стволовых клеток, с помощью различных цитокинов, в том числе гранулоцитарного колониестимулирующего фактора [6].
Используемый в предлагаемом изобретении препарат позволяет активировать механизмы "глубокого резерва" и обеспечить восстановление функционально активной мышечной ткани сердца путем мобилизации в периферическую кровь и хоминга в зону повреждения костномозговых стволовых клеток. Подобранные нами условия введения являются оптимальными для эффективного восстановления миокарда. Данная терапия не требует использования дополнительных лекарственных средств, уменьшая тем самым ксенобиотическую нагрузку на системы жизнеобеспечения организма.
Заявляемые существенные признаки проявили в совокупности новые свойства, не являющиеся очевидными для специалиста и не вытекающие явным образом из уровня техники в данной области. Новые признаки позволяют осуществлять эффективную терапию экспериментального инфаркта миокарда, и предлагаемое изобретение может быть использовано в медицине. Идентичной совокупности признаков не обнаружено при исследовании уровня техники по патентной и научно-медицинской литературе.
Исходя из вышеизложенного, следует считать заявляемое техническое решение соответствующим критериям: "Новизна", "Изобретательский уровень", "Промышленная применимость".
Изобретение будет понятно из следующего описания и приложенных к нему чертежей.
На фиг.1 дана микрофотография зоны постинфарктного кардиосклероза у нелеченых крыс через 30 суток после моделирования инфаркта миокарда (ув. ×80).
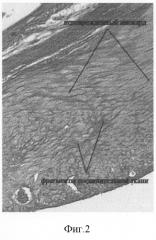
На фиг.2 - микрофотография зоны постинфарктного кардиосклероза у крыс, леченных препаратом гранулоцитарного колониестимулирующего фактора, через 30 суток после моделирования инфаркта миокарда (ув. ×80).
Способ осуществляют следующим образом.
Лабораторному животному (крысе) сразу после моделирования инфаркта миокарда в течение 5 дней 1 раз в день подкожно вводят 100 мкг/кг препарата рекомбинантного человеческого гранулоцитарного колониестимулирующего фактора (рч Г-КСФ).
Предлагаемый способ был изучен в экспериментах на крысах породы Вистар в количестве 36 штук, массой 250-300 г. Животные получены из питомника отдела экспериментального биомедицинского моделирования НИИ фармакологии ТНЦ СО РАМН (сертификат имеется).
Оценку состояния сердечной мышцы животных производили по данным электрокардиографии и путем морфологического изучения гистологических препаратов миокарда: срезов, окрашенных пикрофуксином на соединительную ткань. На микрофотографиях оценивали соотношение мышечных и соединительнотканных структурных элементов миокарда с помощью средств компьютерной обработки графических данных.
Обработку результатов проводили методом вариационной статистики с использованием t-критерия Стьюдента и непараметрического U-критерия Вилкоксона-Манна-Уитни [7].
Пример 1.
Моделирование экспериментального инфаркта миокарда осуществляли путем торакотомии с лигированием левой коронарной артерии на уровне первой четверти расстояния от пульмонального конуса до верхушки сердца под эфирным наркозом с визуальным и электрокардиографическим контролем состояния. После операции крысы с электрокардиографическими признаками ишемического повреждения сердца были поделены на 2 равные группы. Животным экспериментальной группы сразу после моделирования инфаркта миокарда подкожно 1 раз в день в течение 5 дней вводили 100 мкг/кг препарата рекомбинантного человеческого гранулоцитарного колониестимулирующего фактора (НИКТИ БАВ "Вектор", Новосибирск) - растворенного в 0,5 мл растворителя. Первое введение осуществляли через 3 ч после операции. Животным контрольной группы по той же схеме вводили физиологический раствор по 0,5 мл.
Электрокардиографическое исследование проводили всем животным до операции, через 3 ч и 30 сут после лигирования коронарной артерии. На 30 сут эксперимента животных обеих групп умерщвляли передозировкой эфирного наркоза, вскрывали грудную клетку и препарировали сердце.
Для морфологического исследования сердце отсекали от аорты и правого желудочка (не захватывая межжелудочковую перегородку) и помещали в 10% формалин. После обезвоживания по стандартной методике левый желудочек заливали в парафин. Затем через весь левый желудочек от основания до вершины готовили срезы толщиной 5 мкм через каждые 300 мкм. Полученные срезы окрашивали пикрофуксином на соединительную ткань. После этого срезы фотографировали по всей площади с помощью микровидеокамеры "Digital micro" фирмы "Элекарт", Томск. На микрофотографиях оценивали соотношение структурных элементов миокарда с помощью средств компьютерной обработки графических данных.
Исходные параметры ЭКГ у животных опытной и контрольной групп достоверно не различались и не выходили за пределы принятых для данного вида животных физиологических норм. Через 3 ч после лигирования коронарной артерии у крыс развивались выраженные электрокардиографические изменения. Наблюдалось резкое возрастание амплитуды зубца Т, что свидетельствует о развитии значительных ишемических нарушений в миокарде. Одновременно снижалась амплитуда зубца R, и у части животных (42%) появлялся патологический Q-зубец. В ряде случаев комплекс QRS отсутствовал и формировался комплекс QT. Наблюдаемые изменения комплекса QRS отражали формирование в сердечной мышце обширной зоны некроза. Выявленные в комплексе сдвиги параметров ЭКГ свидетельствовали о развитии острой стадии инфаркта миокарда.
Через 30 сут после лигирования коронарной артерии у крыс обеих экспериментальных групп практически нормализовывался зубец Т, что указывает на исчезновение зоны ишемического повреждения. У крыс контрольной группы амплитуда R-зубца оставалась сниженной и составляла 140±26 мкВ. Достоверно была снижена также частота сердечных сокращений (ЧСС) (до 347±13 мин-1) и замедлена "электрическая систола" желудочков (удлинен интервал QT). У одного животного был выявлен патологический Q-зубец. Наблюдаемые изменения ЭКГ указывают на наличие у крыс контрольной группы постинфарктного кардиосклероза (рубцовая стадия инфаркта миокарда).
| ТаблицаЧастота сердечных сокращений (ЧСС) и показатели электрокардиограммы у крыс с экспериментальным инфарктом миокарда (X±m). | ||||||
| Показатель | Контроль (инфаркт) | Опыт (инфаркт + рч Г-КСФ) | ||||
| Исходные значения | 3 ч | 30 сут | Исходные значения | 3 ч | 30 сут | |
| ЧСС, мин-1 | 417±10 | 437±10 | 347±13* | 413±10 | 443±18 | 398±16* |
| PQ, mc | 50±1 | 47±3 | 50±2 | 48±1 | 47±2 | 47±2 |
| QT, mc | 78±3 | 81±2 | 94±5# | 79±4 | 80±4 | 79±4* |
| QRS, мс | 15±1 | 14±2 | 18±2 | 14±1 | 12±1 | 17±2 |
| Р, мкВ | 32±4 | 22±5 | 26±5 | 29±4 | 30±5 | 27±5 |
| R, мкВ | 272±22 | 154±30# | 149±20# | 293±16 | 206±24# | 328±44* |
| Т, мкВ | 92±21 | 2201±41# | 93±9 | 113±16 | 208±31# | 140±26 |
| Q, mkb | - | 87±41# | 5±1# | - | 77±24# | - |
У животных, получавших рч Г-КСФ, к 30 сут после лигирования коронарной артерии амплитуда зубца R составила 328±44 мкВ, что достоверно выше, чем в контрольной группе. ЧСС также была выше на 13%, наблюдалось статистически значимое сокращение длительности интервала QT. У крыс этой группы не только улучшалась ЭКГ по сравнению с контролем, но и отсутствовали достоверные различия со значениями параметров ЭКГ до моделирования инфаркта миокарда. Таким образом, курсовое введение рч Г-КСФ крысам с дотированной коронарной артерией к 30 сут нормализовывало параметры ЭКГ.
При обработке гистологических препаратов обнаружено, что у экспериментальных животных обеих групп через 30 сут после развития инфаркта на месте зоны некроза сформировался соединительнотканный рубец. У большинства крыс контрольной группы практически вся стенка сердца в зоне рубца была представлена соединительной тканью. Доля соединительнотканных элементов в общей площади миокарда на препаратах составила 4,43±0,93% (фиг.1). У животных, получавших рч Г-КСФ, постинфарктный склероз был слабо выражен: в зоне рубца коллагеновые волокна перемежались с кардиомиоцитами, занимая лишь 0,39±0,15% от общей площади миокарда (фиг.2).
Таким образом, препарат рч Г-КСФ обладал выраженным лечебным действием в отношении экспериментального инфаркта миокарда, ускорял регенерационные процессы в ткани сердечной мышцы, подвергнутой ишемическому повреждению, за счет восстановления функционально активных мышечных элементов. Это предотвращало развитие соединительнотканного рубца и повышало функциональную активность миокарда в постинфарктном периоде.
Предлагаемый способ позволяет лечить инфаркт миокарда, достигая эффекта восстановления функционально активной мышечной ткани в зоне поражения взамен формирования соединительнотканного рубца.
Источники информации
1. Бокерия Л.А., Гудкова Р.Г. Сердечно-сосудистая хирургия - 2001. Болезни и врожденные аномалии системы кровообращения. - М.: Изд-во НЦССХ им. Бакулева, 2002. - 83 с.
2. Новиков В.П. Инфаркт миокарда. Патогенез, фармакотерапия, профилактика. - М.: Изд-во РАМН, 2000. - 336 с.
3. Cleland J.G., McGowan J. Heart failure due to ischaemic heart disease: epidemiology, pathophysiology and progression // J. Cardiovasc. Pharmacol. - 1999. - Vol.33., Suppl 3. - P.17-29.
4. Fujii Т., Nagaya N., Iwase T. et al. Adrenomedullin enhances therapeutic potency of bone marrow transplantation for myocardial infarction in rats // Am J. Physiol. Heart. Circ. Physiol. - 2004. - Nov.11. - P.336-337.
5. Holtzer H. Cell lineages, stem cells and the quantal cell cycle concept / Stem cells and tissue homeostasis. Eds: B.I.Lord, C.S.Poten, R.J.Cole. - New York, Cambrige Unyversity Press, 1978. - P.1-28.
6. Haas R., Murea S. The role of granulocyte colony-stimulating factor in mobilization and transplantation of peripheral blood progenitor and stem cells // Mol. Ther. - 1996. - V.2. - N.1. - P.136.
7. Лакин Г.Ф. Биометрия. - М.: Высшая школа, 1973. - 215 с.
Способ экспериментальной терапии инфаркта миокарда, заключающийся во введении препарата, отличающийся тем, что в качестве препарата используют рекомбинантный человеческий гранулоцитарный колониестимулирующий фактор, который вводят подкожно в дозе 100 мкг/кг 1 раз в день в течение 5 дней.