Перенос генов, опосредованный лентивирусным вектором, и их использование
Иллюстрации
Показать всеНастоящее изобретение относится к медицине, в частности к офтальмологии, и может быть использовано для лечения глазных болезней, обусловленных патологической пролиферацией клеток. Для этого в различные отделы глаза вводят терапевтически эффективные дозы лентивирусного вектора, содержащего ген, регулирующий ангиогенез. Такое выполнение способа обеспечивает эффективное ингибирование внутриглазной пролиферации клеток и неоваскуляризации за счет оптимального сочетания терапевтического гена и вирусного носителя. 2 н. и 6 з.п. ф-лы, 1 табл, 34 ил.
Реферат
Предпосылки создания изобретения
Область, к которой относится изобретение
В общих чертах настоящее изобретение относится к области молекулярной биологии векторов и генотерапии. Более конкретно, настоящее изобретение относится к использованию лентивирусных векторов в генотерапии человека для лечения врожденных и пролиферативных глазных болезней.
Описание предшествующего уровня техники
Одной из наиболее распространенных причин слепоты человека является аномальная внутриглазная пролиферация клеток, которая в большинстве случаев, приводит к потере прозрачности зрительной оси или к отделению сетчатки от пигментного эпителия сетчатки (RPE), обусловленному силой натяжения, прилагаемой непосредственно к поверхности сетчатки. Пролиферативное отслоение сетчатки, независимо от того, ассоциируется ли оно с пролиферативным диабетическим заболеванием (PDR), с ретинопатией недоношенных (ROP), с пролиферирующей витреоретинопатией (PRV) или с реваскулярной дегенерацией желтого пятна, связанной со старением (AMD), в конечном счете, приводит к перманентной потере зрения, если оно не подвергалось лечению.
Аномальная пролиферация новых кровеносных сосудов глаза, т.е. неоваскуляризация глаза, является одной из наиболее распространенных причин перманентной слепоты у людей в развивитых странах. В большинстве случаев с развитием внутриглазной неоваскуляризации ассоциируются три заболевания: диабет, ретинопатия недоношенных и дегенерация желтого пятна, ассоциированная со старением. Хотя все эти три нозологические формы отличаются друг от друга и поражают различные группы пациентов, однако, все они имеют один и тот же конечный путь, который приводит к неконтролируемому делению эндотелиальных клеток и тем самым к образованию новых кровеносных сосудов, которые в конечном счете нарушают функцию сетчатки. В целом, в Соединенных Штатах такие состояния приблизительно в 60% случаях являются причиной не поддающейся лечению потери зрения.
Пролиферация васкулярных эндотелиальных клеток в сетчатке инициирует процесс развития пролиферативной диабетической ретинопатии (PDR). Если заболевание не подвергается лечению, то эти эндотелиальные клетки продолжают делиться и в конечном счете образуют фиброваскулярные мембраны, которые простираются вдоль всей внутренней поверхности сетчатки или проникают в стекловидную полость. Сокращение задней поверхности стекловидного тела приводит к натяжению на участках витреофиброваскулярной адгезии и в конечном счете приводит к отслоению сетчатки. Приблизительно у 50% пациентов с диабетом типа 1 пролиферативная диабетическая ретинопатия развивается в течение 20 лет после установления диагноза диабета, и у 10% пациентов с диабетом типа 2 через те же самые промежутки времени также может наблюдаться пролиферативная диабетическая ретинопатия.
Кровеносные сосуды обычно развиваются в соответствии с одним из двух механизмов, таким как образование и развитие сосудов или ангиогенез. В процессе неоваскуляризации еще не развившаяся сеть капилляров образуется во время эмбриогенеза в результате созревания полипотентных мезенхимальных предшественников. В противоположность этому ангиогенез представляет собой процесс ремоделирования с вовлечением уже имеющихся сосудов. При ангиогенезе из уже имеющихся старых сосудов образуются новые сосудистые зачаточные структуры, которые затем внедряются в окружающую ткань. В сетчатке после образования нормальной сосудистой сети ремоделирование этой сети происходит главным образом под действием низкой концентрации кислорода в ткани, то есть при гипоксии (кислородной недостаточности), которая стимулирует ангиогенез. Этот процесс приводит к слепоте у миллионов людей, страдающих диабетом, у недоношенных детей или у людей преклонного возраста.
Следовательно, внутриглазные заболевания, такие как дегенерация желтого пятна, ассоциированная со старением, пролиферативная диабетическая ретинопатия, ретинопатия недоношенных, глаукома и пролиферативная витреоретинопатия, характеризуются аномальной пролиферацией или другими состояниями, для лечения которых может применяться генотерапия. Однако осуществление трансдукции гена в клетки млекопитающих с достаточно высокой эффективностью является трудной задачей. Кроме того, использование таких стандартных векторов, как аденовирусные векторы, липосомы и реагенты на основе дендримеров, дает лишь кратковременный эффект. Введение этих векторов в глаз, но без индуцирования сильного воспалительного ответа также остается проблематичным.
Таким образом, в литературе пока не описан способ трансдукции терминально дифференцированных клеток или пролиферирующих клеток глаза человека или клеток, происходящих из глазной ткани. Настоящее изобретение позволяет решить эту давно назревшую проблему, с которой сталкиваются специалисты в данной области.
Краткое описание изобретения
Целью настоящего изобретения является получение лентивирусных векторов и разработка способов с использованием этих векторов в генотерапии человека для лечения наследственных и пролиферативных глазных болезней. Описано также использование лентивирусных векторов для трансдукции в сетчатку, роговицу, в сосудистый эндотелий, в клетки, ассоциированные с витреоретинопатией, и в пигментные эпителиальные клетки роговицы человека.
В одном из вариантов осуществления настоящего изобретения была продемонстрирована возможность ингибирования деления клеток внутриглазной ткани путем введения конститутивно активного (мутантного или вариантного) гена ретинобластомы (СА-rb), доставляемого лентивирусом. Были протестированы in vitro глазные клетки человека и были также протестированы in vivo две модели внутриглазного пролиферативного заболевания (пролиферативной витреоретинопатии и помутнения задней капсулы после извлечения хрусталика). Для многих различных типов клеток наблюдалось значительное и продолжительное ингибирование деления клеток in vitro. In vivo также наблюдалось ослабление тяжести пролиферативной витреоретинопатии и помутнение задней капсулы после извлечения хрусталика.
В другом варианте осуществления настоящего изобретения было продемонстрировано, что опосредуемый лентивирусом перенос генов, о которых известно, что они играют важную роль в развитии и ингибировании образования новых кровеносных сосудов (ангиогенеза) или в запрограммированной клеточной гибели (апоптоза), может быть использован для лечения патологического глазного ангиогенеза (например, диабетической ретинопатии или ассоциированной со старением дегенерации "мокрого" желтого пятна) или патологической клеточной гибели (например, ассоциированной со старением дегенерации "сухого" желтого пятна). Эти гены помещали под контроль одного из двух отдельных сильных промоторов, о которых известно, что они являются активными в сетчатке, роговице и в пигментных эпителиальных клетках роговицы человека, и ингибирование неоваскуляризации было продемонстрировано на кроличьей модели.
Кроме того, с помощью этой системы доставки векторов в том случае, если в этих векторах имеются гены, которые, как известно, отсутствуют у пациентов с наследственной глазной болезнью, можно осуществлять перенос этих генов в клетки глаза человека. Перенос этих генов с помощью такой системы лежит в основе терапии, которая может быть использована для лечения пациентов с глазными болезнями.
Настоящее изобретение относится к способу ингибирования внутриглазной пролиферации клеток у индивидуума с глазной болезнью, нуждающегося в таком лечении. Этот способ включает стадию введения указанному индивидууму фармакологически эффективной дозы лентивирусного вектора, содержащего терапевтический ген, который ингибирует внутриглазную пролиферацию клеток.
Настоящее изобретение также относится к способу ингибирования внутриглазной неоваскуляризации у индивидуума с глазной болезнью, включающему стадию введения указанному индивидууму фармакологически эффективной дозы лентивирусного вектора, содержащего терапевтический ген, который ингибирует внутриглазную неоваскуляризацию.
Другие и дополнительные аспекты, признаки и преимущества настоящего изобретения будут очевидны из нижеследующего описания предпочтительных вариантов осуществления изобретения. Эти варианты осуществления изобретения приводятся лишь в иллюстративных целях.
Краткое описание
Для того чтобы все вышеописанные признаки, преимущества и цели настоящего изобретения, а также другие его аспекты были более ясными, легко осуществимыми и более понятными в деталях, ниже приводится более конкретное описание кратко сформулированного выше изобретения, которое сопровождается ссылками на некоторые варианты его осуществления и на прилагаемые чертежи. Эти чертежи являются частью описания. Однако следует отметить, что прилагаемые чертежи иллюстрирует предпочтительные варианты осуществления изобретения, а поэтому они не должны рассматриваться как ограничение изобретения.
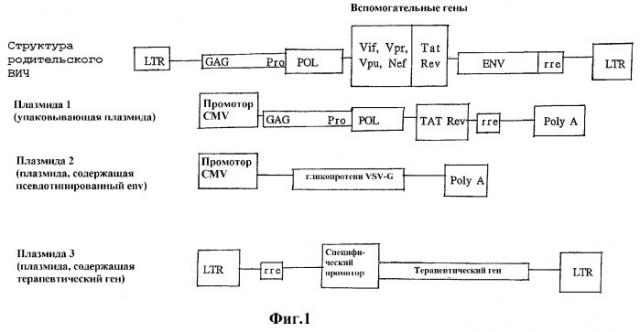
На фиг.1 показан вектор (предоставленный Dr. Inder Verma, Salk Institute, San Diego, CA). ВИЧ: вирус иммунодефицита человека; LTR: длинные концевые повторы; GAG: ген GAG ВИЧ; POL: обратная транскриптаза ВИЧ; ENV: ген оболочки ВИЧ; rre: rev-восприимчивый элемент; CMV: цитомегаловирус; VSV: вирус везикулярного стоматита; Poly A: сигнал полиаденилирования; специфический промотор: может быть использован любой усиливающий транскрипцию промотор так, чтобы он модулировал пространственные, временные или количественные аспекты экспрессии терапевтического гена; терапевтический ген: может быть использован любой терапевтически потенциальный ген, включая, но не ограничиваясь им, например, конститутивно активный ген ретинобластомы или гены, дефицит которых приводит к заболеванию.
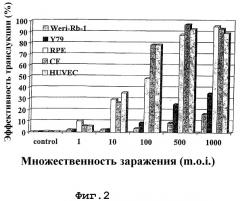
На фигуре 2 проиллюстрирована in vitro трансдукция нижеследующих клеточных линий человека: пигментных эпителиальных клеток сетчатки человека (RPE), эндотелиальных клеток пупочной вены человека (HUVEC), хороидальных фибробластов (CF), клеток ретинобластомы человека (выделенных из сетчатки) (Weri-Rb-1 и Y79). Эти клеточные линии были трансдуцированы с помощью лентивирусных частиц, содержащих маркерный ген (ген белка после стимуляции флуоресцентным зеленым), и фракцию клеток, экспрессирующих маркерный ген, определяли на флуоресцентно-активированном клеточном сортере. Наблюдаемый дозозависимый ответ свидетельствует о том, что большее число клеток трансдуцируется большим числом лентивирусных частиц (множественность заражения - m.o.i.).
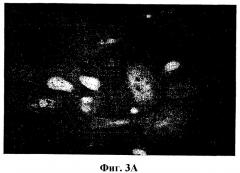
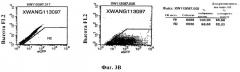
На фиг.3А продемонстрирована лентивирусная трансдукция культивированных пигментных эпителиальных клеток сетчатки. Экспрессия маркерного гена (eGFP) приводит к зеленому флуоресцентному окрашиванию клеток. На фиг.3 В проиллюстрирован анализ эффективности трансдукции, проводимый методом сортировки клеток по интенсивности флуоресценции. Данные за пределами дискриминационного окна R2, представленные на первой панели, указывают на отсутствие флуоресценции перед трансдукцией. На второй панели продемонстрирован сдвиг флуоресценции до >95% после трансдукции.
На фиг.4 проиллюстрирована митотическая активность и эффективность трансдукции в пигментных эпителиальных клетках сетчатки человека. Пигментные эпителиальные клетки сетчатки были трансдуцированы лентивирусными векторами или векторами на основе вируса мышиного лейкоза (MLV). Во время экспонирования вектором клетки были митотически неактивными (конфлюентными) или митотически активными (растущими). Эти результаты, показанные на фиг.4, продемонстрировали очень высокую способность лентивирусных векторов трансдуцировать неделящиеся клетки, в отличие от других ретровирусных векторов.
На фиг.5 проиллюстрирована стабильность экспрессии в пигментных эпителиальных клетках сетчатки человека. Клетки экспонировали eGFP-содержащими лентивирусными векторами, а затем их выдерживали, по крайней мере, в течение 120 дней в непрерывной культуре. На фиг.5А проиллюстрирована стабильность экспрессии eGFP в этих клетках, а также отсутствие отбора на (или против) трансдуцированные лентивирусом клетки (фракция трансдуцированных клеток все время оставалась постоянной). На фиг.5 В представлены результаты Саузерн-анализа на 5 клональных популяциях клеток. Дорожка 1 содержит геномную ДНК от нетрансдуцированной родительской линии. Дорожки 2 и 3 содержат ДНК, происходящей из клеток, которые были экспонированы вектором, но не были окрашены зеленым цветом (нетрансдуцированные). Дорожки 4 и 5 содержат ДНК, происходящей из трансдуцированных зеленых клеток. Клетки оставались eGFP-позитивными в результате геномной интеграции.
На фиг.6 проиллюстрирована экспрессия трансгена фетальных клеток человека. На этой диаграмме проиллюстрирован высокоэффективный метод трансдукции фетальных человеческих клеток, осуществляемый с использованием лентивирусных векторов, по сравнению с использованием нелентивирусного ретровирусного вектора (MND-eGFP) или без использования вирусного вектора (контроль).
На фиг.7 продемонстрирована трансдукция клеток роговицы. На фиг.7А схематически изображена роговица человека. На фиг.7 В продемонстрирована трансдукция эндотелиальных клеток роговицы человека eGFP-содержащими лентивирусными векторами. Шишкоподобные образования на человеческой роговице, удаленные во время трансплантации роговицы, экспонировали лентивирусными частицами. Затем Десцеметову оболочку удаляли и фотографировали при комнатном освещении (слева) и в условиях, подходящих для детекции флуоресценции (справа). На фиг.7С продемонстрирован опосредованный лентивирусом перенос гена eGFP в эпителиальные клетки человеческой роговицы. На субпанели А представлена сделанная на оптическом микроскопе фотография роговицы человека, из которой был искусственно удален эпителиальный слой. Флуоресцентная микроскопия (субпанель В) выявила эпителиальную флуоресценцию.
На фиг.8 приведен пример переноса лентивирусного гена, дефицит которого приводит к развитию заболевания у человека. Нормальная ткань человеческой сетчатки или пигментная эпителиальная ткань сетчатки (RPE), хирургически удаленная во время энуклеации ретинобластомы, обрабатывали лентивирусными векторами, у которых либо отсутствовал терапевтический ген (контроль), либо присутствовал ген периферина человека. Известно, что наследственный дефицит этого гена у человека приводит к различным видам нарушения фенотипов. Представлены результаты полимеразной цепной реакции, проводимой с помощью обратной транскриптазы (ОТ-ПЦР) и с использованием праймеров, сконструированных для распознавания лишь трансдуцированного гена периферина. Была ясно продемонстрирована экспрессия человеческого периферина в эпителии сетчатки и в пигментном эпителии сетчатки.
На фиг.9 продемонстрирована опосредованная лентивирусом экспрессия мРНК СА-rb. На этой фигуре представлены результаты полимеразной цепной реакции с обратной транскриптазой (ОТ-ПЦР), проводимой с использованием праймеров, сконструированных для распознавания лишь конститутивно активной формы гена ретинобластомы. Дорожка 1: маркер; дорожка 2: результат реакции с РНК, выделенной из клеток, трансдуцированных eGFP-лентивирусом; дорожка 3: результат реакции с РНК, выделенной из клеток, трансдуцированных СА-rb-лентивирусом. Продукт реакции имел ожидаемый размер.
На фиг.10 проиллюстрировано ингибирующее действие лентивирусного вектора, содержащего конститутивно активный ген ретинобластомы, на деление ретинальных и хороидальных клеток человека. Клетки обрабатывали уменьшающимися разведениями исходного раствора одного лентивируса (разведение 1:400-1:50), и рост этих клеток сравнивали с ростом клеток, обработанных лентивирусными векторами, которые не содержали конститутивно активного гена ретинобластомы. Ингибирующее действие на деление клеток явно прослеживалось в течение всего времени наблюдения, и это действие было дозозависимым.
На фиг.11 проиллюстрировано ингибирующее действие лентивирусного СА-rb на деление эпителиальных клеток хрусталика человека. Клетки, удаленные из человеческого глаза при операции по поводу катаракты, обрабатывали уменьшающимися разведениями исходного раствора одного лентивируса (разведение 1:400 - 1:50), и рост этих клеток сравнивали с ростом клеток, обработанных лентивирусными векторами, которые не содержали конститутивно активного гена ретинобластомы. Ингибирующее действие на деление клеток явно прослеживалось в течение всего времени наблюдения, и это действие было дозозависимым.
На фиг.12 проиллюстрировано ингибирующее действие in vivo лентивирусного СА-rb на внутриглазную пролиферацию клеток, приводящую к слепоте. Пролиферативная витреоретинопатия была индуцирована у трех групп кроликов. Одну группу не обрабатывали, одну группу обрабатывали лентивирусными векторами, не содержащими конститутивно активного гена ретинобластомы, а последнюю группу интравитреально обрабатывали лентивирусным СА-rb. В первых двух группах наблюдалась высокая частота (>90%) развития пролиферативной витреоретинопатии и отслоения сетчатки. В группе, обработанной конститутивно активным геном ретинобластомы, число животных, у которых наблюдалось отслоение сетчатки, было значительно меньше (26%). На этой фигуре также представлены две фотографии сетчатки. Глаз слева имел целую сетчатку без каких-либо признаков отслоения и был обработан конститутивно активным геном ретинобластомы. Глаз справа имел полностью отслоенную сетчатку, что явилось следствием внутриглазной витреоретинопатической пролиферации клеток, и этот глаз был обработан лентивирусными векторами, не содержащими гена СА-rb.
На фиг.13 проиллюстрировано in vivo ингибирующее действие лентивирусного СА-rb на процесс помутнения задней капсулы после удаления хрусталика. Три группы кроликов подвергали стандартной факоэмульсификации для удаления природного хрусталика. Первую группу (группу 1) ничем не обрабатывали, две других группы обрабатывали либо "пустыми" лентивирусными конструкциями (не содержащими терапевтического гена, группа 2), либо лентивирусными СА-rb (группа 3), вводимыми в капсулярную сумку интактного хрусталика во время закрытия раны после экстракции катаракты. Животных постадийно оценивали на присутствие помутнения задней капсулы. Наличие помутнения оценивали по 5 балльной шкале, где оценка 1 означает отсутствие помутнения, а оценка 5 означает помутнение, которое является достаточно серьезным и не позволяет визуализировать сетчатку путем непрямой бинокулярной офтальмоскопии. Эти результаты статистически не отличались от результатов, полученных для групп 1 и 2 (необработанной группы и группы, обработанной "пустым" вектором). Представленный здесь график иллюстрирует сильное ингибирующее действие лентивирусного СА-rb на развитие помутнения задней капсулы. На день 28 у контрольных животных наблюдалось помутнение, оцененное в среднем 4,4, тогда как у животных, обработанных лентивирусным СА-rb, наблюдалось помутнение, оцененное в среднем 2,1.
На фиг.14 представлена карта гибридного гена эндостатина-18/ангиостатина, доставляемого лентивирусным вектором.
На фиг.15 представлена карта лентивирусного вектора pHR-CMV-Endo/Ang-ires-eGFP, несущего гибридный ген эндостатина/ан-гиостатина.
На фиг.16 представлена карта лентивирусного вектора pHR-CMV-BIK-ires-eGFP, несущего ген BIK.
На фиг.17 представлена карта лентивирусного вектора pHR-CMV-Endo/Kringle-ires-eGFP, несущего гибридный ген эндостатина/крингла.
На фиг.18 представлена карта лентивирусного вектора pHR-CMV-KDR-ires-eGFP, несущего ген KDR.
На фиг.19 представлена карта лентивирусного вектора pHR-CMV-Р16-ires-eGFP, несущего ген Р16.
На фиг.20 представлена карта лентивирусного вектора pHR-CMV-Р21-ires-eGFP, несущего ген р21.
На фиг.21 представлена карта лентивирусного вектора pHR-CMV-Timp1-ires-eGFP, несущего ген Timp1.
На фиг.22 представлена карта лентивирусного вектора pHR-EF1/HTLV-Ang-ires-eGFP, несущего ген ангиостатина.
На фиг.23 представлена карта лентивирусного вектора pHR-EF1/HTLV-Endo XV-ires-eGFP, несущего ген эндостатина XV.
На фиг.24 представлена карта лентивирусного вектора pHR-EF1/HTLV-EndoAng-ires-eGFP, несущего гибридный ген эндостатина/ангиостатина.
На фиг.25 представлена карта лентивирусного вектора pHR-EF1/HTLV-EndoKringle-ires-eGFP, несущего гибридный ген эндостатина/крингла.
На фиг.26 представлена карта лентивирусного вектора pHR-EF1/HTLV-Kringle 1-5-ires-eGFP, несущего ген крингла.
На фиг.27 представлена карта лентивирусного вектора pHR-EF1/HTLV-MigIP10-ires-eGFP, несущего гибридный ген Mig/IP10.
На фиг.28 представлена карта лентивирусного вектора pHR-EF1/HTLV-Timp1-ires-eGFP, несущего ген Timp1.
На фиг.29 представлена карта лентивирусного вектора pHR-EF1/HTLV-Timp4-ires-eGFP, несущего ген Timp4.
На фиг.30 представлена карта лентивирусного вектора pHR-EF1/HTLV-Р21-ires-eGFP, несущего ген р21.
На фиг.31 представлена карта лентивирусного вектора pHR-EF1/HTLV-Endo XVIII-ires-eGFP, несущего ген эндостатина XVIII.
На фиг.32 проиллюстрирована ОТ-ПЦР мРНК, выделенной из микрососудистого русла эндотелиальных клеток кожи человека (hDMVE), трансдуцированных гибридным геном эндостатина-18/ангиостатина. Дорожка 1: смесь леддеров 1000/100 п.н.; дорожки 2-5: ОТ-ПЦР мРНК, выделенной из клеток hDMVE, трансдуцированных 1 мкл, 5 мкл, 10 мкл и 20 мкл супернатанта вируса pHR'-eF1?/HTLV-Endo::Ang-IRES-eGFP из одной лунки 12-луночного планшета; дорожка 6: ОТ-ПЦР мРНК, выделенной из клеток hDMVE, инкубированных с 20 ?л PBS; дорожка 7: негативный контроль (H2O в качестве матрицы для ОТ-ПЦР); дорожка 8: 100 п.н.-лэддер.
На фиг.33 показано присутствие eGFP в микрокармане роговицы у обработанных животных. На фиг.33А представлена микрофотография, полученная на люминесцентном микроскопе и демонстрирующая наличие экспрессии eGFP в микрокармане. На фиг.33 В представлена полученная на нелюминисцентном микроскопе микрофотография аналогично обработанной ткани, взятой от необработанного животного. На фиг.33С представлена микрофотография, полученная на люминисцентном микроскопе, аналогичной ткани, взятой из необработанного животного.
На фиг.34 проиллюстрировано ингибирующее действие на неоваскуляризацию у животных, обработанных лентивирусным вектором Mig/IP10. На фиг.34А представлена фотография нормальной (необработанной, нестимулированной) роговицы. На фиг.34 В представлена фотография обработанной щелочью роговицы животного, которому был введен лентивирусный вектор Mig/IP10. Отмечалось отсутствие кровеносных сосудов в роговице. На фиг.34С представлена фотография обработанной щелочью роговицы животного, которому был введен контрольный лентивирусный вектор без терапевтического антиангиогенного гена. Отмечалось прорастание кровеносных сосудов в роговицу. На фиг.34D представлена фотография обработанной щелочью роговицы необработанного животного. Отмечалось прорастание кровеносных сосудов в роговицу.
Подробное описание изобретения
Лентивирусы представляют собой медленные вирусы, природная патогенность которых сохраняется в течение периода времени от нескольких месяцев до нескольких лет. К вирусам этого рода относятся такие ретровирусы, как ВИЧ. Известно, что эти вирусы инфицируют и трансдуцируют широкий ряд терминально дифференцированных митотически активных или неактивных типов человеческих клеток. Эффективность их трансдукции является очень высокой, и этим вектором могут быть трансдуцированы даже клеточные линии, которые обычно невосприимчивы к переносу генов, например, такие как человеческие клетки сетчатки, клетки роговицы, трабекулярные клетки, лентикулярные клетки, пигментные эпителиальные клетки роговицы, пролиферативные витреоретинопатические клетки и васкулярные эндотелиальные клетки.
После инфицирования лентивирусом вирусный генетический материал сам интегрируется в геном хозяина. Таким образом, вирусные гены становятся перманентной частью генетического материала клетки-хозяина, а экспрессия гена является постоянной на протяжении всего жизненного цикла клетки. Каждая клетка, трансдуцированная лентивирусом, может передавать генетическую информацию потомству. Использование лентивирусов в качестве векторов в генотерапии для лечения внутриглазных болезней возможно только после создания естественных условий инфицирования родительским вирусом, который является внутриглазным патогеном, не ассоциирующимся с воспалительным ответом. Предшествующая работа с этим вирусом продемонстрировала его успешное использование для трансдукции в нервные клетки и в клетки сетчатки (Naldini et al., 1996; Miyoshi et al.,1997).
Настоящее изобретение относится к новому лентивирусному вектору, который включает элемент IRES (внутренний сайт связывания с рибосомой), расположенный между двумя сайтами клонирования. Элемент IRES обеспечивает связывание мРНК с рибосомой и синтез белка. Этот остов может вмещать два различных экспрессируемых гена. В трансдуцированных клетках продуцируется одна матричная РНК, однако благодаря элементу IRES эта матричная РНК является функционально бицистронной и может управлять синтезом двух различных белков. Эти два гена помещают под контроль сильных промоторов, таких как промоторы CMV или HTLV. Альтернативно любой специалист может с таким же успехом использовать и другие промоторы, о которых известно, что они являются активными в клетках человеческой сетчатки, роговицы или пигментных эпителиальных клеток сетчатки. Таким образом, каждый из потенциально терапевтических генов, обсуждаемых ниже, может быть сцеплен с маркерным геном (например, с геном, усиленным флуоресцентным зеленым-геном eGFP), так чтобы трансдуцированные клетки могли быть одновременно меченными и обладали способностью экспрессировать нужный терапевтический ген. Меченые клетки могут быть легко выделены in vitro и исследованы in vivo. Для специалиста очевидно, что, помимо гена белка, усиленного флуоресцентным зеленым, в лентивирусный вектор могут быть введены и другие маркерные гены. Поскольку за последние годы средний уровень знаний специалистов в области генной инженерии и клонирования значительно возрос, то любой специалист в данной области сможет легко сконструировать лентивирусные векторы, содержащие, помимо описанных здесь генов, и другие нужные терапевтические гены. Кроме того, используемая здесь система лентивирусных векторов может обеспечивать перенос генов, о которых известно, что они являются дефицитными у пациентов-людей с наследственными глазными болезнями или другими заболеваниями. Перенос этих генов в клетки человеческого глаза или в другие ткани с помощью указанной системы лежит в основе терапевтического лечения пациентов с различными заболеваниями.
Основное описанное здесь открытие продемонстрировало, что лентивирусные векторы могут быть использованы в целях переноса ряда генов для модифицирования аномальной внутриглазной пролиферации, тем самым снижая частоты неоваскулярных заболеваний, отслоения сетчатки или помутнения задней капсулы после удаления катаракты. В клинике для in vivo ингибирования внутриглазного деления клеток может быть использован ряд терапевтических генов. Эти гены включают ряд недавно идентифицированных модуляторов процесса развития новых кровеносных сосудов (ангиогенеза) или апоптоза. Очевидно, что генетическая регуляция экспрессии этих модуляторов посредством опосредуемого лентивирусом переноса генов должна подтверждать их ценность для лечения ассоциированных с неоваскуляризацией глазных заболеваний, таких как связанная со старением дегенерация желтого пятна (СДП), ретинопатия недоношенных (РНД) и пролиферативная диабетическая ретинопатития (ПДР).
Описанные здесь лентивирусные векторы могут быть легко использованы в клинических условиях.
Васкулярные эндотелиальные клетки играют главную роль как в образовании и развитии сосудов, так и в ангиогенезе. Эти клетки обнаруживают митогенный ответ (становятся активными с точки зрения деления или миграции клеток) на ряд белковых цитокинов. Так, например, васкулярный эндотелиальный фактор роста (VEGF), ангиогенин, ангиопоэтин-1 (Ang1) и ангиотропин представляют собой цитокины, стимулирующие деление и миграцию эндотелиальных клеток или межклеточную адгезию, и таким образом, оказывают благоприятное действие на процесс ангиогенеза. Эндостатин, растворимые рецепторы (ловушки) VEGF (sflt), и тромбоспондин представляют собой эндогенные белковые цитокины, которые ингибируют ангиогенез. В настоящем изобретении продемонстрировано, что многие из этих ингибирующих белков, доставляемых лентивирусными векторами, могут быть использованы для лечения внутриглазной неоваскуляризации. Примерами генов, которые могут быть включены в лентивирусные векторы настоящего изобретения, являются, но не ограничиваются ими, следующие гены.
Тканевые ингибиторы металлопротеиназ
Тканевые ингибиторы металлопротеиназ (TIMP) представляют собой семейство широко распространенных белков, которые являются природными ингибиторами металлопротеиназ матрикса (ММР). Металлопротеиназы матрикса представляют собой группу цинк-связывающих эндопептидаз, участвующих в ремоделировании соединительной ткани матрикса и деградации внеклеточного матрикса (ЕСМ), в главной стадии прорастание опухоли, ангиогенеза и метастазов. Каждая из ММР имеет различные специфичности к субстрату в ЕСМ и играет важную роль в его деградации. Анализ ММР при патологии молочной железы человека показал, что в деградации ЕСМ участвуют несколько ММР, а именно в деградации фибриллярных интерстициальных коллагенов участвует коллагеназа (ММР1); в деградации коллагена типа IV участвует главным образом желатиназа (ММР2); а стромелизин (ММР3) имеет широкий спектр действия (Bramhall et al., 1996, 1997). Семейство TIMP включает четыре члена. TIMP-1 и TIMP-2 способны ингибировать рост опухоли, ее прорастание и метастазы, ассоциированные с ММР-ингибирующей активностью. Кроме того, как TIMP-1, так и TIMP-2 участвуют в ингибировании ангиогенеза. В отличие от других членов семейства TIMP, TIMP-3 был обнаружен только в ЕСМ, а поэтому он может служить маркером для терминальной дифференцировки. И, наконец, предполагается, что TIMP-4 участвует в тканеспецифическом гемостазе внеклеточного матрикса (Gomez et al., 1997).
TIMP-1
Тканевый ингибитор металлопротеиназы-1 (TIMP-1) представляет собой 23 кД-белок, также известный как ингибитор металлопротеиназы-1, ингибитор коллагеназы фибробластов, ингибитор коллагеназы и эритроид-потенциирующей активности (ЕРА). Ген, кодирующий TIMP-1, был описан Docherty et al. (1985). Комплексы TIMP-1 с металлопротеиназами (такими как коллагеназы) вызывают необратимую инактивацию. Эффекты TIMP-1 были исследованы на моделях трансгенных мышей: одной модели со сверхэкспрессией TIMP-1 в печени и другой модели с экспрессией онкогена обезьяньего вируса 40, антигена Т (Tag), приводящего к развитию наследственной гепатоцеллюлярной карциномы. В экспериментах с использованием двух трансгенов (TIMP-1-линия была скрещена с трансгенной TAg-линией), было обнаружено, что сверхэкспрессия TIMP-1 в печени блокирует развитие TAg-индуцированной гепатокарциномы, например, путем ингибирования ее роста и ангиогенеза (Martin et al., 1996).
TIMP-2
Тканевый ингибитор металлопротеиназы-2 (TIMP-2) представляет собой 24 кД-белок, который также известен как ингибитор металлопротеиназы 2. Ген, кодирующей TIMP-2, был описан Stetler-Stevenson et al. (1990). Металлопротеиназа (ММР2), которая играет важную роль в прорастании опухоли, является комплексной и ингибируется TIMP-2. Таким образом, TIMP-2 может быть использован для ингибирования метастазов рака (Musso et al., 1997). При трансфекции клеток мышиной меланомы В16F10 (в высокой степени инвазивной и метастазирующей клеточной линии) плазмидой, кодирующей человеческий TIMP-2 и ее подкожной инъекции мышам, сверхэкспрессия TIMP-2 ограничивала рост опухоли и неоангиогенез in vivo (Valente et al., 1998).
TIMP-3
Тканевый ингибитор металлопротеиназы-3 (TIMP-3) также известен как ингибитор металлопротеиназы 3. При трансфекции клеточных линий карциномы молочной железы и злокачественной мышиной меланомы TIMP-3-содержащими плазмидами и ее подкожной инъекции бестимусным ("голым") мышам наблюдалось ингибирование роста опухоли (Anand-Apte et al., 1996). Однако сверхэкспрессия TIMP-3 не оказывала какого-либо воздействия на рост клеток этих двух клеточных линий in vitro. Таким образом, это позволяет предположить, что TIMP-3, высвобождаемый опухолевыми клетками в окружающий ЕМС ингибирует рост опухоли путем подавления высвобождения отдельных факторов роста в ЕСМ или путем ингибирования ангиогенеза (Anand-Apte et al., 1996).
TIMP-4
Тканевый ингибитор металлопротеиназы-4 (TIMP-4) также известен как ингибитор металлопротеиназы 4. Ген TIMP-4 и его локализация в тканях были описаны Greene et al. (1996). Биохимические исследования показали, что TIMP-4 связывается с человеческой желатиназой А аналогично TIMP-2 (Bigg et al., 1997). Влияние модуляции TIMP-4 на рост клеток рака молочной железы человека in vivo было исследовано Wang et al. (1997). Было обнаружено, что сверхэкспрессия TIMP-4 ингибирует возможность прорастания клеток in vitro, а после инъекции "голым" мышам с TIMP-4-трансфектантов опухолевых клеток in vivo рост опухоли значительно снижался (Wang et al., 1997).
Эндостатин, ангиостатин, РЕХ, крингл-5 и гибридные гены
J. Folkman и его коллеги (Boehm et al., 1997) показали, что введение мышам клеток карциномы легких Льюиса в комбинации с белками эндостатина + ангиостатина индуцировало полную регрессию опухолей, и эти мыши в течение всей своей жизни оставались здоровыми. Этот эффект был достигнут после проведения лишь одного цикла (25 дней) обработки комбинацией эндостатин + ангиостатин, тогда как при использовании только эндостатина для индуцирования торможения опухолевого роста потребовалось 6 циклов его введения.
D. Hanahan и его коллеги (Bergers et al., 1999) продемонстрировали превосходное противоопухолевое действие комбинации белков "эндостатин + ангиостатин" в мышиной модели карциномы панкреатических островков. Комбинация "эндостатин + ангиостатин" давала значительную регрессию опухолей, тогда как введение только эндостатина или только ангиостатина не давало никакого эффекта.
Эндостатин XVIII
Эндостатин, ингибитор ангиогенеза, продуцируемый гемангиоэндотелиомой, был впервые идентифицирован O'Reilly et al. (1997). Эндостатин представляет собой С-концевой 20 кД-фрагмент коллагена XVIII, который специфически ингибирует эндотелиальную пролиферацию и является сильным ингибитором ангиогенеза и роста опухоли. Действительно, было показано что, первичные опухоли, после введения рекомбинантного эндостатина, регрессировали в "пассивные" микроскопические поражения (O'Reilly et al., 1997). Сообщалось, что эндостатин ингибирует ангиогенез посредством его связывания с протеогликанами сульфата гепарина, участвующими в передаче сигналов фактора роста (Zetter, 1998).
Эндостатин XV
Недавно было показано, что С-концевой фрагмент коллагена XV (эндостатин XV) ингибирует ангиогенез подобно эндостатину XVIII, но с некоторыми функциональными различиями (Sasaki et al., 2000).
Ангиостатин
Ангиостатин, внутренний фрагмент плазминогена, содержащего первые четыре крингл-структуры, является одним из самых сильных эндогенных ингибиторов ангиогенеза, известных в настоящее время. Было показано, что системное введение ангиостатина эффективно подавляет рост злокачественной глиомы in vivo (Kirsch et al., 1998). Введение ангиостатина также комбинировали с лучевой терапией, что приводило к полному исчезновению опухоли и при этом не оказывало какого-либо токсического действия in vivo (Mauceri et al., 1998). Другие исследования продемонстрировали, что опосредованный ретровирусами и аденовирусами перенос кДНК гена ангиостатина приводил к ингибированию роста эндотелиальных клеток in vitro и ангиогенеза in vivo. Ингибирование индуцированного опухолью ангиогенеза приводило к усилению гибели опухолевых клеток (Tanaka et al., 1998). Было показано, что перенос кДНК гена, кодирующего мышиный ангиостатин, в мышиные клетки фибросаркомы Т241 подавлял рост первичной опухоли и опухолевых метастазов in vivo (Cao et al., 1998).
РЕХ
РЕХ представляет собой С-концевой домен гемопексина ММР-2, который ингибирует связывание ММР-2 с интегрином альфабета-3, блокирующим коллагенолитическую активность клеточной поверхности, необходимую для ангиогенеза и роста опухоли, и который был клонирован и описан Brooks et al. (1998).
Крингл-5
Было показано, что крингл-домен 5 человеческого плазминогена, который имеет высокую степень гомологии с четырьмя крингл-