Новые производные норборнана и норборнена, их применение и содержащие их ароматные продукты
Иллюстрации
Показать всеИзобретение относится к новым соединениям формулы (I).
где пунктиром отмеченная связь присутствует или отсутствует и где R1 означает: - когда пунктиром отмеченная связь присутствует: -СНСН3ОН или -СНСН3OCOR или -СНСН3ХСН2CHOHR' или -СНСН3OCHR'СН2ОН или
- когда пунктиром отмеченная связь отсутствует:
-СНСН3ОН, -СНСН3OCOR, -СОСН3, -СНСН3XCH2CHOHR',
-CH2CH2XCH2CHOHR', -СНСН3OCHR'СН2OH, -CHCHCOR', CH2CH2CHR'OH, -CH2CH2CHR'OCOR, -CHCHCHOHR' или -CHCHCHR'OCOR, где R означает Н, Me, Et, Pr, изоPr, But, изоBut, СН3(СН2)4, (СН3)2СНСН2, СН2=СН или (СН3)2С=СН, R' означает Н, Me или Et и Х означает О, N или S. Благодаря их запаху указанные соединения представляют большой интерес для парфюмерной промышленности, косметики и продуктов для ухода и могут использоваться в качестве ароматизирующих ингредиентов для получения ароматизирующей композиции или ароматизированного изделия. 5 н. и 6 з.п. ф-лы.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к новым производным норборнана или норборнена, которые имеют специфический аромат, а именно древесный или янтарный аромат, и к их применению в ароматной парфюмерной промышленности.
Уровень техники
Термин "ароматная промышленность" используется здесь для обозначения не только парфюмерии в строгом смысле слова, но также для других областей, в которых важны ароматы продуктов, особенно в косметике, чистящих средствах, освежителях воздуха и т.п.
Длительный период времени был посвящен синтезу новых соединений с определенным (востребованным) ароматом, для их применения в ароматной промышленности. Основополагающими часто выступали природные продукты, на которых были сделаны попытки выделения молекулы (молекул) с ароматными свойствами.
В частности, аромат масла сандалового дерева являлся предметом большинства исследований. Идентифицировав две главные молекулы, которые придают природному маслу сандалового дерева его аромат, а именно α-санталол и β-санталол, были сделаны попытки для обнаружения других молекул, которые могли бы иметь этот аромат. Были также сделаны попытки синтезировать молекулы, которые могут воспроизводить этот аромат. История этого исследования представлена в статье "The Chemistry of Sandalwood Fragrance - a Review of the Last Ten Years" E.-J. Brunke и другие, 15th Journees Int. Huiles Essentielles, Dignes-les-Bains, France, 5-7 September 1996.
Патент US 4229600 раскрывает специфические производные норборнана и норборнена, которые имеют аромат масла сандалового дерева.
При поиске новых молекул исследователи отталкивались, конечно, от структур известных молекул, но опыт показал, что результат бывал часто случайным. Ссылка может быть сделана, например, на статью, упомянутую выше, в которой описана модель зависимости аромата от структуры, непосредственно следующей за противопоставленным примером, молекула, синтезируемая в соответствии с этой моделью, но которая не имеет ожидаемого аромата. Эта же статья приводит некоторое количество молекул подобной структуры, но чьи обонятельные свойства являются различными, некоторые из них имеют аромат, а другие не имеют.
Таким образом, не существует никакого систематического метода конструирования молекулы как функции от желаемого аромата, из известных молекул, посредством выполнения логических и воспроизводимых стадий.
Раскрытие изобретения
После широких исследований было обнаружено новое семейство ароматных молекул.
Это семейство представлено следующей формулой:
в которой пунктирная связь присутствует или отсутствует и в которой R1 представляет:
- когда пунктиром обозначенная связь присутствует:
-СНСН3ОН, или -СНСН3OCOR, или -СНСН3XCH2CHOHR', или
-СНСН3OCHR'СН2OH, или
- когда пунктиром обозначенная связь отсутствует:
-СНСН3ОН, или -СНСН3OCOR, или -СОСН3, или
или -СНСН3ХСН2CHOHR', или -CH2CH2XCH2CHOHR', или -СНСН3OCHR'CH2ОН, или -CHCHCOR', или -CH2CH2CHR'OH, или -CH2CH2CHR'OCOR, или -CHCHCHOHR', или -CHCHCHR'OCOR,
в которой R представляет собой Н, Me, Et, Pr, изоPr, But, изоBut, СН3(СН2)4, (СН3)2СНСН2, СН2СН или (СН3)2ССН,
R' представляет собой Н, Me или Et и Х представляет собой О, N или S.
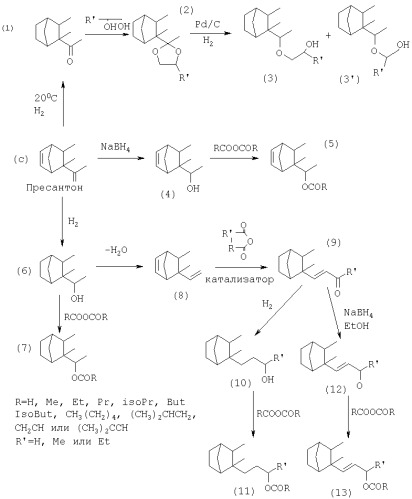
Каждое из соединений этого семейства может быть синтезировано непосредственно или косвенно из соединения (с), указанного ниже:
Это соединение 1-(2,3-диметилбицикло[2,2,1]гепт-5-ен)-этанон, которое уже было описано в литературе и которое обозначается в настоящей заявке как пресантон, может быть получено, например, конденсацией 3-метил-3-пентен-2-она (а) и циклопентадиена (b) по реакции Дильса-Альдера в водной фазе, катализируемой метилренийтриоксидом.
Само собой разумеется, могут использоваться другие реакции для получения пресантона, например, с другими катализаторами или специфическим растворителем.
3-Метил-3-пентен-2-он (а) легко получают, например, конденсацией ацетальдегида или паральдегида с метилэтилкетоном. Этот продукт является недорогим и коммерчески доступным.
Циклопентадиен (b) может быть получен, например, некоторыми известными методами для деполимеризации дициклопентадиена, который получают в нефтяной промышленности.
Пресантон может являться исходным материалом или промежуточным веществом в синтезе соединений в соответствии с изобретением. С помощью неограничивающих примеров ниже представлена схема реакции для получения новых соединений в соответствии с изобретением.
Сокращения Me, Et, Pr, изоPr, But и изоBut имеют обычные значения, известные специалисту в данной области техники, а именно метил, этил, пропил, изопропил, бутил и изобутил соответственно.
Гидрогенизирование пресантона (с) при низкой температуре (между 20 и 50°С) в присутствии никеля Ренея, палладия-на-угле или других подходящих катализаторов приводит к получению насыщенного кетона (1). Этот кетон имеет сильный смолистый древесный запах, оригинальность которого оценена в ароматных композициях.
В соответствии с изобретением ацеталь (2) кетона (1), например, с пропиленгликолем, полученный стандартными способами ацетилирования, гидрогенизуют в присутствии, например, чистого палладия-на-угле или смешанного палладия-на-угле с раскрытием ацеталя на эфиры спиртов (3) и (3'), которые разделяют хроматографически. Реакцию проводят с растворителем или без него. Способ предпочтительно осуществляют под воздействием от 30 до 120 кг водорода при температурах между 120 и 180°С. Полученные эфиры спиртов (3) и (3') имеют сильный древесный длительный аромат, благодаря чему они вызывают большой интерес в ароматной промышленности, косметике, для производства мыла, чистящих средств, моющих средств и других ароматных продуктов. Ацеталь (2) сам по себе также является новым соединением, которое представляет интерес благодаря его аромату.
Восстановление пресантона (с) боргидридом натрия приводит к получению ненасыщенного спирта (4), нового продукта, что также является выгодным.
Стандартные способы этерификации, например, используя ангидриды кислот, позволяют получать эфиры (5), в том числе формильные, ацетильные, пропионильные, бутирильные, изобутирильные и т.д. эфиры, в особенности из спирта (4). Эти эфиры все являются новыми соединениями, которые могут использоваться в ароматной промышленности благодаря оригинальности их древесных запахов.
Гидрогенизация пресантона (с) в присутствии никеля Ренея, например, при температурах между 100 и 180°С под воздействием от 20 до 100 кг водорода приводит к получению насыщенного спирта (6), который также является выгодным соединением.
Этерификация этого насыщенного спирта (6) ангидридами кислот, например, приводит к получению насыщенных эфиров (7), в которых R представляет собой водород, метил, этил, пропил, изопропил, бутил, изобутил, СН3(СН2)4, (СН3)2СНСН2, CH2CH или (СН3)2ССН радикал. Все эти новые эфиры имеют ароматы, которые являются выгодными для ароматной промышленности благодаря их оригинальной фруктовой древесной природе.
Второй способ осуществляют исходя из насыщенного спирта (6). Посредством дегидратации указанного спирта известными методами получают этиленовый углеводород (8).
Ацилирование, например, уксусным или пропионовым ангидридом в присутствии треххлористого эфирата бора или хлорида цинка приводит к получению этиленовых кетонов (9). Может использоваться любой другой известный метод ацилирования.
Восстановление кетонов этилена (9) боргидридом натрия в спирте является простым методом получения спиртов этилена (12), которые являются также очень полезными новыми соединениями. Эфиры (13) спиртов (12), полученные стандартными способами, например, используя ангидриды кислот, обладают более умеренными, но длительно сохраняющимися древесными запахами, которые также хорошо подходят для ароматных составов.
Полная гидрогенизация кетонов этилена (9) стандартными методами приводит к получению насыщенных спиртов (10) и их этерификация любым обычным методом, например, используя ангидриды кислот, приводит к получению эфиров (11), в которых R представляет собой водород, метил, этил, пропил, изопропил, бутил, изобутил, СН3(СН2)4, (СН3)2СНСН2, СН2СН или (СН3)2ССН радикал. Эти соединения также обладают полезными древесными ароматами.
Также возможно получить соединения (14) и (14'), которые разделяют хроматографически путем раскрытия оксидного кольца этилена, пропилена или бутилена с получением этиленгликоля, пропиленгликоля или бутиленгликоля соответственно, алкоксидом соединения (4):
Может использоваться другой способ получения соединений (3) и (3') из соединения (6). Эти соединения могут быть получены из алкоксида соединения (6) раскрытием оксидного кольца этилена, пропилена или бутилена с получением соответствующего гликоля:
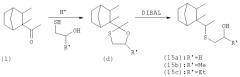
Изобретение также касается другого способа получения соединений (3) и (3'), характеризующегося тем, что исходный продукт или промежуточное соединение представляет собой новое соединение формулы
в котором R' является Н, Me или Et.
Ацеталь (2') может также являться исходным или промежуточным соединением в синтезе соединений формул (14) и (14').
Ацеталь (2') может быть получен, например, непосредственно по реакции Дильса-Альдера, катализируемой FeCI3 между циклопентадиеном и ацеталем (d).
Ацеталь (d) (в котором R'=СН3) может быть получен ацетилированием из метилпентенона (а) и пропиленгликоля.
В одном воплощении ацеталь (2') позволяет осуществить синтез соединений (3) и (3'), например, с помощью одностадийной гидрогенизации, катализируемой палладием-на-угле.
Ацеталь (2') также позволяет осуществить синтез соединений (14) и (14') с помощью гидрогенизации, например, гидридом.
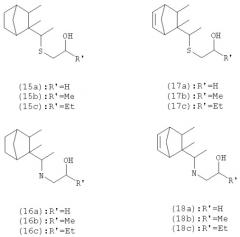
Изобретение также касается других новых соединений, подобных соединениям (3) и (14), в которых атом кислорода замещен на атом серы или азота. Такие соединения (15)-(18) представлены ниже:
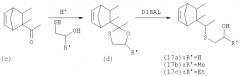
Соединения с серой (15) [(15а), (15b) и (15с)] могут быть получены из соединения (1) в соответствии со следующим способом:
Оксатиолан (d) может быть получен стандартным способом ацетилирования и ацеталь затем раскрывается региоспецифически описанными в литературе способами, например с помощью DIBAL в толуоле при кипячении с обратным холодильником.
Соединения с серой (17) [(17а), (17b) и (17с)] могут быть получены тем же способом, как описано выше, исходя из пресантона (с).
Соединения с атомом азота (16) [(16а), (16b) и (16с)] и соединения с атомом серы (15) [(15а), (15b) и (15с)] могут быть получены из спирта (6), например, мезилированием, тозилированием или галогенированием с последующим нуклеофильным замещением на соответствующий аминоспирт или тиол:
Аминоспирты (18) [(18а), (18b) и (18с)] и тиоэфиры (17) [(17а), (17b) и (17с)] могут быть получены тем же способом, как описано выше, исходя из спирта (4). Углеводород этилена (8) также позволяет осуществить синтез аналогов, содержащих гетероатом в боковой цепи:
Первичный спирт или тиол, полученный гидроборированием двойной связи или добавлением H2S, затем конденсируют с оксидом этилена, пропилена или бутилена с получением соединений (19) [от а до с] и (20) [от а до с]. Оксид пропилена может быть необязательно замещен соответствующим галогенацетоном с получением после восстановления NaBH4 ожидаемых спиртов (19b) и (20b).
Аминоаналоги (21) [от а до с] могут быть получены из первичного спирта, полученного в процессе гидрогенизации тозилированием (или мезилированием) с последующим замещением соответствующего аминоспирта:
Объектом изобретения являются соединения, представленные общей формулой (1) в виде смеси диастереоизомеров в различных пропорциях, в особенности рацемической смеси.
Кроме того, некоторые из диастереоизомеров или энантиомеров имеют запахи и являются столь же выгодными, как и соединения, полученные в форме диастереоизомерных смесей.
Объектом изобретения также являются чистые диастереоизомеры или энантиомеры новых соединений, представленных общей формулой (1), которые могут быть разделены препаративной газовой хроматографией. Они могут также синтезироваться из оптически чистых соединений, например R- или S-пропиленгликоля и спирта (6), полученного из энантиоселективного восстановления пресантона (1-4) и очищенного перегонкой.
Объектом изобретения также являются способы получения новых соединений.
Каждое новое соединение выгодно благодаря его аромату, в особенности его древесному аромату. Соединение (3) с R'-Me является особенно выгодным. Кроме того, изобретение имеет очевидное экономическое преимущество, являющееся результатом простоты используемых реакций и низкой цены используемых исходных продуктов.
Благодаря их качественным запахам эти различные соединения, таким образом, находят очень широкое применение в ароматной промышленности для получения ароматных основ и концентратов, духов и туалетных вод, а также для ароматизации различных потребительских товаров, таких как мыло, гели для душа или гели для ванны, шампуни, и других предметов гигиены волос, косметических составов, дезодорантов для тела, освежителей воздуха или, альтернативно, текстильных моющих средств или смягчителей и чистящих средств.
Для этих применений соединения согласно изобретению могут использоваться отдельно или, что является более обычным в ароматной промышленности, в виде смеси с другими ароматическими компонентами, растворителями или адъювантами, обычно используемыми в ароматной промышленности и которые специалист в данной области техники способен выбрать для желаемого эффекта и учитывая природу ароматизируемого продукта.
Концентрации, в которых эти соединения и их изомерные смеси могут использоваться для получения желаемых ароматных эффектов, изменяются в очень широких пределах (от 0,1 до 99%) и известно, что их величины зависят от природы ароматизируемого продукта, желаемого ароматного эффекта и природы других компонентов в данной композиции.
Таким образом, объектом изобретения также является применение новых соединений для получения ароматной композиции или ароматного продукта в областях, описанных выше, особенно в парфюмерии, в косметике, например, для шампуней или мыл и для чистящих средств, таких как смягчители или моющие средства.
Объектом изобретения также являются ароматические продукты, включающие, по крайней мере, одно соединение в соответствии с настоящим изобретением, либо в области парфюмерии, косметики или чистящих средств.
Следующие далее примеры иллюстрируют различные способы получения новых соединений в соответствии с изобретением, а также их применение и их преимущество. Эти примеры представлены только с целью иллюстрации и не могут рассматриваться как ограничивающие изобретение.
Осуществление изобретения
Пример 1: Реакция Дильса-Альдера (пресантон (с))
Сухой толуол (110 г) помещают в круглодонную колбу объемом 500 мл, находящуюся в атмосфере азота, оборудованную магнитной мешалкой, термометром и дополнительным горлышком. После охлаждения до температуры 0°С добавляют одной порцией 4 г хлорида алюминия, а затем дополнительно при температуре около 10°С, 88 г 94% 3-метил-3-пентен-2-она (а) в течение от 20 до 30 минут при мягком охлаждении. После чего добавляют раствор 66 г циклопентадиена (b) в 140 г сухого толуола при температуре между 12 и 14°С в течение от 1 часа 10 минут до 1 часа 20 минут при поддержании температуры охлаждения.
После разделения фаз при отстаивании органическую фазу промывают разбавленной соляной кислотой (100 мл) и 5% раствором карбоната. После концентрирования растворителя в вакууме продукт отгоняют в вакууме при давлении 2 мм (температура кипения: 56-70°С/2 мм). Получают 128 г дистиллята. Указанный продукт помещают в толуол и обрабатывают триэтиламином и раствором карбоната натрия. После промывания и упаривания растворителя в вакууме продукт перегоняют в вакууме при давлении 1 мм. Получают 112 г 1-(2,3-диметилбицикло[2,2,1]гепт-5-ен)этанона (температура кипения.: 56-60°С/1 мм), выход: 76%.
Смесь оставляют перемешиваться при температуре 14-15°С в течение еще 15 минут и затем ее охлаждают до температуры 0°С, а затем быстро добавляют раствор 20 г 32% соляной кислоты в 100 г воды быстро, давая температуре подняться. Газофазный хроматографический анализ показывает наличие двух основных изомеров (32 и 56%). Анализ инфракрасного и масс-спектров соответствует структурам ожидаемых соединений.
Пример 2: Насыщенный кетон (1)
Гидрогенизация 50 г этиленкетона (с) в присутствии 0,5 г никеля Ренея при комнатной температуре и при пониженном давлении водорода (от 1 до 10 кг) поглощает теоретическое количество водорода в течение около 2 часов.
После отделения катализатора продукт перегоняют в вакууме. Получают рассчитанное количество насыщенного кетона (1).
Продукт перегоняют при температуре 54-58°С в вакууме при давлении 1 мм.
Газофазный хроматографический анализ показывает два главных пика - и инфракрасный и масс, спектры соответствуют структурам ожидаемых соединений.
Пример 3: Этиленовый спирт (4)
Путем восстановления 40 г пресантона (с) в 200 мл 96% спирта, порционно добавляя 6 г боргидрида натрия при температуре 25°С в течение более 2 часов, а затем постепенно доведя температуру до 40°С в течение более 2 часов и поддерживая смесь при указанной температуре в течение еще 3 часов, получают полностью восстановленную кетонную группу в спирте.
После медленного подкисления 2% соляной кислотой, экстракции толуолом и промывания продукт концентрируют в вакууме и затем перегоняют. Получают 36 г этиленового спирта (4) с точкой кипения 72-75°С в вакууме при давлении 1 мм, то есть 90 мол.% выход.
Газофазный хроматографический анализ показывает наличие трех основных изомеров, которые имеют очень близкую массу и инфракрасный спектр.
Пример 4: Этиленовые эфиры (5)
С помощью медленного введения 10 г этиленового спирта (4) в 10 г уксусного ангидрида при температуре 115-120°С в течение более 2 часов получают этиленовый ацетат (5). Полученный продукт концентрируют в вакууме при давлении 30 мм, чтобы отогнать кислоту и избыток уксусного ангидрида с помощью 25 см колонки Вигре. Вакуум медленно снижают до значения 1 мм и отгоняют этиленовый ацетат (5). Получают 10 г этиленовой кислоты (5) с точкой кипения 73-76°С при давлении 1 мм в вакууме. Газофазный хроматографический анализ, ММ- и ИК-анализы соответствуют структурам ожидаемых соединений.
Пропионовый, масляный и изомасляный эфиры этиленового спирта (4) получают с помощью нагревания спирта (4) с соответствующими ангидридами в присутствии небольшого количества толуола, чтобы поддержать температуру кипения при значении около 125-130°С.
Продолжительность кипения повышают до 2 часов, чтобы завершить этерификацию. С помощью перегонки под вакуумом выделяют кислоты и эфиры ангидридов. С помощью повышения вакуума получают эфиры (5), пропионат этиленового спирта (5) с точкой кипения 80-83°С в вакууме при давлении 1 мм, бутират этиленового спирта (5) с точкой кипения 88-91°С в вакууме при давлении 1 мм, изобутират этиленового спирта (5) с точкой кипения 85-88°С в вакууме при давлении 1 мм.
Пример 5: Насыщенный спирт (6)
100 г этиленового кетона (с) помещают в автоклав, перемешивают и нагревают в присутствии 2 г никеля Ренея. После продувания три раза 10 кг водорода давление повышают, вводя 30 кг водорода, и автоклав нагревают до температуры 150-160°С при перемешивании.
Гидрогенизацию выполняют под давлением 60 кг водорода, пока давление не перестанет снижаться (от 5 до 6 часов).
Сырой насыщенный продукт (5) отгоняют в вакууме при давлении 1 мм в устройстве, оснащенном 20 см колонкой Вигре.
Получают 97 г спирта (5) с точкой кипения 72-75°С в вакууме при давлении 1 мм.
Газофазный хроматографический анализ показывает, что имеется 4 основных изомера, которые имеют очень близкую массу и инфракрасный спектр.
Пример 6: Насыщенные эфиры (7)
Насыщенные эфиры получают с помощью стандартного способа, использующегося для получения ненасыщенных эфиров (Пример 4), то есть нагревания насыщенного спирта (6) в присутствии соответствующего ангидрида кислоты.
Получают следующие соединения: ацетат насыщенного спирта (7) с точкой кипения 73-76°С в вакууме при давлении 1 мм, пропионат насыщенного спирта (7) с точкой кипения 80-83°С в вакууме при давлении 1 мм, бутират насыщенного спирта (7) с точкой кипения 88-91°С в вакууме при давлении 1 мм, изобутират насыщенного спирта (5) с точкой кипения 85-88°С в вакууме при давлении 1 мм.
Пример 7: Эфир спирта (3)
7.1. Ацеталь (2)
Ацеталь насыщенного кетона (1) и пропиленгликоля могут быть получены с помощью кипячения, используя 30 см колонку Вигре и ловушку для воды, пропиленгликоль (50 г), кетон (1) (80 г), растворенный в толуоле (40 г), и п-толуолсульфокислоту (0,4 г) в качестве кислотного катализатора. Воду удаляют азеотропно (кипячение в течение от 18 до 20 часов). Толуол и вода могут также быть удалены с помощью отгонки в вакууме.
Реакционную смесь промывают 5% раствором карбоната натрия, а затем водой до нейтрального значения рН.
Фракционирование в высоком вакууме в устройстве, оснащенном 50 см колонкой Вигре, позволяет получать следующие соединения: 25 г выделенного кетона (1) для рецикла с точкой кипения 54-58°С в вакууме при давлении 1 мм, 65 г ацеталя (2) с точкой кипения 64-58°С в вакууме при давлении 1 мм, 10 г промежуточных фракций для рецикла
7.2. Эфир спирта(3)
Помещают 50 г ацеталя (2), 100 г изопропанола и 0,5 г палладия-на-угле при перемешивании в автоклав.
После продувания водородом автоклав поддерживают при температуре между 160 и 170°С под давлением 50-60 кг водорода в течение от 18 до 24 часов.
Процесс реакции контролируют с помощью газофазного хроматографического анализа и реакцию останавливают, когда процентное содержание ацеталя (2) упадет до 5-6%.
После выделения катализатора продукт отгоняют в вакууме при давлении 1 мм в устройстве, оборудованном 50 см колонкой Вигре. Получают 6 г головных фракций с точкой кипения 40-50°С, 16 г кетона (1) + ацеталь (2) с точкой кипения 54-68°С в вакууме при давлении 1 мм для рецикла и 25 г эфира спирта (3) с точкой кипения 85-92°С в вакууме при давлении 1 мм. Масс- и инфракрасный спектры соответствуют структурам ожидаемых соединений.
Пример 8: Этиленовый кетон (9)
8.1. Дегидратация спирта (6)
В круглодонную колбу объемом 500 мл помещают 150 г спирта (6) и 100 г борной кислоты.
Смесь нагревают при давлении 40 мм вакуума, чтобы удалить воду процесса боронизации и после этого доводят температуру до 230-250°С для дегидратации. После отгонки от 70 до 80 г этиленового соединения (8) дегидратацию продолжают при постепенном введении спирта (6), постепенно по мере дегидратации.
Исходя из 1 кг спирта (6) получают 880 г этиленового соединения (8), содержащего 7-10% спирта (5).
С помощью фракционирования на 30 см колонке Вигре отделяют 800 г этиленового соединения (8) и 70 г спирта (6) для рецикла.
8.2. Этиленовый кетон (9)
В круглодонную колбу объемом 1 литр, оборудованную магнитной мешалкой, помещают 120 г этиленового соединения (8) и 120 г уксусного ангидрида и смесь нагревают до температуры 70-75°С. После чего вводят 16 мл эфирата треххлористого бора в течение более 15 минут при температуре 75-80°С. Температуру и процесс перемешивания сохраняют в течение 3 часов на уровне 80-82°С. После охлаждения до температуры около 60°С разлагают избыток уксусного ангидрида с помощью медленного добавления воды, начиная с 320 г, поддерживая температуру около 60-65°С.
Органическую фазу отделяют и водную фазу экстрагируют дважды 60 мл циклогексана. Объединенные органические фазы промывают 10% раствором карбоната натрия, а затем водой.
После концентрирования растворителя при слабом вакууме сырой продукт (138 г) фракционируют в устройстве с 30 см колонкой Вигре. В вакууме при давлении 5 мм выделяют 80 г исходного продукта (8), который надо повторно использовать, и 32 г этиленового кетона (9) с точкой кипения 75-88°С при давлении 1 мм в вакууме.
Пример 9: Этиленовый спирт (13)
В круглодонную колбу объемом 250 мл, оборудованную магнитной мешалкой и термометром, помещают 30 г этиленового кетона (9) и 75 г 96° этанола. При незначительном охлаждении, поддерживая температуру 20-25°С, добавляют порционно 3 г боргидрида натрия. После введения смесь перемешивают в течение 6 часов при комнатной температуре, а затем ее постепенно нагревают до температуры 40°С в течение от 2 до 3 часов, а затем выдерживают при температуре 40-45°С в течение 4 часов.
Значительную часть спирта концентрируют под небольшим вакуумом. К остатку добавляют 30 г воды, а затем медленно окисляют, пока температура поддерживается в пределах 20-25°С, с помощью 16 г концентрированной соляной кислоты, разбавленной 50 г воды. После чего добавляют 30 мл толуола с последующим разделением фаз при стоянии.
Органическую фазу отделяют и водные фазы экстрагируют дважды 20 мл толуола. После объединения органических фаз их промывают дважды 80 мл воды. Толуол после этого концентрируют в вакууме и остаток (30 г) перегоняют под высоким вакуумом в устройстве, оснащенном 15 см колонкой Вигре.
Таким образом получают 25 г этиленовой кислоты (12) с точкой кипения 85-92°С в вакууме при давлении 1 мм вместе с 3 г продукта для рецикла. Инфракрасный и масс-спектры соответствуют структурам ожидаемых соединений.
Пример 10: Этиленовый ацетат (13)
В круглодонную колбу объемом 100 мл, оборудованную магнитной мешалкой, термометром и 20 см колонкой Вигре, помещают 30 г этиленового спирта(12) и 25 г уксусного ангидрида.
Смесь нагревают под небольшим вакуумом так, чтобы значение температуры составляло 115-120°С в течение 2 часов. Вакуум затем повышают, чтобы выделить смесь уксусной кислоты/ангидрида. Конечное значение температуры составляет 125-130°С. Затем в вакууме при давлении 1 мм отгоняют ацетат (14) с точкой кипения 80-88°С в вакууме при давлении 1 мм. Получают 27 г ацетата (13) и 3 г продукта для рецикла. Инфракрасный и масс-спектры соответствуют структурам ожидаемых соединений.
Пример 11: Насыщенный спирт (10)
30 г этиленового кетона (9) и 0,6 г никеля Ренея помещают в перемешиваемый и нагреваемый автоклав. После продувания водородом температуру смеси доводят до 150-160°С под давлением 60 кг водорода.
Реакция завершается через 12 часов. Катализатор отделяют и продукт отгоняют под высоким вакуумом. Получают 27 г насыщенного спирта (11) с точкой кипения 82-90°С в вакууме при давлении 1 мм.
Пример 12: Насыщенный ацетат (12)
Процесс выполняют, как и для этиленового ацетата (13), исходя из 25 г насыщенного спирта (10), получают после перегонки 26 г ацетата (11) с точкой кипения 78-86°С при давлении в вакууме 1 мм.
Пример 13: Эфир спирта (3) через ацеталь (2')
В атмосфере азота 46,00 г дихлорметана помещают в приемную колбу перегонного аппарата, в который вмонтирована 30 см колонка Вигре, и колбу охлаждают до температуры 0°С. Масляную баню перегонного аппарата нагревают до температуры около 195°С для того, чтобы получить температуру 165°С внутри трехгорлой колбы. По каплям вводят 13,80 г (0,45 моль) дициклопентадиена через верхний конец колонки, причем только что деполимеризованный циклопентадиен восстанавливают в охлажденном растворителе. В течение более 4 часов получают 56,00 г раствора циклопентадиена в дихлорметане, то есть потенциально 10,00 г циклопентадиена (0,151 моль) получают в течение более 4 часов. Выход: 72,5%. Раствор используют непосредственно в следующей реакции Дильса-Альдера.
14,80 г (0,076 моль) 80,0% 2,4-диметил-2-(1-метилпропенил)[1,3]диоксалана и 1,5 г кремневого хлорида железа (III) помещают в круглодонную колбу, находящуюся в атмосфере азота при комнатной температуре, и смесь охлаждают до температуры 0°С. Добавляют по каплям при указанной температуре в течение более 10 минут 56,00 г раствора циклопентадиена в дихлорметане. Смесь перемешивают в течение 2 часов при температуре 0°С, а затем в течение еще 15 часов, позволяя температуре подняться до комнатной. Катализатор отфильтровывают и растворитель отгоняют при пониженном давлении (около 35 мм рт. столба = 4,67×103 Па). Получают 23,00 г бледно-желтого масла, которое переносят в микроперегонное устройство с 15 см колонкой Вигре. Получают 1,5 г (5,6 ммоль) 83% 2-(2,3-диметилбицикло[2.2.1]гепт-5-ен-2-ил)-2,4-диметил-[1,3]диоксалана (сумма изомеров). Выход: 7,4%.
Пример 14: Обонятельная оценка
На первой стадии обонятельные характеристики соединения (3), когда R' представляет собой метил, одновременно были оценены набором как обонятельные характеристики коммерчески доступных известных соединений. Оценочный набор составлен несколькими специалистами, которые оценивают каждое соединение качественно и количественно. Результаты оценок представлены в таблице ниже.
| Запах: | Древесный | Кедровый | Янтарный | Ветиверовый | Ириса | Камфарный | Кожанный |
| Соединение(3) | XXX | XX | XX | XX | |||
| Изо Е Супер(1) | XXX | Х | XXX | Х | |||
| Вертофикс(2) | XXX | XX | XX | Х | |||
| Бойсамбрен(3) | XXX | XX | Х | ||||
| (1) 2-Ацетил-1,2,3,4,5,6,7,8-октагидро-2,3,8,8-тетра-метилнафтален (смесь изомеров);из:International Flavors & Fragrances, USA.(2) 4-Ацетил-1,1,6-триметил-6,8a-этано-1,2,3,4,5,6,7,8,8a-октагидронафтален от:International Flavors и Fragrances, USA.(3) (Этоксиметил) циклододекан от: Henkel. |
Эти три ссылочных продукта очень широко используются в ароматных композициях для получения мыла, детергентов и смягчителей или шампуней. Они также очень часто используются в парфюмерии, когда используют спирт.
Можно отметить, что соединение (3) имеет древесную, кедровую, янтарную и камфорную природу.
На второй стадии были оценены воздействующие или обонятельные характеристики соединения (3), когда его используют на носителе. Использовались три различных носителя:
- как 10%-ый раствор в 96° этиловом спирте,
- в стандартной основе для смягчении при 0,5%: оценка при влажной стирке и при сухой стирке,
- в стандартной основе шампуня при 0,5%: оценка основы покрытия и диффузии в растворе в горячей воде.
Были получены две основные ароматические композиции путем смешивания упомянутых ниже ингредиентов. Тестирования выполняли с помощью добавления 50 частей по весу соединения (3) к основной смеси.
| КОМПОЗИЦИЯ 1 | ||
| Тест в детергенте (применение при 0.5%) | ||
| КОМПОНЕНТЫ | ТЕСТ 1 | ТЕСТ 2 |
| GERANIUM RECO VMF(1) | 20 | 20 |
| БЕНЗИЛАЦЕТАТ | 60 | 60 |
| ДИМЕТИЛБЕНЗИЛКАРБИНИЛАЦЕТАТ | 20 | 20 |
| ФЕНОКСИАЛЛИЛАЦЕТАТ | 2 | 2 |
| ФЕНИЛЭТИЛОВЫЙ СПИРТ | 100 | 100 |
| ГЕКСИЛЦИННАМАЛЬДЕГИД | 200 | 200 |
| С 12 ЛАУРИЛАЛЬДЕГИД | 2 | 2 |
| С 12 MNA АЛЬДЕГИД | 3 | 3 |
| ГАММА-УНДЕКАЛАКТОН | 7 | 7 |
| ЦИТРОНЕЛЛОЛ | 30 | 30 |
| КУМАРИН | 15 | 15 |
| ДИГИДРОФЛОРИФОН(2) | 1 | 1 |
| ДИГИДРОМИРЦЕНОЛ | 50 | 50 |
| ВЕРДИЛАЦЕТАТ(3) | 15 | 15 |
| МАДАГАСКАРСКАЯ ГВОЗДИКА ЭССЕКСА | 12 | 12 |
| ЛИЛИАЛ(4) | 70 | 70 |
| МЕТИЛИОНОН | 55 | 55 |
| ФЕНИЛОКСИД | 25 | 25 |
| РОЗЕНОКСИД | 3 | 3 |
| АМИЛОВЫЙ САЛИЦИЛАТ | 95 | 95 |
| БЕНЗИЛОВЫЙ САЛИЦИЛАТ | 135 | 135 |
| ТРИПЛАЛ(5) | 4 | 4 |
| ВЕРДОКС(6 | 20 | 20 |
| ОКСИФЕНИЛОН при 10% EDG | 6 | 6 |
| СОЕДИНЕНИЕ (3) | 50 | |
| ВСЕГО | 950 | 1000 |
| (1) V. MANE FILS | ||
| (2) 1-(2,6,6-триметил-3-циклогексен-1-ил)-2-бутен-1-он | ||
| (3) 3а,4,5,6,7,7а-гексагидро-4,7-метано-1Н-инден-5 (или 6)-ол ацетат - от Givaudan (Швейцария) | ||
| (4) п-трет-бутил-альфа-метилгидроциннамальдегид - от Givaudan (Швейцария) | ||
| (5) 2,4-диметил-3-циклогексен-1-карбальдегид - от IFF (International Flavors and Fragrances, США) | ||
| (6) 2-трет-бутилциклогексилацетат - от IFF |
| КОМПОЗИЦИЯ 2 | ||
| Ароматический тест (применение при 7%) | ||
| КОМПОНЕНТЫ | ТЕСТ1 | ТЕСТ 2 |
| GERANIUM RECO VMF(1) | 5 | 5 |
| ИЗОБОРНИЛЦИКЛОГЕКСАНОЛ на 50% EDG | 90 | 90 |
| ИЛАНГ РЕКО(1) | 25 | 25 |
| БЕНЗИЛАЦЕТАТ | 80 | 80 |
| ФЕНИЛЭТИЛОВЫЙ СПИРТ | 80 | 80 |
| АНИСАЛЬДЕГИД | 10 | 10 |
| БАКДАНОЛ(2) | 20 | 20 |
| ЦИТРОНЕЛЛОЛ | 55 | 55 |
| КУМАРИН | 35 | 35 |
| ДИГИДРОМИРЦЕНОЛ | 20 | 20 |
| ЭТИЛВАНИЛЛИН | 7 | 7 |
| ГАЛАКСОЛИД(3) | 140 | 140 |
| ГЕРАНИОЛ | 80 | 80 |
| ГЕЛИОТРОПИН | 10 | 10 |
| ЧИСТЫЙ ИРИЗОН(4) | 25 | 25 |
| ЛИЛИАЛ | 45 | 45 |
| МЕТИЛИОНОН | 25 | 25 |
| БЕНЗИЛ САЛИЦИЛАТ | 80 | 80 |
| ВАНИЛЛИН | 8 | 8 |
| ВЕРТЕНЕКС(5) | 80 | 80 |
| С10 КАПРИЛАЛЬДЕГИД на 10% DPG | 10 | 10 |
| С12 ЛАУРИЛАЛЬДЕГИД на 10% DPG | 15 | 15 |
| ИНДОЛ на 10% DPG | 5 | 5 |
| СОЕДИНЕНИЕ (3) | 50 | |
| ВСЕГО | 950 | 1000 |
| (1) V. MANE FILS | ||
| (2) 4-(2,2,3-триметил-3-циклопентенил) -2-этил-3-бутен-1-ол - от IFF | ||
| (3) 1,3,4,6,7,8-гексагидро-4,6,6,7,8,8-гексаметилцикло-пента-(g)-2-бензан - от IFF | ||
| (4) смесь иононов | ||
| (5) 4-трет-бутилциклогексилацетат - от IFF |
В каждом случае оценки обонятельного воздействия выполняли при t0, t+48 час и
t+168 час, чтобы оценить главный отличительный признак, основной отличительный признак и фоновый отличительный признак.
Во всех случаях подчеркивается, что соединение (3) дает преимущественно главный отличительный признак и охватывает основу с богатой и оригинальной древесной, камформой природой.
Как и в спиртовом растворе (композиция 2), так и в смягчающей композиции (композиция 1) богатый древесный янтарный отличительный признак очень заметен после 48 часов сушки и дает оригинальный оттенок, который является и чистым, и косметическим.
Оказывается, что снижение интенсивности через какое-то время является почти линейным без любого значительного изменения в обонятельной характеристике, что является примечательным.
Диффузия в горячей воде, в шампуне дает дискретный, но утонченный и очень приятный древесный отличительный признак.
Результаты этих оценок недвусмысленно показывают, что соединение (3) имеет преимущественные обонятельные характеристики, которые найдут применение, в частности, в косметике, парфюмерии и моющих средствах.
1. Соединение формулы
где пунктиром отмеченная связь присутствует или отсутствует и где R1 означает:
когда пунктиром отмеченная связь присутствует
СНСН3ОН или -СНСН3OCOR или -СНСН3ХСН2CHOHR' или -СНСН3OCHRCH2OH или
когда пунктиром отмеченная связь отсутствует
СНСН3ОН, -СНСН3OCOR, -СОСН3, -СНСН3ХСН2CHOHR',
CH2CH2XCH2CHOHR', -СНСН3OCHR'СН2OH, -CHCHCOR', -CH2CH2CHR'OH, -CH2CH2CHR'OCOR, -CHCHCHOHR' или -CHCHCHR'OCOR,
где R означает Н, Me, Et, Pr, изоPr, But, изоBut, СН3(СН2)4, (СН3)2СНСН2, СН2=СН или (СН3)2С=СН,
R' означает Н, Me или Et, и Х означает О, N или S.
2. Соединение по п.1, г