Способ аллергодиагностики по показателям хемилюминесцентного свечения нейтрофилов
Иллюстрации
Показать всеИзобретение относится к области лабораторной диагностики и может быть использовано для диагностики аллергии. Сущность способа состоит в том, что выделяют нейтрофильные лейкоциты, проводят формирование иммунных комплексов, измеряют фоновую люминесценцию среды инкубации (А), добавляют нейтрофилы, измеряют уровень спонтанной хемилюминесценции (Б), затем вносят иммунный комплекс и определяют значение стимулированной хемилюминисценции (В), вычисляют коэффициент стимуляции (КС) и при значении КС≥0,3 диагностируют аллергическую реакцию. Техническим результатом является повышение точности и специфичности определения наличия аллергической сенсибилизации к конкретным антигенам, возможность скринингового серийного анализа, исключается дополнительная сенсибилизация организма, связанная с введением аллергенов при кожной пробе. 1 з.п. ф-лы, 6 табл.
Реферат
Изобретение относится к способам выявления специфической сенсибилизации организма к полноценным антигенам различной природы. Способ предназначен для выявления повышенной чувствительности к полноценным антигенам, в том числе оценки аллергического побочного действия лечебных и профилактических медицинских препаратов.
В последнее время наблюдается ухудшение общего аллергического статуса у населения, увеличение числа аллергических заболеваний и реакций, в том числе анафилактических, что связано с неблагоприятной экологической обстановкой, химическим загрязнением окружающей среды, широким использованием химических средств в быту, злоупотреблением лекарств, изменением характера питания, ростом числа профессиональных аллергенов. Установлено, что 1/5 часть жителей нашей планеты обращается за медицинской помощью из-за различных клинических проявлений аллергического характера (Мачаридзе Д.Ш., Тарасова С.В. Динамика распространенности симптомов аллергических заболеваний по данным ISAAC 1997-2000, г.Москва. // Аллергология и иммунология. - 2002. - том. 3. - №2. - С.50-54). В настоящее время антигены различной природы и строения рассматривают в качестве индукторов аллергии (Пыцкий В.И., Адрианова Н.В., Артомасова А.В.. Аллергические заболевания. - М.: Медицина, 1984). На территории Российской Федерации за последние 15-20 лет заболеваемость бронхиальной астмой возросла 3-4 раза.(Федоскова Т.Г. и др. Принципы диагностики аллергических заболеваний. // Consilium medicum. - 2002. - №4. - С.13-19). При этом в 80-90% случаях этого заболевания имеет инфекционную этиологию (Пыцкий В.И., Адрианова Н.В., Артомасова А.В.. Аллергические заболевания. - М.: Медицина, 1984).
Принципиально выявление аллергической перестройки организма возможно с использованием двух подходов - in vivo и in vitro.
Выявление этиологического фактора аллергии до настоящего времени базируется главным образом на результатах кожных проб (Пыцкий В.И., Адрианова Н.В., Артомасова А.В.. Аллергические заболевания. - М.: Триада-Х, 1999. - С.102-112). Постановка кожных проб является диагностическим методом выявления специфической сенсибилизации организма путем введения под кожу аллергена и оценки величины и характера развившегося при этом отека или воспалительной реакции. Метод основан на взаимодействии аллергена с сенсибилизированными Т-лимфоцитами и антиген-презентирующими клетками (макрофагами и клетками Лангенгарса), что вызывает высвобождение медиаторов аллергии и развитие местной реакции у сенсибилизированных лиц (Федоскова Т.Г. и др. Принципы диагностики аллергических заболеваний. // Consilium medicum. - 2002. - №4. - С.13-19). Существуют разные методы кожного тестирования с использованием аллергенов: прик-тесты, скарификационные, аппликационные и внутрикожные пробы (Скепьян Н.А. Аллергические болезни. Диффиренциальный диагноз, лечение. - Минск: Беларусь, 2000. - С.35-43).
В настоящее время одним из наиболее часто используемых кожных аллергопроб является прик-тест на специфический аллерген. Постановка этого теста производится путем укола в кожу и введением раствора аллергена на глубину не более 1-1,5 мм. Этот кожный тест считают менее травматичным по сравнению со скарификационными пробами, он требует меньшей поверхности кожи для проведения аллергодиагностики, что позволяет исследовать большее число проб.
Скарификационные аллерготесты широко используются для выявления сенсибилизации к пищевым аллергенам, аллергенам бактериального и грибкового происхождения. Однако при их постановке часто возникают ложноположительные результаты, так же как и при постановке накожной и внутрикожной пробы, например с туберкулином реакция бывает положительной у лиц, инфицированных нокардиями, родококками, коринебактериями. (Гущин И.С. Аллергическое воспаление и его фармакологическое действие. М.: Фармакус Приит, 1998). В настоящее время эксперты Европейской Академии Аллергологии и Клинической Иммунологии не рекомендуют использовать скарификационные кожные тесты для диагностики аллергии ввиду их низкой информативности (Федоскова Т.Г. и др. Принципы диагностики аллергических заболеваний. // Consilium medicum. - 2002. - №4. - С.13-19).
Внутрикожные тесты считают более чувствительными, чем скарификационные, но они менее специфичны. (Бережная Н.М., Бобкова Л.П., Петровская И.А. и др. Аллергология словарь-справочник. Киев: Наукова Думка, 1986).
Таким образом, к общим недостаткам кожного тестирования как способа диагностики аллергии можно отнести следующее:
во-первых, способ небезопасен для обследуемого, так как не исключается возникновение не только (местных) локальных, но и общих реакций организма на введение аллергена, а в случае высокого уровня сенсибилизации - развития тяжелых аллергических осложнений. Кроме того, для постановки аллергологических проб требуется опытный, специально подготовленный персонал, безупречно владеющий методикой их постановки, а также наличие постоянного запаса противошоковых препаратов, что обуславливает необходимость проведения реакции в условиях специализированных аллергоцентров;
во-вторых, недостаточна экспрессность - результаты пробы учитываются через 24-48 часов;
в-третьих, ограничено количество анализируемых антигенов.
Другим методом диагностики аллергии является постановка провокационных тестов. Провокационные тесты считают достаточно достоверным методом аллергодиагностики. Их используют в случае расхождения данных анамнеза и результатов кожного тестирования. В зависимости от способа введения аллергена в организм различают конъюнктивальный, назальный, ингаляционный и подъязычный провокационные тесты (Федоскова Т.Г. и др. Принципы диагностики аллергических заболеваний. // Consilium medicum. - 2002. - №4. - C.13-19).
Недостатком провокационных тестов является частое развитие аллергических осложнений, поэтому проведение провокационных проб ограничено только одним исследованием в день (Пыцкий В.И., Адрианова Н.В., Артомасова А.В.. Аллергические заболевания. - М.: Триада-Х, 1999. - С.102-112). Кроме того, при их постановке требуется специально подготовленный персонал, а также специально оборудованное помещение для проведения ингаляционного провокационного теста.
В связи с вышесказанным особую актуальность для оценки специфической сенсибилизации приобретают методы диагностики аллергии in vitro, что подчеркивается в решении международной группы экспертов-иммунологов ВОЗ. (Федоскова Т.Г. и др. Принципы диагностики аллергических заболеваний. // Consilium medicum. - 2002. - №4. - C.13-19).
Известен инструментальный метод оценки сенсибилизации организма к аллергену (антигену), основанный на выявлении антител класса IgE в сыворотке крови в условиях in vitro - радиоаллергосорбентный тест (PACT) (Бережная Н.М., Бобкова Л.П., Петровская И.А. и др. Аллергология словарь-справочник. Киев: Наукова Думка, 1986). Сущность метода заключается в связи специфического IgE исследуемой сывортки с аллергеном, размещенным на бумажной пластинке. После отмывания неспецифического IgE к пробе добавляются меченные 125I антитела против IgE. Образовавшийся радиоактивный комплекс считывается на сцинтилляционном счетчике (Пыцкий В.И., Адрианова Н.В., Артомасова А.В.. Аллергические заболевания. - М.: Триада-Х, 1999. - С.102-112). PACT является экспрессным методом, высокочувствительным, специфичным и точным, так как основан на использовании радиоактивной метки (Скепьян Н.А. Аллергические болезни. Дифференциальный диагноз, лечение. - Минск: Беларусь, 2000. - С.35-43).
Недостатком метода PACT является необходимость использования специальной дорогостоящей аппаратуры, он обладает меньшей чувствительностью по сравнению с кожной пробой, требует организации регулярной поставки меченных изотопом компонентов, специально оборудованного рабочего места и соблюдения мер радиационной безопасности при проведении работы с радиоактивно меченным анти-IgE (Федоскова Т.Г. и др. Принципы диагностики аллергических заболеваний. // Consilium medicum. - 2002. - №4. - C.13-19).
Известен также инструментальный метод определения содержания общего и аллергоспецифического IgE - постановка иммуноферментного анализа (ИФА). Принцип метода по существу совпадает с PACT. Оптимальной концентрацией аллергена обрабатывают сорбент (полистирол в виде микроплат), избыток аллергена отмывают, добавляют исследуемую сыворотку, в результате происходит образование комплекса «антиген-антитело». После этого несвязавшиеся компоненты удаляют отмыванием, добавляют анти-IgE (меченные ферментом), полученный субстрат определяют фотометрическим способом (Фрадкин. В.А. Диагностические и лечебные препараты. - М.: Медицина, 1990). Метод является достаточно чувствительным, специфичным и экспрессным, кроме того, в настоящее время чаще используется для определения аллергенспецифических IgE (Азимов А.Г. О роли иммуноглобина Е в патологии. // Иммун. Пат. Аллер., инфекц. - 2002. - №2. - С.73-77).
Недостатком иммуноферментного анализа является необходимость наличия специальных стандартизированных препаратов (тест-систем) к конкретным аллергенам, однако выбор доступных систем в настоящее время ограничен. Кроме того, метод предъявляет высокие требования к стандартности постановки теста и к качеству антигенных компонентов, то есть воспроизводимость метода существенно зависит от качества и производителя тест-системы.
Известен также метод диагностики аллергии - прямой и непрямой тест дегрануляции базофилов, основанный на выявлении активации (дегрануляции) иммунокомпетентных базофильных лейкоцитов крови, сенсибилизированных IgE, при воздействии на такие клетки специфическим антигеном (Sheley W/ Circulating basophile as indicator of hyper-sensitivity in man. - // Arch. Dermal. - 1963. - v.88. - P.759). Метод не требует дорогостоящих препаратов, обеспечивает высокую специфичность.
Недостатком данной методики является сложность ее воспроизведения, высокая субъективность полученных результатов, низкая экспрессность, наличие лабораторных животных при постановке непрямого теста.
Известен способ оценки наличия аллергии in vitro путем регистрации активности сенсибилизированных клеток крови по специфическому повреждению (разрушению) нейтрофилов (В.А.Фрадкин. Диагностика аллергии реакциями нейтрофилов крови. - М., 1985).
Для данного подхода общим с заявляемым способом является гипотеза о взаимодействии специфического иммунного комплекса «аллерген (антиген) - антитело» со специфическими рецепторами нейтрофилов.
К недостаткам рассматриваемого способа следует отнести субъективность при учете результатов реакции, плохую воспроизводимость и большую трудоемкость. Одним из существенных источников ошибок этой методики являются погрешности в приготовлении фиксированных мазков, качестве их окрашивания, а также сложность обеспечения точного подсчета поврежденных клеток до и после инкубации фагоцитов (Н.Д.Беклемишев, Г.С.Суходоева. Аллергия в клинике и эксперименте. - М.: Медицина, 1979).
Наиболее близким к заявляемому способу является способ выявления сенсибилизации организма к бактериальным антигенам с использованием хемилюминесцентного анализа нейтрофилов периферической крови (Н.К.Вознесенский, Н.С.Манеркина. Хемилюминесценция нейтрофилов в аллергодиагностике. // Клинич. лабораторная диагностика. 1999. - №8. - С.18-20), включающая диагностику аллергии у лиц, контактирующих с аллергенами грибкового происхождения (C.albicans).
Способ включает в себя следующие этапы:
получение из образца исходной крови нейтрофилов с концентрацией 2×106 кл·мл-1;
формирование in vitro комплекса антиген-антитело;
добавление комплекса к суспензии;
измерение хемилюминесценции образца суспензии.
Для получения фракции нейтрофилов используют 1 мл гепаринизированной крови. Взвесь нейтрофилов готовят из цельной гепаринизированной крови методом лизиса эритроцитов. Каждые 300 мкл крови гемолизируют 3 мл 0,083% раствора хлорида аммония, начиная с экспозиции 40 с и уменьшая ее до 20, 10 и 1 с соответственно. Прекращения действия хлорида аммония добиваются введением в смесь 7 мл 1,5 М фосфатного буфера (рН 7,2) с последующей отмывкой клеток путем центрифугирования при 200 g в течение 7 мин и их ресуспендированием в этом же растворе с концентрацией 2×10 кл·мл-1.
Для формирования иммунных комплексов in vitro используют различные соотношения аллергена и сыворотки в количестве 20 и 100 мкл соответственно. Аллерген разводят 5% раствором глюкозы.
Хемилюминесцентный анализ проводят с использованием прибора БХЛ-06. В кювету прибора вносят реакционную смесь, содержащую 400 мкл фосфатного буфера (рН 7,6), 100 мкл 5 мМ раствора глюкозы, 100 мкл 0,37 мМ раствора сульфата магния и 200 мкл 0,65 мМ раствора люминола, добавляют 50 мкл лейковзвеси, измеряют уровень спонтанной хемилюминесценции. Затем в кювету вносят 20 мкл сыворотки с иммунными комплексами и регистрируют динамику свечения на протяжении 7-8 мин. В качестве контроля используют аутологическую сыворотку без антигена и раствор антигена без сыворотки. Для оценки результатов используют отношение максимального значения хемилюминесценции (Imax) к уровню стационарного свечения (I0) - так называемый индекс стимуляции (ИС). ИС=Imax/I0.
Общим с заявляемым способом является принцип индукции хемилюминесцентного свечения нейтрофилов крови за счет воздействия на них преформированным in vitro иммунным комплексом аллергена с антителом.
Недостатками рассматриваемого способа являются:
многоэтапная процедура лизиса эритроцитов, приводящего к значительному повреждению и гибели до 60-70% нейтрофилов, что отрицательно влияет как на хемилюминесцентную способность, так и существенно снижает концентрацию клеток, т.е. уровень (амплитуду) хемилюминесцентного сигнала.
Кроме того, для оценки результатов исследований в прототипе в формуле расчета не используется показатель фоновой хемилюминесценции реакционной смеси, что существенно искажает результат измерения. Следует отметить, что использованная в прототипе концентрация нейтрофилов 2×106 кл·мл-1 является недостаточной в условиях измерения для получения статистически значимых различий значений фоновой хемилюминесценции реакционной среды и спонтанной хемилюминесценции нейтрофилов в силу получения низких по абсолютной величине цифр показателя хемилюминесценции (единиц у.е.).
Задачей изобретения является разработка усовершенствованного способа выявления специфической сенсибилизации организма к антигенам на основе регистрации хемилюминесценции нейтрофилов крови in vitro.
Поставленная задача решается благодаря тому, что что нейтрофилы выделяют в градиенте плотности разделяющей жидкости с последующей отмывкой клеток в щадящем режиме; концентрацию нейтрофилов доводят до (4...6)·106 кл·мл-1, иммунные комплексы получают, смешивая сыворотку крови исследуемого и антиген (аллерген), и инкубируют их; измеряют показатели фонового значения хемилюминесценции среды инкубации, спонтанной хемилюминесценции внесенных в пробу отмытых нейтрофилов и интенсивность хемилюминесценции после добавления в пробу комплекса сыворотки крови и исследуемого аллергена (антигена); вычисляют показатель коэффициента стимуляции; оценку достоверности отличий в показателях до и после стимуляции проводят по результатам не менее чем трехкратных повторных измерений.
Поставленная задача решается благодаря тому, что:
на этапе подготовки пробы объем отбираемой у исследуемого крови увеличен до 5 мл гепаринизированной и 5 мл негепаринизированной крови;
на этапе выделения фракции нейтрофилов предусмотрено использование жидкости для разделения клеток (фиколл-верографин, фиколл-гипак, фиколл-урографин или любой коммерческой смеси или жидкости для выделения фракции нейтрофилов);
выполнение операции предварительной отмывки нейтрофилов в щадящих режимах (1000 об·мин-1), в минимальной степени повреждающих нейтрофильные лейкоциты крови;
свечение регистрируется на доступном для большинства лабораторий люминометре;
в качестве жидкости, разводящей суспензию нейтрофилов, используется коммерческий раствор Хенкса (рН 7,4), благодаря которому обеспечиваются оптимальные условия для сохранения жизнеспособности клеток;
по результатам регистрации хемилюминесцентного свечения рассчитывают коэффициент стимуляции хемилюминесценции и определяется уровень значимости его величины.
Способ включает следующие этапы:
1. Получение из образца исследуемой крови суспензии нейтрофилов с концентрацией (4-6)·106 кл·мл-1;
2. Формирование in vitro комплекса «антиген-сыворотка крови»;
3. Измерение уровня фоновой хемилюминесценции реакционной среды, хемилюминесценции нейтрофилов спонтанной и после добавления комплекса «антиген-сыворотка крови».
Этап 1. Для получения суспензии нейтрофилов используют 5 мл гепаринизированной крови. Пробу крови инкубируют в термостате при 37°С в течение 40 мин. Отбирают надосадочную жидкость (плазму), содержащую фракцию лейкоцитов, и наслаивают на 5 мл разделяющей жидкости, центрифугируют в течение 15 мин при 1500 об·мин-1. В результате происходит разделение образца на три слоя. Нижний слой состоит из разделяющей жидкости, в среднем слое находится фракция нейтрофилов, в верхнем слое - плазма крови. Осторожно с помощью пластиковой пипетки собирают фракцию нейтрофилов. Выделенные клетки ресуспендируют и отмывают бесцветным раствором Хенкса в течение 10 мин при 1000 об·мин-1. Концентрацию нейтрофильных лейкоцитов доводят до (4-6)·106 кл·мл-1, разводя раствором Хенкса.
Этап 2. Для формирования иммунных комплексов in vitro используют сыворотку крови исследуемого и антиген (аллерген). Сыворотку получают из того же отобранного образца негепаринизированной крови путем центрифугирования при скорости 1500 об·мин-1 в течение 15 мин. Разведения антигенов готовят на физиологическом растворе. Равные количества сыворотки и раствора антигена (по 0,1 мл) инкубируют при 37±1°С в течение 40 мин.
Этап 3. Измерение уровня хемилюминесценции осуществляют с помощью хемилюминометра.
В кюветы прибора вносят 0,7...0,9 мл раствора Хенкса, добавляют 0,1 мл 0,1...0,5 мМ раствора люминола и определяют уровень фоновой хемилюминесценции. Затем добавляют 0,1 мл подготовленной, как указано выше, суспензии нейтрофилов, перемешивают, инкубируют 5 мин и измеряют уровень спонтанной хемилюминесценции, при этом регистрация значений проводится в промежутке от 5 до 40 мин с момента окончания периода инкубации суспензии нейтрофилов. Для индукции хемилюминесцентного ответа нейтрофилов в пробу вносят 0,1 мл сформированного in vitro комплекса «антиген-сыворотка крови», вновь фиксируют интенсивность хемилюминесценции. Результаты оценивают по показателю коэффициента стимуляции (КС) хемилюминесценции, который определяют по формуле:
где В - уровень ХЛ после стимуляции, мВ;
Б - уровень спонтанной ХЛ, мВ;
А - уровень фоновой ХЛ, мВ.
и при значении КС≥0,3 диагностируют аллергическую реакцию.
Для повышения достоверности результатов регистрируют хемилюминесценцию образцов, приготовленных не менее чем в трех повторностях (независимо приготовленных из исходной суспензии нейтрофилов), определяют среднее арифметическое и доверительный интервал с 95% уровнем вероятности.
По результатам исследований определяют уровень значимости коэффициента стимуляции хемилюминесценции. Коэффициент стимуляции значимый при условии наличия статистически значимых различий значений уровня спонтанной хемилюминесценции нейтрофилов и хемилюминесценции после стимуляции комплексом «антиген-сыворотка крови», т.е. доверительные интервалы средних величин этих показателей не перекрываются. Наличие причинно-следственной связи между совокупностью существенных признаков заявляемого объекта и достигаемыми техническими результатами показано в таблице 1.
Возможность осуществления предлагаемого способа показана в следующих примерах.
Пример 1. Оценка количества нейтрофилов при получении суспензии клеток с помощью разделяющей жидкости и методом лизиса эритроцитов.
Этапы получения суспензии нейтрофилов с помощью жидкости для разделения клеток проводили согласно заявляемому способу, описанному выше, получение нейтрофилов методом лизиса эритроцитов проводили по вышеописанной методике Н.К.Вознесенского (прототип).
Из представленных в таблице 2 данных следует, что при выделении фракции нейтрофилов из крови людей при помощи разделяющей жидкости наблюдается гибель 4-8% клеток, в то время как гибель нейтрофилов, выделенных методом лизиса эритроцитов, составила 68-82%.
Пример 2. Оценка хемилюминесцентной реакции нейтрофилов (спонтанная хемилюминесценция) при подготовке образца клеток с использованием разделяющей жидкости и методом лизиса эритроцитов.
Для исследования использовали суспензию нейтрофилов, полученную в опыте 1. Хемилюминесцентную реакцию нейтрофилов измеряли с помощью люминометра LKB-1251. Реакционные среды готовили согласно описанным выше методикам, при этом концентрация клеток составила (4-6)·106 кл·мл-1 в заявляемом способе и (1-2)·106 кл·мл-1 - в прототипе.
Анализ результатов регистрации хемилюминесценции, представленных в таблице 3, показал, что уровень спонтанной хемилюминесценции нейтрофилов, выделенных по методике заявляемого способа значительно выше, чем в случае выделения клеток по методике, предложенной в прототипе, кроме того, при регистрации хемилюминесценции нейтрофилов, полученных по методике Н.К.Вознесенского, отмечается отсутствие статистически значимых различий интенсивности уровня фоновой и спонтанной хемилюминесценции.
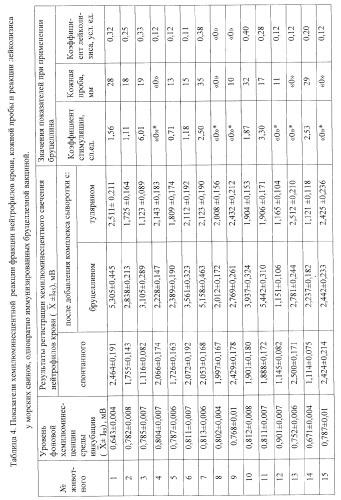
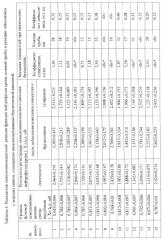
Пример 3. Оценка уровня сенсибилизации организма морских свинок, однократно иммунизированных бруцеллезной вакциной.
Выявление феномена специфической аллергизации в ответ на введение вакцин было проведено на морских свинках - животных, рекомендованных для оценки побочного действия вакцин, с использованием живой коммерческой бруцеллезной вакцины (шт. 19-ВА), которую вводили подкожно по 0,5 мл с концентрацией 2·109 КОЕ·мл-1. Хемилюминесцентную реакцию нейтрофилов морских свинок оценивали на 35 сутки после иммунизации, при этом конечная концентрация нейтрофилов составила 2·106 кл·мл-1. В качестве специфического антигена в этих опытах использовали коммерческий препарат бруцеллина. Для определения специфичности хемилюминесцентной реакции к бруцеллезному антигену в качестве неспецифического антигена применяли коммерческий препарат тулярина. Одновременно выполняли реакцию лейколизиса и постановку кожной пробы с использованием бруцеллина.
Из данных, представленных в таблице 4, видно, что в группе животных у 11 из 20 (55%) иммунизированных морских свинок отмечалось значительное повышение уровня хемилюминесценции после индукции специфическим комплексом антиген - антитело в сравнении со значениями показателя спонтанной хемилюминесценции (р<0,05). У остальных 9 животных значение показателя хемилюминесценции после воздействия бруцеллина не отличались от уровня спонтанной хемилюминесценции (р>0,05) что свидетельствует об отсутствии стимуляции ХЛ нейтрофилов специфическим аллергеном данных животных. По результатам статистического анализа значимый уровень КС хемилюминесценции в этих исследованиях составил ≥0,71. В этой же группе животных наблюдались выраженные реакции при кожной пробе и положительная реакция лейколизиса. Статистический анализ результатов оценки коэффициента стимуляции хемилюминесценции, кожной пробы и реакции лейколизиса у опытных животных показали их хорошую сходимость (коэффициент корреляции Спирмена 0,879 (р<0,001) и 0,795 (р<0,001) для кожной пробы и лейколизиса соответственно). При анализе результатов изменения интенсивности хемилюминесценции нейтрофилов крови иммунизированных морских свинок после добавления неспецифического комплекса тулярин-сыворотка достоверно отмечается отсутствие стимуляции хемилюминесценции лейкоцитов. Этот факт свидетельствует о специфическом характере индукции хемилюминесцентной реакции нейтрофильных лейкоцитов антигенами бруцеллезной вакцины.
Пример 4. Оценка уровня сенсибилизации организма людей, однократно и многократно иммунизированнных туляремийной, бруцеллезной и сибиреязвенной вакцинами.
Хемилюминесцентный анализ нейтрофилов людей, иммунизированных туляремийной вакциной, осуществляли в соответствии с методикой заявляемого способа. В ходе хемилюминесцентного анализа для стимулирования нейтрофильных лейкоцитов крови лиц, иммунизированных бруцеллезной вакциной, использовали бруцеллин, туляремийной вакциной - тулярин, сибиреязвенной вакциной - антраксин. Кроме того, для оценки специфичности хемилюминесцентной реакции нейтрофилов осуществляли индукцию хемилюминесценции клеток иммунизированных лиц неспецифическими антигенами.
В целях сравнения результатов разных методов оценки сенсибилизации людей, иммунизированных бруцеллезной, туляремийной и сибиреязвенными вакцинами, выполняли реакцию лейколизиса с соответствующими антигенами (бруцеллином, тулярином или антраксином), постановку кожной пробы с антраксином (у первично привитых сибиреязвенной вакциной) и определяли уровень общего IgE в сыворотке крови методом иммуноферментного анализа. Результаты исследований представлены в таблице 5.
Как видно из данных, представленных в таблице 5, хемилюминесцентный анализ нейтрофилов крови людей, однократно и неоднократно иммунизированных против туляремии, показал повышение уровня ХЛ нейтрофилов после индукции клеток тулярином, значимый уровень КС ХЛ у этих людей составил ≥0,3. При этом у привитых туляремийной вакциной с резковыраженной и сильной ХЛ реакцией на антиген одновременно отмечались положительные и резко положительные реакции лейколизиса с тулярином (коэффициент корреляции Спирмена в этих исследованиях ставил 0,863, р<0,01).
В результате анализа хемилюминесцентной реакции нейтрофилов крови людей, иммунизированных бруцеллезной вакциной, было установлено достоверное повышение уровня ХЛ нейтрофилов после стимулирования клеток иммунным комплексом. Значимый уровень КС ХЛ у этих исследуемых составил ≥0,30. Статистический анализ результатов применения метода регистрации ХЛ нейтрофилов и реакции лейколизиса показал высокую корреляцию (r=0,929, р<0,001). При анализе результатов определения хемилюминесцентной реакции нейтрофилов людей, однократно и неоднократно привитых сибиреязвенной вакциной, была установлена повышенная реакция на антраксин. Значимый уровень КС ХЛ в этих исследованиях составил ≥0,32. Высокая степень надежности подтверждена при постановки реакции лейколизиса и кожной пробы на антраксин, при этом коэффициент корреляции Спирмена составил 0,762 (р<0,05) и 0,875 (р<0,01) соответственно.
Таким образом, аллергическая перестройка организма происходит индивидуально и по КС ХЛ может колебаться в широких диапазонах от полного отсутствия стимуляции ХЛ до значительного повышения значений этого показателя. Необходимо отметить, что наибольшим сенсибилизирующим действием обладает туляремийная вакцина и меньшим - сибиреязвенная.
Пример 5. Хемилюминесценция нейтрофилов людей, имеющих аллергические реакции на аллергены пера подушки.
Для исследования использовали суспензию нейтрофилов людей, имеющих повышенную чувствительность к аллергенам пера подушки. Работу по выявлению специфической сенсибилизации проводили согласно описанной выше методике. В качестве специфического стимулятора хемилюминесцентной реакции нейтрофилов у лиц с повышенной чувствительностью к аллергену пера подушки использовали коммерческий препарат аллергена пера подушки, в качестве неспецифического антигена - бруцеллин. Одновременно проводили реакцию лейколизиса со специфическим аллергеном.
Анализ данных, представленных в таблице 6, показывает, что значения КС ХЛ людей, имеющих аллергию к перу подушки, составили от 1,12 до 3,12. Одновременно отмечается отсутствие стимуляции хемилюминесценции нейтрофилов крови людей при воздействии неспецифического антигена.
| Таблица 1.Сведения о причинно-следственной связи между совокупностью существенных признаков заявляемого объекта и достигаемыми техническими результатами. | |||
| Виды технического результата и их размерность | Показатели фактические или расчетные | Объяснение за счет чего (отличительный признак и/или их совокупность) стало возможным улучшение показателей предложенного объекта по сравнению с прототипом | |
| прототипа | заявляемого объекта | ||
| Способ получения суспензии нейтрофилов. | Многоэтапный лизис эритроцитов хлоридом аммония с последующей отмывкой фосфатным буфером. | Одноэтапное выделение клеток с помощью разделяющей жидкости, однократная отмывка раствором Хенкса. | Одностадийное выделение фракции нейтрофилов позволяет уменьшить повреждение клеток, получить суспензию нейтрофилов с большим содержанием жизнеспособных высокоактивных нейтрофильных лейкоцитов, с меньшим количеством примесей, что обеспечивает более качественный анализ. |
| Концентрация нейтрофилов в конечной пробе, кл·мл-1. | 2·106 | (4-6)·106 | Увеличение концентрации нейтрофилов наряду с улучшенным их качеством (жизнеспособностью) обеспечивает увеличение абсолютных регистрируемых показателей хемилюминесценции, получение статистически значимых различий величин интенсивности фоновой и спонтанной хемилюминесценции. |
| Показатель фоновой хемилюминесценции при вычислении результатов измерения. | Не учитывается | Учитывается | Учет результатов фоновой хемилюминесценциии обеспечивает повышение достоверности анализа. |
| Состав среды инкубации. | Фосфатный буфер, рН 7,6-0,4 мл; глюкоза 5 мМ - 0,1 мл; MgSO4 0,37 мМ - 0,1 мл; люминол 0,65 мМ - 0,2 мл | Раствор Хенкса, рН 7,4 - 0,7 мл; люминол 1 мМ - 0,1 мл | Использование коммерческого раствора Хенкса обеспечивает оптимальные условия для поддержания жизнеспособности нейтрофилов, сохранение стабильной величины рН. |
| Повторность числа измерений уровня хемилюминесценции. | Отсутствует. | Не менее чем в трех повторностях. | Повторная регистрация хемилюминесценции образца обеспечивает повышение достоверности результатов исследования. |
| Оценка достоверности отличий в показателях хемилюминесценции до и после стимуляции. | Не определяется. | Определяется. | Оценка достоверности отличий в показателях до и после стимуляции нейтрофильных лейкоцитов позволяет определить факт стимуляции нейтрофилов специфическим иммунным комплексом. |
| Таблица 2.Количество жизнеспособных нейтрофилов при различных способах подготовки клеток. | |||
| № пробы | Доля жизнеспособных нейтрофилов при выделении клеток (%) | ||
| с помощью разделяющей жидкости (по предлагаемому способу) | методом лизиса эритроцитов (по прототипу) | ||
| 1 | 94±0,18 | 25±0,31 | |
| 2 | 92±0,44 | 32±0,12 | |
| 3 | 95±0,43 | 18±0,24 | |
| 4 | 95±0,41 | 19±0,17 | |
| 5 | 96±0,78 | 20±0,21 | |
| Средняя для выборочных средних | 94,2±1,5 | 22,8±5,8 | |
| Таблица 3.Показатели хемилюминесценции образцов проб крови при различных режимах подготовки суспензии нейтрофилов. | |||
| № пробы | Способ разделения нейтрофилов | Интенсивность хемилюминесценции мВ | |
| фоновой | спонтанной | ||
| 1 | С помощью разделяющей жидкости (по предложенному способу). | 0,698±0,007 | 4,174±0,514 |
| 2 | 0,762±0,008 | 6,646±0,353 | |
| 3 | 0,696±0,004 | 4,752±0,385 | |
| 4 | 0,681±0,008 | 4,512±0,227 | |
| 5 | 0,762±0,007 | 6,438±0,116 | |
| 1 | Методом лизиса эритроцитов (по прототипу). | 0,697±0,067 | 1,007±0,261 |
| 2 | 0,865±0,082 | 1,114±0,107 | |
| 3 | 0,781±0,154 | 0,757±0,048 | |
| 4 | 0,759±0,203 | 0,821±0,206 | |
| 5 | 0,875±0,203 | 0,862±0,134 |
| Таблица 5.Сравнительная характеристика методов диагностики аллергии у людей, однократно и неоднократно иммунизированных туляремийной, бруцеллезной и сибиреязвенной вакцинами. | |||||
| Условный номер иследуемого | Наименование вакцины | Коэффициент стимуляции, усл.ед. | Коэффициент лейколизиса, усл.ед. | Кожная проба, мм | Общий IgE, МЕ·мл-1 |
| 1 | туляремийная | 1,80 | 1,80 | - | 410 |
| 2 | 4,30 | 4.30 | - | 62,6 | |
| 3 | 0,34 | 0,34 | - | 257,6 | |
| 4 | 0,96 | 0,96 | - | 132,9 | |
| 5 | 1,62 | 1,62 | - | 26,0 | |
| 6 | 3,46 | 3,46 | - | 404 | |
| 7 | «0» | «0» | - | 14,5 | |
| 8 | «0» | «0» | - | 44,4 | |
| 9 | бруцеллезная | «0» | «0» | - | 12,5 |
| 10 | 1,83 | 0,31 | - | 28,2 | |
| 11 | 2,96 | 0,40 | - | 501,3 | |
| 12 | 1,06 | 0,31 | - | 279,9 | |
| 13 | «0» | 0,18 | - | 47,5 | |
| 14 | 0,30 | 0,14 | - | 64,1 | |
| 15 | 0,91 | 0,28 | - | 187,3 | |
| 16 | «0» | «0» | - | 75,6 | |
| 17 | сибиреязвенная | «0» | «0» | 13 | 40,4 |
| 18 | «0» | «0» | 16 | 187,3 | |
| 19 | 0,37 | 0,4 | 40 | 75,6 | |
| 20 | «0» | 0,11 | 15 | 0,1 | |
| 21 | «0» | 0,18 | 20 | 31,1 | |
| 22 | «0» | 0,12 | 18 | 29,8 | |
| 23 | 0,44 | 0,28 | 40 | 149 | |
| 24 | 0,35 | 0,12 | 25 | 26,3 | |
| Примечания: 1 «0» - коэффициент стимуляции меньше значимого уровня;2 - - не определяли |
| Таблица 6.Показатели хемилюминесценции образцов проб крови людей, при оценке сенсибилизации к аллергену пера подушки. | ||||||
| Условный номер исследуемого | Уровень фоновой хемилюминесценции (X±I95), мВ | Интенсивность хемилюминесценции нейтрофилов мВ: | Значения показателей при использовании тулярина | |||
| спонтанной | После добавления комплекса сыворотка с... | Коэффициент стимуляции, усл.ед. | Коэффициент лейколизиса, усл.ед. | |||
| аллергеном пера пуха подушки | бруцеллином | |||||
| 1 | 0,842±0,004 | 4,174±0,356 | 14,570±0,483 | 5,035±0,126 | 3,12 | 0,24 |
| 2 | 0,811±0,006 | 6,646±0,251 | 13,181±0,758 | 6,870±0,543 | 1,12 | 0,28 |
| 3 | 0,769±0,005 | 5,364±0,139 | 5,257±0,107 | 5,408±0,087 | «0»* | 0,12 |
| 4 | 0,711±0,006 | 6,943±0,265 | 6,457±0,520 | 6,704±0,183 | «0»* | «0» |
| 5 | 0,837±0,008 | 4,752±0,149 | 9,646±0,543 | 5,251±0,127 | 1,25 | 0,11 |
| 6 | 0,753±0,007 | 5,815±0,074 | 6,009±0,235 | 5,819±0,504 | «0»* | «0» |
| 7 | 0,802±0,008 | 5,448±0,127 | 5,639±0,154 | 5,085±0,496 | «0»* | 0,12 |
| Примечания: 1 «0»* - коэффициент стимуляции меньше значимого уровня;2 «0» - коэффициент лейколизиса отрицательный |
1. Способ аллергодиагностики, включающий выделение нейтрофильных лейкоцитов, формирование иммунных комплексов и измерение уровней хемилюминесценции, отличающийся тем, что нейтрофильные лейкоциты выделяют путем наслаивания плазмы крови на разделяющую жидкость и центрифугирования 15 мин при 1500 об/мин, фракцию нейтрофилов выделяют из среднего слоя, ресуспендируют и отмывают средой Хенкса, концентрацию нейтрофильных лейкоцитов раствором Хенкса доводят до 4·106-6·106 кл/мл, формирование иммунных комплексов проводят путем смешивания равных количеств исследуемой сыворотки крови и антигена, приготовленного на физиологическом растворе, инкубируют 40 мин при 37°С, измеряют фоновую люминесценцию среды инкубации (А), состоящей из 0,7-0,9 мл раствора Хенкса и 0,1 мл 0,1-0,5 мМ раствора люминола, добавляют 0,1 мл суспензии нейтрофилов, инкубируют 5 мин и измеряют уровень спонтанной хемилюминесценции (Б) в промежутке времени 5-40 мин с м