Способ получения 4-аминодифениламина и его промежуточных соединений
Иллюстрации
Показать всеИзобретение относится к способам получения 4-аминодифениламина, его промежуточных соединений 4-нитродифениламино и/или 4-нитрозодифениламино или алкилированного производного 4-аминодифениламина. Способы включают стадии: а) взаимодействие анилина или его производного и нитробензола в закрытой зоне в присутствии смеси, включающей основание и оксидант, содержащий перекись водорода в количестве от приблизительно 0,01 до приблизительно 0,60 моль перекиси водорода, приходящихся на число молей нитробензола, для получения, по крайней мере, одного промежуточного соединения 4-аминодифениламина; указанные оксидант и нитробензол подают одновременно в указанную закрытую зону, удаляя воду и анилин кипячением; и b) восстановление промежуточного соединения до 4-аминодифениламина; и с) необязательное гидроалкилирование 4-аминодифениламина до получения алкилированного производного 4-аминодифениламина. 2 н. и 8 з.п. ф-лы, 14 табл., 5 ил.
Реферат
Настоящее изобретение относится к способу получения промежуточных соединений 4-аминодифениламина и алкилированных производных 4-аминодифениламина.
4-Аминодифениламины широко используют в качестве промежуточных соединений при производстве алкилированных производных, которые используют в качестве антиозонантов и антиоксидантов, в качестве стабилизаторов мономеров и полимеров, а также в многообразных специальных применениях. Например, при гидроалкилировании 4-аминодифениламина (4-ADPA) метилизобутилкетоном получают N-(1,3-диметилбутил)-N'-фенил-п-фенилендиамин, который используют как антиозонант для защиты разнообразных продуктов на основе каучуков.
Производные 4-аминодифениламина могут быть получены различными способами. Наиболее интересным синтезом является реакция необязательно замещенного анилина с необязательно замещенным нитробензолом в присутствии основания, который раскрыт, например, в патенте США 5608111 (Stern et al.) и патенте США 5739403 (Reinartz et al.). В патенте США 5608111 описывается способ получения необязательно замещенного 4-ADPA, в котором на первой стадии необязательно замещенный анилин и необязательно замещенный нитробензол, в присутствии основания, вступают в реакцию (сопряженную). В демонстративных примерах анилин и нитробензол взаимодействуют в присутствии гидроксида тетраметиламмония в качестве основания, а воду и анилин удаляют в виде азеотропной смеси в процессе реакции сочетания.
Международная публикация WO 00/35853 раскрывает способ получения промежуточных соединений 4-аминодифениламина посредством реакции анилина с нитробензолом в жидкой среде, где реакционная система состоит из раствора солей истинных цвиттерионов с гидроксидами. Примером служит комбинация гидроксида калия и бетаингидрата. Реакция может происходить в присутствии свободного кислорода.
Публикация ЕР 566783 раскрывает способ получения 4-нитродифениламина взаимодействием нитробензола с анилином в среде полярного апротонного растворителя в сильнощелочной реакционной системе. В данном способе используют межфазный катализатор, такой как гидросульфат тетрабутиламмония. Как требуется в указанной ссылке, эту реакцию необходимо проводить в атмосфере, в которой отсутствует кислород, чтобы предотвратить нежелаемые побочные реакции, вызываемые окислением.
В патенте США N 5117063 и международной публикации WO 01/14312 описываются способы получения 4-нитродифениламина и 4-нитрозодифениламина, при использовании различных оснований, включая гидроксиды тетраалкиламмония, используемые сами по себе, или неорганическое основание, используемое совместно с краун-эфиром в качестве межфазного катализатора. Описано использование аэробных условий, в том числе и на примерах. В меньшей степени упоминают азобензол в реакциях, протекающих в анаэробных условиях и использующих анилин в качестве растворителя, или применение аэробных условий при использовании в качестве растворителя ДМСО и других аналогичных растворителей.
В патенте США N 5612483 описывается способ получения нитрозамещенных ариламинов, в том числе и 4-нитродифениламина, включающий взаимодействие ариламина с нитроариламином, в присутствии оснований, при введении кислорода в полярные растворители. Патент констатирует, что реакции приводят к хорошим выходам соответствующих аминов при использовании простых оснований, предпочтительно, неорганических оснований.
Патент США N 6140538 раскрывает способ получения необязательно замещенного 4-аминодифениламина, включающий взаимодействие необязательно замещенного анилина и необязательно замещенного нитробензола, в присутствии воды и основания, при контроле содержания воды, гарантирующем, что молярное соотношение воды и загружаемого основания составляет не менее чем приблизительно 4:1 при начале реакции сочетания, и не менее чем приблизительно 0,6:1, в конце реакции сочетания, приводящей к получению 4-нитродифениламина и/или 4-нитрозодифениламина и/или их солей. За реакцией сочетания следует реакция гидрирования, где продукт реакции сочетания гидрируют в присутствии катализатора гидрирования и добавляемой воды, таким образом, чтобы гарантировать, что по окончании гидрирования молярное соотношение суммарной воды и основания составляло, по крайней мере, приблизительно 4:1. Получают водную и органическую фазы и необязательно замещенный 4-аминодифениламин регенерируют из органической фазы, а водную фазу, содержащую основание, повторно используют.
В патенте США 6395933 описывается способ получения одного или нескольких промежуточных продуктов 4-аминодифениламина, включающий стадии приведения в химически активный контакт анилина или производного анилина и нитробензола и взаимодействие анилина и нитробензола в закрытой зоне при соответствующих времени и температуре, в присутствии смеси, содержащей сильное основание, пригодный межфазный катализатор и оксидант. Некоторые межфазные катализаторы, такие как гидроксиды тетраалкиламмония, могут также выполнять функцию сильного основания. Приведены примеры, которые показывают увеличение селективности реакций в присутствии воздуха или перекиси водорода, при использовании КОН в качестве сильного основания и хлорида тетраметиламмония в качестве межфазного катализатора. Пример с перекисью водорода не обозначает оптимального количества перекиси при изменении мольного соотношения, H2O2/NB, от 0 до 1,0, тогда как с возрастанием мольного соотношения степень превращения устойчиво падает. Отсутствовали примеры оксиданта с межфазными катализаторами, который также выполняет функцию сильного основания.
Целью настоящего изобретения является предоставление наилучшего способа получения одного или нескольких промежуточных соединений 4-ADPA взаимодействием анилина и нитробензола, в присутствии сильного органического основания, или его эквивалента, и оксиданта, содержащего перекись водорода.
В итоге, основной вариант осуществления настоящего изобретения касается способа получения 4-аминодифениламина, содержащего нижеследующие стадии:
а) взаимодействие в закрытой зоне анилина или его производного и нитробензола в присутствии смеси, содержащей основание и оксидант, содержащий перекись водорода в количестве от приблизительно 0,01 до приблизительно 0,60 моль перекиси водорода, приходящихся на число молей нитробензола, для получения, по крайней мере, одного промежуточного соединения 4-аминодифениламина; и
b) восстановление промежуточного соединения до 4-аминодифениламина, и
c) необязательное, гидроалкилирование 4-аминодифениламина до алкилированного производного 4-аминодифениламина.
Следующий вариант осуществления изобретения относится к способу получения промежуточного соединения 4-аминодифениламина, включающему стадию взаимодействия анилина или его производного и нитробензола в закрытой зоне, в присутствии смеси, содержащей основание и оксидант, включающий перекись водорода в количестве от приблизительно 0,01 до приблизительно 0,60 моль перекиси водорода на число молей нитробензола.
В других вариантах осуществления настоящего изобретения заключаются данные о реакционных смесях, соотношениях компонентов, отдельных сильных органических основаниях и условиях реакции, все они раскрыты далее в нижеследующем обсуждении каждой из граней настоящего изобретения.
Настоящее изобретение направлено на способ получения промежуточных соединений 4-ADPA, как описано выше, который обладает наилучшей селективностью и дает наилучший выход данных промежуточных соединений. Такие промежуточные соединения включают 4-нитрозо-и/или 4-нитродифениламины (p-NDPA и 4-NDPA, соответственно) и их соли. Промежуточные соединения затем могут быть подвергнуты гидрированию с получением 4-аминодифениламина.
Хотя анилин наиболее эффективно соединяется с нитробензолом, отдельные производные анилина, включающие такие амиды, как форманилид, фенилмочевина и карбанилид, а также тиокарбанилид или их смеси, могут заменять анилин или использоваться совместно с анилином для получения промежуточных соединений 4-ADPA.
Хотя реагенты в способе по изобретению обозначают как "анилин" и "нитробензол" и, в случае получения 4-ADPA, эти реагенты в действительности являются анилином и нитробензолом, понятно, что такие реагенты могут также включать замещенный анилин и замещенный нитробензол. Типичные примеры замещенных анилинов, которые могут быть использованы согласно способу по настоящему изобретению, включают, в числе прочих, 2-метоксианилин, 4-метоксианилин, 4-хлоранилин, п-толуидин, 4-нитроанилин, 3-броманилин, 3-бром-4-аминотолуол, п-аминобензойную кислоту, 2,4-диаминотолуол, 2,5-дихлоранилин, 1,4-фенилендиамин, 4,4'-метилендианилин, 1,3,5-триаминобензол и их смеси. Типичные примеры замещенных нитробензолов, которые могут быть использованы согласно способу по настоящему изобретению, включают, в числе прочих, о- и м-метилнитробензол, о- и м-этилнитробензол, о- и м-метоксинитробензол и их смеси.
Молярное соотношение анилина и нитробензола в способе по настоящему изобретению не является особенно существенным, способ будет эффективен при избытке любого из них.
В способе по изобретению перекись водорода могут подавать в виде водного раствора, содержащего от приблизительно 3 мас.% до приблизительно 50 мас.% перекиси водорода.
Промежуточные соединения по изобретению могут быть восстановлены для получения 4-аминодифениламина. Восстановление может быть выполнено любым известным способом, включая использование водорода, что подразумевает использование катализатора гидрирования. Подробности, касающиеся выбора катализатора и других сторон реакции гидрирования, таких как добавление воды, можно найти в патенте США 6140538. Конечные точки гидрирования можно определить по времени протекания реакции и/или по профилю расхода водорода и/или посредством одной из разнообразных инструментальных методик, которые известны специалисту в данной области. Другие способы восстановления, которые не включают непосредственного использования водорода и известны специалисту в данной области, также могут быть использованы для восстановления промежуточных соединений 4-ADPA или их замещенных производных до 4-ADPA или его замещенных производных.
Полученный 4-аминодифениламин может быть подвергнут гидроалкилированию до получения алкилированного производного 4-аминодифениламина, который используют для защиты продуктов на основе каучука; в этом способе необязательно замещенный анилин и необязательно замещенный нитробензол сочетают, затем восстанавливают согласно способу по изобретению, после чего таким образом полученный 4-аминодифениламин подвергают гидроалкилированию согласно способам, известным специалисту в данной области техники, до получения алкилированного производного 4-аминодифениламина. Обычно 4-ADPA и соответствующий кетон, или альдегид, взаимодействуют в присутствии водорода и платины на углеродном носителе, используемой в качестве катализатора. Конечные точки гидрирования можно определить по времени протекания реакции и/или по профилю расхода водорода, и/или с помощью одной из многообразных инструментальных методик, которые известны специалисту в данной области. Пригодные кетоны включают метилизобутилкетон, ацетон, метилизоамилкетон и 2-октанон. Смотри, например, патент США 4463191, внесенный в настоящий документ в виде ссылки, и Banerjee et al., J. Chem. Soc. Chem. Comm. 18, 1275-1276 (1988). Пригодные катализаторы могут быть, в числе прочих, такими же, как те, которые были описаны выше для получения 4-ADPA.
Перекись водорода представляет собой оксидант, превосходящий воздух, так как количество воздуха, необходимое для получения значительного увеличения селективности, привело бы к сильным перегрузкам любой экономичной компрессорной системы, выпускаемой промышленностью, что привело бы к большим потерям органических соединений через компрессорное устройство. Более того, несмотря на то, что чистый кислород был бы более эффективен, чем воздух, использование чистого кислорода создает небезопасную реакционную среду. В дополнение, перекись водорода не требует иного растворителя, кроме избыточного количества анилина.
Оксидант может быть введен в закрытую зону после начала введения нитробензола в закрытую зону, или введение оксиданта в закрытую зону может быть закончено до окончания введения нитробензола в закрытую зону, или можно использовать оба варианта.
Нитробензол и анилин взаимодействуют с образованием Meisenheimer комплекса, и оптимально, если оксидант вводят в закрытую зону в той точке, где концентрация указанного Meisenheimer комплекса максимальна. Оксидант могут подавать с регулируемой скоростью, такой чтобы оптимально соответствовала кинетике реакции образования и исчезновения Meisenheimer комплекса, получаемого из нитробензола и анилина. Место ввода оксиданта в закрытую зону может находиться у места ввода нитробензола или вблизи него.
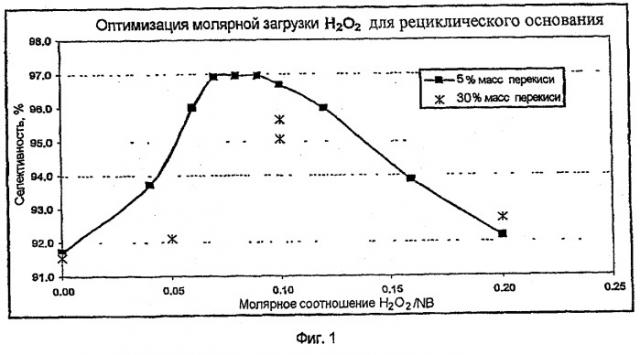
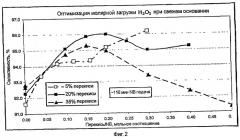
Сочетание анилина с нитробензолом в присутствии основания происходит через образование Meisenheimer комплекса, который претерпевает внутримолекулярное окисление до соли p-NODPA и межмолекулярное окисление нитробензолом и некоторыми примесями, появляющимися в ходе процесса, до соли 4-NDPA. Перекись улучшает селективность, окисляя комплекс быстрее чем это делают нитробензол и примеси, и преимущественно окисляя комплекс, а не анилин. Таким образом, любой технологический параметр, который воздействует на скорости образования и внутримолекулярного окисления Meisenheimer комплекса, такой как уровни примесей в потоках рециклического продукта, температура реакции, скорость удаления воды и скорость подачи нитробензола, будет влиять на оптимальную мольную концентрацию перекиси и эффективный диапазон ее изменения. Более того, концентрация перекиси может влиять на локальную селективность взаимодействия перекиси с Meisenheimer комплексом, по сравнению с анилином. Таким образом, хотя эффективный диапазон соотношения H2O2/NB, показанный на примере конкретной методики реакции с рециклическим основанием, составляет 0,01-0,2, а при использовании свежего основания он составляет 0,01-0,46, предусмотрена возможность подбора таких условий, при которых эффективный диапазон для соотношения H2O2/NB составляет 0,01-0,6. В дополнение, профили реакции показывают, что в начале реакции, когда уровень основания наиболее высок, нитробензол реагирует быстро, и реагирует более медленно около конца реакции, когда уровень основания наиболее низкий. Поэтому по альтернативной методике ввода перекиси подачу перекиси замедляют на старте и заканчивают рано, добавляя ее с фиксированной или переменной скоростью, в то время когда скорость реакции нитробензола находится в среднем диапазоне. Еще по одной альтернативной методике перекись добавляют на всем протяжении реакции, но в начале и в конце реакции ее добавляют более медленно. Еще по одной альтернативной методике скорость добавления перекиси меняют на всем протяжении реакции. Способ по изобретению подразумевает использование свежего основания, рециклического основания и рециклического основания, регенерированного путем электролиза, как описано в WO 2002034372, введенной в настоящий документ в виде ссылки, или посредством любой иной методики, и их смеси.
Для максимально эффективного использования перекиси водорода перекись следует подавать в реактор в том месте, где концентрация Meisenheimer комплекса, полученного из анилина и нитробензола, является максимальной. Это обеспечивает наибольшую возможность для взаимодействия перекиси с Meisenheimer комплексом, вместо анилина. Следует ожидать, что оптимальное место для ввода перекиси в реактор промышленного типа должно находиться в месте ввода нитробензола или рядом с ним, так как концентрация Meisenheimer комплекса в этом месте должна быть наибольшей. Однако, в зависимости от формы и функционирования реактора промышленного типа, оптимальное место ввода может каким-то образом меняться, и это способен определить специалист в данной области.
Главным преимуществом использования перекиси в способе по изобретению в сравнении со способом, не использующим перекиси, является значительное уменьшение количества азобензола, которое необходимо гидрировать до анилина для осуществления рециркуляции. При существующем промышленном производственном оборудовании для получения 4-ADPA это трансформируется в значительные избыточные мощности для операции регенерирования анилина (из азобензола). Эта избыточная мощность может быть использована в процессе подачи нитробензола в реактор гидрирования азобензола для производства некоторого количества анилина, который является более дорогим сырьем в способе по изобретению. Для нового производственного оборудования для получения 4-ADPA значительно уменьшенное количество азобензола может быть трансформировано в сильное уменьшение капиталовложений в систему регенерирования анилина (из азобензола). Или, наоборот, это может быть трансформировано в незначительные капиталовложения в систему, которая способна превращать как нитробензол, так и азобензол в анилин для повторного использования.
Особенно эффективные основания в способе по настоящему изобретению включают сильные органические основания, такие как четвертичные аммониевые соли, выбранные из гидроксида тетраметиламмония, гидроксида тетрабутиламмония, гидроксида метилтрибутиламмония, гидроксида бензилтриметиламмония, гидроксида трикаприлметиламмония, гидроксида цетилтриметиламмония, гидроксида холина. Вместо гидроксидов могут быть использованы эквивалентные четвертичные аммониевые соли, такие как алкоксиды, ацетаты, карбонаты, гидрокарбонаты, цианиды, фенолальдегидные смолы, фосфаты, гидрофосфаты, гипохлориты, бораты, гидробораты, дигидробораты, сульфиды, силикаты, гидросиликаты, дигидросиликаты и тригидросиликаты. Наиболее предпочтительным органическим основанием является гидроксид тетраметиламмония (ТМАН).
Промежуточные соединения могут быть восстановлены до 4-аминодифениламина, и основание может быть возвращено из продуктов реакции восстановления на повторный цикл, одно или вместе с приготовленными, согласно стандарту, количествами свежего основания, или очищенного рециклического основания, или обоих, для использования в реакции по способу данного изобретения. Точнее говоря, промежуточные соединения могут быть восстановлены до получения 4-аминодифениламина, и основание в продуктах реакции восстановления может быть подвергнуто очистке, для удаления некоторых или всех примесей четвертичной аммониевой соли, образованных в реакции сочетания способа по данному изобретению и в реакции восстановления. Очищенное основание может быть возвращено на повторный цикл как единственное основание, так и в комбинации с неочищенным рециклическим основанием и/или вместе с приготовленными, согласно стандарту, количествами свежего основания.
Химически активный контакт в способе по изобретению осуществляют в присутствии оксиданта, содержащего перекись водорода. Когда органическим основанием является гидроксид тетраметиламмония, перекись водорода могут подавать в виде водного раствора, содержащего от приблизительно 3 мас.% до приблизительно 50 мас.% перекиси водорода, или, более предпочтительно, в виде водного раствора, содержащего от приблизительно 3 мас.% до приблизительно 7 мас.% перекиси водорода в количестве от приблизительно 0,01 до приблизительно 0,5 моль перекиси водорода по отношению к числу молей нитробензола. Более предпочтительно, когда перекись водорода подают в виде водного раствора, содержащего от приблизительно 15 мас.% до приблизительно 25 мас.% перекиси водорода, в количестве от приблизительно 0,01 до приблизительно 0,45 моль перекиси водорода по отношению к числу молей нитробензола. Наиболее предпочтительно, когда перекись водорода подают в виде водного раствора, содержащего от приблизительно 25 мас.% до приблизительно 40 мас.% перекиси водорода, в количестве от приблизительно 0,01 до приблизительно 0,35 моль перекиси водорода по отношению к числу молей нитробензола.
Органическое основание, в частности гидроксид тетраметиламмония, может быть возвращено из продуктов реакции восстановления на повторный цикл, само по себе или вместе с приготовленными, согласно стандарту, количествами свежего основания, или вместе с очищенным рециклическим основанием, или вместе с обоими, для использования в реакции по указанному способу. Перекись водорода может затем быть подана в виде водного раствора, содержащего от приблизительно 20 мас.% до приблизительно 40 мас.% перекиси водорода, в количестве от приблизительно 0,01 до приблизительно 0,25 моль перекиси водорода по отношению к числу молей нитробензола, или, более предпочтительно, где перекись водорода предусмотрена в количестве от приблизительно 0,06 до приблизительно 0,21 моль перекиси водорода, по отношению к числу молей нитробензола, или, еще более предпочтительно, там, где перекись водорода подают в количестве от приблизительно 0,08 до приблизительно 0,17 моль перекиси водорода по отношению к числу молей нитробензола. Перекись водорода могут подавать в виде водного раствора, содержащего от приблизительно 3 мас.% до приблизительно 7 мас.% перекиси водорода, в количестве от приблизительно 0,01 до приблизительно 0,20 моль перекиси водорода по отношению к числу молей нитробензола, предпочтительно, от приблизительно 0,03 до приблизительно 0,16 моль перекиси водорода по отношению к числу молей нитробензола или, еще более предпочтительно, там, где перекись водорода подают в количестве от приблизительно 0,06 до приблизительно 0,12 моль перекиси водорода по отношению к числу молей нитробензола. Аналогичные эффективные диапазоны мольных соотношений специалисты в данной области могут определить для других концентраций перекиси водорода, в интервале от 3 мас.% до 50 мас.% Кроме того, возможно получить эквивалентную селективность, используя меньшее количество перекиси водорода при любой концентрации перекиси, содержащейся в настоящем документе, путем подачи перекиси, в течение только части времени подачи нитробензола, или меняя скорость подачи перекиси, или используя оба этих фактора.
Очищенное рециклическое основание может быть использовано как единственное основание или вместе с приготовленными, согласно стандарту, количествами свежего основания, а время подачи нитробензола может составлять приблизительно 100 минут или меньше.
Химически активный контакт в реакции сочетания в способе по изобретению может быть осуществлен при температуре от приблизительно 20°С до приблизительно 125°С, предпочтительно, от приблизительно 65°С до приблизительно 95°С. Другие условия для химически активного контакта включают давление в диапазоне от приблизительно 20 мбар до приблизительно атмосферного давления. Время реакция обычно оказывается меньше, чем приблизительно 4 ч. Полезно перемешивать реакционную смесь в течение всего времени протекания реакции.
Изобретение иллюстрируют нижеследующими неограничивающими примерами.
АНАЛИТИЧЕСКИЙ ПРИМЕР
Выходы отдельных компонентов определяли наружной стандартной ВЭЖХ как среднюю величину повторных анализов. Приблизительно 0,06 граммов анализируемого вещества, аккуратно взвешивают в 50-мл мерной колбе и разбавляют буферным раствором, содержащим 39% об./об. воды, 36% об./об. ацетонитрила, 24% об./об. метанола и 1% об./об. буфера при рН 7. Раствор инжектируют через петлю объемом в 10 мкл на колонку (250×4,6 мм) для ВЭЖХ с обращенной фазой, ODS типа, фирмы Zorbax, используя насоснотрубопроводную систему с двойным градиентом и следующее градиентное элюирование, при постоянной скорости потока, составляющей 1,5 мл/мин (см. Табл. 1).
Таблица 1.
| Время, минуты | % Элюента А | % Элюента В |
| 0 | 100 | 0 |
| 25 | 25 | 75 |
| 35 | 0 | 100 |
| 37,5 | 0 | 100 |
| 38 | 100 | 0 |
| 40 | 100 | 0 |
Элюент А состоит из 75% об./об. воды, 15% об./об. ацетонитрила и 10% об./об. метанола. Элюент В состоит из 60% об./об. ацетонитрила и 40% об./об. метанола. Определение разделенных компонентов осуществляют УФ-детектором на длине волны 254 нм.
ЭКСПЕРИМЕНТАЛЬНЫЕ ПРИМЕРЫ
Экспериментальные методики описаны при описании каждого примера. Эксперименты с рециклическим основанием использовали типичные образцы, которые получали от промышленного предприятия, работающего без добавления перекиси, и для которых количественное определение содержания ТМАН (24,4 мас.% и 26,8 мас.%) проводили с помощью титрования. Рециклическое основание содержало разнообразные соли тетраметиламмония вместе с анилином и низкие уровни других органических примесей. Одной из солей является (ТМА)2СО3, которая вносит вклад в количественный анализ рециклического основания, так как ее первый эквивалент титруют вместе с ТМАН.
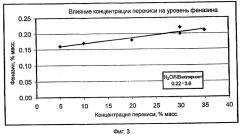
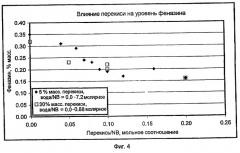
Степень превращения для примеров рассчитывали на основе количества непрореагировавшего нитробензола, остающегося в конечной массе реакции сочетания. Если нитробензол не был обнаружен, то полагали, что превращение составляет 100%. Селективность определяли по следующему молярному соотношению: (p-NDPA + 4-NDPA)/(p-NDPA + 4-NDPA + азобензол + феназин). 4-NDPA представляет собой 4-нитродифениламин, а p-NDPA является 4-нитрозодифениламином. В примерах "NB" представляет собой нитробензол, "т-Азо" является транс-азобензолом, "Фен" представляет собой феназин, а "Другой" относят к побочным продуктам сочетания анилина и нитробензола, главным образом, к 4-фенилазодифениламину, и любым неизвестным побочным продуктам.
ПРИМЕР 1
Данный пример предоставляет справочную информацию для обсуждения влияния использования перекиси водорода, в процессе реакции сочетания, в других примерах. Методика опытов 1-3 аналогична методике примера 2, исключая использование промышленного рециклического ТМАН (26,8 мас.%) и промышленного рециклического анилина, с концентрированием и высушиванием основания при давлении 62 торр и проведением реакции при давлении 60 торр. Методика опытов 4-6 состоит в загрузке 145,28 г свежего анилина (1,56 моль) и 87,36 г предварительно сгущенного свежего водного раствора ТМАН (36,0 мас.%, 0,345 моль ТМАН) в 500-мл круглодонную колбу, оборудованную термопарой, нагревающей оболочкой, расположенными подповерхностно трубками подачи нитробензола и перекиси или воды и тефлоновой лопастной мешалкой. При давлении 70 торр смесь нагревают до удаления 18 мл воды вместе с анилином (около 30 мин) и затем начинают подачу нитробензола (36,93 г, 0,30 моль). Температура поднимается в течение времени протекания реакции от приблизительно 66-67°С до 80°С, тогда как вода и анилин выкипают. Таблица 2 приводит времена подачи нитробензола и проведения реакции для всех шести опытах. Вода и анилин выкипают в течение реакции. Порции для опытов 4-6 гасят 20 мл воды после периода реакции. Загрузка перекиси водорода, осуществляемая одновременно с загрузкой нитробензола, составляет 20,40 г (0,03 моль) 5 мас.% водного раствора. Так как вода может воздействовать на селективность, путем защиты ТМАН от разложения и сдвига равновесия реакции, воду подают одновременно с нитробензолом для возможности непосредственного сравнения с перекисью.
Пример иллюстрирует то, что как более короткое время подачи нитробензола, так и добавление воды могут увеличить селективность, хотя вода, вследствие более длительного времени подачи, не является очень эффективной. Однако перекись приводила к наиболее высокой селективности, которая оказывалась на 1,9% выше, чем при добавлении воды. Более существенно для промышленного способа, который включает повторные циклы и удаление отходов, то, что водная перекись значительно понижает, в сравнении с одной водой, уровни двух ключевых побочных продуктов, а именно, азобензола (на 39%) и феназина (на 36%). Повторение основных опытов по слегка измененной методике приводило к селективностям, составляющим 92,7% и 92,6%, что указывает на очень хорошую воспроизводимость приведенных здесь экспериментальных результатов. Более того, повторения указывают на то, что незначительные различия в селективности, такие как увеличение селективности на 1,9% при использовании перекиси по сравнению с использованием воды действительно существенны.
| Таблица 2Накопленные данные для сравнения с перекисью водорода | ||||||||
| Добавка | Время (мин) | Превр. (%) | Селек. (%) | Состав порции продукта (мас.%) | ||||
| Подачи | Реакции | p-NDPA | 4-NDPA | т-Азо | Фен | |||
| 1. ничего | 110 | 20 | -99 | 91,5 | 25,36 | 2,30 | 2,01 | 0,32 |
| 2. Вода1 | 110 | 20 | -99 | 91,9 | 26,24 | 2,30 | 2,01 | 0,29 |
| 3. Вода2 | 110 | 20 | -98 | 91,5 | 25,91 | 2,45 | 2,14 | 0,25 |
| 4. ничего | 80 | 40 | 100,0 | 94,0 | 26,61 | 2,32 | 1,31 | 0,37 |
| 5. Вода3 | 80 | 40 | 100,0 | 95,3 | 30,11 | 2,02 | 1, 04 | 0,39 |
| 6. Перекись4 | 80 | 40 | 100,0 | 97,2 | 31,42 | 2,42 | 0,63 | 0,25 |
1 Н2О/NB=0,56, молярное; 2Н2<Э/NB=1,9 молярное, среднее из двух порций
3 Масса загрузки воды, равная 5 мас.% массы загрузки перекиси, Н2О/NB=3,8, молярное
4 5,0 мас.% водный раствор перекиси водорода при H2O2/NB=0,10
ПРИМЕР 2
Некоторые опыты в нижеследующих примерах имеют относительно низкую степень превращения, так как способ использовал фиксированное время подачи нитробензола плюс время проведения реакции, а не удерживал состав порций до окончания реакции. Этот пример показывает влияние увеличенного времени проведения реакции на селективность.
Согласно методике в реактор в рубашке, содержащей 1:1 смесь вода/гликоль, загружают 432,85 г промышленного рециклического основания (24/4 мас.% ТМАН, 1,16 моль). Начинают перемешивание при 150 об./мин, и 92 мл воды удаляют кипячением при постоянном давлении 65 торр при начальной температуре водяной бани 72°С и повышении ее на 1°С на каждые 10 мл удаляемой воды. Затем в вакууме загружают 301,50 г (3,24 моль) свежего анилина. Продолжают удаление воды вместе с анилином при давлении 65 торр, поднимая температуру бани на 1°С на каждые 9 мл удаляемой воды, при этом непрерывно загружая 120 мл анилина из капельной воронки с боковым вентилем, регулирующим давление. После удаления 72 мл воды (всего 164 мл) начинают совместную подповерхностную подачу через перистальтический насос 123,11 г нитробензола (1,00 моль) и 27,20 г перекиси водорода (10 мас.% водный раствор, 0,08 моль), на протяжении периода в 80 минут. В течение стадии реакции непрерывно добавляют 60 мл анилина, поддерживая давление 65 торр и удаляя воду вместе с анилином кипячением. Постепенно поднимают температуру бани с шагом, составляющим 0,5°С, до достижения к моменту окончания стадии реакции температуры бани 91°С и температуры реактора 80-82°С. Снижением давления до 60 торр и увеличением температуры бани и реактора еще на 1°С инициируют далее период проведения реакции. Продолжают удаление воды вместе с анилином в течение увеличенного периода проведения реакции.
Этот пример показывает, что проведение серии превращений при низкой степени превращения до, по существу, полного превращения оказывало минимальное влияние на селективность. В примерах, следующих за этим примером, степень превращения попадает в диапазон от 73,4% до 100%. Эти результаты показывают, что изменение степени превращения от 89,3% до 99,8% снижает селективность только на 0,5%, а изменение степени превращения от 96% до 99,8% снижает селективность только на 0,2%. Поэтому низкие степени превращения, полученные в некоторых опытах нижеследующих примеров, не меняют общих выводов.
| Таблица 3Профиль порции, полученной при длительном времени проведения реакции, в присутствии перекиси | ||||||
| Время реакции (минуты) | Превращение (%) | Селек. (%) | Состав порции продукта (мас.%) | |||
| p-NDPA | 4-NDPA | т-Азо | Фен | |||
| 0 | 89,3 | 97,5 | 22,78 | 1,50 | 0,36 | 0,20 |
| 10 | 93,9 | 97,2 | 24,37 | 1,72 | 0,49 | 0,21 |
| 20 | 95,9 | 97,2 | 25,00 | 1,82 | 0,49 | 0,20 |
| 30 | 97,1 | 97,1 | 25,05 | 1,86 | 0,51 | 0,22 |
| 40 | 97,9 | 97,1 | 25,45 | 1,91 | 0,53 | 0,21 |
| 50 | 98,5 | 97,1 | 25,70 | 1,95 | 0,53 | 0,21 |
| 60 | 98,9 | 97,1 | 26,07 | 2,00 | 0,55 | 0,22 |
| 70 | 99,2 | 97,1 | 26,22 | 2,01 | 0,56 | 0,22 |
| 80 | 99,5 | 97,1 | 26,48 | 2,04 | 0,57 | 0,22 |
| 90 | 99,7 | 97,0 | 26,59 | 2,06 | 0,58 | 0,22 |
| 100 | 99,8 | 97,0 | 26,83 | 2,09 | 0,61 | 0,22 |
ПРИМЕР 3
Осуществляли дизайн экспериментов (DOE), составленных из 8 опытов, основанных на исследовании 3 показателей, где параметрами были давление, скорость подачи нитробензола и перекись. Концентрацию перекиси (5 мас.% водный раствор) и соотношение H2O2/NB (молярное соотношении 0,1) произвольно выбирали для четырех опытов, использующих перекись. В 500-мл круглодонную колбу, оборудованную нагревающей оболочкой, термопарой, подповерхностно расположенными трубками подачи нитробензола и перекиси и тефлоновой лопастной мешалкой, загружали 130,02 г рециклического основания (24,4 мас.%), которое затем концентрировали до 31 мас.%, посредством удаления 28 мл воды кипячением при давлении, указанном в таблице 4. Затем добавляли 145,28 г анилина и еще 16 мл воды удаляли вместе с анилином (всего 44 мл воды). Затем начинали подачу 36,93 г нитробензола, продолжая удалять воду и анилин кипячением. При использовании перекиси, совместно подавали 20,40 г 5 мас.% раствора перекиси и нитробензол, при соответствующей скорости подачи, для того чтобы закончить подачу нитробензола. Порции поддерживали такими, как описано ниже, затем гасили водой (20 мл). Реакции проводили на уровне 0,3 моль, при 80°С, при давлении 65 или 95 торр (подробно обозначено в проекте). Периоды проведения реакции фиксировали при 20 минутах, при подаче нитробензола в течение 110 минут и при 45 минутах, при подаче нитробензола в течение 70 минут, в обоих случаях, продолжая удалять воду и анилин кипячением.
Результаты, приведенные в таблице 4, показывают, что селективность последовательно выше, когда используют низкие уровни перекиси, и диапазон изменения селективности, при изменениях давления реакции и скорости подачи нитробензола, оказывается значительно уже (от 96,1 до 96,6%, в присутствии перекиси, по сравнению с интервалом от 89,8 до 94,8%, в отсутствии перекиси). Кроме того, в присутствии перекиси получали относительно большее количество 4-NDPA по отношению к количеству азобензола, тогда как в отсутствие перекиси получали почти эквимолярные количества. При более длительном времени подачи нитробензола, в присутствии перекиси, получали уменьшение количества 4-NDPA (на 30-40%); и во всех опытах, проходящих в присутствии перекиси, получали много меньше азобензола и феназина. Пример 1 показал, что скорость подачи нитробензола, в отсутствии перекиси, может воздействовать на селективность, и этот пример показывает, что присутствие перекиси понижает как влияние скорости подачи нитробензола, так и влияние давления реакции, что является неожиданным.
| Таблица 4Экспериментальный проект для перекиси, на основе трех показателей | ||||||||
| Опыт №№ | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| Цели проекта | ||||||||
| Скорость подачи NB (мин) | 75 | 75 | 110 | 110 | 75 | 75 | 110 | 110 |
| Давление (торр) | 95 | 65 | 95 | 65 | 95 | 65 | 95 | 65 |
| Перекись | Да | Да | Да | Да | Нет | Нет | Нет | Нет |
| Фактическая Подача NB (мин) | 74 | 76 | 113 | 111 | 73 | 74 | 115 | 112 |
| Результаты | ||||||||
| Превращение (%) | 98,1 | 99,8 | 89,6 | 96,8 | 99,7 | 100,0 | 98,9 | 100,0 |
| Селективность (%) | 96,1 | 96,4 | 96,6 | 96,5 | 94,8 | 92,8 | 94,5 | 89,8 |
| Состав порции продукта (мас.%) | ||||||||
| p-NDPA | 24,05 | 26,06 | 22,76 | 24,31 | 24,31 | 24,23 | 23,78 | 22,3 |
| 4-NDPA | 1,78 | 2,13 | 1,20 | 1,83 | 1,66 | 2,21 | 1,71 | 2,98 |
| т-Азобензол | 0,85 | 0,77 | 0,62 | 0,68 | 1,09 | 1,58 | 1,11 | 2,28 |
| Феназин | 0,12 | 0,18 | 0,14 | 0,20 | 0,21 | 0,30 | 0,25 | 0,34 |
ПРИМЕР 4
Усовершенствующий проект DOE выполняли, для того чтобы оценить 1) количество перекиси и 2) концентрацию перекиси в реакции сочетания. Метод