Способ определения функциональной активности фагоцитов
Иллюстрации
Показать всеИзобретение относится к области медицины, а именно к иммунологии, аллергологии, пульмонологии, дерматологии, микробиологии; ветеринарии, и может быть использовано для оценки пригодности хромогенного реактива - нитросинего тетразолия /НСТ/ для применения в реакции фагоцитоза при оценке иммунного статуса здорового и больного организма. Способ включает: приготовление контрольной смеси /КС/; забор крови с антикоагулянтом; приготовление смеси для исследования фагоцитоза /СИФ/ путем внесения в исследуемую пробу крови предварительно приготовленного 0,1% раствора НСТ, растворенного в 0,9% растворе натрия хлорида; инкубацию СИФ; приготовление мазков из проинкубированной СИФ с последующим определением количества формазан-положительных фагоцитов в процентах от общего количества фагоцитов и оценкой ФАФ путем сопоставления полученных значений с нормальными величинами. Для приготовления КС часть предварительно приготовленного раствора НСТ объемом не менее 0,05 мл смешивают с дрожжами Saccharomyces cerevisiae и выдерживают полученную КС в течение не менее 6 мин при температуре (20±2)°С, затем анализируют окраску КС и используют остальную часть раствора НСТ для приготовления СИФ только при наличии в КС розового окрашивания. Реализация заявленного способа позволяет повысить точность определения ФАФ на 25-33% за счет исключения возможности получения ложнозаниженных результатов, обусловленных применением образцов НСТ с утраченной способностью к восстановлению в формазан. 6 з.п. ф-лы, 8 табл.
Реферат
Изобретение относится к области медицины, а именно к иммунологии, аллергологии, пульмонологии, дерматологии, микробиологии; ветеринарии, и может быть использовано для оценки пригодности хромогенного реактива - нитросинего тетразолия /далее - "НСТ"/ для применения в реакции фагоцитоза при оценке иммунного статуса здорового и больного организма.
Известны способы определения функциональной активности фагоцитов /далее - "ФАФ"/ по результатам пробы с восстановлением НСТ - так называемого НСТ-теста [1, 2].
Так, известен способ определения ФАФ у детей в норме и при гнойно-бактериальных инфекциях [1]. Постановку НСТ-теста согласно способу-аналогу [1] осуществляют следующим образом. Приготавливают смесь для исследования фагоцитоза /далее - "СИФ"/. При этом к 0,1 мл гепаринизированной крови (взятой из пальца обследуемого лица) добавляют 0,1 мл 0,075% раствора НСТ. Инкубируют СИФ в течение 10 мин при температуре 37°С. После истечения времени инкубации фиксируют указанную смесь 50% раствором формалина, разведенного в 0,9% растворе натрия хлорида, в течение 3 мин. Центрифугируют СИФ в течение 5 мин при 750 об/мин. Надосадочную жидкость удаляют, из осадка готовят мазки. Фиксируют мазки в спирт-формалине в течение 30 с. Докрашивают ядра 0,1% раствором нейтрального красного, разведенного в 0,5% растворе хлорида натрия. Под микроскопом, пользуясь иммерсионной системой, производят подсчет 200 фагоцитов и определяют процент положительно реагирующих с НСТ клеток, в цитоплазме которых отмечается образование гранул формазана (фиолетово-синего цвета) /далее - "формазан-положительные клетки"/. ФАФ оценивают путем сопоставления полученных значений НСТ-теста с аналогичными показателями здоровых детей, которые, по данным авторов способа-аналога [1], составляют в среднем (14,4±0,68)%, варьируясь в пределах 4-33%. В результате указанного сопоставления авторами рассматриваемого способа-аналога было установлено, в частности, что при инфекционных заболеваниях имеет место значимое повышение показателей НСТ-теста.
Наиболее близким к заявленному решению по совокупности существенных признаков является способ определения ФАФ [2]. Способ, принятый за прототип, осуществляют следующим образом. Приготавливают СИФ. При этом 0,1 мл крови смешивают с 0,1 мл 0,1% раствора НСТ в 0,9% растворе натрия хлорида (0,15 М NaCl). Инкубируют СИФ в течение 20 мин при 37°С; после завершения инкубации указанную смесь тщательно перемешивают. Из содержимого пробирки, полученного после инкубирования СИФ, готовят мазки и производят микроскопию. Определяют в мазке количество формазан-положительных фагоцитов в процентах от общего количества фагоцитов. ФАФ оценивают путем сопоставления полученных значений с нормой, которая, по данным авторов способа-прототипа [2], составляет около 30%.
Однако известные способ-аналог [1] и способ-прототип [2] не позволяют получить технический результат, достигаемый при использовании заявленного способа, по следующим причинам. Результаты клинических наблюдений авторов изобретения (определение ФАФ в ходе комплексного обследования 467 детей) показали, что при постановке НСТ-теста с помощью известных способов [1, 2] в 25-33% случаев были зафиксированы результаты, не коррелирующие с данными комплексного обследования и расцененные как ложноотрицательные. Было установлено, что в указанных случаях замена используемого образца НСТ на образец, соответствующий критерию пригодности (согласно заявленному способу), приводила к получению результатов НСТ-теста, полностью подтверждавшихся результатами комплексного обследования. Таким образом, авторы заявленного способа пришли к заключению о наличии прямой связи между активностью используемого в реакции фагоцитоза образца НСТ и результатами определения ФАФ. Это предположение подтверждается следующим. Известно, что НСТ представляет собой окислительно-восстановительный индикатор, который, поступая в фагоцитирующие клетки, подвергается восстановлению до нерастворимого формазана под влиянием оксидаз свободных нуклеотидов НАД·Н и НАДФ·Н [1]. Известно, что НСТ сохраняет свою активность только при соблюдении определенных условий хранения (в темноте, в герметичной упаковке) [3]. Имеются данные о фотолабильности НСТ [4]. В ряде работ, касающихся техники применения реактива НСТ, в частности в работе [5], даны рекомендации о необходимости ежедневного приготовления заново хромогенных субстратов, содержащих НСТ. По мнению авторов предложенного способа, в образце НСТ, условия хранения которого были нарушены (тем или иным способом), происходят изменения химической структуры, препятствующие превращению НСТ в гранулы формазана под влиянием соответствующих ферментов (НАД·Н и НАДФ·Н). Это, в свою очередь, препятствует достоверной оценке ФАФ с помощью НСТ-текста. Таким образом, отсутствие предварительной оценки пригодности образца НСТ для применения в реакции фагоцитоза приводит к снижению точности определения ФАФ за счет невозможности получения достоверных результатов НСТ-теста при использовании образцов НСТ с утраченной способностью к образованию восстановленной формы.
Задачей изобретения является создание способа определения ФАФ, обеспечивающего возможность предварительной оценки способности НСТ к химическому превращению в формазан под влиянием окислительно-восстановительных ферментов за счет использования тест-культуры клеток, структурно-функциональные особенности мембран и поверхностных слоев цитоплазмы которых способствуют проявлению макроскопически различимой окраски при положительном результате реакции восстановления НСТ в формазан.
Поставленная задача решается тем, что в способе определения ФАФ, включающем забор крови с антикоагулянтом, приготовление СИФ путем внесения в исследуемую пробу крови предварительно приготовленного 0,1% раствора НСТ, растворенного в 0,9% растворе натрия хлорида, инкубацию СИФ, приготовление мазков из проинкубированной СИФ с последующим определением количества формазан-положительных фагоцитов в процентах от общего количества фагоцитов и оценкой ФАФ путем сопоставления полученных значений с нормальными величинами, согласно изобретению перед приготовлением СИФ готовят контрольную смесь /далее - "КС"/. Для этого часть предварительно приготовленного раствора НСТ объемом не менее 0,05 мл смешивают с дрожжами Saccharomyces cerevisiae и выдерживают полученную КС в течение не менее 6 мин при температуре (20±2)°С. Затем анализируют окраску КС и используют остальную часть раствора НСТ для приготовления СИФ только при наличии в КС розового окрашивания. Наиболее эффективно смешивать с дрожжами Saccharomyces cerevisiae часть предварительно приготовленного раствора НСТ объемом 0,05-0,1 мл. При использовании для приготовления КС дрожжей Saccharomyces cerevisiae в сухом виде оптимальным является смешивать их с раствором НСТ в концентрации 50-250 мг дрожжей/мл раствора НСТ, а при использовании указанных дрожжей в виде взвеси - в концентрации (2,5-12,5)×108 клеток дрожжей/мл раствора НСТ /далее - "рабочая концентрация КС"/. Наиболее эффективным является выдерживание полученной КС в течение 6-10 мин. Кроме того, эффективно дополнительно центрифугировать СИФ, например в течение 5 мин при 750 об/мин, и готовить мазки из полученного после центрифигирования осадка.
Для выбора и обоснования оптимальных значений причинно-значимых параметров заявленного способа, при которых достигается наибольшая эффективность функционирования предложенного критерия пригодности НСТ для использования в ходе постановки НСТ-теста /далее - "предложенный критерий пригодности"/, были проведены двухэтапные испытания. На первом этапе оценивалась путем визуального анализа КС качественная составляющая предложенного критерия пригодности - наличие розового окрашивания КС /далее - "проверка на соответствие"/. На втором этапе подтверждалась достоверность критерия пригодности путем выявления корреляции между оцениваемой визуально качественной составляющей указанного критерия и оцениваемой клинико-лабораторными методами количественной составляющей данного критерия (подтвержденные значения показателя ФАФ).
В ходе испытаний было поставлено четыре серии опытов, в которых были исследованы 19 образцов НСТ, полученных из разных источников, хранившихся при различных условиях в течение различных сроков. В каждой из серий опытов использовались образцы с однотипными условиями и сроками хранения:
I серия опытов - образцы НСТ из партий, полученных перед испытаниями; без явных нарушений упаковки (10 образцов);
II серия опытов - образцы НСТ из тех же партий, что и в I серии опытов, прошедшие проверку на соответствие предложенному критерию пригодности с положительным результатом, хранившиеся (после проведения проверки на соответствие) на свету в течение 7 суток (3 образца);
III серия опытов - образцы НСТ из тех же партий, что и в I серии опытов, прошедшие проверку на соответствие предложенному критерию пригодности с положительным результатом, хранившиеся (после проведения проверки на соответствие) в упаковке с нарушенной герметичностью в течение 30 суток (3 образца);
IV серия опытов - образцы НСТ из разных партий, хранившиеся в лаборатории, где проводились испытания, свыше 10 лет; без явных нарушений упаковки (3 образца).
Испытания проводили в иммунологической лаборатории Детской городской больницы №1 Санкт-Петербурга /далее - "ДГБ №1"/. Визуальный анализ КС на первом этапе испытаний осуществляли с использованием метода экспертной оценки. В испытаниях первого этапа принимали участие 60 лабораторных работников в возрасте от 18 до 75 лет, из них 36 человек - со 100% зрением; 15 чел. - с близорукостью (-2)-(-8)Д; 9 чел. - с дальнозоркостью (+2)-(+6) Д /далее - "эксперты"/. Каждому из экспертов предлагалось охарактеризовать визуально различимую окраску КС, приготовленной согласно заявленному способу с использованием каждого из исследуемых образцов НСТ (каждой из серий). В соответствии с заявленным способом считали, что исследуемый образец НСТ соответствует предложенному критерию пригодности при определении цвета КС данного образца НСТ как "розовая". При этом оценку цвета исследуемой КС считали адекватной, если результаты оценки совпадали у 100% экспертов /далее - "адекватная экспертная оценка цвета КС"/.
В ходе испытаний первого этапа с помощью визуального анализа КС, приготовленной согласно заявленному способу с использованием каждого из исследуемых образцов НСТ:
- устанавливался факт наличия или отсутствия розового окрашивания КС каждого конкретного образца НСТ /далее также, соответственно, - "положительный или отрицательный результат визуального анализа"/ в условиях гарантированной адекватной экспертной оценки цвета КС;
- для всех образцов НСТ, для которых был получен положительный результат визуального анализа /далее также - "образцы НСТ, соответствующие предложенному критерию пригодности", "позитивные образцы НСТ" "ПО НСТ"/, исследовалась визуальная различимость розовой окраски КС каждого из указанных образцов НСТ при различных значениях заявленных параметров, и по суммарным результатам исследований определялись интервалы оптимальных значений указанных параметров.
При этом под гарантированной адекватной экспертной оценкой понимали оценку цвета КС каждого конкретного позитивного образца НСТ при концентрации дрожжей Saccharomyces cerevisiae 250 мг дрожжей/мл раствора НСТ - при использовании дрожжей в сухом виде или 12,5×108 клеток дрожжей/мл раствора НСТ - при использовании дрожжей в виде взвеси при объеме вносимого раствора НСТ 0,1 мл и времени выдерживания КС 10 мин при температуре 22°С (верхние граничные значения интервалов оптимальных значений данных параметров). Визуальную различимость розовой окраски КС позитивных образцов НСТ исследовали в условиях варьирования концентрации дрожжей при постоянном (оптимальном) объеме вносимого раствора НСТ и постоянном (оптимальном) времени выдерживания КС при температуре 20°С; в условиях варьирования объема вносимого раствора НСТ при постоянной (оптимальной) концентрации дрожжей и постоянном (оптимальном) времени выдерживания КС при температуре 20°С и в условиях варьирования времени выдерживания КС при температуре 20°С при постоянной (оптимальной) концентрации дрожжей и постоянном (оптимальном) объеме вносимого раствора НСТ. Кроме того, в условиях варьирования температуры и времени выдерживания КС при каждой из температур исследуемого диапазона при постоянной (оптимальной) концентрации дрожжей и постоянном (оптимальном) объеме вносимого раствора НСТ для каждого позитивного образца НСТ фиксировали время появления розового окрашивания КС данного образца, исследовали его визуальную различимость, а также возможность адекватной экспертной оценки цвета КС.
Для постановки экспериментов первого и второго этапов испытаний предварительно готовили 0,1% раствор каждого из исследуемых образцов НСТ, растворенного в 0,9% растворе натрия хлорида. На первом этапе часть предварительно приготовленного раствора каждого из образцов НСТ использовали для приготовления КС по десяти вариантам, указанным ниже (остальную часть указанного раствора использовали для приготовления СИФ на втором этапе испытаний). Каждый из вариантов приготавливали, базируясь на методике заявленного способа, с учетом конкретных количественных значений постоянных и переменных параметров, задаваемых условиями постановки эксперимента в каждом из вариантов /далее, также - "опытные пробы"/:
| вариант 1: | дрожжи Saccharomyces cerevisiae в сухом виде; концентрация КС 250 мг дрожжей/мл раствора НСТ при объеме вносимого раствора НСТ 0,1 мл; |
| время выдерживания КС 10 мин при 22°С; | |
| вариант 2: | дрожжи Saccharomyces cerevisiae в виде взвеси; оконцентрация КС 12,5×108 клеток дрожжей/мл раствора НСТ при объеме вносимого раствора НСТ 0,1 мл; |
| время выдерживания КС 10 мин при 22°С; | |
| вариант 3: | дрожжи Saccharomyces cerevisiae в сухом виде; варьирование концентраций КС в пределах 5-300 мг дрожжей/мл раствора НСТ (с инкриментом 5 мг дрожжей/мл раствора НСТ) при постоянном объеме вносимого раствора НСТ 0,1 мл;время выдерживания КС 8 мин при 20°С; |
| вариант 4: | дрожжи Saccharomyces cerevisiae в виде взвеси; варьирование концентраций КС в пределах (0,25÷15)×108 клеток дрожжей/мл раствора НСТ (с инкриментом 0,25×10 клеток дрожжей/мл раствора НСТ) при постоянном объеме вносимого раствора НСТ 0,1 мл; |
| время выдерживания КС 8 мин при 20°С; | |
| вариант 5: | дрожжи Saccharomyces cerevisiae в сухом виде; варьирование объема вносимого раствора НСТ в пределах 0,01÷0,2 мл (с инкриментом 0,025 мл) при постоянной концентрации дрожжей 150 мг дрожжей/мл раствора НСТ; |
| время выдерживания КС 8 мин при 20°С; | |
| вариант 6: | дрожжи Saccharomyces cerevisiae в виде взвеси; варьирование объема вносимого раствора НСТ в пределах 0,01÷0,2 мл (с инкриментом 0,025 мл) при постоянной концентрации дрожжей 7,5×108 клеток дрожжей/мл раствора НСТ;время выдерживания КС 8 мин при 20°С; |
| вариант 7: | дрожжи Saccharomyces cerevisiae в сухом виде; варьирование времени выдерживания КС в пределах 1-15 мин (с инкриментом 1 мин) при 20°С при постоянной концентрации дрожжей 150 мг дрожжей/мл раствора НСТ и при постоянном объеме вносимого раствора НСТ 0,1 мл; |
| вариант 8: | дрожжи Saccharomyces cerevisiae в виде взвеси; варьирование времени выдерживания КС в пределах 1÷15 мин (с инкриментом 1 мин) при 20°С; при постоянной концентрации дрожжей 7,5×108 клеток дрожжей/мл раствора НСТ и при постоянном объеме вносимого раствора НСТ 0,1 мл; |
| вариант 9: | дрожжи Saccharomyces cerevisiae в сухом виде; варьирование температуры, при которой выдерживалась КС, в пределах 2÷37°С (с инкриментом 2°С; в области предполагаемого интервала оптимальных значений и в области верхних граничных значений исследуемого диапазона - 1°С), при варьировании времени выдерживания КС при каждой из температур исследуемого диапазона в пределах 1÷15 мин (с инкриментом 1 мин) при постоянной концентрации дрожжей 150 мг дрожжей/мл раствора НСТ и при постоянном объеме вносимого раствора НСТ 0,1 мл; |
| вариант 10: | дрожжи Saccharomyces cerevisiae в виде взвеси; варьирование температуры, при которой выдерживалась КС, в пределах 2÷37°С (с инкриментом 2°С; в области предполагаемого интервала оптимальных значений и в области верхних граничных значений исследуемого диапазона - с инкриментом 1°С), при варьировании времени выдерживания КС при каждой из температур исследуемого диапазона в пределах 1÷15 мин (с инкриментом 1 мин) при постоянной концентрации дрожжей 7,5×108 клеток дрожжей/мл раствора НСТ и при постоянном объеме вносимого раствора НСТ 0,1 мл. |
Для целей визуального анализа (для предъявления экспертам) использовали прозрачные центрифужные пробирки объемом 10 мл, содержащие КС каждого из вариантов приготовления по каждому из исследуемых образцов НСТ /далее - "опытные пробирки"/. Параллельно с каждой из опытных проб в аналогичных пробирках /далее - "контрольные пробирки"/ готовили контрольные пробы. При этом в качестве исходного компонента для приготовления контрольной пробы использовали дрожжи Saccharomyces cerevisiae того же состава и в том же количестве, что и для соответствующей опытной пробы (равная навеска дрожжей или равное количество дрожжевых клеток из плотного осадка). В каждую контрольную пробирку, содержащую дрожжевые клетки, вносили 0,9% раствор натрия хлорида в объеме, равном объему раствора исследуемого образца НСТ, вносимого в соответствующую опытную пробирку. Визуальный анализ каждой из опытных проб (КС одного из исследуемых образцов НСТ соответствующего варианта приготовления) производили дважды в сравнении с соответствующей контрольной пробой: оценивали окраску содержимого опытной и контрольной пробирок непосредственно после приготовления опытной и контрольной проб и после выдерживания указанных проб в условиях, предусмотренных соответствующим вариантом приготовления КС. При постановке экспериментов, связанных с варьированием температуры, при которой выдерживались КС исследуемых образцов НСТ, использовали холодильник фармакологический марки ХФ-250 "Позис-574" (производства "Инком центр "Вариант", ЗАО, Россия /Санкт-Петербург/) и ультратермостат "УТ-15" (производства Экспериментального завода лабораторной медицинской техники, Россия /Одесса/), предусматривающие установку требуемой температуры (соответственно, выдерживания на холоду или термостатирования).
Статистическую обработку результатов экспериментов первого этапа испытаний проводили с использованием критериев Фишера и Вилкоксона-Манна-Уитни [6].
Результаты визуального анализа КС исследуемых образцов НСТ при различных значениях концентрации дрожжей, объема вносимого раствора НСТ, времени и температуры выдерживания КС выборочно приведены в табл.1-3.
| Таблица 1Соответствие исследованных образцов нитросинего тетразолия /НСТ/ предложенному критерию пригодности (наличие розового окрашивания контрольной смеси /КС/) в условиях гарантированной адекватной экспертной оценки | |||||||
| Номер серии опытов | Номер варианта приготовления КС | Общее количество исследованных образцов НСТ | Количество образцов НСТ: | ||||
| соответствующих предложенному критерию пригодности | не соответствующих предложенному критерию пригодности | ||||||
| абс.ед. | % | абс.ед | % | абс.ед | % | ||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| I | 1 | 10 | 100,0 | 8 | 80,0 | 2 | 20,0 |
| 2 | 10 | 100,0 | 8 | 80,0 | 2 | 20,0 | |
| II | 1 | 3 | 100,0 | - | - | 3 | 100,0 |
| 2 | 3 | 100,0 | - | - | 3 | 100,0 | |
| III | 1 | 3 | 100,0 | 1 | 33,3 | 2 | 66,7 |
| 2 | 3 | 100,0 | 1 | 33,3 | 2 | 66,7 | |
| IV | 1 | 3 | 100,0 | 1 | 33,3 | 2 | 66,7 |
| 2 | 3 | 100,0 | 1 | 33,3 | 2 | 66,7 |
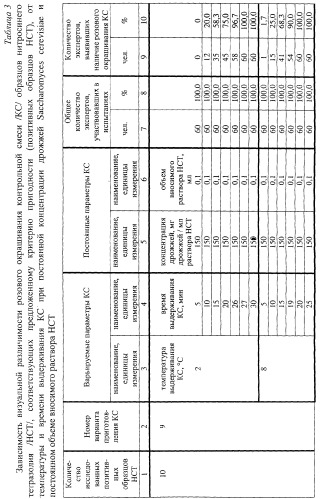
| Таблица 2Зависимость визуальной различимости розового окрашивания контрольной смеси /КС/ образцов нитросинего тетразолия /НСТ/, соответствующих предложенному критерию пригодности (позитивных образцов НСТ), от концентрации дрожжей Saccharomyces cerevisiae, объема вносимого раствора НСТ и времени выдерживания КС при температуре 20°С | ||||||||
| Количество исследованных позитивных образцов НСТ | Номер варианта приготовления КС | Варьируемый параметр КС | Постоянные параметры КС | Общее количество экспертов, участвовавших в испытаниях | Количество экспертов, выявивших наличие розового окрашивания КС | |||
| наименование, единицы измерения | наименование, единицы измерения | наименование, единицы измерения | чел. | % | чел. | % | ||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 10 | 3 | концентрация дрожжей, мг дрожжей/мл раствора НСТ | объем вносимого раствора НСТ, мл | время выдерживания КС, мин | ||||
| 5 | 0,1 | 8 | 60 | 100,0 | 13 | 21,7 | ||
| 25 | 0,1 | 8 | 60 | 100,0 | 37 | 61,7 | ||
| 45 | 0,1 | 8 | 60 | 100,0 | 49 | 81,7 | ||
| 50 | 0,1 | 8 | 60 | 100,0 | 60 | 100,0 | ||
| 150 | 0,1 | 8 | 60 | 100,0 | 60 | 100,0 | ||
| 250 | 0,1 | 8 | 60 | 100,0 | 60 | 100,0 | ||
| 255 | 0,1 | 8 | 60 | 100,0 | 50 | 83,3 | ||
| 275 | 0,1 | 8 | 60 | 100,0 | 43 | 71,7 | ||
| 300 | 0,1 | 8 | 60 | 100,0 | 25 | 41,7 |
| Продолжение табл.2 | ||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 10 | 4 | концентрация дрожжей, ×108 клеток дрожжей/мл раствора НСТ | объем вносимого раствора НСТ, мл | время выдерживания КС, мин | ||||
| 0,25 | 0,1 | 8 | 60 | 100,0 | 15 | 25,0 | ||
| 1,25 | 0,1 | 8 | 60 | 100,0 | 39 | 65,0 | ||
| 2,25 | 0,1 | 8 | 60 | 100,0 | 52 | 86,7 | ||
| 2,50 | 0,1 | 8 | 60 | 100,0 | 60 | 100,0 | ||
| 7,50 | 0,1 | 8 | 60 | 100,0 | 60 | 100,0 | ||
| 12,50 | 0,1 | 8 | 60 | 100,0 | 60 | 100,0 | ||
| 12,75 | 0,1 | 8 | 60 | 100,0 | 59 | 98,3 | ||
| 13,75 | 0,1 | 8 | 60 | 100,0 | 57 | 95,0 | ||
| 15.0 | 0,1 | 8 | 60 | 100,0 | 54 | 90,0 | ||
| 10 | 5 | объем вносимого раствора HCT, мл | концентрация дрожжей, мг дрожжей/мл раствора НСТ | время выдерживания КС, мин | ||||
| 0,01 | 150 | 8 | 60 | 100,0 | 3 | 5,0 | ||
| 0,025 | 150 | 8 | 60 | 100,0 | 27 | 45,0 | ||
| 0,05 | 150 | 8 | 60 | 100,0 | 60 | 100,0 | ||
| 0,075 | 150 | 8 | 60 | 100,0 | 60 | 100,0 | ||
| 0,10 | 150 | 8 | 60 | 100,0 | 60 | 100,0 | ||
| 0,125 | 150 | 8 | 60 | 100,0 | 60 | 100,0 | ||
| 0,15 | 150 | 8 | 60 | 100,0 | 60 | 100,0 | ||
| 0,20 | 150 | 8 | 60 | 100,0 | 60 | 100,0 |
| Продолжение табл.2 | ||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 10 | 6 | объем вносимого раствора НСТ, мл | концентрация дрожжей ×108 клеток дрожжей/мл раствора НСТ | время выдерживания КС, мин | ||||
| 0,01 | 7,50 | 8 | 60 | 100,0 | 4 | 6,7 | ||
| 0,025 | 7,50 | 8 | 60 | 100,0 | 28 | 46,7 | ||
| 0,05 | 7.50 | 8 | 60 | 100,0 | 60 | 100,0 | ||
| 0,075 | 7,50 | 8 | 60 | 100,0 | 60 | 100,0 | ||
| 0,10 | 7,50 | 8 | 60 | 100,0 | 60 | 100,0 | ||
| 0,125 | 7,50 | 8 | 60 | 100,0 | 60 | 100,0 | ||
| 0,15 | 7,50 | 8 | 60 | 100,0 | 60 | 100,0 | ||
| 0,20 | 7,50 | 8 | 60 | 100,0 | 60 | 100,0 | ||
| 10 | 7 | время выдерживания КС, мин | концентрация дрожжей, мг дрожжей/мл раствора НСТ | объем вносимого раствора НСТ, мл | ||||
| 1 | 150 | 0,1 | 60 | 100,0 | 24 | 40,0 | ||
| 3 | 150 | 0,1 | 60 | 100,0 | 44 | 73,3 | ||
| 5 | 150 | 0,1 | 60 | 100,0 | 51 | 85,0 | ||
| 6 | 150 | 0,1 | 60 | 100,0 | 60 | 100,0 | ||
| 8 | 150 | 0,1 | 60 | 100,0 | 60 | 100,0 | ||
| 10 | 150 | 0,1 | 60 | 100,0 | 60 | 100,0 | ||
| 12 | 150 | 0,1 | 60 | 100,0 | 60 | 100,0 | ||
| 15 | 150 | 0,1 | 60 | 100,0 | 60 | 100,0 |
| Окончание табл.2 | ||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 10 | 8 | время выдерживания КС, мин | концентрация дрожжей, ×108 клеток дрожжей/мл раствора НСТ | объем вносимого раствора НСТ, мл | ||||
| 1 | 7,50 | 0,1 | 60 | 100,0 | 25 | 41,7 | ||
| 3 | 7,50 | 0,1 | 60 | 100,0 | 45 | 75,0 | ||
| 5 | 7,50 | 0,1 | 60 | 100,0 | 53 | 88,3 | ||
| 6 | 7,50 | 0,1 | 60 | 100,0 | 60 | 100,0 | ||
| 8 | 7,50 | 0,1 | 60 | 100,0 | 60 | 100,0 | ||
| 10 | 7,50 | 0,1 | 60 | 100,0 | 60 | 100,0 | ||
| 12 | 7,50 | 0,1 | 60 | 100,0 | 60 | 100,0 | ||
| 15 | 7,50 | 0,1 | 60 | 100,0 | 60 | 100,0 |
Как видно из данных табл.1, предложенному критерию пригодности соответствовали: в I серии опытов - 8 образцов НСТ из 10 исследованных; в III и в IV сериях опытов - по одному образцу из трех исследованных (в каждой серии). Во II серии опытов предложенному критерию пригодности не соответствовал ни один из трех исследованных образцов НСТ. При этом идентичные результаты были получены при использовании дрожжей как в сухом виде (вариант 1), так и в виде взвеси (вариант 2). По результатам анализа образцы НСТ, исследованные в условиях I-IV серий опытов, были распределены по партиям. Образцы, соответствовавшие предложенному критерию пригодности (позитивные образцы НСТ), и образцы, не соответствовавшие предложенному критерию пригодности /далее также - "негативные образцы НСТ", "НО НСТ"/, составили, соответственно, партии: I-ПО, I-HO (I серия); II-НО (II серия); III-ПО, III-НО (III серия); IV-ПО, IV-НО (IV серия).
Данные визуального анализа (в сравнении с контрольными пробами) КС образцов НСТ (из числа исследованных), соответствовавших предложенному критерию пригодности (партии I-ПО, III-ПО, IV-ПО), в условиях варьирования концентрации дрожжей при постоянном объеме вносимого раствора НСТ (0,1 мл) и постоянном времени выдерживания проб (8 мин) при температуре 20°С (табл.2: варианты 3 и 4) показали следующее. Непосредственно после приготовления содержимое как опытных, так и контрольных пробирок представляло собой: при концентрациях менее 25 мг дрожжей/мл раствора НСТ (при использовании дрожжей в сухом виде) или менее 1,25×108 клеток дрожжей/мл раствора НСТ (при использовании дрожжей в виде взвеси) - прозрачный раствор с белесовато-мутным оттенком; при концентрациях равных или превышающих 25 мг дрожжей/мл раствора НСТ (при использовании дрожжей в сухом виде) либо равных или превышающих 1,25×108 клеток дрожжей/мл раствора НСТ (при использовании дрожжей в виде взвеси) - молочно-белый раствор. После выдерживания в указанных условиях внешний вид контрольных проб (включая окраску) оставался без изменений, тогда как в опытных пробах отмечалось наличие розового окрашивания КС различной степени выраженности. При этом при концентрациях менее 25 мг дрожжей/мл раствора НСТ или менее 1,25×108 клеток дрожжей/мл раствора НСТ визуальное определение розовой окраски КС являлось крайне затруднительным (при нижних граничных значениях исследуемых диапазонов концентраций ошибочная оценка цвета КС имела место в 75,0-78,3% случаев) из-за высокой прозрачности исследуемых КС (как показали предварительные эксперименты, при концентрациях 3 мг дрожжей/мл раствора НСТ или 0,15×108 клеток дрожжей/мл раствора НСТ выявить наличие розовой окраски удавалось 1,7-3,3% экспертов). В диапазонах концентраций 25÷45 мг дрожжей/мл раствора НСТ или (1,0-2,25)×108 клеток дрожжей/мл раствора НСТ оценку цвета исследуемых КС как розового давало от 61,7 до 86,7% экспертов. При концентрациях 50-250 мг дрожжей/мл раствора НСТ или (2,5-12,5)×108 клеток дрожжей/мл раствора НСТ имела место адекватная экспертная оценка цвета КС как розового, что обусловило выбор концентраций указанного диапазона в качестве оптимальных. Дальнейшее увеличение концентрации дрожжей (в диапазонах 255-300 мг дрожжей/мл раствора НСТ или (12,75÷15,0)×108 клеток дрожжей/мл раствора НСТ) приводило к значимому снижению процента экспертов, определявших наличие розового окрашивания КС (соответственно, 83,3-41,7% и 98,3-90,0%), что обусловливалось уменьшением интенсивности указанной окраски КС вследствие того, что значительная часть дрожжевых клеток оказывалась неокрашенной.
В ходе визуального анализа (в сравнении с контрольными пробами) позитивных образцов НСТ (из числа исследованных) при использовании в качестве варьируемого параметра объема вносимого раствора НСТ при постоянной концентрации дрожжей (150 мг дрожжей/мл раствора НСТ или 7,50×108 клеток дрожжей/мл раствора НСТ) и постоянном времени выдерживания проб (8 мин) при температуре 20°С (табл.2: варианты 5 и 6) установлено следующее. Непосредственно после приготовления содержимое как опытных, так и контрольных пробирок представляло собой мелочно-белый раствор (разной прозрачности). После выдерживания в указанных условиях: контрольные пробы - без изменений; в опытных пробах - наличие розового окрашивания КС различной степени выраженности. При этом при малых объемах вносимого раствора НСТ (0,01-0,025 мл) наблюдался относительно высокий процент ошибок при визуальной оценке цвета КС как при использовании дрожжей в сухом виде, так и в виде взвеси (соответственно, 95,0-55,0% и 93,3-53,3%), вследствие наличия в пробирке несмоченных (и, соответственно, неокрашенных) сухих дрожжей или высокой прозрачности и малого суммарного объема КС (в случае использования взвеси дрожжей). Интервал 0,05-0,1 мл вносимого объема раствора НСТ был выбран в качестве оптимального, т.к. при указанных значениях исследуемого параметра имела место адекватная экспертная оценка цвета КС как розового при оптимальном расходе дорогостоящего химического реактива - НСТ (рекомендуемый в методиках определения ФАФ расход раствора НСТ /в концентрации 0,075-0,1%/, как правило, не превышает 0,1 мл). Увеличение объема вносимого раствора НСТ свыше 0,1 мл не меняло точность визуальной оценки окраски КС (адекватная экспертная оценка розового окрашивания), однако приводило к неоправданному возрастанию расхода раствора дорогостоящего НСТ.
Визуальный анализ (в сравнении с контрольными пробами) в условиях варьирования времени выдерживания проб при температуре 20°С при постоянной концентрации дрожжей (150 мг дрожжей/мл раствора НСТ или 7,50×10 клеток дрожжей/мл раствора НСТ) и постоянном объеме (0,1 мл) вносимого раствора НСТ (табл.2: варианты 7 и 8) показал следующее. Непосредственно после приготовления содержимое как опытных, так и контрольных пробирок имело вид молочно-белого раствора. После выдерживания в указанных условиях контрольные пробы оставались без изменений. В опытных пробах отмечалось появление розового окрашивания КС, начиная с первой минуты выдерживания при относительно высоком проценте ошибочных экспертных оценок (60% - для сухих дрожжей, 58,3% - для взвеси дрожжей), который уменьшался по мере увеличения сроков инкубации, составляя при 5 мин, соответственно, 26,7% (для сухих дрожжей) и 25,0% (для взвеси дрожжей). Адекватная экспертная оценка наличия розового окрашивания КС зафиксирована, начиная со времени выдерживания 6 мин (при использовании дрожжей как в сухом виде, так и в виде взвеси). Дальнейшее увеличение указанного параметра (7-15 мин) не влияло на точность экспертной оценки. Однако увеличение срока инкубации свыше 10 мин, по мнению авторов изобретения, нецелесообразно, т.к. приводит к непроизводительным затратам рабочего времени врача и лаборанта, проводящих анализ.
Результаты визуального анализа (в сравнении с контрольными пробами) КС позитивных образцов НСТ в условиях варьирования температуры и времени выдерживания проб при каждой из температур в диапазоне варьирования при постоянной концентрации дрожжей (150 мг дрожжей/мл раствора НСТ или 7,50×108 клеток дрожжей/мл раствора НСТ) и постоянном объеме (0,1 мл) вносимого раствора НСТ (табл.3: варианты 9 и 10) позволили сделать следующие выводы. Непосредственно после приготовления содержимое как опытных, так и контрольных пробирок имело вид мелочно-белого раствора. После выдерживания в указанных условиях окраска контрольных проб визуально не изменялась. В опытных пробах наблюдалось появление розового окрашивания КС, причем при увеличении температуры инкубации до некоторой критической величины (22°С) время проявления указанного изменения цвета КС сокращалось, а интенсивность окраски - увеличивалась, что приводило к повышению точности экспертных оценок; при превышении критической температуры (начиная с 23°С) процент ошибочных оценок снова возрастал. Так, при выдерживании КС, приготовленной с использованием дрожжей как в сухом виде, так и в виде взвеси, в условиях относительно невысоких температур (в диапазоне 2÷14°С) адекватная экспертная оценка наличия розового окрашивания КС становилась возможной только при относительно длительном времени выдерживания (соответственно, 20/27/÷15 мин). Увеличение температуры до 16-17°С обеспечивало возможность адекватной экспертной оценки розового цвета КС на более ранних сроках инкубации (8-10 мин). И наконец, в интервале 18÷22°С выявление всеми экспертами (100%) наличия розового окрашивания КС имело место, начиная с 6-ой минуты (нижнее граничное значение интервала оптимальных значений температуры). Дальнейшее повышение температуры выдерживания КС (в диапазоне 23÷37°С) приводило к резкому сокращению времени появления интенсивной розовой окраски КС (начиная с 32°С наибольшая точность экспертных оценок отмечалась на 2-3-минутах инкубации), однако при этом адекватная экспертная оценка наличия указанного факта становилась невозможной из-за выраженного газообразования в исследуемых пробах - образования белой пены в объеме КС (аналогичное явление наблюдалось при указанных условиях и в контрольных пробах). Таким образом, в качестве оптимального был выбран интервал температур выдерживания КС 18÷22°С.
Сопоставительный анализ результатов визуального анализа КС позитивных образцов НСТ различных вариантов приготовления в условиях варьирования исследуемых параметров (табл.2, 3) показал, что в вариантах с использованием взвеси дрожжей при варьировании концентрации дрожжей, объема вносимого раствора НСТ и времени выдерживания КС при оптимальной температуре получены незначительно (статистически недостоверно) более высокие результаты по сравнению с вариантами, основой которых являлись сухие дрожжи. Однако в условиях варьирования температуры выдерживания КС (при использовании температур, превышающих верхнюю границу интервала оптимальных значений) при оптимальных значениях прочих параметров (концентрация дрожжей, объем вносимого раствора НСТ) меньший (статистически недостоверно) процент ошибочных экспертных оценок был зафиксирован в вариантах с применением сухих дрожжей. При оптимальных значениях заявленных параметров результаты, полученные при использовании