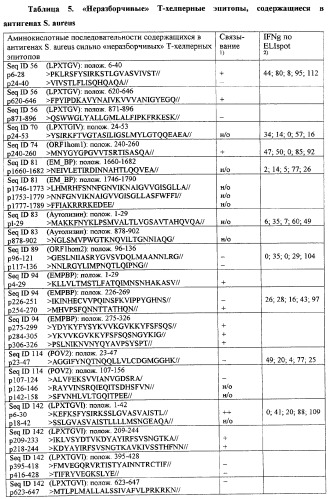
Способ идентификации, выделения и получения антигенов определенного патогена
Иллюстрации
Показать всеОписан способ идентификации, выделения и получения реагирующих с гипериммунной сывороткой антигенов из определенного патогена, причем указанные антигены подходят для применения в вакцине, предназначенной для определенного типа животных или для человека. Способ характеризуется следующими стадиями: получение препарата антител из пула плазмы данного типа животных или пула плазмы человека или индивидуальных сывороток с антителами против данного конкретного патогена; получение по меньшей мере одной экспрессионной библиотеки данного конкретного патогена; скрининг данной по меньшей мере одной экспрессионной библиотеки с помощью указанного препарата антител; идентификация антигенов, связывающихся при скрининге с антителами в препарате антител; скрининг идентифицированных антигенов с помощью индивидуальных препаратов антител из индивидуальных сывороток от лиц с антителами против данного конкретного патогена; идентификация реагирующей с гипериммунной сывороткой антигенной части идентифицированных антигенов, которые связываются с релевантной частью индивидуальных препаратов антител из индивидуальных сывороток; при необходимости выделение реагирующих с гипериммунной сывороткой антигенов и их получение химическими или рекомбинантными методами. Использование способа позволяет идентифицировать эффективные антигены данного патогена, которые могут быть использованы как предпочтительные кандидаты в антигенные вакцины. 2 н. и 18 з.п. ф-лы, 11 ил., 10 табл.
Реферат
Область техники, к которой относится изобретение
Изобретение касается способа идентификации, выделения и получения антигенов определенного патогена, а также новых антигенов, пригодных для применения в вакцине, предпочтительной для определенного вида животных или для человека.
Уровень техники
Вакцины могут спасти больше жизней (и ресурсов), чем любое другое медицинское вмешательство. Благодаря всемирным программам вакцинации резко снизилась частота многих смертельных заболеваний. Хотя это верно в отношении целого ряда заболеваний, к примеру, дифтерии, коклюша, кори и столбняка, однако не существует эффективных вакцин против многих инфекционных заболеваний, включая большинство вирусных инфекций, таких как HIV, HCV, CMV и многих других. Также не существует эффективных вакцин и против других болезней, причем не только инфекционных, которые уносят жизни миллионов больных в год, включая малярию или рак. Кроме того, быстрое появление устойчивых к антибиотикам бактерий и микроорганизмов требует альтернативных методов, из которых вакцины представляют логический выбор. Наконец, большая потребность в вакцинах также иллюстрируется тем, что именно инфекционные заболевания, а не сердечно-сосудистые, раковые или травматические повреждения остаются самой большой причиной смертности и инвалидности в мире.
Некоторые признанные вакцины состоят из живых аттенуированных организмов, у которых существует опасность реверсии к вирулентному дикому типу. В частности, при иммунодефицитных состояниях это может представлять опасность для жизни. С другой стороны, вакцины можно вводить в виде комбинации антигенов, происходящих из патогена, вместе с соединениями, индуцирующими или усиливающими иммунные ответы на эти антигены (такие соединения обычно называют адъювантами), поскольку такие субъединичные вакцины в общем не эффективны сами по себе.
Хотя несомненно, что указанные выше вакцины являются ценными средствами лечения, однако есть и недостаток, а именно то, что вследствие их сложности они могут вызывать тяжелые побочные эффекты, к примеру, на антигены, входящие в состав вакцины и проявляющие перекрестную реактивность с молекулами, которые экспрессируются в клетках вакцинируемых лиц. Кроме того, существующие правила, исходящие из контролирующих органов, к примеру, Всемирной Организации Здравоохранения (ВОЗ), Управления по контролю за продуктами и лекарствами (FDA) и их аналогов в Европе, требуют точного указания состава вакцины и механизма индукции иммунитета, что трудновыполнимо.
Некоторые распространенные вакцины представляют собой вакцины из целых клеток - аттенуированных бактерий или вирусов, например, бацилл Calmette-Guerin (БЦЖ) (против туберкулеза), вакцины против кори, свинки, краснухи, пероральная вакцина против полиомиелита (Sabin); убитых бактерий или вирусов, например, вакцина против коклюша, инактивированная вакцина против полиомиелита (Salk); субъединичные вакцины, например, из токсоида (против дифтерии, столбняка), капсульного полисахарида (Н.influenzae типа В), дрожжевой рекомбинантной субъединицы (поверхностный белок гепатита В).
Вакцина может содержать целый ряд различных антигенов. Примерами антигенов являются целые убитые организмы, такие как инактивированные вирусы или бактерии, простейшие, грибы и даже раковые клетки. Антигены также могут состоять из субклеточных фракций этих организмов/тканей, из белков или, в простейшем виде, из пептидов. Антигены могут распознаваться иммунной системой и в виде гликозилированных белков или пептидов, а также могут представлять собой или содержать полисахариды или липиды. Могут использоваться короткие пептиды, так как, например, цитотоксические Т-клетки (CTL) распознают антигены в виде коротких пептидов, обычно из 8-11 аминокислот, в сочетании с главным комплексом гистосовместимости (МНС). В-клетки могут распознавать линейные эпитопы длиной всего лишь в 4-5 аминокислот, а также 3-мерные структуры (конформационные эпитопы). Для того, чтобы вызвать продолжительный антиген-специфичный иммунный ответ, адъювант должен запустить иммунный каскад, в котором должны участвовать все клетки иммунной системы. Главным образом адъюванты действуют, не ограничиваясь этим механизмом, на так называемые антигенпрезентирующие клетки (АРС). Эти клетки обычно первыми сталкиваются с антигенами, после чего следует предъявление (презентация) процессированного либо необработанного антигена иммуноэффекторным клеткам. Могут также принимать участие промежуточные типы клеток. При продуктивном иммунном ответе активируются лишь те эффекторные клетки, которые обладают надлежащей специфичностью. Адъюванты также могут удерживать на месте антигены и другие введенные вместе с ними факторы. Кроме того, адъювант может действовать в качестве хемоаттрактанта для других иммунных клеток или оказывать местное и/или системное действие как стимулятор иммунной системы.
Антигенпрезентирующие клетки принадлежат к системе врожденного иммунитета, которая возникла как первая линия защиты организма, ограничивающая инфекцию сразу после контакта с микроорганизмами. Клетки системы врожденного иммунитета распознают шаблоны или сравнительно неспецифичные структуры, экспрессированные на их мишенях, тогда как система адаптивного иммунитета распознает более сложные, специфичные структуры. Примерами клеток системы врожденного иммунитета являются макрофаги и дендритные клетки, а также гранулоциты (например, нейтрофилы), естественные клетки-киллеры и другие. В отличие от них, клетки системы адаптивной иммунной системы распознают специфические антигенные структуры, включая пептиды в случае Т-клеток и пептиды наряду с 3-мерными структурами в случае В-клеток. Система приобретенного иммунитета намного более специфична и сложна, чем система врожденного иммунитета, и совершенствуется при повторном воздействии данного патогена/антигена. В эволюционном отношении система врожденного иммунитета намного более древняя и обнаруживается даже у очень примитивных организмов. Тем не менее, система врожденного иммунитета играет решающую роль в начальной фазе антигенного воздействия, так как, наряду со сдерживанием распространения патогенов, клетки системы врожденного иммунитета, то есть АРС, примируют клетки системы приобретенного иммунитета и тем самым запускают специфические имунные ответы, ведущие к устранению "незванных гостей". Таким образом, клетки системы врожденного иммунитета, в особенности АРС, играют решающую роль в индукционной фазе иммунных ответов тем, что они: а) сдерживают распространение инфекций посредством примитивной системы распознавания простых структур и б) примируют клетки системы приобретенного иммунитета, что ведет к специфическим иммунным ответам и запоминанию, приводящим к устранению вторгающихся патогенов или других мишеней. Эти механизмы также могут иметь значение в устранении или сдерживании раковых клеток.
Используемые для таких вакцин антигены зачастую выбирают случайным образом или по доступности. Существует потребность в идентификации эффективных антигенов данного патогена или - предпочтительно - почти полного набора всех антигенов данного патогена, имеющих практическое (клиническое) значение. Такие антигены могут быть предпочтительными кандидатами на антигены для вакцин.
Сущность изобретения
Таким образом, предметом настоящего изобретения является удовлетворение этих потребностей и обеспечение способа, с помощью которого такие антигены могут быть получены и с помощью которого практически полный набор антигенов определенного патогена может быть идентифицирован с применением данной сыворотки как источника антител. Такой способ должен подходить и для очень изменчивых патогенов, у которых быстро развивается устойчивость к обычным препаратам или вакцинам. Способ также должен быть применимым для идентификации и выделения опухолевых антигенов, аллергенов, аутоиммунных антигенов.
Итак, настоящее изобретение обеспечивает способ идентификации, выделения и получения реагирующих с гипериммунной сывороткой антигенов из определенного патогена, причем указанные антигены подходят для применения в качестве вакцины, предназначенной для определенного типа животных или для человека, характеризующийся следующими стадиями:
- получение препарата антител из пула плазмы данного типа животных или пула плазмы человека или индивидуальных сывороток с антителами против данного определенного патогена,
- получение по меньшей мере одной экспрессионной библиотеки дисплея на бактериальной поверхности данного определенного патогена,
- скрининг данной по меньшей мере одной экспрессионной библиотеки дисплея на бактериальной поверхности с помощью указанного препарата антител,
- идентификация антигенов, связывающихся при скрининге с антителами в указанном препарате антител,
- скрининг идентифицированных антигенов с помощью индивидуальных препаратов антител из индивидуальных сывороток от лиц с антителами против указанного определенного патогена,
- идентификация реагирующей с гипериммунной сывороткой антигенной части идентифицированных антигенов, где указанные реагирующие с гипериммунной сывороткой антигены связываются с релевантной частью индивидуальных препаратов антител из индивидуальных сывороток, и
- при необходимости выделение реагирующих с гипериммунной сывороткой антигенов и их получение химическими или рекомбинантными способами при условии, что указанные индивидуальные сыворотки получают от пациентов, имеющих титр антител к указанному определенному патогену, превышающий 90-процентиль, и титр IgG выше 10000 ед.
Этот способ также подходит вообще для идентификации практически полного набора реагирующих с гипериммунной сывороткой антигенов определенного патогена с помощью данных сывороток как источников антител, если проводить скрининг по меньшей мере трех разных экспрессионных библиотек по программе идентификации патогенов/антигенов способом настоящего изобретения. Следовательно, настоящее изобретение также касается способа идентификации, выделения и получения практически полного набора реагирующих с гипериммунной сывороткой антигенов определенного патогена, причем указанные антигены подходят для применения в качестве вакцины, предназначенной для определенного типа животных или для человека, характеризующегося следующими стадиями:
- получение препарата антител из пула плазмы данного типа животных или пула плазмы человека или индивидуальных сывороток с антителами против данного конкретного патогена,
- получение по меньшей мере трех разных экспрессионных библиотек указанного определенного патогена, причем по меньшей мере одна является экспрессионной библиотекой дисплея на бактериальной поверхности,
- скрининг данных по меньшей мере трех экспрессионных библиотек с помощью указанного препарата антител,
- идентификация антигенов, связывающихся хотя бы при одном из по крайней мере трех скринингов с антителами в указанном препарате антител,
- скрининг идентифицированных антигенов с помощью индивидуальных препаратов антител из индивидуальных сывороток от лиц с антителами против данного конкретного патогена,
- идентификация реагирующей с гипериммунной сывороткой антигенной части идентифицированных антигенов, где указанные реагирующие с гипериммунной сывороткой антигены связываются с релевантной частью индивидуальных препаратов антител из индивидуальных сывороток,
- повторение стадий скрининга и идентификации по меньшей мере еще один раз,
- сравнение реагирующих с гипериммунной сывороткой антигенов, идентифицированных при повторении стадий скрининга и идентификации, с реагирующими с гипериммунной сывороткой антигенами, идентифицированными на стадиях первоначального скрининга и идентификации,
- дальнейшее повторение стадий скрининга и идентификации, если только на стадиях повторного скрининга и идентификации было идентифицировано по меньшей мере 5% реагирующих с гипериммунной сывороткой антигенов, до тех пор, пока при следующем повторении стадий будет идентифицировано менее 5% реагирующих с гипериммунной сывороткой антигенов для получения полного набора реагирующих с гипериммунной сывороткой антигенов данного патогена,
- при необходимости выделение реагирующих с гипериммунной сывороткой антигенов и их получение химическими или рекомбинантными способами при условии, что указанные индивидуальные сыворотки получают от пациентов, имеющих титр антител к указанному определенному патогену, превышающий 90-процентиль, и титр IgG выше 10000 ед.
Перечень чертежей
На фиг.1 представлен предварительный отбор сывороток на основе титров антител против стафилококков, измеренных методом ELISA.
На фиг.2 представлено распределение по размеру фрагментов ДНК в библиотеке LSA50/6 в векторе pMAL4.1.
На фиг.3 представлена селекция методом магнитной сортировки клеток (MACS) с помощью биотинилированной сыворотки человека. Библиотеку LSA50/6 в векторе pMAL4.1 подвергали скринингу с помощью 10 мкг биотинилированной сыворотки человека в первом (А) и 1 мкг во втором (В) цикле скрининга. Сыворотка Р - сыворотка больных, сыворотка В - детская сыворотка. Показано число отобранных клеток после 2-й и 3-й элюции для каждого цикла селекции.
На фиг.4 представлена иммунореактивность специфических клонов, полученных путем дисплея на бактериальной поверхности по результатам анализа методом Вестерн-блоттинга с помощью сыворотки больного в разведении 1:5000.
На фиг.5 представлен анализ методом ELISA с помощью сыворотки больных и здоровых лиц пептида с эпитопом, идентифицированным способом рибосомного дисплея.
На фиг.6 представлен репрезентативный двухмерный иммуноблот поверхностных белков S.aureus, детектированных с помощью сыворотки человека. 800 мкг белка из S. aureus/COL, культивированного на BHI, разделяли методами ИЭФ (рI 4-7) и ДДС-Na-ПАГ-электрофореза (9-16%), а затем переносили на мембрану из PVDF. После блокирования мембрану инкубировали с сывороткой IC35 (1:20000). Связывание сывороточного IgG визуализировали при помощи конъюгата HRPO с антителом к IgG человека и проявления с помощью усиленной хемилюминесценции ECL.
На фиг.7 представлен репрезентативный двумерный гель, показывающий поверхностные белки S.aureus при окрашивании Кумасси голубым. 1 мг белка из S.aureus/COL разделяли методами ИЭФ (рI 4-7) и ДДС-Na-ПАГ-электрофореза (9-16%). Отмечены пятна, выбранные для секвенирования после серологического протеомного анализа.
На фиг.8А и 8В представлена структура белков клеточной стенки LPXTG.
На фиг.9 представлен IgG-ответ у неинфицированных (N, С) и инфицированных (Р) пациентов на LPXTGV, новый антиген и вероятный поверхностный адгезин S.aureus, открытый согласно изобретению с помощью дисплея на бактериальной поверхности и протеомного подхода.
На фиг.10 представлено окрашивание поверхности S.aureus очищенными IgG против LPXTGV.
На фиг.11 представлен двухмерный гель, на котором поверхностные белки S.aureus окрашивали Кумасси голубым (слева). 1 мг белка из S. aureus/agr, культивированного до ранней логарифмической фазы, разделяли методами ИЭФ (рI 4-7) и ДДС-Na-ПАГ-электрофорезе (9-16%). Отмечены пятна, выбранные для секвенирования после серологического протеомного анализа. Соответствующий двухмерный иммуноблот (справа). 800 мкг белка из того же препарата разделяли параллельно методом двухмерного электрофореза, а затем переносили на мембрану из PVDF. После блокирования мембрану инкубировали с пулом Р (1:10000). Связывание сывороточного IgG визуализировали при помощи конъюгата HRPO с антителом к IgG человека и проявления с помощью усиленной хемилюминесценции ECL.
Сведения, подтверждающие возможность осуществления изобретения
Способ по настоящему изобретению в основном состоит из трех основных частей, а именно: 1) идентификация источников гипериммунной сыворотки, содержащих специфические антитела против определенного патогена, 2) скрининг подходящих экспрессионных библиотек с помощью соответствующего препарата антител, при котором отбираются антигены-кандидаты (или антигенные фрагменты таких антигенов), и 3) второй цикл скрининга, в котором реагирующие с гипериммунной сывороткой антигены идентифицируют по их способности к связыванию с релевантной частью индивидуальных препаратов антител из индивидуальных сывороток для того, чтобы убедиться, что эти антигены практически значимы и не только реагируют с гипериммунной сывороткой, но и обладают широкой иммуногенностью (то есть что множество индивидуальных сывороток реагирует с данным антигеном). Настоящий способ дает возможность получить набор антигенов определенного патогена, который будет практически полным в отношении данного патогена и данной сыворотки. Таким образом, в настоящем способе исключается перекос в сторону "плохих" антигенов-кандидатов или неполного набора антигенов данного патогена.
Полнота набора антигенов данного патогена в контексте настоящего изобретения, конечно, зависит от полноты экспрессионных библиотек, используемых в настоящем способе, и от качества и размера тестируемых коллекций сыворотки (числа индивидуальных плазм/сывороток), как в отношении репрезентативности библиотеки, так и пригодности экспрессионной системы. Поэтому предпочтительные воплощения настоящего способа отличаются тем, что по меньшей мере одна из экспрессионных библиотек выбрана из библиотеки рибосомного дисплея (ribosome display library), библиотеки дисплея на бактериальной поверхности (bacterial surface library) и протеома.
Коллекция сыворотки, используемая в настоящем изобретении, должна быть проверена против набора известных антигенных соединений данного патогена, таких как полисахариды, липиды и белковые компоненты клеточной стенки, клеточных мембран и цитоплазмы, а также секретируемые продукты. Предпочтительно используют три отдельные коллекции сывороток: 1) с очень стабильным репертуаром антител: от нормальных взрослых, клинически здоровых людей, перенесших прежние случаи контакта, или от носителей данного патогена без острых проявлений и симптомов заболевания; 2) с антителами, индуцированными острым присутствием патогенного организма: от пациентов с острым заболеванием в различных проявлениях (к примеру, сепсис или заражение раны S.aureus и т.д.); 3) без каких-либо специфических антител вообще (в качестве отрицательного контроля): от грудных детей в возрасте 5-8 месяцев, утративших материнские иммуноглобулины через 5-6 месяцев после рождения. Сыворотка должна реагировать с множеством патоген-специфичных антигенов, тогда ее можно считать гипериммунной для данного патогена (бактерии, грибка, червя или др.), благодаря чему она будет релевантной для скрининга способом настоящего изобретения.
В программе идентификации антигенов для выявления полного набора антигенов согласно настоящему изобретению предпочтительно, чтобы указанные по меньшей мере три экспрессионные библиотеки были представлены по крайней мере библиотекой рибосомного дисплея, библиотекой дисплея на бактериальной поверхности и протеомом. Было отмечено, что хотя все экспрессионные библиотеки могут быть полными, однако использование только одной или двух экспрессионных библиотек в программе идентификации антигенов не приводит к полному набору антигенов вследствие присущих каждой из различных экспрессионных библиотек свойств предпочтительной экспрессии. Таким образом, хотя и можно получить реагирующие с гипериммунной сывороткой антигены при помощи только одной или двух различных экспрессионных библиотек, однако во многих случаях это может и не привести в конце концов к идентификации полного набора реагирующих с гипериммунной сывороткой антигенов. Конечно, термин "полный" согласно настоящему изобретению означает не теоретический максимум, а лишь практическую полноту, то есть что у данного патогена идентифицировано по меньшей мере 95% практически значимых антигенов или антигенных детерминант. При этом практическая значимость определяется распространенностью антител к данному патогену в популяции пациентов.
Согласно настоящему изобретению, пулы сыворотки или фракции плазмы или другие пулы внутренних сред организма, содержащих антитела, также представляют собой "пулы плазмы".
Экспрессионная библиотека, используемая в настоящем изобретении, должна по крайней мере обеспечивать экспрессию всех потенциальных антигенов, например, всех поверхностных белков данного патогена. Экспрессионная библиотека по настоящему изобретению обеспечивает по меньшей мере один набор потенциальных антигенов данного патогена, и предпочтительно этот набор представляет собой полный теоретический набор (поли)пептидов, кодируемых геномом патогена (то есть геномные библиотеки, как описано в Примере 2) и экспрессируемых либо в рекомбинантном хозяине (см. Пример 3), либо in vitro (см. Пример 4). Этот набор возможных антигенов может представлять собой и белковый препарат, в случае внеклеточных патогенов - белковый препарат, содержащий поверхностные белки патогена, полученные из патогена, культивированного в определенных физиологических условиях (см. Пример 5). В то время, как геномный подход способен обеспечить полный набор антигенов, последний подход обладает тем преимуществом, что он дает белки в природном состоянии, то есть включая, к примеру, пост-трансляционные модификации или подвергнутые процессингу формы этих белков, которые не очевидны из последовательности ДНК. Эти и любые другие наборы потенциальных антигенов из патогена, опухоли, аллергена, либо ткани или организма, подверженного аутоиммунным реакциям, в дальнейшем именуются как "экспрессионная библиотека". Совершенно различные экспрессионные библиотеки могут применяться при осуществлении настоящего изобретения. Соответствующие примеры приведены, к примеру, в Ausubel et al., 1994. Особенно предпочтительны экспрессионные библиотеки, представляющие собой дисплей генетического набора патогена в рекомбинантном виде типа методов трансляции in vitro, например, рибосомный дисплей, или прокариотической системы экспрессии, например, экспрессионные библиотеки дисплея на бактериальной поверхности, или такие, которые близки к специфическим состояниям физиологической экспрессии данного патогена в данном физиологическом состоянии типа протеома.
Рибосомный дисплей является признанным методом технологии рекомбинантной ДНК, который применим к любому определенному патогену в интересах настоящего изобретения (Schaffitzel et al., 1999). Библиотеки дисплея на бактериальной поверхности представлены рекомбинантной библиотекой бактериального хозяина, представляющей (полный) набор пептидных последовательностей данного патогена, экспрессируемых, к примеру, на выбранном наружном мембранном белке на мембране бактериального хозяина (Georgiou et al., 1997). Помимо представления пептидных или белковых последовательностей на наружном мембранном белке, для экспрессионной библиотеки дисплея на бактериальной поверхности предпочтительны и другие методы бактериального дисплея, такие как технологии дисплея на бактериофагах и экспрессия через секретируемые белки (Forrer et al., 1999; Rodi and Makowski, 1993; Georgiou et al., 1997).
Препарат антигена для первого цикла скрининга способом настоящего изобретения может происходить из любого источника, содержащего антитела к данному патогену. Предпочтительно, если в качестве источника препарата антител используют пул плазмы, то выбирают пул плазмы человека, включающий доноров, перенесших или находящихся в состоянии инфицирования данным патогеном. Хотя такой выбор плазмы или пулов плазмы в принципе является стандартным методом, например, при получении гипериммунных препаратов иммуноглобулина, однако неожиданно оказалось, что эти методы оказывают такие эффекты, особенно как показывают предпочтительные воплощения настоящего изобретения.
Предпочтительно экспрессионные библиотеки представляют собой геномные экспрессионные библиотеки данного патогена, или же, альтернативно, библиотеки мРНК. Предпочтительно эти геномные или мРНК-библиотеки являются полными геномными или мРНК-библиотеками, что означает, что они содержат как минимум по одной копии всех возможных белков, пептидов или пептидных фрагментов, которые может экспрессировать патоген. Предпочтительно геномные экспрессионные библиотеки проявляют избыточность не менее 2-кратной, более предпочтительно не менее 5-кратной, в особенности не менее 10-кратной.
Предпочтительно способ настоящего изобретения включает скрининг по меньшей мере библиотеки рибосомного дисплея, библиотеки дисплея на бактериальной поверхности и протеома с помощью препарата антител и идентификацию антигенов, связывающихся по меньшей мере при двух, а предпочтительно при всех скринингах с антителами в препарате антител. Тогда такие антигены можно считать чрезвычайно подходящими в качестве гипериммуногенных антигенов, независимо от способа их экспрессии. Предпочтительно эти по меньшей мере два скрининга должны как минимум включать протеом, так как в протеоме антигены всегда представлены в виде экспрессируемых естественным образом белков, включая пост-трансляционные модификации, процессинг и т.п., которые не очевидны из последовательности ДНК.
Способ настоящего изобретения может применяться к любому патогену. Следовательно, патогены предпочтительно выбирают из числа бактериальных, вирусных, грибковых и протозойных патогенов. Способ настоящего изобретения также применим к раку, то есть для идентификации опухолевых антигенов, а также для идентификации аллергенов или антигенов, участвующих в аутоиммунных заболеваниях. Конечно, рекомбинантные методы будут особенно простыми для патогенов, имеющих небольшой геном или сравнительно небольшое число экспрессируемых белков (например, бактериальных или вирусных патогенов), и более трудными для сложных (эукариотических) организмов с большими геномами. Однако, даже такие большие геномные библиотеки патогенов из числа высших организмов можно анализировать способом настоящего изобретения, по крайней мере быстрее и более надежно, чем известными методами идентификации соответствующих антигенов.
Предпочтительные патогены, предназначенные для анализа или экстракции антигенов, соответственно, включают вирус иммунодефицита человека (HIV), вирус гепатита A (HAV), вирус гепатита В (HBV), вирус гепатита С (HCV), вирус саркомы Рауса (RSV), вирус Эпштейна-Барра (EBV), вирус гриппа (IV), ротавирус (RV), Staphylococcus aureus (S.aureus), Staphylococcus epidermidis (S.epidermidis), Chlamydia pneumoniae (C.pneumoniae), Chlamydia trachomatis (C.trachomatis), Mycobacterium tuberculosis (M.tuberculosis), Mycobacterium leprae (M.leprae), Streptococcus pneumoniae (S.pneumoniae), Streptococcus pyogenes (S.pyogenes), Streptococcus agalactiae (S.agalactiae), Enterococcus faecalis (E.faecalis), Bacillus anthracis (В.anthracis), Vibrio cholerae (V.cholerae), Borrelia burgdorferi (B.burgdorferi), Plasmodium sp., грибковые патогены, такие как Pneumocystis carinii, Aspergillus sp., Cryptococcus sp., Candida albicans, или паразитарные патогены, такие как аскариды (Ascaris lumbricoides) и ленточные черви (Taenia saginata). Способ настоящего изобретения наиболее применим к бактериям, червям или Candida.
В качестве модельного организма для настоящей заявки выбран Staphylococcus aureus, чтобы показать применимость и эффективность способа настоящего изобретения. В особенности из примеров становится ясно, что изобретение легко переносится на все возможные патогены, особенно те, что перечислены выше.
Неожиданно оказалось, что способ настоящего изобретения обеспечивает эффективный и быстрый биологический скрининг определенного патогена, особенно ввиду того, что лишь малая доля репертуара антител пациента направлена на данный патоген, даже в том случае, когда против этого патогена вырабатывается эффективная защита. В ходе настоящего изобретения, особенно при выполнении примера с S.aureus, было сделано открытие, что лишь 1-2% репертуара антител пациента с высоким титром антител к S.aureus в действительности представляют антитела, направленные против S.aureus. Более того, свыше 70% из этой специфической доли в 1% направлено против небелковых антигенов, таких как тейхоевая кислота, так что лишь 0,1% или меньше антител направлено против белковых антигенов.
Одно из преимуществ использования рекомбинантных экспрессионных библиотек, особенно библиотек рибосомного дисплея и библиотек дисплея на бактериальной поверхности, состоит в том, что идентифицированные антигены, реагирующие с гипериммунной сывороткой, могут быть незамедлительно получены путем экспрессии кодирующих последовательностей прошедших скрининг и отобранных клонов, экспрессирующих антигены, реагирующие с гипериммунной сывороткой, причем дальнейшие стадии технологии рекомбинантной ДНК или клонирования становятся ненужными.
Поэтому реагирующие с гипериммунной сывороткой антигены, получаемые способом настоящего изобретения, могут быть незамедлительно заключены в фармацевтический состав, предпочтительно путем добавления фармацевтически приемлемого носителя и/или наполнителя, сразу после получения (в ходе второй стадии селекции), например, при экспрессии из экспрессионной библиотеки.
Предпочтительно фармацевтический состав, содержащий антиген, реагирующий с гипериммунной сывороткой, представляет собой вакцину для профилактики или лечения инфекции, вызванной определенным патогеном, из которого были отобраны антигены.
Фармацевтический состав может содержать любые подходящие вспомогательные вещества, такие как буферные вещества, стабилизаторы или дополнительные активные ингредиенты, в особенности известные ингредиенты, связанные с получением вакцин.
Предпочтительно носитель и/или наполнитель для реагирующих с гипериммунной сывороткой антигенов по настоящему изобретению представляет собой соединение-иммуностимулятор для дополнительной стимуляции иммунного ответа на данный реагирующий с гипериммунной сывороткой антиген. Предпочтительно соединение-иммуностимулятор в фармацевтическом составе по настоящему изобретению выбирают из числа поликатионных веществ, особенно поликатионных пептидов, иммуностимуляторных дезоксинуклеотидов, квасцов, полного адъюванта Фрейнда, неполного адъюванта Фрейнда, нейроактивных соединений, особенно гормона роста человека, или их комбинаций.
Поликатионные соединения для применения по настоящему изобретению могут представлять собой любые поликатионные соединения, проявляющие характерные эффекты согласно WO 97/30721. Предпочтительные поликатионные соединения выбирают из основных полипептидов, органических поликатионов, основных полиаминокислот или их смесей. Длина цепи у таких полиаминокислот должна составлять не менее 4 аминокислотных остатков (см. Tuftsin, как описано в Goldman et al., 1983). Особенно предпочтительны вещества типа полилизина, полиаргинина и полипептидов, содержащие более 20%, предпочтительно более 50% основных аминокислот в пределах от более 8, предпочтительно более 20 аминокислотных остатков, или их смеси. Другие предпочтительные поликатионы и их фармацевтические композиции описаны в WO 97/30721 (к примеру, полиэтиленимин) и WO 99/38528. Предпочтительно такие полипептиды содержат от 20 до 500 аминокислотных остатков, более предпочтительно от 30 до 200 остатков.
Такие поликатионные соединения могут быть получены химическим путем или рекомбинантными методами, либо происходить из природных источников.
Катионные (поли)пептиды также могут обладать антимикробными свойствами, как описано в обзорах: Ganz et al., 1999; Hancock, 1999. Такие (поли)пептиды могут происходить из прокариот, животных или растений, либо могут быть получены химическим путем или рекомбинантными методами (Andreu et al., 1998; Ganz et al., 1999; Simmaco et al., 1998). Пептиды также могут принадлежать к классу дефензинов (Ganz, 1999; Ganz et al., 1999). Последовательности таких пептидов, к примеру, можно найти в Базе данных по антимикробным последовательностям по следующему адресу Интернета: http://www.bbcm.univ.trieste.it/˜tossi/pag2.html.
Такие защитные пептиды организма-хозяина или дефензины также являются предпочтительной формой поликатионных полимеров согласно настоящему изобретению. В общем, в качестве поликатионных полимеров используют соединения, обеспечивающие в конечном счете активацию (или понижающую регуляцию) системы адаптивного иммунитета, предпочтительно опосредованную АРС (включая дендритные клетки).
Особенно предпочтительны для применения в качестве поликатионных веществ в настоящем изобретении антимикробные пептиды, происходящие из кателицидина, или их производные (международная патентная заявка РСТ/ЕР01/09529, включенная в описание в качестве ссылки), особенно антимикробные пептиды, происходящие из кателицидина млекопитающих, предпочтительно человека, быка или мыши.
К поликатионным соединениям природного происхождения относятся HIV-REV и HIV-TAT (производные катионные пептиды, пептиды antennapedia, хитозан и другие производные хитина) и другие пептиды, полученные из этих пептидов или белков биохимическим или рекомбинантным способом. Другие предпочтительные поликатионные соединения - кателин и родственные ему или производные вещества. Например, кателин мыши - это пептид, имеющий аминокислотную последовательность NH2-RLAGLLRKGGEKIGEKLKKIGOKIKNFFQKLVPQPE-COOH. Родственные кателину или производные вещества содержат полную или частичную последовательность кателина, включающую по меньшей мере 15-20 аминокислотных остатков. Производные могут включать замещение или модификацию природных аминокислот такими аминокислотами, которые не входят в число стандартных 20 аминокислот. Кроме того, в такие молекулы кателина могут вводиться дополнительные катионные остатки. Такие молекулы кателина являются предпочтительными для комбинирования с антигеном. Неожиданно эти молекулы кателина также оказались эффективными как адъюванты для антигена без добавления других адъювантов. Поэтому такие молекулы кателина можно использовать в качестве эффективных адъювантов в составе вакцин вместе с другими иммуноактивирующими веществами или без них.
Другим предпочтительным поликатионным веществом для применения согласно настоящему изобретению является синтетический пептид, содержащий по меньшей мере 2 мотива KLK, разделенные линкером из 3-7 гидрофобных аминокислот (международная патентная заявка РСТ/ЕР01/12041, включена в описание в качестве ссылки).
К иммуностимуляторным дезоксинуклеотидам относятся природные или искусственные CpG-содержащие ДНК, короткие отрезки ДНК из беспозвоночных или короткие олигонуклеотиды (ODNs), содержащие неметилированные динуклеотиды цитозин-гуанин (CpG) в определенном контексте (см. Krieg et al., 1995), а также содержащие инозин ODNs (I-ODNs), как описано в WO 01/93905.
Нейроактивные соединения, к примеру, комбинируемые с поликатионными веществами, описаны в WO 01/24822.
Согласно предпочтительному воплощению, индивидуальные препараты антител для второго цикла скрининга получают от больных острой инфекцией, вызванную данным патогеном, особенно от больных, у которых титр антител к этому патогену превышает определенный минимальный уровень, например, титр антител, превышающий 80-процентиль, предпочтительно превышающий 90-процентиль, более предпочтительно превышающий 95-процентиль для протестированных образцов сыворотки человека (больных или носителей). Использование индивидуальных препаратов антител с таким высоким титром во втором цикле скрининга обеспечивает высокую избирательность при идентификации реагирующих с гипериммунной сывороткой антигенов данного патогена.
Важно то, что второй скрининг с помощью индивидуальных препаратов антител (которыми могут служить и отобранные сыворотки) обеспечивает избирательную идентификацию реагирующих с гипериммунной сывороткой антигенов из всех перспективных кандидатов, полученных в первом цикле. Поэтому при идентификации таких антигенов во втором цикле скрининга предпочтительно следует использовать по меньшей мере 10 индивидуальных препаратов антител (то есть препаратов антител, к примеру, сывороток, полученных как минимум от 10 различных лиц, перенесших инфекцию, вызванной данным патогеном). Конечно, можно использовать и меньше 10 индивидуальных препаратов, однако при малом числе индивидуальных препаратов антител избирательность на этой стадии может оказаться неоптимальной. С другой стороны, если данный реагирующий с гипериммунной сывороткой антиген (или его антигенны