Косметическое и/или дерматологическое средство и антиоксидант
Иллюстрации
Показать всеНастоящее изобретение относится к области косметологии и касается косметических и/или дерматологических средств, содержащих антиоксидантные добавки. Косметическое и/или дерматологическое средство включает эмульсию перфторуглеродов и антиоксидант в фармацевтически приемлемой форме, в качестве которого оно содержит пропофол (2,6-диизопропилфенол) в эффективном количестве. При этом используют эмульсию перфторуглеродов при содержании перфторуглеродов в ней 0,2-140 мас./об.%. Предложено использовать пропофол (2,6-диизопропилфенол) в качестве антиоксиданта при приготовлении косметических и/или дерматологических средств. 1 з.п. ф-лы, 2 табл., 6 ил.
Реферат
Настоящее изобретение относится к области косметологии и касается косметических и/или дерматологических средств, содержащих антиоксидантные добавки.
В нормальных физиологических условиях небольшие количества кислорода, потребляемого митохондрией клетки, постоянно конвертируются в супероксид анионы, перекись водорода, гидроксильные радикалы. В небольших количествах они выполняют важную роль в регуляции многих клеточных функций и действуют как вторичные мессенджеры активаторов транскрипции. Избыточная продукция этих радикалов является фактором повреждения, поэтому в клетке имеется естественная антиоксидантная система. Она представлена ферментами, среди которых наибольшее значение имеют Mn2+- и Cu2+-зависимые супероксиддисмутазы (SOD), глютатионпероксидаза GPX, глютатионредуктаза и каталаза CAT. SOD конвертирует супероксид-анионы в перекись водорода, которая затем трансформируется в воду другими ферментами, GPX и CAT.
Увеличение внутриклеточного уровня свободных радикалов, непременных спутников оксидативного стресса, является отражением токсических процессов, протекающих во всех компартментах клетки. Оксидативный стресс клетки отражает, в общем случае, дисбаланс между продукцией реактивных форм кислорода (азота) и антиоксидантной системой защиты. Он выражается в мембранной дисфункции, повреждении ДНК, инактивации белкового синтеза. Если клетка обладает антиоксидантным потенциалом, наблюдается ARE-индуцированная транскрипция естественных антиоксидантных ферментов. В случае нарушений в этой системе развивается оксидативный стресс с последующим образованием первичных и вторичных реактивных форм кислорода и азота, чаще известных как свободные радикалы.
Свободные радикалы - высоко реактивные атомы или молекулы, которые имеют неспаренные электроны (O2·-, ОН·, NO·). Их вторичные производные (Н2O2, ONOO-, HOCl) могут быть даже более реактивными, чем первичные радикалы. Объектами их разрушительного воздействия становятся белки, липиды, сахара, нуклеиновые кислоты, внеклеточный матрикс. Многие реакции генерации кислородных или азотных радикалов являются фермент- или металл-катализируемые.
Несмотря на изобилие внешних источников свободных радикалов (окружающая среда, курение, пестициды, озон), существуют несколько эндогенных путей для их формирования. Во-первых, в процессе синтеза АТФ в митохондрии супероксид анион генерируется моновалентной редукцией кислорода через цитохром-оксидазный путь. Реакции, катализируемые железом, формируют высокоагрессивные гидроксильные радикалы, пример этому - реакция Фентона в присутствии железа и реакция Хабера-Вейса в присутствии меди. Кроме того, в процессе воспаления, как общего, так и системного, иммунокомпетентные клетки продуцируют свободные радикалы в качестве защитного фактора против патогенов.
Кислородные либо азотные свободные радикалы обладают разрушительным воздействием на все клетки организма. Реактивные кислородные радикалы (РКР) продуцируются в большом количестве активированными макрофагами в ответ на различного рода стимулы, как часть т.н. ″кислородного взрыва". Свободные радикалы образуются в ответ на воспаление, провоспалительные цитокины, тканевые металлопротеиназы, а также в процессе метаболизма канцерогенов. Поскольку РКР содержат неспаренные электроны, они крайне нестабильны и высокореактивны.
Однако они могут нейтрализовываться различными экзогенными антиоксидантами, а также естественными внутриклеточными антиоксидантными ферментами.
Реактивные азотные радикалы (РАР) включают NO и другие реактивные промежуточные формы этого соединения. NO является токсичным газом, несущим все признаки действия свободных радикалов, вызывающих NO-опосредованный апоптоз клеток. РАР продуцируются в относительно высоких количествах в реакциях воспаления большинством клеточных типов посредством индуцибельной формы NO-синтазы совместно с другими медиаторами воспаления - цитокинами интерлейкином-1 (IL-1) и фактором некроза опухоли-альфа (TNF-α).
РКР и РАР повреждают все компоненты клеточных структур, включая липиды мембран, белки и ДНК, что ведет к мутагенезу и высокому риску опухолеобразования: мутации на уровне генов способствуют экспрессии альтернативных факторов, - активаторов транскрипции генов, вовлеченных в канцерогенез.
На активность антиоксидантных ферментов оказывают влияние также и возрастные изменения, которые выражаются в снижении их экспрессии и уровня в крови и тканях. Наибольший вклад в снижение активности естественных антиоксидантных систем клетки вносят нарушения респираторной функции митохондрий, снижение митохондриального потенциала, выход цитохрома С, стимуляция проапоптотических белков теплового шока, дисбаланс в системе белков Bax/Bcl, активация каспаз-3 и -9, других апоптогенных факторов. Таким образом, гиперпродукция свободных радикалов является также и характеристикой старения, что проявляется токсичностью на разных уровнях - органном, клеточном, генном.
Стимуляция естественных антиоксидантных систем, привнесение экзогенных антиоксидантов - ключевой момент профилактики воспаления и раннего старения. Поэтому поиск мощных антиоксидантов, которые работают на всех уровнях клеточной защиты, - задача первостепенной важности.
В настоящее время для предотвращения или коррекции оксидативного стресса применяются различные антиоксиданты, обладающие разной силой защитного ответа.
Биологическими антиоксидантами являются хорошо известные ферменты, такие как супероксиддисмутаза, каталаза, глутатионпероксидаза. Ферментные антиоксиданты являются средствами внутриклеточной защиты, поскольку в плазме крови и в лимфе они обнаруживаются лишь в следовых количествах. Поэтому для защиты организма на всех уровнях, где могут протекать радикальные процессы, существуют низкомолекулярные антиоксиданты. К ним относятся жирорастворимые (витамины Е, А, К, убихинон, водорастворимые витамины (вит.С, В6, РР), полифенолы (эвгенол, конидендрин, пирокатехин, производные галловой кислота), флавоноиды (рутин, кверцетин), SH-соединения, стероидные гормоны и др. Многие из перечисленных выше природных анти-оксидантов могут быть получены путем химического синтеза. Неспецифической анти-оксидантной активностью обладают также экстракты какао, зеленого чая, а также оливковое масло.
Кроме природных, существует также множество искусственно созданных веществ с антиоксидантными свойствами - гидроксианизол (butylated hydroxyanisole, ВНА), гидрокситолуен (butylated hydroxytoluene, BHT), пропил-галлат (PG) ионол и др. (Vitaglione P, Fogliano V. Use of antioxidants to minimize the human health risk associated to mutagenic/carcinogenic heterocyclic amines in food. J Chromatogr В Analyt Technol Biomed Life Sci. 2004 Mar 25; 802(1):189-99.)
Механизмы антиоксидативного действия всех этих веществ различны: они могут обрывать свободнорадикальные реакции перекисного окисления, тормозить эти реакции, связывать радикалы с образованием относительно слабореактивные молекул, которые не обладают столь сильным повреждающим эффектом, и др.
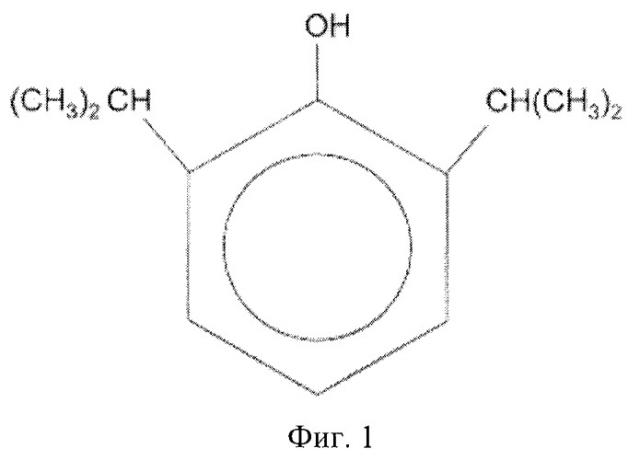
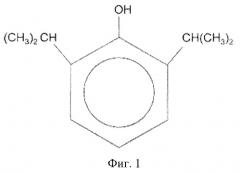
В настоящее время известен коммерческий препарат диприван, используемый в качестве седативного и анальгезирующего средства в анестезии. Пропофол (2,6-диизопропилфенол) - его основной компонент. Химическая структура пропофола показана на фиг.1. Активность пропофола изучается с 1973 года. Было показано, что среди других 350 тестируемых фенолов только пропофол обеспечивал оптимальный баланс свойств для анестезии (быстрое поглощение, короткое время воздействия, способность контроля седативного действия, простота введения) (Thompson KA, Goodale DV. The recent development of propofol (DIPRIVAN). Intensive Care Med 2000, 26, 400-404.).
Несколько позже (первые публикации относятся к концу 80-х - началу 90-х годов) было замечено, что при использовании пропофола в анестезиологии у людей (как при интубационном, так и при внутривенном введении) он способен проявлять и иные свойства. Употребление пропофола в качестве интубационного анестетика способствует защите легочной ткани, улучшению клеточного дыхания, быстрому восстановлению дыхательной функции у пациентов после операции.
В работе Sayin с соавторами показано, что в процессе хирургического вмешательства по поводу аорто-коронарного шунтирования на фоне применения фентанила и мидазолама наблюдалось стимулирование перекисного окисления липидов в интиме аорты, в то время как у пациентов, получавших в качестве анестезирующего средства пропофол, этот процесс существенно ингибировался (Sayin et al., 2002). Sayin MM, Ozatamer О, Tasoz R, Kilinc К, Unal N. Propofol attenuates myocardial lipid peroxidation during coronary artery bypass grafting surgery. Br.J.Anaesth. 2002 Aug; 89(2):242-6.
Сравнительный анализ пропофола и используемого в качестве антиоксиданта в косметических и/или дерматологических средствах витамина Е (токоферола) показал, что они имеют схожие структурно-функциональные особенности, а именно фенольную ОН- группу, благодаря которой они могут взаимодействовать со свободными радикалами, вызывая обрыв цепи свободнорадикальных реакций. Кроме того, оба эти вещества липофильны, и, взаимодействуя с фосфолипидами мембраны, препятствуют воздействию агрессивных свободных радикалов, на основании чего заявителем были высказаны предположения, что пропофол может быть использован в качестве антиоксидантного средства при накожном применении.
Вместе с тем, не является очевидным тот факт, что препарат, вводимый внутривенно, может быть использован и при накожном применении; необходимым условием для этого является возможность его прохождение через кожные барьеры. Для исследования этого вопроса на модельных экспериментах заявителем была изучена динамика внутрикожного воспалительного процесса при накожном нанесении пропофола и без него. Воспаление, как известно, сопровождается активацией процессов перекисного окисления, в связи с чем влияние накожно нанесенного пропофола на динамику воспаления является косвенным свидетельством проникновения его через кожные барьеры.
Описание эксперимента
1. Половозрелым крысам создавали очаг воспаления в задних лапках путем подкожной инъекциии полного адъюванта Фрейнда (по 0,5 мл физиологического раствора в полном адъюванте Фрейнда 1:1). Затем одну из лапок обрабатывали пропофолом 3 раза с интервалом 2 часа), вторая лапка ничем не обрабатывалась (контроль). Через сутки определяли относительное увеличение размеров лапок в области инъекции (измерение поперечного и продольного размеров проводили с использованием штангенциркуля), характеризующее интенсивность воспалительного процесса. Через сутки наблюдалось относительное увеличение размеров обработанной пропофолом лапки на 7,2±1,3%, а контрольной - на 14,2±1,6%.
2. На кожу тыльной стороне руки добровольцам наносили по два легких ожога нагретым металлическим предметом, которые сопровождались покраснением и легким жжением (ожоги 1-й степени без повреждения кожных покровов). Затем один ожог обрабатывали пропофолом, другой служил в качестве контроля. Регистрировали время редукции симптоматики, которое составило 20-30 минут для обработанных пропофолом ожогов и 2-2,5 часа для "контрольных".
Приведенные эксперименты свидетельствуют о том, что пропофол проникает через кожные барьеры и значительно редуцирует воспалительную симптоматику, проявляя присущие ему свойства.
Ни в одном из известных заявителю источниках не были высказаны подобные предположения и не описано использование пропофола в качестве антиоксидантного средства в косметических и/или дерматологических препаратах, в частности препаратах, содержащих перфторуглероды.
Антиоксиданты широко используются в косметических и/или дерматологических средствах, особенно в средствах, используемых при старении кожи, при стрессах, при болезненных состояниях, связанных с воспалением. Весьма обоснованно использование антиоксидантов в средствах после загара, в косметике для увядающей кожи.
Кроме того, антиоксиданты вводятся в косметические и/или дерматологические средства, чтобы предотвратить окисление самого косметического средства, поскольку перекисное окисление биологических молекул может протекать и вне клеток и тканей организма, например в маслах, содержащих полиненасыщенные жирные кислоты, в белковых и липопротеидных растворах и т.п. В связи с этим, актуальной является проблема сохранности косметических средств, содержащих жировую или эмульсионную основу, а также разнообразные биологически-активные молекулы.
Таких средств известно множество. Среди многих других широко применяются косметические и/или дерматологические препараты, содержащие перфторуглероды.
В частности, было установлено, что эмульсии перфторуглеродов являются эффективными переносчиками кислорода и представляют собой перспективный класс соединений для использования в средствах для ухода за кожей.
Было запатентовано применение перфторуглеродов в качестве средства, стимулирующего ранозаживление и/или улучшающего обмен веществ в покровных тканях. (Патент РФ №2033163, кл. А 61 К 33/16, 1992 г.).
Известно применение стабилизированной эмульсии перфторуглеродов в качестве средства для биологического омоложения ткани кожи путем сдвига биохимических процессов в сторону показателей, характерных для физиологически более молодого возраста. (Патент РФ №2119790, кл. А 61 К 7/00, 1996 г.).
Наличие в косметическом и/или дерматологическом средстве эмульсии перфторуглеродов, являющейся донором кислорода, способствует активизации процессов перекисного окисления. Кроме того, такие эмульсии в качестве эмульгатора часто содержат лецитин, который также является мишенью для повреждения свободными радикалами кислорода. Традиционно используемые в таких косметических средствах антиоксиданты, например токоферол, не в полной мере решают проблемы защиты тканей кожи и самих косметических средств от процессов перекисного окисления.
Задачей настоящего изобретения было создание косметического и/или дерматологического средства, содержащего антиоксидант, который проявлял бы высокую антиокислительную активность при низких концентрациях и способствовал сохранности самого косметического и/или дерматологического средства, а также использование пропофола (2,6-диизопропилфенола) при приготовлении косметических и/или дерматологических средств в качестве антиоксиданта.
Для решения этой задачи заявителем предложено косметическое и/или дерматологическое средство, включающее эмульсию перфторуглеродов и антиоксидант в фармацевтически приемлемой форме, в качестве которого оно содержит пропофол (2,6-диизопропилфенол) в эффективном количестве. При этом используют эмульсию пер-фторуглеродов при содержании перфторуглеродов в ней 0,2-140 мас./об. %.
Кроме этого, заявитель предлагает использовать пропофол (2,6-диизопропилфенол) в качестве антиоксиданта при приготовлении косметических и/или дерматологических средств.
Для иллюстрации вышесказанного заявителем были проведены сравнительные исследования свойств пропофола и токоферола.
Количественное сравнение антиокислительных свойств пропофола и α-токоферола было осуществлено на модели индуцированного ионами Fe2+ ПОЛ в суспензии яичного липопротеида хемилюминесцентным методом.
Одной из наиболее распространенных и чувствительных систем для анализа антиокислительных свойств потенциальных антиксидантов является суспензия яичного липопротеида (Рощупкин Д.И., Потапенко А.Я., Клебанов Г.И. Практикум по биофизике, ч. 1. М.: Изд-во 2 МОЛГМИ им. Н.И.Пирогова, 1975, с.177-207.).
Мицеллы этой липидной системы весьма близки по структуре к липопротеидам плазмы крови, а процессы перекисного окисления липидов (ПОЛ) в них протекают аналогично тем, которые могут происходить в клеточных мембранах.
Для оценки эффективности ПОЛ в суспензии яичного липопротеида использовали метод хемилюминесцентного анализа (Владимиров Ю.А. "Сверхслабые свечения при биохимических реакциях". М.: "Наука", 1966) с индукцией окисления липидов ионами Fe2+. Это очень чувствительная методика, позволяющая оценить не только способность препарата к индуцированному ПОЛ, но и степень окисленности липида в нем на момент введения индукторов окисления. Характер и механизм влияния антирадикальных липидных антиоксидантов классического типа (в частности, α-токоферола) хорошо известны (Владимиров Ю.А., Суслова Т.Е., Оленев В.И. "Хемилюминесценция, сопряженная с образованием липидных перекисей в биологических мембранах" Биофизика, 1969, 14, с.836-842), что позволяет количественно оценивать величину их антикислительной активности в данных условиях.
В работе использовали коммерческий препарат пропофола в виде суспензии мицелл из фосфатидилхолина, обогащенных данным веществом. Содержание пропофола в нем составляло 10 мг/мл. α-Токоферол был производства "Sigma", США. Использовавшиеся соли были российского производства, марок "хч" и "чда". Все водные растворы готовили на бидистиллированной воде, а для приготовления этанольных растворов применяли перегнанный этанол.
Водную суспензию яичного липопротеида готовили путем суспендирования 1 части яичного желтка в 9 частях бидистиллированной воды. Перед использованием препарат интенсивно перемешивали. Готовый препарат хранили при 4°С.
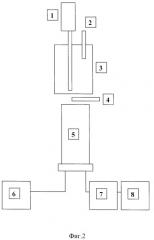
Измерения кинетики индуцированной Fe2+хемилюминесценции в исследовавшихся образцах проводили при комнатной температуре на хемилюминометре ((LKB, Швеция, иодель 1520). На фиг.2 показана блок-схема хемилюминометра, где 1 - мешалка для перемешивания объекта; 2 - зонд для введения добавок; 3 - кювета с объектом; 4 - шторка фотоэлектронного умножителя; 5 - фотоэлектронный умножитель (ФЭУ-39); 6 - источник питания ФЭУ; 7 - усилитель постоянного тока (ОР-205); 8 - регистрирующий потенциометр (КСП).
Контрольный образец состоял из 9 мл калий-фосфатного буфера (KCl 115 мМ; КН2PO4 20 мМ; рН 7,5), 1 мл маточной суспензии яичного липопротеида и 0,1 мл этанола. Хемилюминесцентный ответ индуцировали введением 1 мл закисленного водного раствора FeSO4·7H2O (10-2 М). Конечная концентрация ионов Fe2+составляла, таким образом, 10-3 М.
Исследуемые антиоксиданты вводили в образцы за 5 минут до измерения кинетики хемилюминесценции в виде этанольных растворов, медленно, при непрерывном перемешивании на магнитной мешалке. Объем вводившегося этанола составлял 0,1 мл.
Расчет антиокислительной активности исследованных соединений осуществляли следующим образом
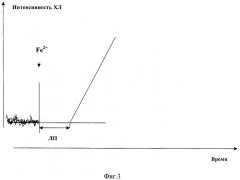
Из данных литературы (Владимиров Ю.А., Суслова Т.Е., Оленев В.И. "Хемилюминесценция, сопряженная с образованием липидных перекисей в биологических мембранах" Биофизика, 1969, 14, с.836-842) известно, что показателем активности антиоксиданта в изученной модели служит величина латентного периода (ЛП, время между завершением быстрой и началом медленной вспышки хемилюминесценции). Этот показатель использовали в настоящих исследованиях.
Типичный вид кинетики индуцированной ионами Fe2+хемилюминесценции суспензии яичного липопротеида приведен на фиг.3, позволяющей рассчитать величину латентного периода.
Поскольку введение веществ с антиоксидантными свойствами приводит к увеличению латентного периода, эффект антиоксиданта оценивали по величине, обратной латентному периоду. Антиокислительную активность (АО) рассчитывали по формуле:
АО = (ЛПоп - ЛПк)/ЛПк; %, где АО - антиокислительная активность, ЛПоп - величина латентного периода в опыте, ЛПк - величина латентного периода в контроле.
Для определения концентрации полумаксимального ингибирования (IC50) строили зависимости 1/ЛП от концентрации антиоксиданта в образцах. После аппроксимации полученной зависимости экспоненциальной функцией рассчитывали концентрацию вещества, приводившую к снижению параметра 1/ЛП на 50%.
Полученные результаты представлены в Таблице 1, где показаны изменения в латентном периоде кинетики индуцированной ионами Fe2+хемилюминесценции суспензии яичного липопротеида в присутствии различных концентраций пропофола и остокоферола и величины антиокислительной активности данных соединений при этих концентрациях (средние значения по 5 экспериментам, m±SD).
Из представленных данных видно, что пропофол обладает более выраженной антиокислительной активностью, чем α-токоферол. Величины IC50 у пропофола и α-токоферола различаются примерно в 10 раз.
Расчетные значения IC50: для пропофола: (5,3±0,3)*10-8 М; для α-токоферола: (5,1±0,1)*10-7М
Заявителем также было проведено сравнительное исследование антиокислительных свойств пропофола и (α-токоферола для антиоксидантной защиты самой эмульсии перфторуглеродов. В исследованиях была использована эмульсия перфторуглеродов под торговым названием заявителя "Аквафтем". Перекисное окисление липидов в исследуемой эмульсии индуцировали либо ионами Fe2+, либо ультрафиолетовым излучением. Продукты перекисного окисления в случае Fe2+ - индуцированного перекисного окисления измеряли хемилюминесцентным методом.
Ультрафиолетовое облучение образцов осуществляли полным спектром излучения ртутно-кварцевой лампы ДРК-120, большая часть испускания которой в ультрафиолетовой части приходится на средневолновый диапазон (УФВ-область, диапазон длин волн 270-320 нм). Образцы подвергали облучению в пластиковых открытых кюветах сверху при толщине облучаемого слоя 2,5 см и непрерывном перемешивании магнитной мешалкой. Доза облучения варьировали за счет изменения его продолжительности.
При анализе фотоиндуцированного темнового автоокисления образцов они подвергались инкубации после облучения в течение 30 минут при 45°С. Инкубацию осуществляли в водном термостате, в стеклянных пробирках, негерметично прикрытых стеклянными пробками (предупреждавшими испарение воды во время инкубации).
Контрольный образец состоял из 9,5 мл калий-фосфатного буфера (KCl 115 мМ; КН2PO4 20 мМ; рН 7,5), 0,5 мл эмульсии перфторуглеродов "Аквафтем" и 0,1 мл этанола. Хемилюминесцентный ответ индуцировали введением 0,5 мл закисленного водного раствора FeSO4·7H2O (10-2 М). Конечная концентрация ионов Fe2+составляла, таким образом, 5×10-4 M.
Исследуемые антиоксиданты вводили в образцы за 5 минут до измерения кинетики хемилюминесценции в виде этанольных растворов, медленно, при непрерывном перемешивании на магнитной мешалке. Объем вводившегося этанола составлял 0,1 мл на 10 мл образца.
В случае индукции перекисного окисления липидов ультрафиолетовым излучением в перфторуглеродной эмульсии "Аквафтем" оценивали накопление продуктов перекисного окисления в образующих окрашенный комплекс с 2-тиобарбитуровой кислотой (ТБК) - активных продуктов ПОЛ. Это связано с тем, что в этом случае чувствительность хемилюминесцентного метода оказалась слишком высокой. Определение ТБК-активных продуктов ПОЛ проводили по методу, описанному в литературе. (Asakawa Т., Matsushita S. Colouric conditions for hydroperoxides detection in biological media. - Lipids, 1980, 15, p.137-140).
Ход исследований состоял в следующем:
- к 1,3 мл образца добавляли 0,15 мл 80%-ного водного раствора трихлоруксусной кислоты;
- смесь интенсивно перемешивали и подвергали центрифугированию в течение 5 минут при 1860 g и комнатной температуре;
- супернатант количественно переносили в чистые пробирки;
- к каждой пробе добавляли 0,13 мл этанольного раствора ионола (ди-трет-бутилфенола, 10-2 М) и 0,65 мл ТБК-реактива (совместный водный раствор 0,5% 2-тиобарбитуровой кислоты и 0,3% додецилсульфата натрия);
- пробирки с образцами негерметично прикрывали стеклянными пробками и инкубировали в течение 15 минут на кипящей водяной бане;
- по окончании инкубации образцы охлаждали до комнатной температуры и в них спектрофотометрически определяли содержание комплексов 2-тиобарбитуровой кислоты и ТБК-активных продуктов ПОЛ.
Хотя основным стабильным продуктом перекисного окисления липидов, дающим окрашенный комплекс с 2-тиобарбитуровой кислотой с максимумом поглощения при 532 нм, является малоновый диальдегид (МДА), возможно образование окрашенных комплексов и с другими соединениями. Поэтому истинное поглощение при 532 нм рассчитывали на основании измерения спектра поглощения образцов в диапазоне длин волн 510-560 нм по величинам оптических плотностей при 514, 532 и 550 нм.
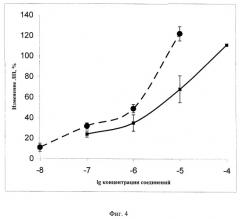
Полученные результаты исследования антиокислительной активности пропофола и α-токоферола в модели перекисного окисления липидов эмульсии перфторуглеродов "Аквафтем", индуцированного ионами Fe2+,представлены на фиг.4, где показаны изменение величины латентного периода кинетики, индуцированной ионами Fe2+, в эмульсии перфторуглеродов "Аквафтем" в присутствии пропофола и α-токоферола.
По оси абсцисс - концентрация добавленного соединения (логарифмический масштаб); по оси ординат - увеличение латентного периода в % к контролю. Приведены данные, усредненные по 5 независимым измерениям.
Расчетные значения IC50: для пропофола: (6,0±1,0)*10-7 М
для α-токоферола: (6,3±2,0)*10-6 М
Полученные данные сведены в Таблицу 2, где показаны изменения в латентном периоде кинетики индуцированной ионами Fe2+ хемилюминесценции эмульсии перфторуглеродов "Аквафтем" в присутствии различных концентраций пропофола и α-токоферола и величины антиокислительной активности данных соединений при этих концентрациях (средние значения по 5 экспериментам, m±SD).
Заявителем было проведено изучение антиокислительной активности пропофола и α-токоферола в отношении перекисного фотоокисления липидов в суспензии "Аквафтем".
В ходе выполнения этой работы регистрировались дозовые зависимости накопления ТБК-активных продуктов перекисного окисления липидов в образцах эмульсии "Аквафтем" (0,5 мл исходной суспензии + 9,5 мл фосфатного буфера) при действии на изучаемые образцы ультрафиолетового излучения в присутствии или в отсутствие в них исследуемых веществ. Пропофол и α-токоферол в концентрации 10-6 М вводились в образцы за 5 минут до начала облучения. Количество ТБК-активных продуктов перекисного окисления липидов в образцах регистрировалось сразу по окончании облучения.
Полученные результаты представлены на фиг.5, где показаны дозовые зависимости накопления продуктов перекисного окисления липидов в смеси из 0,5 мл суспензии "Аквафтем" и 9,5 мл фосфатного буфера (KCl 115 mM; КН2РО4 20 mM; рН 7,5).
По оси абсцисс - продолжительность облучения образца, минуты; по оси ординат - прирост содержания продуктов перекисного окисления липидов, реагирующих с 2-тиобарбитуровой кислотой в % к необлученной пробе.
1 - облучение в присутствии 0,9% этанола;
2 - облучение в присутствии 10-6 М α-токоферола;
3 - облучение в присутствии 10-6 М пропофола;
Приведены данные, усредненные по 5 независимым измерениям. Из данных фиг.5 видно, что по мере увеличения продолжительности воздействия ультрафиолетового излучения на эмульсию "Аквафтем" в облучаемых образцах происходит увеличение содержания ТБК-активных продуктов перекисного окисления липидов. Это указывает на протекание в суспензии во время облучения процесса перекисного фотоокисления липидов. Введение в облучавшиеся образцы за 5 минут до облучения 10-6 М α-токоферола; 10-6 М пропофола снижало накопление продуктов перекисного фотоокисления липидов в облучаемых образцах.
Заявителем было проведено изучение антиокислительной активности пропофола и α-токоферола в отношении темнового фотоиндуцированного перекисного окисления липидов в суспензии "Аквафтем".
Известно, что в образцах, содержащих ненасыщенные жирнокислотные остатки, процесс перекисного окисления липидов продолжает некоторое время развиваться и по окончании действия на них ультрафиолетового излучения. Это связано с тем, что, во-первых, в ходе облучения происходит увеличение стационарной концентрации свободных радикалов, способствующих инициации новых цепей окисления, а, во-вторых, из-за прямого фотолиза снижается количество антиоксидантов в образце. По механизму темновое фотоиндуцированное перекисное окисление липидов ничем не отличается от обычного автоокисления липидов (остатков ненасыщенных жирных кислот в них) при длительной инкубации. Исходя из изложенного, на данном этапе работы изучалось влияние α-токоферола и пропофола на темновое фотоиндуцированное перекисное автоокисление липидов в суспензии "Аквафтем".
Схема экспериментов этой части работы состояла в следующем.
- Готовился образец разбавленной фосфатным буфером суспензии "Аквафтем" (9,5 мл буфера + 0,5 мл "Аквафтем").
- 1,3 мл этого образца отбирались и в них определялось содержание ТБК-активных продуктов перекисного окисления липидов. Назовем эту пробу К0.
- Оставшаяся часть суспензии подвергалась ультрафиолетовому облучению в течение 15 минут. По окончании облучения отбирались еще 1,3 мл образца, в которых проводилось определение содержания ТБК-активных продуктов перекисного окисления липидов. Назовем эту пробу К1.
- Оставшаяся часть облученной суспензии разделялась на 3 пробы. В одну из этих проб вводилось 0,013 мл этанола (проба К2); в другую - 0,013 мл этанольного раствора α-токоферола (10-4 М), в третью - 0,013 мл этанольного раствора пропофола (10-4 М). Конечные концентрации исследуемых веществ в полученных образцах составляли таким образом 10-6 М.
- Все пробы интенсивно перемешивались в течение 5 минут при комнатной температуре, а затем подвергались инкубации на водном термостате в течение 30 минут при 45°С.
- Немедленно по окончании инкубации в пробах определялось содержание ТБК-активных продуктов перекисного окисления липидов.
Величина темнового прироста количества продуктов перекисного окисления липидов в пробе рассчитывалась по следующей формуле:
Абс. прирост = [ТБКАП]П - [ТБКАП]К1,
где [ТБКАП]П - содержание ТБК-активных продуктов перекисного окисления липидов в рассматриваемой пробе, а [ТБКАП]К1 - содержание этих продуктов в пробе К1. Прирост содержания продуктов перекисного окисления липидов в пробе К2 затем принимался за 100%, и все остальные приросты нормировались по отношению к нему.
Результаты этой серии экспериментов представлены на фиг.6, где показаны дозовые зависимости накопления продуктов перекисного окисления липидов в смеси из 0,5 мл суспензии "Аквафтем" и 9,5 мл фосфатного буфера (KCl 115 mM; KH2PO4 20 mM; рН 7,5).
По оси абсцисс - продолжительность облучения образца, минуты; по оси ординат - прирост содержания продуктов перекисного окисления липидов, реагирующих с 2-тиобарбитуровой кислотой в % к необлученной пробе.
1 - облучение в присутствии 0,9% этанола;
2 - облучение в присутствии 10-6 М α-токоферола;
3 - облучение в присутствии 10-6 М пропофола.
Приведены данные, усредненные по 5 независимым измерениям. Из представленных данных видно, что и α-токоферол, и пропофол в концентрации 10-6 М весьма эффективно ослабляют накопление продуктов перекисного окисления липидов в образцах "Аквафтем", наблюдающееся во время темновой инкубации после ультрафиолетового облучения. Количественно это можно выразить следующими цифрами: в присутствии α-токоферола накопление ослабляется в 4,2 раза, в присутствии пропофола - в 17 раз.
Таким образом, в данной модели антиокислительная активность пропофола примерно в 4 раза выше, чем у α-токоферола в той же концентрации.
Проведенные исследования показали, что пропофол обладает более мощной антиокислительной активностью по сравнению с традиционно используемым токоферолом и легко проникает через кожные барьеры, поэтому он может быть использован в косметических средствах в качестве мощного антиоксиданта, проявляя свои защитные свойства при накожном использовании для защиты тканей кожи от неблагоприятных процессов, сопряженных с процессами перекисного окисления (оксидативный стресс, старение, воспалительные процессы и т.д.) и, что не менее важно, защищая от перекисного окисления само косметическое средство.
Содержание перфторуглеродов в эмульсии может составлять 0,2-140% вес./об., предпочтительно 75-120% вес./об., и в конечном итоге оно должно быть таково, чтобы обеспечить концентрацию перфторуглеродов в готовом косметическом и/или дерматологическом средстве на уровне от 5 до 30 вес./об.%.
В качестве эмульгаторов могут быть применены любые, традиционно используемые в таких случаях соединения, но предпочтительно использовать Проксанол, фосфолипиды или лецитин. В качестве перфторуглеродов могут быть использованы перфторалканы и циклоалканы, перфторированные амины и эфиры различного строения, бис(перфторалкил)этилены, перфтороктилбромид, а также их смеси.
В предлагаемом косметическом и/или дерматологическом средстве пропофол используют в эффективных количествах, однако, учитывая высокую антиокислительную активность пропофола, содержание антиоксиданта в средстве может быть существенно снижено.
Следующие примеры иллюстрируют предложение заявителя, не ограничивая его по существу.
Пример 1.
В реактор (вакуум 0,4-0,5 атм) заливают 20 кг воды (t 65-70°C) и добавляют 62,1 кг предварительно приготовленной масляной фазы (приготовление масляной фазы см. ниже), полученную смесь гомогенизируют 5 мин при 2500 об/мин, добавляют в нее 320 кг воды t° 65-67° и гомогенизируют 5 мин при 3000 об/мин. Затем к полученной эмульсии добавляют 1 кг карбопола в 50 кг воды (приготовление карбопола см. ниже), 4.5 кг Гермабена II и 13.5 кг глицерина, продолжая гомогенизировать при 1500 об/мин. После охлаждения смеси до 35-40°С в нее добавляют 1 кг триэтаноламина и затем при включенной мешалке добавляют отдушки и 2,5 кг Аквафтэма. Перемешивают до получения однородной массы, измеряют рН и при необходимости доводят его до значения рН 6,0-6,5 триэтаноламином.
Приготовление масляной фазы
В плавильный котел загружают 9 кг каприлик/каприк триглицеридов, 6,75 кг миндального масла, 4.5 кг масла какао, 9 кг масла макадамии, 2,25 кг диметикона, 5,85 кг стеариновой кислоты, 11,25 кг воска эмульсионного, 6,75 кг глицерил стеарата и 4,5 кг ПЭГ стеарата. Полученную смесь нагревают до 65-70°С при постоянном перемешивании. Перед загрузкой в реактор в масляную фазу добавляют 0,25 кг токоферола.
Приготовление карбопола
В 50 кг воды (t 30°C) засыпают 1 кг карбопола Ультрез 10 и оставляют для набухания на мешалке до получения однородной массы.
Пример 2.
В реактор (вакуум 0,4-0,5 атм) заливают 300 кг воды (t 65-70°C) и добавляют 0,18 кг ЭДТА и предварительно приготовленный раствор ксантановой камеди в глицерине (приготовление раствора ксантановой меди см. ниже). Смесь гомогенизируют при 2000 об/мин, после чего в нее добавляют 44,4 кг масляной фазы (приготовление масляной фазы см. ниже) и, продолжая гомогенизтровать, охлаждают до 40°С. Затем в полученную массу добавляют 4,5 кг гермабена, отдушки и 9 кг Аквафтэма. Перемешивают до получения однородной массы, измеряют рН и при необходимости доводят его до значения рН 6,5-7,0 триэтаноламином.
Приготовление раствора ксантановой меди.
В 20 кг воды (t 60°C) постепенно добавляют 0,45 кг диспергированной в 13,5 кг глицерина ксантановой меди и интенсивно перемешивают на скоростной мешалке в течение 15-20 минут.
Приготовление масляной фазы
В плавильный котел загружают 9 кг каприлик/каприк триглицеридов, 6 кг миндального масла, 3.15 кг масла какао, 6,75 кг масла Ши, 5,0 кг микрокристаллического воска, 9 кг ПЭГ-8 пчелиного воска и 5 кг спирта цетилового, 0,15 кг пропофола.
Полученную смесь нагревают до 65-70°С и перемешивают до однородной массы.
Регулярное применение полученных кремов позволяет снять раздражение, покраснение и улучшить цвет кожных покровов; придать коже свежий здоровый вид, существенно сгладить морщины.
Однако, благодаря использованию пропофола, срок годности второго крема увеличился до 18 месяцев; на протяжении этого времени крем не изменил своего запаха и цвета. Срок годности первого крема с токоферолом составлял 12 месяцев. Кроме того, крем с пропофолом оказался более эффективен в плане снятия раздражения и покраснения кожи.
| Таблица 1. | ||||
| №№ | Добавка | Антиокислительная активность | Латентный период | Обратный латентный период (1/ЛП) |
| Время (минуты) | % от ко |