Фармацевтическое средство для лечения вич-инфекции, содержащая его композиция и способы его применения
Иллюстрации
Показать всеИзобретение относится к фармакологии и медицине и касается фармацевтического средства для лечения ВИЧ-инфекции и содержащее: ингибитор слияния для лечения ВИЧ-инфекции, содержащий аминокислотную последовательность:
X-SWETWEREIENYTKQIYKILEESQEQQDRNEKDLLE-Z (SEQ ID NO:1), в которой: Х представляет аминогруппу или -X1-Х2, где X1 означает иминогруппу и Х2 выбирают из группы, состоящей из ацетильной группы, гидрофобной группы и макромолекулярной несущей группы; Z представляет карбоксильную группу или -Z1-Z2, где Z1 означает карбонильную группу и Z2 выбирают из группы, состоящей из аминогруппы, трет-бутилоксикарбонильной группы, гидрофобной группы и макромолекулярной несущей группы. Указанный ингибитор обладает сильной ингибирующей активностью в отношении ВИЧ-инфекции. 5 н. и 3 з.п. ф-лы, 5 ил.
Реферат
Перекрестная ссылка на родственные заявки
Данная заявка притязает на приоритет китайской заявки на патент № 01130985.7, поданной 29 августа 2001 г., в настоящее время китайский патент № ZL 01130985.7, заявки РСТ/CN02/99405, поданной 6 июня 2002 г., содержание которых полностью включено в данное описание изобретения в качестве ссылки.
Область техники
Настоящее изобретение относится к ингибитору слияния, который можно использовать для лечения ВИЧ-инфекции.
Предпосылки изобретения
1. ВИЧ и эпидемия СПИДа
Инфицирование вирусом иммунодефицита человека (ВИЧ), который является патогенным ретровирусом, может вызвать синдром приобретенного иммунодефицита (СПИД) (Barre-Sinossi, F. et al., 1983, Science 220:868-870). Несмотря на то что макрофаги, нейроны и другие клетки могут быть инфицированы ВИЧ (Maddon et al., 1986, Cell 47:333-49), главными клетками-мишенями для ВИЧ являются лимфоциты CD4+ (Dalgleish, A. et al., 1984, Nature 312:767-8), так как ВИЧ обладает сильным сродством к молекулам CD4 на поверхности клеток CD4+. ВИЧ-инфекция, попавшая в организм человека, разрушает так много лимфоцитов CD4+, что организм начинает утрачивать иммунную функцию, в результате чего больной СПИДом становится восприимчивым к разным инфекциям, нарушениям функции нервных клеток, опухолям и другим заболеваниям. Больные, у которых возникают указанные симптомы, в конце концов умирают (edited by Levy, J.A.: Acute HIV infection and susceptible cells, published in USA, 2000, Page 63-78).
Из-за тяжести симптомов и высокого коэффициента смертности эпидемическое распространение СПИДа стало одной из главных причин, угрожающих здоровью человека. В настоящее время число ВИЧ-инфицированных людей во всем мире составило в общей сложности 57900000. 21800000 человек умерли от СПИДа за последнее десятилетие. Установлено, что в 2000 г. были ВИЧ-инфицированы 5300000 человек. В Китае наблюдается быстрое распространение ВИЧ-инфекции. По оценке экспертов, в 2000 г. число людей с положительной реакцией на ВИЧ превысило 800000-1000000, причем в указанное число входят как взрослые, так и дети (отчет ВОЗ за 2000 г., UNAIDS and WHO).
В настоящее время обнаружены по крайней мере два типа ВИЧ: ВИЧ-1 (Gallo, R. et al., 1984, Science 224:500-503) и ВИЧ-2 (Clavel, F. et al., 1986, Science 223:343-346). Оба типа вируса обладают высокой генетической гетерогенностью. Только ВИЧ-1 имеет не менее 11 разных генотипов (подтипы A-J и О) (Jonassen, T.O. et al., 1997, Virol. 231:43-47). Подтип Е ВИЧ-1 распространен главным образом в Центральной Африке, Таиланде, Индии, Вьетнаме, Кампучии, Малайзии, Бирме, Китае и западном полушарии (отчет ВОЗ за 1996 г.). Подтипы ВИЧ, обнаруженные в Китае, представляют в основном подтипы В, Е или С (Yu, E.S. et al., 1996, American J. Public Health 86(8 Pt1): 1116-22).
Репродуктивный цикл ВИЧ включает несколько важных стадий. Сначала гликопротеин gp120 вирусной оболочки прикрепляется к мембране клетки-хозяина посредством специфического связывания с молекулой CD4, находящейся на поверхности лимфоцита Т4. При помощи корецептора хемокина оболочка вируса сливается с мембраной клетки-хозяина (Berger, E.A., et al., 1999, Ann. Rev. Immunol., 17:657-700). После слияния вирион ВИЧ, упакованный в нуклеокапсид, проникает в клетку-хозяина, при этом капсид разрушается и выделяется нуклеиновая кислота вируса. Обратная транскриптаза вируса катализирует транскрипцию одноцепочечной РНК ВИЧ в одноцепочечную ДНК, которая затем трансформируется в двухцепочечную ДНК в результате катализа клеточной полимеразой. Двухцепочечная ДНК может свободно существовать в цитоплазме или встраиваться в виде провируса в хромосомную ДНК хозяина в результате катализа вирусной интегразой, вследствие чего происходит латентное инфицирование ВИЧ (Roe, T. et al., 1997, J.Virol. 71(2):1334-40). Провирус, который нельзя вырезать из хромосомы хозяина, является очень устойчивым и репродуцируется вместе с репликацией хромосомы хозяина. После трансляции мРНК ВИЧ в полипротеин большой длины вирусные протеазы разрезают данный полипротеин и процессируют его с образованием структурных белков зрелого вируса (Xiang, Y. & Leis, J., 1997, J.Virol. 71(3):2083-91). Затем происходит сборка указанных структурных белков и нуклеиновых кислот ВИЧ с образованием новых вирусных гранул, которые высвобождаются из клетки путем баддинга (Kiss-Lazozlo, Hohn, T., 1996, Trends in Microbiology 4(12):480-5).
Основные стадии репликации ВИЧ можно кратко охарактеризовать следующим образом: 1) прикрепление к клеточной оболочке и проникновение в клетку-хозяин в результате процесса слияния; 2) обратная транскрипция и встраивание в хромосому; 3) трансляция и процессинг белка; 4) сборка и высвобождение вируса.
2. Лечение ВИЧ-инфекции
Несмотря на большие многолетние усилия, направленные на создание эффективных способов лечения и профилактики, до сих пор не существует действенной вакцины или способа лечения СПИДа.
Идеальная вакцина должна быть безвредной и способной индуцировать нейтрализующие антитела, а также устойчивые иммунные реакции в слизистой оболочке и крови (Levy, J.A., and Levy, J.A., 1988, Trens Med. Rev. 2:265-71). Многие вакцины против ВИЧ, создаваемые в настоящее время в мире, все еще находятся на стадиях экспериментов на животных. Хотя вакцины против белков gp160 и gp120 оболочки ВИЧ уже прошли первую, вторую или третью стадии клинических испытаний, результаты таких испытаний являются неутешительными. Многие вакцины, которые эффективно предотвращают инфицирование ВИЧ у лабораторных животных, оказываются неэффективными для человека (McElrath, M.J. et al., 1996, Pro. Natl. Acad. Sci. USA 93:3972-77). То, что ученые не добились значительных успехов в создании вакцины против ВИЧ, можно объяснить сложностью и вариабельностью генетических веществ ВИЧ (Bloom, B.R., 1996, Science 272:1888-1900).
Лекарственные средства против СПИДа, нашедшие признание во всем мире, можно классифицировать в две категории: ингибиторы обратной транскриптазы ВИЧ (Charles, C.J. et al., 1996, JAMA 276:146) и ингибиторы протеазы ВИЧ (Miles, S.A. et al., International AIDS Society USA 4(3):15). Лекарственные средства, относящиеся к обеим категориям, воздействуют на более поздние стадии репликации ВИЧ-инфекции - транскрипцию и сборку новых вирусов. Хорошо известная "смешанная терапия" представляет комбинированное лечение с использованием ингибиторов обоих типов (Lafeuillade, A. et al., 1997, J. Infect. Dis. 175:1051-55).
Ингибиторы обратной транскриптазы, включающие AZT, ddI, ddC, 3TC, d4Т и т.д., рано или поздно вызывают лекарственную устойчивость, в результате чего вирусы становятся менее восприимчивыми к указанным лекарственным средствам, поэтому эффективные ингибирующие концентрации лекарственных средств увеличиваются в несколько раз или даже в десятки раз (Vella, S. and Floridia, M., 1996, International AIDS Society USA 4(3): 15). Подобная лекарственная устойчивость обусловлена высокой частотой мутаций ВИЧ. В организме человека один вирус ВИЧ может ежедневно продуцировать 108-1010 новых вирусных гранул, при этом частота мутаций равна 3×105 в одном цикле репликации. Множество миссенс-мутаций, воздействующих на экспрессию аминокислот, может произойти в регуляторных генах и белках оболочки. В некоторых штаммах ВИЧ частота мутаций может охватывать до 40% аминокислотных последовательностей определенных генов (Myers, G. and Montaner. J.G., 1992, The Retroviridae vol.1, Plenum Press, New York 51-105). В результате этого ингибиторы обратной транскриптазы вызывают лекарственную устойчивость, облегчая пролиферацию устойчивых штаммов, которые появляются до и после мутаций наряду с контрольными чувствительными вирусными штаммами.
Кроме того, все ингибиторы обратной транскриптазы характеризуются специфической токсичностью в зависимости от дозы. Возникающие симптомы включают подавление функции спинного мозга, рвоту, нарушение функции печени, мышечную слабость, заболевания периферической нервной системы и воспаление поджелудочной железы. Многим субъектам приходится приостанавливать лечение из-за непереносимых побочных эффектов (Fischl, M.A., et al., 1987, N. Engl. J. Med. 317:185-91; Lenderking, W.R., et al., 1994, N. Engl. J. Med. 330:738-43).
Лекарственная устойчивость также является важной проблемой при использовании ингибиторов протеазы. Мутации гена вирусной протеазы вызывают лекарственную устойчивость при использовании всех ингибиторов протеазы, применяемых в настоящее время для лечения СПИДа (Condra, J.H. et al., 1995, Nature 374:569-71). Побочные эффекты, вызываемые ингибиторами протеазы, включают нарушение функции печени, расстройство желудочно-кишечного тракта, почечно-каменную болезнь, онемение тканей вокруг рта, нарушение липидного обмена и психическое расстройство (Deeks, et al., 1997, JAMA 277:145-53).
Большинство используемых в настоящее время лекарственных средств против ВИЧ являются высокотоксичными и вызывают лекарственную устойчивость. Поэтому по-прежнему существует непреодолимое препятствие при лечении ВИЧ-инфекции. Несомненно, существует острая нужда в новых лекарственных средствах для лечения ВИЧ-инфекции, характеризующихся большей эффективностью и меньшей токсичностью.
Необходимы новые лекарственные средства, направленно воздействующие на разные стадии цикла репликации ВИЧ. После фундаментального исследования ВИЧ и СПИДа недавно были созданы несколько лекарственных средств против СПИДа с новыми механизмами действия. Указанные лекарственные средства включают некоторые новые ингибиторы обратной транскриптазы ВИЧ и ингибиторы протеазы ВИЧ, а также некоторые новые лекарственные средства против ВИЧ, направленно воздействующие на другие указанные здесь мишени (De, C.E., 2000, Rev. Med. Virol. 10(4):255-77).
1) Абсорбенты вирусов, такие как лаурилсульфат натрия, сульфат декстрозы и гепарин, могут препятствовать сцеплению gp120 на оболочке ВИЧ с лимфоцитом благодаря воздействию полианионных групп. Однако указанные абсорбенты характеризуются плохой специфичностью и высокой токсичностью. Некоторые из них даже могут увеличивать вирусный потенциал (Baba, M. et al., 1988. Pro. Natl. Acad. Sci. USA, 85:6132-6).
2) Растворимые CD4 используют для предотвращения связывания gp120 с клетками-хозяевами. Некоторые рекомбинантные растворимые CD4 могут связывать вирусные гранулы до контактирования gp120 с молекулами CD4 на клеточной мембране и предотвращать распространение ВИЧ-инфекции. Однако указанные рекомбинантные растворимые CD4 не оказывают выраженного воздействия на штаммы ВИЧ-1, выделенные у некоторых пациентов. Кроме того, клинические эксперименты не позволили получить надежные данные, свидетельствующие об их антивирусной активности (Gomatos, P.J. et al., 1990, J.Immunol. 144:4183-9).
3) Хемокины и их аналоги, включающие RANTES, MIP-1α, MIP-1β, связывающийся с CCR5, и SDF, связывающийся с CXCR4, можно использовать для предотвращения проникновения ВИЧ в клетки-хозяева. Указанные средства могут не только конкурентно блокировать сцепление gp120 ВИЧ с клеточными корецепторами хемокина, но и ограничивать участки проникновения ВИЧ, подавляя экспрессию указанного корецептора на клетке. Самые последние блокаторы корецептора хемокина включают положительно заряженные короткие пептиды, такие как ALX40-4C и Т22, и соединения, такие как AMD3100, ТАК-779 и трихосантин.
4) Хотя растворимый CD4-IgG может подавлять репликацию ВИЧ in vitro, указанное вещество не демонстрирует надежную антивирусную активность при выполнении клинических испытаний.
5) Лекарственные средства, такие как 2,2'-дитио-бис-бензамиды (DIBA) и азадикарбонамид (ADA), могут блокировать сборку и распад вирусов в результате взаимодействия с цинксодержащим пальцеобразным сайтом NCp7.
6) Сегмент gp41 или его аналог можно использовать в качестве ингибитора слияния. Например, Т-20 способен блокировать проникновение вируса в клетку (Jiang, S. et al., 1993, Nature 365:113).
7) Ингибиторы транскриптазы вирусной мРНК, такие как CGP64222, фторхинолон К-12 и ЕМ2487.
8) Ингибиторы интегразы, такие как производные карбонила J [N,N'-бис-(2-(5-гидрокси-7-нафталинсульфоновая кислота)мочевины], могут предотвращать встраивание генома ВИЧ в геном лимфоцита хозяина (Maurer K., et al., 2000, Bioorg Chem 28(3): 140-155).
3. Ингибиторы слияния, блокирующие проникновение вируса в клетки
Многие биологические процессы включают слияние мембран. В эукариотических клетках постоянно происходит слияние клеточных мембран, включая эндоцитоз, секрецию, рециркуляцию мембранных компонентов и так далее (White, J. M., 1992, Science 258:917-24). Примеры слияния в некоторых конкретных клетках включают секрецию гормона регулируемого слияния, фермента и нервных медиаторов. Некоторые более известные примеры включают слияние зародышевых клеток и мышечных клеток.
В соответствии с одним вариантом осуществления настоящего изобретения лекарственное средство, препятствующее слиянию клеток или слиянию мембран, представляет вещество, которое ингибирует или подавляет слияние двух или большего числа биологических мембран. В соответствии с одним вариантом осуществления настоящего изобретения две или большее число биологических мембран являются клеточными или вирусными структурами, такими как клеточная мембрана и оболочка вируса. В соответствии с одним вариантом осуществления настоящего изобретения антивирусное средство представляет соединение, которое ингибирует инфицирование клеток вирусом, например, ингибирует слияние вируса с клеткой или слияние клеток. В соответствии с одним вариантом осуществления настоящего изобретения инфицирование представляет слияние мембран, например, при инфицировании клеток вирусом с оболочкой, и другие процессы, аналогичные слиянию вирусов с клетками, которые происходят во время бактериальной конъюгации.
И наконец, слияние мембран является главной стадией процесса воздействия вируса с оболочкой на клетки-хозяева и проникновения в указанные клетки (Weissenhorn, W. et al., 1997, Nature 387:426-30). Лекарственное средство против ВИЧ по настоящему изобретению, в частности фузонекс и его производные, представляет блокатор слияния, предотвращающий проникновение вирусов в клетки-хозяева.
Процесс слияния контролируется гликопротеинами в оболочке ВИЧ. Предшественником гликопротеинов является gp160, содержащий полисахаридные группы. В процессе репродукции вируса gp160 гидролизуется определенной протеазой с образованием двух субъединиц: gp120, находящегося снаружи оболочки, и gp41, являющегося трансмембранным белком. После гидролиза gp120 и gp41 все еще остаются связанными нековалентными связями и полимеризованными в виде тримеров снаружи вирусной гранулы. Трансмембранный белок gp41, эктодомен которого имеет высокоспиральную структуру, обладает очень эффективным механизмом инициации слияния мембран и известен как главная молекула, открывающая доступ в клетки благодаря ее непосредственному участию в процессе слияния клеточных мембран (Ferrer, M., et al., 1999, Nat. Struct. Biol. 6(10):953-60; Zhou, G., et al., 2000, 1:Bioorg. Med. Chem. 8(9):2219-27).
Анализ дифракции на кристалле продемонстрировал, что при слиянии вирусов с клетками ядро gp41 состоит из шести спиральных пучков, в которых N-концевая и С-концевая спирали образуют три "шпильки", которые крепят оболочку ВИЧ к клеточной мембране. Хотя тример gp41 может образовывать отверстие для слияния, которое облегчает проникновение вируса в клетку-хозяин (Chan, D.C. et al., 1997, Cell 89:263-73), он существует в виде неустойчивой естественной неслитой конформации на поверхности свободной вирусной гранулы, только что высвободившейся из инфицированных клеток. Сначала N-концевая спираль завертывается внутрь С-концевой спирали, благодаря чему скрывается N-концевая область слияния, затем после объединения gp120 на поверхности вируса с рецептором CD4 и корецептором хемокина на клеточной мембране происходит активируемое рецептором конформационное изменение gp41, в результате которого N-конец проникает с поверхности вируса в клеточную мембрану хозяина. В это время gр41 трансформируется из неустойчивой естественной неслитой конформации в промежуточную конформацию "прошпильки". Когда С-концевой и N-концевой пептиды gp41 связываются друг с другом, обнажается гидрофобное N-концевое ядро тримерной структуры и промежуточная "прошпилька" трансформируется в более энергостабилизированную конформацию "шпильки", и к этому времени оболочка вируса сливается с клеточной мембраной (Jones, P.L. et al., 1998, J. Biol. Chem. 273:404).
Впервые обнаруженный ингибитор слияния представляет пептид, содержащий 36 аминокислот и выделенный из С-конца (127-162) gp41, который получил название Т-20 и имеет нижеследующую последовательность:
X-YTSLIHSLIEESQNQQEKNEQELLELDKWASLWNWF-Z
Структурное сходство Т-20 с С-концом gp41 позволяет ему конкурировать с С-концевым пептидом gp41 за связывание с N-концевой областью слияния. Т-20, находящийся на поверхности Т-клетки в очень низкой концентрации, может препятствовать слиянию gp41 ВИЧ с клеточной мембраной хозяина (значение IC50 находится в диапазоне нМ) (Jiang, S. et al., 1993, Nature 365:113; Wild, C.T. et al., 1994, Pro. Natl. Acad. Sci. USA 91:9770-74). В состоянии "прошпильки", которое сохраняется в течение многих минут, Т-20 эффективно препятствует связыванию С-концевого пептида gp41 с N-концевой областью слияния, блокируя таким образом образование "шпильки" между оболочной вируса и клеточной мембраной (Kliger, Y. and Shai, Y., 2000, J. Mol. Biol. 295:163-8).
Так как ингибитор слияния действует на клеточной мембране, не нужно обеспечивать его проникновение внутрь клеток для выполнения указанной функции. В отличие от этого все лекарственные средства против ВИЧ, применяемые в настоящее время в клинической практике, действуют на средней или поздней стадии инфицирования вирусом клеток-хозяев, из чего следует, что их нужно сначала ввести в клетки для подавления репродукции проникшего в клетку ВИЧ. Кроме того, высококонсервативная аминокислотная последовательность гидрофобного ядра gp41 позволяет предположить, что, по-видимому, вирус будет не в состоянии выработать лекарственную устойчивость к ингибиторам слияния. Результаты экспериментов in vitro показывают, что Т-20 может специфически блокировать проникновение ВИЧ в клетки. С другой стороны, на первой и второй стадиях клинических испытаний было установлено, что больные СПИДом хорошо переносят введение Т-20. Т-20 не оказывает токсического воздействия на спинной мозг, и большинство побочных эффектов выражены в низкой или средней степени. При суточной дозе, равной 200 мг, Т-20 может существенно уменьшить ВИЧ-потенциал у большинства субъектов, причем у 30% субъектов вирусный потенциал снижается ниже обнаруживаемого уровня (менее 400/мл). Кроме того, Т-20 эффективно воздействует на ВИЧ-инфицированных субъектов, у которых уже возникла лекарственная устойчивость. В научной литературе приведены данные об увеличении количества клеток CD4+ у некоторых субъектов после введения Т-20 (Kilby, J.M. et al., 1998, Nat. Med. 4:1302-1307). Некоторое беспокойство вызывал тот факт, что при длительном введении Т-20 может индуцировать образование специфических антител против Т-20, в результате чего у больных СПИДом появится устойчивость к Т-20. Тем не менее, при выполнении эксперимента в течение нескольких недель Т-20 сохранял антивирусную активность на протяжении всего времени (Pilcher, C.D. et al., 1999, AIDS 13(15): 2171-4).
По сравнению с ингибиторами обратной транскриптазы и ингибиторами протеазы ВИЧ, применяемыми в настоящее время в клинической практике, ингибитор слияния Т-20 обладает такими преимуществами, как более высокая эффективность, более низкая токсичность и отсутствие лекарственной устойчивости. Однако клиническая доза Т-20, равная 200 мг в сутки, является показателем плохой устойчивости указанного средства и низкого противодействия слиянию. Кроме того, из-за высокой дозы Т-20 вызывает некоторые местные реакции у некоторых субъектов (Kilby, J.M. et al., 1998, Nat. Med. 4:1302-1307).
Краткое изложение существа изобретения
Настоящее изобретение относится к ингибиторам слияния, обладающим высокой устойчивостью и высоким потенциалом лечения ВИЧ-инфекции. Ингибиторы слияния согласно настоящему изобретению можно использовать при комбинированном лечении СПИДа, при изготовлении лекарственных средств или в других случаях. По сравнению с Т-20 ингибиторы согласно настоящему изобретению обладают более высокой эффективностью, характеризуются более низкими дозами введения и, как следствие этого, более низкой токсичностью.
В соответствии с одним вариантом осуществления настоящего изобретения ингибитор слияния представляет специфический пептид, содержащий 36 аминокислотных остатков, к обоим концам которого добавлены концевые кэппирующие группы.
Настоящее изобретение относится к нижеследующим технологическим схемам.
В соответствии с предпочтительным вариантом осуществления настоящего изобретения ингибитор слияния представляет пептид, выделенный из трансмембранного гликопротеина gp41 ВИЧ. В соответствии с другим предпочтительным вариантом осуществления настоящего изобретения указанный пептид имеет аминокислотную последовательность, представленную в SEQ ID NO:1 и приведенную ниже:
X-SWETWEREIENYTKQIYKILEESQEQQDRNEKDLLE-Z (SEQ ID NO:1)
В указанном пептиде (именуемом также "фузонекс" в приводимом ниже описании изобретения):
Х представляет аминогруппу или -Х1-Х2, где Х1 означает иминогруппу и Х2 означает ацетильную группу, гидрофобную группу или макромолекулярную несущую группу, причем гидрофобная группа предпочтительно является карбобензоксигруппой, дансильной группой, трет-бутилоксикарбонильной группой или 9-флуоренилметилоксикарбонильной группой; макромолекулярная несущая группа является хелатным комплексом липид - жирная кислота, полиэтиленгликолем или углеводом;
Z представляет карбоксильную группу или -Z1-Z2, где Z1 означает карбонильную группу и Z2 означает аминогруппу, трет-бутилоксикарбонильную группу, гидрофобную группу или макромолекулярную несущую группу.
Используемые в данном описании изобретения однобуквенные коды, служащие для обозначения аминокислотных остатков, имеют нижеследующие значения:
| А | аланин |
| R | аргинин |
| N | аспарагин |
| D | аспарагиновая кислота |
| C | цистеин |
| Q | глутамин |
| E | глутаминовая кислота |
| G | глицин |
| H | гистидин |
| I | изолейцин |
| L | лейцин |
| K | лизин |
| M | метионин |
| F | фенилаланин |
| P | пролин |
| S | серин |
| T | треонин |
| W | триптофан |
| Y | тирозин |
| V | валин |
В соответствии с предпочтительным вариантом осуществления настоящего изобретения Х2, или Z2, либо оба вместе означают гидрофобную группу. Гидрофобная группа представляет карбобензоксигруппу, дансильную группу, трет-бутилоксикарбонильную группу или 9-флуоренилметилоксикарбонильную группу.
В соответствии с альтернативным вариантом осуществления настоящего изобретения Х2, или Z2, либо оба вместе означают макромолекулярную несущую группу. Макромолекулярная несущая группа представляет хелатный комплекс липид - жирная кислота, полиэтиленгликоль или углевод.
В другом предпочтительном варианте осуществления настоящего изобретения вышеуказанный Х2 означает ацетильную группу и Z2 означает аминогруппу.
В соответствии с одним вариантом осуществления настоящего изобретения композиция, предназначенная для комбинированного лечения СПИДа, содержит указанный ингибитор и по крайней мере один компонент, выбранный из группы, включающей ингибиторы обратной транскриптазы, ингибиторы вирусной протеазы, ингибиторы гликозидазы, ингибиторы кэппирования вирусной мРНК, амфотерицин В, связующие молекулы кастаноспермина сложноэфирной связи, обладающие анти-ВИЧ активностью, гидроксимочевину, α-интерферон, β-интерферон и γ-интерферон.
В соответствии с предпочтительным вариантом осуществления настоящего изобретения ингибитор обратной транскриптазы является по крайней мере одним веществом, выбранным из группы, включающей AZT(3'-азид-2',3'-дидезоксицитидин), ddI (2',3'-дидезоксиинозин), ddC (2',3'-дидезоксицитидин), ddA (2',3'-дидезоксиаденозин), d4T (2',3'-дидезоксидидезокситимидин), 3ТС, невирапин, атевирапин, делавирдин, PMEA, PMPA и/или ловирид; ингибитор гликозидазы представляет SC-48334, или MDL-28574, либо оба вместе; ингибитор кэппирования вирусной мРНК представляет рибовирин.
Настоящее изобретение относится также к ингибитору, который вводят для лечения ВИЧ-инфекции в виде инъекции дозированной лекарственной формы для перорального введения, дозированной лекарственной формы для ректального введения или дозированной лекарственной формы для чрескожного введения.
Композицию, содержащую указанный ингибитор, можно также вводить для лечения ВИЧ-инфекции в виде инъекции, дозированной лекарственной формы для перорального введения, дозированной лекарственной формы для ректального введения или дозированной лекарственной формы для чрескожного введения.
Указанный ингибитор можно получить обычными способами, известными в данной области. Например, короткие пептиды можно синтезировать на определенном носителе или в растворе. Более длинные пептиды можно получить методами рекомбинантных ДНК или синтезировать в виде нескольких отдельных сегментов и затем соединить друг с другом. Нуклеотидную последовательность, кодирующую данный пептид, можно синтезировать и/или клонировать и экспрессировать методами, известными специалистам в данной области.
Одну или несколько пептидных связей ингибитора, соединяющих аминокислотные остатки, можно заменить непептидными связями, включающими (не ограничиваясь ими) имино, сложноэфирные, фталгидразидные, семикарбазидные, азосвязи и т.д. Реакции замены непептидных связей хорошо известны специалистам в данной области. Указанный пептид может быть синтезирован путем введения других химических групп в его аминоконец и/или карбоксильный конец для усиления устойчивости, биологической доступности и/или ингибирующей активности и т.д. Например, к аминоконцу можно добавить гидрофобные группы, такие как карбобензоксигруппа, дансильная группа или трет-бутилоксикарбонильная группа, и в аминоконец может быть также введен ацетил или 9-флуоренилметилоксикарбонил. К карбоксильному концу пептида можно добавить вышеуказанную гидрофобную группу, трет-бутилоксикарбонильную группу или аминогруппу. Кроме того, пептид можно синтезировать, изменяя его пространственную конфигурацию. Например, можно использовать D-изомеры одной или нескольких аминокислот пептида вместо обычных L-изомеров. По крайней мере один аминокислотный остаток пептида по настоящему изобретению можно заменить известным неприродным аминокислотным остатком, чтобы усилить устойчивость, биологическую доступность и/или ингибирующую слияние активность данного пептида.
Кроме того, любые вышеуказанные пептиды могут содержать непептидную макромолекулярную несущую группу, связанную с аминоконцом и/или карбоксильным концом при помощи ковалентной связи, которая включает (не ограничиваясь ими) хелатный комплекс липид - жирная кислота, полиэтиленгликоль или углевод.
Краткое описание чертежей
На фигуре 1 показана аминокислотная последовательность фузонекса (SEQ ID NO:1), которая представляет полипептид, состоящий из 36 аминокислот. Фузонекс выделен из аминокислотной последовательности (117-151) (SEQ ID NO:2) у С-концевого пептида gp41 ВИЧ-1 (подтип Е). На всех фигурах для обозначения аминокислот использованы вышеуказанные однобуквенные коды.
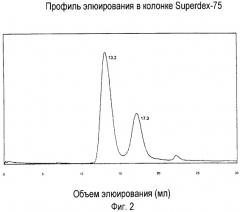
На фигуре 2 показан профиль элюирования в хроматографической колонке Superdex, на котором изображены характеристические пики фузонекса и комплекса фузонекса с N-концевым пептидом gp41 (35-70).
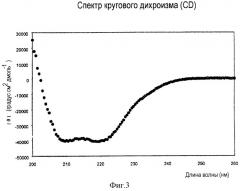
На фигуре 3 показаны спектры кругового дихроизма макромолекулярной вторичной структуры комплекса фузонекса с N-концевым пептидом gp41 (35-70).
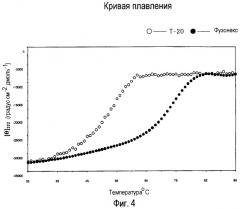
На фигуре 4 показаны результаты сравнения устойчивости фузонекса и Т-20, где кривая с правой стороны (закрашенные кружки) представляет кривую плавления комплекса фузонекса с N-концевым пептидом gp41 и кривая с левой стороны (незакрашенные кружки) представляет кривую плавления комплекса Т-20 с N-концевым пептидом gp41. Как видно, в интервале температур 35-80°С фузонекс является более устойчивым, чем Т-20 при той же температуре.
На фигуре 5 показаны величины ингибирующей слияние активности фузонекса и Т-20. В данном эксперименте для количественного анализа ингибирующей слияние активности фузонекса (кружки) и Т-20 (квадратики) использована активность люциферазы. Слияние клеток было индуцировано gp160НХВ ВИЧ-1. Когда эффекторная клетка, экспрессирующая ген gp160НХВ и ген полимеразы Т7, сливается с клеткой-мишенью, экспрессирующей ген CD4 и ген-репортер люциферазы, происходит экспрессия гена люциферазы и возникает химическая флуоресценция. Результаты данного эксперимента свидетельствуют о 100% активности люциферазы в контрольной группе при отсутствии любого ингибитора слияния. При одинаковой концентрации фузонекс характеризуется лучшей ингибирующей активностью, чем Т-20, что установлено на основании сравнения их активности ингибирования слияния клеток, индуцированного gp160НХВ ВИЧ-1.
Подробное описание изобретения
На основании анализа трехмерной структуры gp41 получен новый ингибитор слияния, названный фузонексом, который является объектом настоящего изобретения. Ниже дано подробное описание антивирусного пептида по настоящему изобретению.
1. Фузонекс является полипептидом, состоящим из 36 аминокислотных остатков. Фузонекс (SEQ ID NO:1) выделен из сегмента (аминокислотная последовательность, содержащая остатки 117-152) (SEQ ID NO:2) С-концевого пептида эктодомена трансмембранного белка gp41 ВИЧ-1 (подтип Е), который имеет нижеследующую аминокислотную последовательность:
WIEWEREISNYTNQIYEILTESQNQQDRNEKDLLE (SEQ ID NO:2)
2. К N-концу добавлен S (серин), так как серин обычно добавляют к N-концу α-спирали для увеличения ее устойчивости.
3. I (изолейцин) заменен E (глутаминовой кислотой) в положении остатка 118, в результате чего возникает взаимодействие зарядов с R (аргинином) в положении остатка 122, что может увеличивать устойчивость α-спирали.
4. Е (глутаминовая кислота) заменен Т (треонином) в положении остатка 119 для закрытия гидрофобного кармана, включающего остатки W (триптофан) 117, W120 и W60.
5. S (серин) заменен Е (глутаминовой кислотой) в положении остатка 125, в результате чего возникает взаимодействие зарядов с К (лизином) в положении остатка 129, что может увеличивать устойчивость α-спирали.
6. N (аспарагин) заменен К (лизином) в положении остатка 129, в результате чего возникает взаимодействие зарядов с Е (глутаминовой кислотой) в положении остатка 125, что может увеличивать устойчивость α-спирали.
7. Е (глутаминовая кислота) заменен К (лизином) в положении остатка 133, в результате чего возникает взаимодействие зарядов с Е (глутаминовой кислотой) в положениях остатков 136 и 137, что может увеличивать устойчивость α-спирали.
8. Т (треонин) заменен Е (глутаминовой кислотой) в положении остатка 136, в результате чего возникает взаимодействие зарядов с К (лизином) в положении остатка 133, что может увеличивать устойчивость α-спирали.
9. N (аспарагин) заменен Е (глутаминовой кислотой) в положении остатка 140, в результате чего возникает взаимодействие зарядов с R (аргинином) в положении остатка 144, что может увеличивать устойчивость α-спирали.
После выполнения ряда вышеуказанных замен получают новый ингибитор слияния вируса "фузонекс", который имеет нижеследующую аминокислотную последовательность:
SWETWEREIENYTKQIYKILEESQEQQDRNEKDLLE (SEQ ID NO:1)
Настоящее изобретение относится к пептиду (фузонекс) с высоким потенциалом антивирусной активности. Фузонекс содержит 36 аминокислот и выделен из С-концевой аминокислотной последовательности (остатки 117-151) эктодомена трансмембранного гликопротеина gp41 ВИЧ-1 (подтип Е). Полипептид фузонекс по настоящему изобретению даже при очень низкой концентрации способен блокировать процесс слияния между вирусами и клетками и между вирус-инфицированными клетками и неинфицированными клетками. Блокируя доступ к клеткам, фузонекс способен предотвращать проникновение вирусов в клетки и распространение вирусов из инфицированных клеток в неинфицированные клетки.
Результаты анализа слияния вируса с клеткой показывают, что концентрация ингибирования слияния для фузонекса в 20 раз ниже аналогичного показателя для Т-20. Таким образом, пептид по настоящему изобретению более эффективно борется с ВИЧ-инфекцией и обладает более низкой токсичностью. Благодаря высокой устойчивости и высокой эффективности пептид по настоящему изобретению является гораздо лучшим ингибитором слияния вируса, чем Т-20.
Антивирусная активность фузонекса включает (не ограничиваясь ею) предотвращение распространения ВИЧ в неинфицированные клетки CD4+ и другие клетки. Кроме того, антивирусная активность ингибитора по настоящему изобретению не требует возбуждения какой-либо иммунной реакции у хозяина.
Ингибитор по настоящему изобретению может быть использован в любых областях биологии, относящихся к ингибированию слияния мембран, в том числе для предотвращения переноса ретровируса человека или животного кроме человека (в частности, ВИЧ) в неинфицированные клетки. В соответствии с предпочтительным вариантом осуществления настоящего изобретения ингибитор фузонекс и его производные используют в качестве ингибиторов переноса ретровируса (в частности, ВИЧ) в неинфицированные клетки человека или животного кроме человека.
Ингибитор по настоящему изобретению может также регулировать биологические процессы внутри клеток, которые относятся к спиралям вторичной структуры белка. В используемом здесь значении термин "регулировать" означает активирующее или подавляющее действие, производимое пептидом по настоящему изобретению на уровне определенной биологической активности внутри клеток (по сравнению с отсутствием пептида по настоящему изобретению).
Ингибитор по настоящему изобретению можно также использовать для идентификации соединений, способных ингибировать слияние вируса, антивирусных соединений и соединений, обладающих регуляторной активностью внутри клетки. Кроме того, фузонекс по настоящему изобретению можно также использовать для диагностики биологически специфических типов и/или подтипов вирусов.
Настоящее изобретение относится к новому ингибитору слияния фузонексу и его производным. Настоящее изобретение относится также к совместному введению фузонекса или его производных с другими лекарственными средствами, например, с другими антивирусными средствами, для лечения и/или профилактики вирусной инфекции, в частности, ВИЧ-инфекции. Указанные лекарственные средства могут иметь или не иметь такие же участки или механизмы действия, что и ингибиторы слияния вирусов. В результате совместного введения лекарственных средств может возникать комплексный или синергичный эффект.
В соответствии с одним вариантом осуществления настоящего изобретения фузонекс или его производные можно вводить вместе с другими лекарственными средствами в соответствии с нижеследующими схемами введения, которые включают (не ограничиваясь ими) одновременное введение, последовательное введение, периодическое введение и периодическое лечение (например, введение антивирусного соединения, затем введение второго антивирусного соединения через определенный период времени с повторением такой последовательности введения (то есть периода) для уменьшения возможной лекарственной устойчивости в процессе антивирусного лечения).
Комбинированное лечение фузонексом или его производными в сочетании с другими антивирусными средствами представляет новый метод лечения, который позволяет уменьшить эффективную дозу и, таким образом, токсичность указанных антивирусных препаратов. Кроме того, лекарственная композиция позволяют подавлять вирусную инфекцию в клетках-хозяевах при помощи разных механизмов, что не только увеличивает антивирусную эффективность, но и предотвращает возникновение устойчивости вирусов к любому отдельно используемому препарату. Поэтому повышается вероятность успешного лечения.
Настоящее изобретение относится также к лекарственным композициям и препаратам, предназначенным для лечения или профилактики вирусной (в частности, ВИЧ) инфекции. Лекарственная композиция содержит эффективную дозу фузонекса или его производных, по крайней мере одно другое лекарственное средство и/или фармацевтически приемлемый носитель.
Лекарственные средства, используемые вместе с фузонексом или его производными, включают любые средства, которые известны в данной области или находятся в процессе исследования. В соответствии с предпочтительным вариантом осуществления настоящего изобретения фузонекс или его производные вводят вместе с другим лекарственным средством, обладающим другим ме