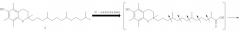Способ получения 2,5,7,8-тетраметил-2-(2'-карбоксиэтил)-6-ацетоксихромана - предшественника альфа-сенс
Иллюстрации
Показать всеИзобретение относится к области синтеза биологически активных веществ, а именно к способу получения 2,5,7,8-тетраметил-2-(2'-карбоксиэтил)-6-ацетоксихромана (α-СЕНС), который заключается в конденсации триметилгидрохинона с линалоолом в кипящем н-октане в присутствии катализатора n-толуолсульфокислоты или (+)-камфор-10-сульфокислоты в течение трех часов при мольном соотношении триметилгидрохинон:линалоол:катализатор 1:1:0.1 с последующим ацетилированием полученного продукта уксусным ангидридом в пиридине при комнатной температуре в течение 0.5 часа, озонированием в ацетоне в присутствии Ba(OH)2, окислением реагентом Джонса в ацетоне и выделением колоночной хроматографией на силикагеле. Данное соединение является ацетатным производным основного метаболита α-токоферола - α-СЕНС, для которого отмечена высокая эффективность при лечении заболеваний центральной нервной системы.
Реферат
Предлагаемое изобретение относится к области синтеза биологически активных веществ, конкретно 2,5,7,8-тетраметил-2-(2'-карбоксиэтил)-6-ацетоксихромана, который является предшественником главного водорастворимого метаболита α-токоферола-2,5,7,8-тетраметил-2-(2'-карбоксиэтил)-6-гидроксихромана (α-СЕНС).
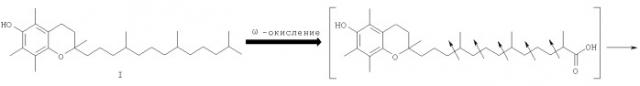
α-Токоферол (витамин Е) (I)- известный природный антиоксидант, предохраняющий липиды от пероксидного окисления. В последнее десятилетие были обнаружены его другие жизненно важные функции, α-Токоферол определяет деятельность протеинкиназы С (фермента, ответственного за фосфорилирование мембранных белков), моделирует размножение васкулярных клеток гладкой мускулатуры и способствует накоплению α-тропомиазина в мышечных волокнах [R.Brigelius-Flohe, F.J.Kelly, J.T.Salonen, J.Neuzil, J.-M.Zingg, A.Azzi "Витамин Е: современные данные и будующие исследования" American journal of clinical nutrition 2002, V.76, №4, рр.703-716].
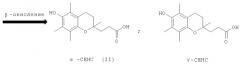
Одним из основных факторов, определяющим биологию α-токоферола, является метаболическое превращение боковой фитильной цепи, затрагивающее 2-,4'- и 8'-углеродные атомы. Накоплены неопровержимые факты, из которых следует, что в процессе природного метаболизма боковая фитильная цепь ω-токоферола подвергается α-окислению, катализируемому цитохромзависимым энзимом Р450 с последующим окислительным расщеплением. Этот процесс в основном происходит в печени и приводит к водорастворимым глюкоронидным и сульфатным коньюгатам 2,5,7,8-тетраметил-2-(2'-карбоксиэтил)-6-гидроксихромана, известного под названием α-СЕНС (II) [К.Hensley, E.J.Benaksas, R.Bolli, P.Comp, P.Grammas, L.Hamdheydari, S.Mou, Q.N.Pye, M.F.Stoddard, G.Wallis, K.S.Williamson, M.West, W.J.Wechter, R.A.Floyd "New perspectives on vitamin E: γ-tocopherol and carboxymethylhydroxychroman metabolites in biology and medicine" // Free Radical Biology and medicine 2004, v.36, №1, pp.1-15].
Схема 1
Наличие гидроксильной группы в 6-ом положении хроманового фрагмента токоферола и его аналогов необходимо для проявления их биологической активности. Вместе с тем, некоторые сложные эфиры хроманолов, в том числе ацетаты, проявляют более высокую биологическую активность, чем свободные хроманолы. Например, витаминная активность α-токоферилацетата в 1.47 раза превышает активность неацетилированного α-токоферола. Ацетатные производные хроманолов более устойчивы к окислению, легче усваиваются организмом и легко гидролизуются [В.М Березовский. Химия витаминов. М., Пищевая промышленность, 1973, с.286].
Изучение метаболизма α-токоферола чрезвычайно полезно для определения его функции in vivo, а кислота (II) и ее сложные эфиры - подходящий биомаркер для определения статуса витамина Е, поскольку экскреция коньюгатов кислоты (II) возрастает при увеличении потребления α-токоферола после превышения его пороговой концентрации в плазме крови [М.Schultz, M.Leist, M.Petrizka, В.Gassmann, R.Brigelius-Flohe "Novel urinary metabolite of α-tocopherol, 2,5,7,8-tetramethyl-2(2'-carboxymethyl)-6-hydroxychroman, as an indicator of an adequate vitamin E supply // Am.J.din. Nutr. 1995, 62, pp.1527-1534].
Препараты, полученные на основе метаболита (II) α-СЕНС и его аналога, синтезированного из γ-токоферола (γ-СЕНС), существенно отличаются по своей биологической активности от предшествующих им токоферолов. Активность этих кислот не связана напрямую с их антиоксидантными свойствами. В большей степени они оказывают противовоспалительное, противоопухолевое и натрийуретическое действие, основанное на их взаимодействии с белками в качестве эндогенных лигандов. Недавно γ-СЕНС (известный также под названием LLU-α) был идентифицирован как эндогенный натрийуретический фактор у больных уремией [Jr.E.D.Murray, D.Kantoci, S.A. DeWind, A.E.Bigorma, D.C.D'Amico, Jr.J.G.King, T.Pham, B.H.Levine, M.E.Jung, W.J.Wechter // Life Sci. 1995, 57, 2145]. В отличие от известных диуретиков он исключительно избирательно промотирует экскрецию ионов натрия без затрагивания ионов калия. [W.J.Wecher, D.Kantoci, E.D.Murray, D.C.D'Amico, M.E.Jung, W.-H.Wang " A new endogenous natriuretic factor: LLU-alpha" // Proc. Nate. Acad. Sci. USA 93, pp.6002-6007].
Высокая эффективность метаболитов α-СЕНС и γ-СЕНС в сравнении с классическими лекарственными препаратами была отмечена при лечении таких заболеваний центральной нервной системы как болезнь Альцгеймера, болезнь Паркинсона и др. [Free Radical Biology and Medicine, 2004, v.36, №1, pp.1-5].
Исследования антиоксидантной активности кислоты (II) in vitro в различных модельных окислительных реакциях показали ее высокие антиоксидантные свойства, сравнимые с такими известными препаратами, как α-токоферол, аскорбиновая кислота и короткоцепочный аналог α-токоферола - кардиозащитное средство Trolox [A.Betancor-Fernandez, Н.Sies, W.Stahl, MC.Polidori "In vitro antioxidant activity of 2,5,7,8-tetramethyl-2-(2'-carboxyethyl)-6-hydroxychroman (alpha-CEHC), a vitamin E metabolite // Free Radic. Res. 2002, v.36, №8, pp. 915-921; Y.Yoshida, E.Niki "Antioxidant effect of alpha- and gamma-carboxyethyl-6-hydroxychromans" // Biofactors 2002, v.16, №3-4, pp 93-103].
Несмотря на обнаруженные уникальные свойства кислоты (II) и открывающиеся перспективы ее использования в биологии и медицине, методы синтеза этого соединения очень ограничены.
Известен способ получения кислоты (II) и ее предшественника - 2,5,7,8-тетраметил-2-(2'-карбоксиэтил)-6-ацетоксихромана (V), основанный на реакции конденсации триметилгидрохинона (ТМГХ) (III) с γ-метил-γ-винилбутиролактоном (IV), которую проводили в диоксане в присутствии эфирата трехфтористого бора [D.Kantoci, W.J.Wechter, E.D.Murray, S.A.Dewind, D.Borchardt, S.I.Khan "Endogenous natriuretic factor. The stereochemistry of natriuretic gamma-tocopherol metabolite LLU-alpha. // J.Pharmol Exp.Her. 1997, 282, pp. 648-656. S.A.S.Pope, G.E.Burtin, P.T.Clayton, D.J.Madge, D.P.R.Muller "Synthesis and analysis of conjugates of the major vitamin E metabolite, α-CEHC" Free Radical Biology and Medicine, 2002, v.33, №6, pp. 807-817] или в смеси уксусной кислоты и уксусного ангидрида под действием смеси ZnCl2 и BF3·OEt2. Последующий гидролиз ацетатной защиты в 2,5,7,8-тетраметил-2-(2'-карбоксиэтил)-6-ацетоксихромане (V) приводил к кислоте (II) [J.Weichet, L.Blaha, В. Collect. Czech. Chem. Commun. 1959, 24, 1689. Н.Mayer, О.Isler "Synthesis of vitamin E." Methods in Enzymologe, v.XVIII. Vitamin and Coenzymes. Part C.Academ. Press. 1971, pp.274].
Схема 2
Промежуточный лактон (IV) получали конденсацией винилмагнийбромида с этиловым эфиром левулиновой кислоты (VI) или взаимодействием левулиновой кислоты (VII) с ацетилинидом натрия в жидком аммиаке с последующим частичным гидрированием этинильной группы в промежуточном γ-лактоне (VIII).
Как видно, известные способы синтеза ацетатного производного кислоты (II) - 2,5,7,8-тетраметил-2-(2'-карбоксиэтил)-6-ацетоксихромана (V), приведенные на схеме 2, предполагают предварительное получение в несколько стадий γ-метил-γ-винилбутиролактона (IV). Они имеют следующие недостатки: γ-метил-γ-винилбутиролактон (IV) не является товарным продуктом; и его получают в две стадии из этилового эфира левулиновой кислоты (VI) или в три стадии из левулиновой кислоты (VII), используя пожаро- и взрывоопасные ацетиленид натрия или реагент Гриньяра. Реакция конденсации мало технологична, так как протекает под действием конденсирующих средств, высокочувствительных к влаге воздуха. При получении лактона (IV) и при проведении реакции конденсации лактона (IV) с ТМГХ (III) необходимо использование сухих растворителей и инертной атмосферы.
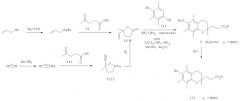
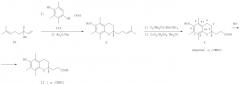
Предлагается новый способ получения ацетатного производного кислоты (II) - 2,5,7,8-тетраметил-2-(2'-карбоксиэтил)-6-ацетоксихромана (V), заключающийся в проведении реакции конденсации ТМГХ (III) с линалоолом (IX) в кипящем н-октане под действием катализаторов: n-TsOH или (+)-камфор-10-сульфоновой кислоты (CSA) с последующей обработкой продукта конденсации уксусным ангидридом в пиридине при комнатной температуре. Реакция конденсации приводит к 2,5,7,8-тетраметил-2-(4-метил-3-пентен-1-ил)-6-ацетоксихроману (X) с селективностью 68% и 75% (катализ n-TsOH и CSA соответственно). Озонолиз 2,5,7,8-тетраметил-2-(4-метил-3-пентен-1-ил)-6-ацетоксихромана (X) в ацетоне в присутствии Ва(ОН)2 при комнатной температуре и последующее окисление образующегося альдегида реактивом Джонса в ацетоне при комнатной температуре приводят к целевому ацетатному производному α-СЕНС - 2,5,7,8-тетраметил-2-(2'-карбоксиэтил)-6-ацетоксихроману (V). Выход 2,5,7,8-тетраметил-2-(2'-карбоксиэтил)-6-ацетоксихромана (V) в расчете на линалоол (IX) составляет 28-29% (схема 3).
2,5,7,8-тетраметил-2-(2'-карбоксиэтил)-6-гидроксихроман (α-СЕНС) (II) при необходимости может быть легко получен гидролизом 2,5,7,8-тетраметил-2-(2'-карбоксиэтил)-6-ацетоксихромана (V) по известному методу [J.Weichet, L.Blaha, В.Kakac. Collect. Of Czechoslovak Chem. Commun. 1959, v.24, pp 1689-1694].
Схема 3
Преимущества предлагаемого способа:
1. В реакции конденсации используется легкодоступный винилкарбинол - линалоол.
2. В качестве катализаторов используются стабильные сульфокислоты (n-TsOH и CSA), работа с которыми в отличие от используемых ранее катализаторов (ZnCl2 и BF3·OEt2) не требует особых условий (отсутствие влаги, инертная атмосфера).
3. Помимо реакции конденсации предлагаемая схема синтеза ацетатного производного (α-СЕНС) (V) включает реакции ацетатной защиты фенольного гидроксила, озонолиза и окисления, которые выполняются по типовым, нетрудоемким методикам и протекают селективно с высоким выходом требуемых продуктов. Конечный продукт -2,5,7,8-тетраметил-2-(2'-карбоксиэтил)-6-ацетоксихроман (V) легко очищается колоночной хроматографией на силикагеле от минорных примесей, образующихся в реакции конденсации ТМГХ (III) с линалоолом (IX).
Изобретение поясняется следующими примерами:
ПРИМЕР 1. Получение 2,5,7,8-тетраметил-2-(2'-карбоксиэтил)-6-ацетоксихромана (V). К кипящей суспензии 0.4 г (2.6 ммоля) ТМГХ III и 0.061 г (0.26 ммоля) катализатора CSA в 3 мл н-октана при кипении медленно прибавили 0.40 г (2.6 ммоля) винилкарбинола IX. Реакционную смесь кипятили 3 ч, затем охладили до комнатной температуры и вылили в насыщенный раствор NaHCO3 (30 мл). Продукт экстрагировали EtOAc, органические слои промыли насыщенным раствором NaCl и сушили над MgSO4. Фильтрат упарили и остаток хроматографировали на колонке с SiO2 (16 г). Элюированием н-гексаном выделили фракцию (Rf 0.9, н-гексан - EtOAc, 1:1) неполярных веществ, затем смесью (10:1) н-гексан - EtOAc элюировали фракцию (Rf 0.7, «-гексан - EtOAc, 1:1), упариванием которой получили 0.57 г маслообразного вещества, которое растворили в 5.6 мл сухого пиридина, при перемешивании добавили 4.3 мл уксусного ангидрида, выдержали 0.5 ч при комнатной температуре, затем вылили в 15 мл ледяной воды, экстрагировали EtOAc, промыли последовательно 3 н. раствором HCl, насыщенным раствором NaHCO3, Н2O, и сушили MgSO4. После упаривания получили 0.63 г продукта, содержащего по данным ГЖХ 75% ацетата X, или 0.47 г (1.4 ммоля), который растворили в 6 мл ацетона, добавили 0.6 г (3.5 ммоля) Ва(ОН)2, 0.15 мл Н2О и при комнатной температуре пропускали озонокислородную смесь со скоростью 30 л·ч-1 в течение 9 мин (1.5 ммоля О3 при производительности озонатора 10 ммоль О3·ч-1), после чего реакционную смесь отфильтровали, фильтрат упарили в вакууме. Полученный продукт растворили в 15 мл Et2O, сушили MgSO4, упарили, остаток (0.54 г) растворили в 20 мл ацетона, раствор охладили льдом и при интенсивном перемешивании прикапали 2 мл реагента Джонса, приготовленного из 1.33 г CrO3, 3.8 мл H2O и 1.2 мл H2SO4. При этом наблюдалось расслоение реакционной смеси на нижний зеленый слой хромовых солей и верхний слой, содержащий продукты реакции, растворенные в ацетоне. Смесь перемешивали 2 ч при комнатной температуре, экстрагировали EtOAc (15 мл), органический слой промыли насыщенным раствором NaCl и сушили MgSO4. Остаток после упаривания хроматографировали на колонке с SiO2 (6 г). Элюированием смесью (5:1) к-гексан - EtOAc выделили фракцию (Rf 0.7, н-гексан - EtOAc, 1:1), содержащую минорные примеси, образующиеся в реакции конденсации ТМГХ III с винилкарбинолом IX. Затем элюировали метанолом, получили фракцию с Rf 0.5 (CHCl3-МеОН 1:1), упаривание которой дало 0.24 г (29% в расчете на винилкарбинол IX) 2,5,7,8-тетраметил-2-(2'-карбоксиэтил)-6-ацетоксихромана V, т.пл. 149-150°С. [ср.: J.Weichet, L.Blaha, В.Kakac. Collect. Of Czechoslovak Chem. Commun. 1959, v.24, pp.1689-1694]. ИК-спектр, ν/см-1: 1730, 1700 (С=0), 1210, 1080 (С-O). УФ-спектр (СН3ОН), λmax/нм(ε): 278(1415); 284(1489). Спектр ЯМР 1Н (δ, м.д., J/Гц): 1.21 (с, 3Н, С(2)СН3); 1.79-2.20 (м, 6Н, Н(3), Н(1'), Н(2')); 1.94, 1.97, 2.06 (с, 9Н, Ar-СН3), 2.28 (с, 3Н, СН3-ОАс); 2.62 (м, 2Н, Н(4)). Спектр ЯМР 13С (δ, м.д.): 12.06 (Ar-СН3); 12.25 (Ar-СН3); 13.12 (Ar-СН3); 20.5 (СН3СО); 21.43 (С(4)); 24.02 (2-СН3); 32.26 (С(2')); 33.35 (С(3)); 36.96 (С(1')); 75.78 (С(2)); 118.70 (С(5)); 123.75 (С(4а)); 126.11 (С(7)); 127.65 (С(8)); 141.97 (С(6)); 150.26 (С(8а)); 171.69 (СН3СО); 183.05 (СО2Н).
ПРИМЕР 2. Из 4.0 г (26 ммоля) ТМГХ III, 4.01 г (26 ммоля) IX и 0.45 г (2.6 ммоля) n-TsOH в условиях, приведенных в примере 1, получили 5.3 г продукта, который растворили в 52 мл сухого Ру, при перемешивании добавили 40.2 мл уксусного ангидрида, выдержали 0.5 ч. при комнатной температуре, затем вылили в 120 мл ледяной воды, экстрагировали EtOAc, промыли 3 н. раствором HCl, насыщенным раствором NaHCO3, Н2О, сушили MgSO4, получив 5.9 г маслообразного вещества, содержащего по данным ГЖХ 68%, или 4.01 г (12.1 ммоля) ацетата X, которое растворили в 60 мл ацетона, добавили 5.12 г (29.9 ммоля) Ва(ОН)2, 1.5 мл Н2О и при комнатной температуре пропускали озонокислородную смесь со скоростью 30 л·ч-1 в течение 75 мин (12.5 ммоля О3 при производительности озонатора 10 ммоль О3·ч-1), после чего реакционную смесь отфильтровали, фильтрат упарили при пониженном давлении. Полученный продукт растворили в 100 мл Et2O, сушили MgSO4, упарили. Остаток (5.2 г) растворили в 20 мл ацетона, охладили льдом и при интенсивном перемешивании прикапали 7 мл реагента Джонса, приготовленного из 2.66 г CrO3, 7.6 мл Н2О и 2.4 мл Н2SO4. При этом наблюдалось расслоение реакционной смеси на нижний зеленый слой хромовых солей и верхний слой, содержащий продукты реакции, растворенные в ацетоне. Смесь перемешивали 2 ч при комнатной температуре, экстрагировали EtOAc, органические слои промыли насыщенным раствором NaCl и сушили MgSO4. Фильтрат упарили и остаток хроматографировали на колонке с SiO2 (50 г), как описано в примере 1. Получили фракцию с Rf 0.5 (CHCl3-MeOH, 1:1), упаривание которой дало 2.3 г (28% в расчете на винилкарбинол IX) 2,5,7,8-тетраметил-2-(2'-карбоксиэтил)-6-ацетоксихромана V, спектры ЯМР 1Н и 13С идентичны спектрам, приведенным в примере 1.
Способ получения 2,5,7,8-тетраметил-2-(2'-карбоксиэтил)-6-ацетоксихромана - предшественника α-СЕНС, отличающийся тем, что триметилгидрохинон вводят в кислотно-катализируемую реакцию конденсации с линалоолом в кипящем н-октане в присутствии n-толуолсульфокислоты или (+)-камфор-10-сульфокислоты в качестве катализатора при мольном соотношении триметилгидрохинон: линалоол: катализатор, равном 1:1:0.1, с последующей обработкой продукта конденсации уксусным ангидридом в пиридине, озонированием при комнатной температуре в ацетоне в присутствии Ва(ОН)2, окислением в том же растворителе с помощью реагента Джонса (CrO3/Н2SO4) и выделением целевого продукта колоночной хроматографией на силикагеле.