Модифицированный вариант вируса коровьей оспы ankara
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, вирусологии и медицины. Предложен ослабленный вирус, который происходит от модифицированного вируса коровьей оспы Ankara. Вирус характеризуется потерей способности к своей репродукции путем репликации в клеточных линиях человека. Кроме того, описаны применение вируса или его рекомбинантных вариантов в качестве лекарства или вакцины. Дополнительно предлагается способ индукции иммунного ответа даже у больных с нарушенным иммунитетом, у больных с исходно существующим иммунитетом к вирусу вакцины или у больных в процессе проведения противовирусной терапии. Изобретение может быть использовано в медицине и ветеринарии. 14 н. и 72 з.п. ф-лы, 11 ил., 1 табл.
Реферат
В настоящем изобретении предлагается ослабленный вирус, который происходит от модифицированного вируса коровьей оспы Ankara и который характеризуется потерей способности к своей репродукции путем репликации в клеточных линиях человека. В нем дополнительно описываются рекомбинантные вирусы, которые происходят от данного вируса, и применение вируса или его рекомбинантных вариантов в качестве лекарства или вакцины. Дополнительно предлагается способ индукции иммунного ответа даже у больных с нарушенным иммунитетом, больных с исходно существующим иммунитетом к вирусу вакцины или больных в процессе проведения противовирусной терапии.
ИЗВЕСТНЫЙ УРОВЕНЬ ТЕХНИКИ
Модифицированный вирус коровьей оспы Ankara (MVA) относится к вирусу коровьей оспы, члену рода Orthopoxvirus семейства Poxiviridae. MVA был создан в результате 516 серийных пассажей вируса коровьей оспы (CVA) в эмбриональных фибробластах цыплят линии Ankara (в качестве обзора смотри Mayr, A., et al. Infection 3, 6-14 [1975]). Вследствие данных многочисленных пассажей полученный вирус MVA потерял приблизительно 31 тысячу оснований своей геномной последовательности и, следовательно, был описан как вирус с крайне ограниченными клетками-хозяевами, относящимися к клеткам птиц (Meyer, H. et al., J. Gen. Virol. 72, 1031-1038 [1991]). На различных животных моделях было показано, что полученный MVA был практически авирулентным (Mayr, A. & Danner, K. [1978], Dev. Biol. Stand. 41:225-34). Кроме того, данный штамм MVA был протестирован при клинических испытаниях в качестве вакцины для иммунизации против оспы человека (Mayr et al., Zbl. Bakt. Hyg. I, Abt. Org. B 167, 375-390 [1987], Stickl et al., Dtsch. med. Wschr. 99, 2386-2392 [19974]). В данное исследование было вовлечено более 120000 людей, включая пациентов с высоким риском заболевания, и было доказано, что по сравнению с вакцинами, основанными на вирусе коровьей оспы, MVA имеет ослабленную вирулентность или инфекционность, сохраняя в то же время хорошую иммуногенность.
В последующие десятилетия были созданы генно-инженерные конструкции MVA для применения их в качестве вирусного вектора для экспрессии рекомбинантных генов или в качестве рекомбинантной вакцины (Sutter, G. et al. [1994], Vaccine 12:1032-40).
В данном отношении наиболее удивительным является то, что даже несмотря на то, что Mayr et al. в 1970-е годы показали, что MVA является крайне ослабленным и авирулентным у человека и млекопитающих, в настоящее время в некоторых представленных работах (Blandchard et al., 1998, J Gen Virol 79, 1159-1167; Carroll & Moss, 1997, Virology 238, 198-211; Altenberger, патент США 5185146; Ambrosini et al., 1999, J Neurosci Res 55(5), 569) показано, что в клеточных линиях человека и млекопитающих MVA не является полностью ослабленным, так как в данных клетках может происходить остаточная репликация. Предполагается, что результаты, представленные в данных публикациях, получены с различными штаммами MVA, так как использованные вирусы существенно различаются по своим свойствам, особенно по характеру своего роста в различных клеточных линиях. Характер роста рассматривается в качестве индикатора ослабленности вируса. Обычно штамм вируса считается ослабленным, если он потерял свою способность или только снизил свою способность к своей репродукции путем репликации в клетках-хозяевах. Указанный выше факт, что MVA не является полностью не способным к репликации в клетках человека и млекопитающих, ставит вопрос о том, насколько абсолютна безопасность MVA как вакцины для человека или вектора для рекомбинантных вакцин.
Особенно для вакцины, а также для рекомбинантной вакцины баланс между эффективностью и безопасностью вирусного вектора вакцины является крайне важным.
ЦЕЛЬ ИЗОБРЕТЕНИЯ
Таким образом, целью изобретения является обеспечение новыми штаммами, характеризуемыми повышенной безопасностью, для разработки более безопасных продуктов, таких как вакцины или лекарства. Более того, дополнительной целью является обеспечение средствами для улучшения существующего режима вакцинации.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Для достижения перечисленных выше целей в соответствии с предпочтительным осуществлением настоящего изобретения предлагаются новые вирусы коровьей оспы, которые способны к репродукции путем репликации в клетках и в клеточных линиях животных, не являющихся человеком, особенно в фибробластах эмбрионов цыплят (CEF) и в линии клеток почки детенышей хомячка BHK (ECACC 85011433), но не способны к репродукции путем репликации в клеточных линиях человека.
Известные штаммы вирусов коровьей оспы способны к репродукции путем репликации в, по меньшей мере, некоторых клеточных линиях человека, в частности в клеточной линии кератиноцитов человека HaCat (Boukamp et al. 1988, J Cell Biol 106(3): 761-71). Репликация в клеточной линии HaCat предполагает репликацию in vivo, в частности репликацию in vivo у человека. Конечно, в разделе примеров показано, что все протестированные известные штаммы вируса коровьей оспы, которые проявляют способность к остаточному воспроизведению путем репликации в HaCat, также реплицируются in vivo. Таким образом, изобретение предпочтительно относится к вирусам коровьей оспы, которые не способны к репродукции путем репликации в клеточной линии HaCat человека. Наиболее предпочтительно изобретение касается штаммов вируса коровьей оспы, которые не способны к репродукции путем репликации в любой из следующих клеточных линий человека: клеточной линии аденокарциномы шейки матки человека HeLa (ATCC № CCL-2), линии клеток почки эмбриона человека 293 (ECACC № 85120602), клеточной линии остеосаркомы кости человека 143B (ECACC № 91112502) и клеточной линии HaCat.
Характер роста или амплификации/репликации вируса обычно выражается отношением количества вирусов, продуцируемых инфицированной клеткой (выход), к количеству, первоначально используемому для исходного инфицирования клеток (вход) ("амплификационное отношение"). Отношением между выходом и входом, равным "1", определяется такой амплификационный статус, при котором количество вируса, продуцируемого инфицированными клетками, является тем же самым, что и количество, исходно используемое для инфицирования клеток. Данный статус указывает на тот факт, что инфицированные клетки являются пермиссивными для вирусной инфекции и репродукции вируса. Амплификационное отношение, составляющее менее 1, т.е. снижение амплификации ниже уровня входа является индикатором недостаточности репликации и, таким образом, индикатором ослабленности вируса. Следовательно, для изобретателей особый интерес представляет идентификация и, в конечном итоге, выделение штамма, который характеризуется амплификационным отношением менее 1 в нескольких клеточных линиях человека, в частности во всех клеточных линиях человека 143B, HeLa, 293 и HaCat.
Таким образом, термин "не способный к репродукции путем репликации" обозначает, что вирус в соответствии с изобретением характеризуется амплификационным отношением менее 1 в клеточных линиях человека, таких как клеточные линии 293 (ECACC № 85120602), 143B (ECACC № 91112502), HeLa (ATCC № CCL-2) и HaCat (Boukamp et al. 1988, J Cell Biol 106(3): 761-71), в условиях, описанных в примере 1 настоящего описания, для некоторых конкретных штаммов MVA. Предпочтительно, чтобы амплификационное отношение для вируса в соответствии с изобретением составляла 0,8 или менее в каждой из перечисленных выше линиях HeLa, HaCat и 143B.
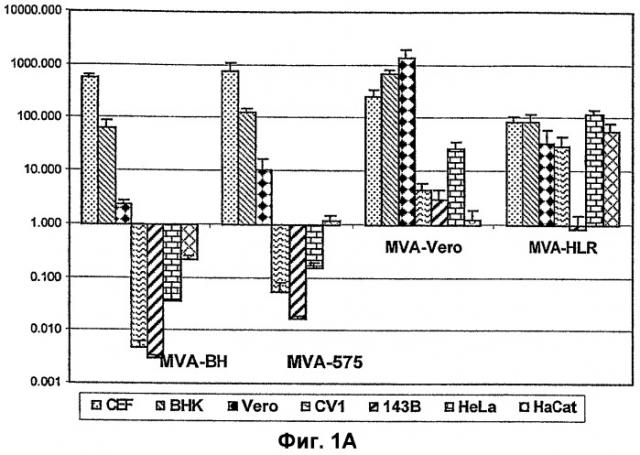
В примере 1 и в таблице 1 показано, что вирусы в соответствии с настоящим изобретением не способны к репродукции путем репликации ни в одной из клеточных линий 143B, HeLa и HaCat. Особый штамм в соответствии с настоящим изобретением, который был использован в примерах, был положен на хранение в Европейскую коллекцию клеточных культур под номером V00083008. Данный штамм обозначается во всем описании как "MVA-BN".
Известные штаммы MVA проявляют способность к остаточной репликации в, по меньшей мере, одной из протестированных клеточных линий человека (фиг.1, пример 1). Все известные штаммы вирусов коровьей оспы проявляют способность к, по меньшей мере, некоторой репликации в клеточной линии HaCat, в то время как штаммы MVA в соответствии с настоящим изобретением, в частности MVA-BN, не проявляют способности к воспроизведению путем репликации в клетках HaCat. В более подробном изложении MVA-BN характеризуются амплификационным отношением от 0,05 до 0,2 в линии клеток почки эмбриона человека 293 (ECACC № 85120602). В клеточной линии остеосаркомы кости человека 143B (ECACC № 91112502) отношение находится в диапазоне от 0,0 до 0,6. Для клеточной линии аденокарциномы шейки матки человека HeLa (ATCC № CCL-2) и клеточной линии кератиноцитов человека HaCat (Boukamp et al. 1988, J Cell Biol 106(3): 761-71) амплификационное отношение находится в диапазоне от 0,04 до 0,8 и от 0,02 до 0,8, соответственно. MVA-BN характеризуется амплификационным отношением от 0,01 до 0,06 в клетках почки африканской зеленой мартышки (CV1: ATCC № CCL-70). Таким образом, MVA-BN, который является образцом штамма в соответствии с настоящем изобретением, не способен к воспроизведению путем репликации ни в одной из протестированных клеточных линий.
Амплификационное отношение MVA-BN равняется величине, несомненно, выше 1 в фибробластах эмбрионов цыплят (CEF: первичные культуры) или в линии клеток почки детенышей хомячка BHK (ATCC № CRL-1632). Как отмечалось выше, отношение, составляющее более "1", указывает на репродукцию путем репликации, так как количество вирусов, продуцируемых инфицированными клетками, увеличивается по сравнению с количеством вирусов, которое использовалось для инфицирования клеток. Следовательно, вирус может легко размножаться и амплифицироваться в первичных культурах CEF с отношением выше 500 или в клетках BHK с отношением выше 50.
В конкретном осуществлении настоящего изобретения изобретение касается производных вируса, депонированного под № ECACC V0083008. "Производные" вирусов, депонированных под № ECACC V00083008, обозначают вирусы, проявляющие по существу те же самые репликационные характеристики, что и депонированный штамм, но имеющие отличия в одной или более частей своего генома. Вирусы, имеющие те же самые "репликационные характеристики", что и депонированный вирус, представляют собой вирусы, которые реплицируются со сходными амплификационными отношениями, что и депонированный штамм, в клетках CEF и клеточных линиях BHK, HeLa, HaCat и 143B, и которые проявляют сходную репликацию in vivo при определении на модели трансгенной мыши AGR129 (смотри ниже).
В предпочтительном осуществлении штаммы вируса коровьей оспы в соответствии с настоящим изобретением, в частности MVA-BN и его производные, характеризуются отсутствием способности реплицироваться in vivo. В контексте настоящего изобретения "отсутствие способности реплицироваться in vivo" относится к вирусам, которые не реплицируются в клетках человека и мышиной модели, описанной ниже. "Отсутствие способности реплицироваться in vivo" может быть определено предпочтительно на мышах, которые не способны продуцировать зрелые B- и T-клетки. Примером таких мышей являются трансгенные мыши модели AGR129 (полученные от Mark Sutter, Institute of Virology, University of Zurich, Швейцария). Данная линия мышей характеризуется направленными генетическими повреждениями в генах рецептора IFN типа I (IFN-α/β) и типа II (IFN-γ) и в RAG. Из-за данных повреждений мыши не имеют системы IFN и не способны продуцировать зрелые B- и T-клетки и в результате этого характеризуются существенно нарушенным иммунитетом и высокой восприимчивостью к репликации вирусов. Вместо мышей AGR129 может быть использована любая другая линия мышей, которая не способна продуцировать зрелые B- и T-клетки и в результате этого характеризуется существенно нарушенным иммунитетом и высокой восприимчивостью к репликации вирусов. В частности, вирусы в соответствии с настоящим изобретением не убивают мышей AGR129 в течение периода времени, по меньшей мере, 45 дней, более предпочтительно в течение, по меньшей мере, 60 дней, наиболее предпочтительно в течение 90 дней после инфицирования мышей путем внутрибрюшинного введения 107 БОЕ вируса. Предпочтительно, чтобы вирусы, которые проявляют "отсутствие способности реплицироваться in vivo", дополнительно характеризовались тем, что ни одного вируса не могло выявляться в органах или тканях мышей AGR129 через 45 дней, предпочтительно через 60 дней и наиболее предпочтительно через 90 дней после инфицирования мышей путем внутрибрюшинного введения 107 БОЕ вируса. Подробная информация об испытаниях по инфицированию мышей AGR129 и тестах, которые применяются для определения того, может ли вирус выявляться в органах или тканях инфицированных мышей, может быть найдена в разделе примеров.
В предпочтительном осуществлении штаммы вируса коровьей оспы в соответствии с настоящим изобретением, в частности MVA-BN и его производные, характеризуются более высокой иммуногенностью по сравнению с известным штаммом MVA-575 при определении на модели мышей с летальным инфицированием. Подробности данного эксперимента описаны в примере 2, представленном ниже. Вкратце, в такой модели невакцинированные мыши умирают после инфицирования репликативными компонентами штаммов вирусов коровьей оспы, такими как штамм L929 TK+ Western Reserve или IHD-J. В контексте описания модели с летальным заражением, "заражением" обозначается инфицирование репликативными компонентами вирусов коровьей оспы. Через четыре дня после заражения мышей обычно забивают и определяют титр вирусов в яичниках с помощью стандартных тестов образования бляшек с применением клеток VERO (для более подробного описания смотри раздел примеров). Титр вирусов определяют у невакцинированных мышей и у мышей, вакцинированных вирусной вакциной в соответствии с настоящим изобретением. Более конкретно, вирусы в соответствии с настоящим изобретением характеризуются тем, что в данном тесте после вакцинации 102 TCID50/мл вирусами в соответствии с настоящим изобретением титры вирусов в яичнике снижены, по меньшей мере, на 70%, предпочтительно, по меньшей мере, на 80%, более предпочтительно, по меньшей мере, на 90% по сравнению с невакцинированными мышами.
В предпочтительном осуществлении вирусы коровьей оспы в соответствии с настоящим изобретением, в частности MVA-BN и его производные, пригодны для иммунизации путем первичного/повторного введения вакцины. Существуют многочисленные сообщения, предполагающие, что режимы первичной/повторной иммунизации с применением MVA в качестве вектора для доставки индуцируют слабые иммунные ответы и уступают режиму первичной иммунизации с помощью ДНК и повторной иммунизации MVA (Schneider et al., 1998, Nat. Med. 4; 397-402). Во всех данных исследованиях применялись штаммы MVA, которые отличаются от вирусов коровьей оспы в соответствии с настоящим изобретением. Для объяснения слабого иммунного ответа при применении MVA для первичного и повторного введения была выдвинута гипотеза о том, что антитела, выработанные против MVA при первичном введении, нейтрализуют MVA, вводимые при повторной иммунизации, предотвращая эффективное повышение иммунного ответа. В противоположность этому режимы с первичной иммунизацией ДНК и повторной иммунизацией MVA, как сообщается, являются прекрасными в плане генерации антител с высокой авидностью, потому что при данном режиме способность ДНК эффективно примировать иммунный ответ сочетается со свойствами MVA усиливать данный ответ при повторной иммунизации в отсутствие ранее существующего иммунитета по отношению к MVA. Ясно, что, если ранее существующий иммунитет к MVA и/или вирусу коровьей оспы предотвращает усиление иммунного ответа после повторной иммунизации, то применение MVA в качестве вакцины или лекарства должно иметь ограниченную силу, особенно у больных, которые были вакцинированы против оспы. Однако в соответствии с дополнительным осуществлением вирус коровьей оспы в соответствии с настоящим изобретением, в частности MVA-BN и его производные, также как соответствующие рекомбинантные вирусы, включающие гетерологичные последовательности, могут быть использованы для эффективных первичного примированного и последующего усиливающего иммунных ответов у интактных животных, а также у животных с предсуществующим иммунитетом по отношению к вирусам оспы. Таким образом, вирус коровьей оспы в соответствии с настоящим изобретением индуцирует, по меньшей мере, по существу тот же уровень иммунитета при режимах первичной иммунизации вирусом коровьей оспы/повторной иммунизации вирусом коровьей оспы по сравнению с режимами первичной иммунизации ДНК/повторной иммунизации вирусом коровьей оспы.
Вирус коровьей оспы рассматривается как индуцирующий, по меньшей мере, по существу тот же уровень иммунитета при режимах первичной иммунизации вирусом коровьей оспы/повторной иммунизации вирусом коровьей оспы по сравнению с режимами первичной иммунизации ДНК/повторной иммунизации вирусом коровьей оспы, если CTL (ЦТЛ) ответ при измерении в одном из следующих двух тестов ("тест 1" и "тест 2"), предпочтительно в обоих тестах, является, по меньшей мере, по существу тем же самым при режимах первичной иммунизации вирусом коровьей оспы/повторной иммунизации вирусом коровьей оспы по сравнению с режимами первичной иммунизации ДНК/повторной иммунизации вирусом коровьей оспы. Более предпочтительно, чтобы CTL ответ после первичной иммунизации вирусом коровьей оспы/повторной иммунизации вирусом коровьей оспы был выше, по меньшей мере, в одном из тестов по сравнению с режимами первичной иммунизации ДНК/повторной иммунизации вирусом коровьей оспы. Наиболее предпочтительно, чтобы CTL ответ был выше в обоих из последующих тестов.
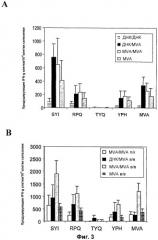
Тест 1: для первичного введения вируса коровьей оспы/повторного введения вируса коровьей оспы проводят первичную иммунизацию 6-8 недельных мышей BALB/c (H-2d) путем внутривенного введения 107 TCID50 вируса коровьей оспы в соответствии с настоящим изобретением, экспрессирующего мышиный политоп, как описано в Thomson et al., 1988, J. Immunol. 160, 1717, и повторно иммунизируют тем же количеством того же вируса, вводимого тем же путем через три недели. Для данной цели необходимо создать конструкцию рекомбинантного вируса коровьей оспы, экспрессирующий указанный политоп. Способы создания конструкций таких рекомбинантных вирусов известны специалисту в данной области техники и описываются более подробно ниже. В случае режимов первичной иммунизации ДНК/повторной иммунизации вирусом коровьей оспы первичную вакцинацию проводят путем внутримышечного введения мышам 50 мкг ДНК, экспрессирующей тот же самый антиген, что и вирус коровьей оспы; при повторном введении вводят вирус коровьей оспы точно тем же путем, что и в случае первичной иммунизации вирусом коровьей оспы/повторной иммунизации вирусом коровьей оспы. Плазмидная ДНК, экспрессирующая политоп, описана также в указанной выше публикации Thomson et al. В случае обоих режимов развитие CTL ответа против эпитопов SYIPSAEKI, RPQASGVYM и/или YPHFMPTNL определяют через две недели после повторного введения. Определение CTL ответа предпочтительно осуществляют путем использования анализа ELISPOT, как описано Schneider et al., 1998, Nat. Med. 4, 397-402, и представлено в разделе примеров ниже для одного конкретного вируса в соответствии с настоящим изобретением. Вирус в соответствии с настоящим изобретением характеризуется в данном эксперименте тем, что иммунный CTL ответ против указанных выше эпитопов, который индуцируется первичным введением вируса коровьей оспы/повторным введением вируса коровьей оспы, является по существу тем же самым, предпочтительно, по меньшей мере, тем же самым, что и индуцируемый первичным введением ДНК/повторным введением вируса коровьей оспы при оценке по числу клеток, продуцирующих IFN-γ/106 клеток селезенки (смотри также экспериментальный раздел).
Тест 2: данный тест в основном соответствует тесту 1. Однако вместо использования в/в введения 107 TCID50 вируса коровьей оспы, как в случае теста 1, в данном тесте 108 TCID50 вируса коровьей оспы в соответствии с настоящим изобретением вводят подкожно для первичной иммунизации и для повторной иммунизации. Вирус в соответствии с настоящим изобретением характеризуется в данном эксперименте тем, что иммунный CTL ответ против эпитопов, указанных выше, который индуцируется первичным введением вируса коровьей оспы/повторным введением вируса коровьей оспы, является по существу тем же самым, предпочтительно, по меньшей мере, тем же самым, что и индуцируемый первичным введением ДНК/повторным введением вируса коровьей оспы при оценке по числу клеток, продуцирующих IFN-γ/106 клеток селезенки (смотри также экспериментальный раздел).
Сила CTL ответа, измеренная в одном из тестов, представленных выше, соответствует уровню защиты.
Таким образом, вирусы в соответствии с настоящим изобретением особенно подходят для целей вакцинации.
В целом вирус в соответствии с настоящим изобретением характеризуется наличием, по меньшей мере, одного из следующих свойств:
(i) способностью к репродукции путем репликации в фибробластах эмбрионов цыплят (CEF) и в клеточной линии BHK, но отсутствием способности к репродукции путем репликации в клеточной линии HaCat человека,(ii) отсутствием способности к репликации in vivo,
(iii) индукцией более высокого иммунитета по сравнению с известным штаммом MVA-575 (ECACC V00120707) в модели летального заражения и/или
(iv) индукцией, по меньшей мере, по существу того же самого уровня иммунитета при режимах первичной иммунизации вирусом коровьей оспы/повторной иммунизации вирусом коровьей оспы по сравнению с режимами первичной иммунизации ДНК/повторной иммунизации вирусом коровьей оспы.
Предпочтительно вирус коровьей оспы в соответствии с настоящим изобретением имеет, по меньшей мере, два из указанных выше свойств, более предпочтительно, по меньшей мере, три из указанных выше свойств. Наиболее предпочтительными являются вирусы коровьей оспы, имеющие все указанные выше свойства.
В дополнительном осуществлении изобретение касается набора для вакцинации, включающего вирус в соответствии с настоящим изобретением для первичной вакцинации ("примирования") в одном флаконе/контейнере и для повторной вакцинации ("бустинга") во втором флаконе/контейнере. Вирус может представлять собой нерекомбинантный вирус коровьей оспы, т.е. вирус коровьей оспы, который не содержит гетерологичных нуклеотидных последовательностей. Примером такого вируса коровьей оспы является MVA-BN и его производные. В альтернативном варианте вирус может представлять собой рекомбинантный вирус коровьей оспы, который содержит дополнительные нуклеотидные последовательности, которые являются гетерологичными по отношению к вирусу коровьей оспы. Как указано в других разделах описания, гетерологичные последовательности могут кодировать эпитопы, которые индуцируют ответ иммунной системы. Таким образом, можно применять рекомбинантный вирус коровьей оспы для вакцинации против белков или агентов, включающих указанный эпитоп. Вирусы могут быть включены в составы, как более подробно показано ниже. Количество вируса, которое может быть использовано для каждой вакцинации, указано выше.
Специалисту в данной области техники известно как можно получить вирусы коровьей оспы, имеющие, по меньшей мере, одно из следующих свойств:
- способность к репродукции путем репликации в фибробластах эмбрионов цыплят (CEF) и в линии клеток почек детенышей хомячка BHK, но отсутствие способности к репродукции путем репликации в клеточной линии кератиноцитов человека HaCat,
- отсутствие способности к репликации in vivo,
- индукция более высокого иммунитета по сравнению с известным штаммом MVA-575 в модели летального заражения и/или
- индукция, по меньшей мере, по существу того же самого уровня иммунитета при режимах первичной иммунизации вирусом коровьей оспы/повторной иммунизации вирусом коровьей оспы по сравнению с режимами первичной иммунизации ДНК/повторной иммунизации вирусом коровьей оспы.
Способ получения такого вируса может включать следующие стадии:
(i) введение известного штамма вируса коровьей оспы, предпочтительно MVA-574 или MVA-575 (ECACC V00120707) в клетки, отличные от клеток человека, в которых вирус способен к репродукции путем репликации, где клетки, отличные от клеток человека, предпочтительно выбраны из клеток CEF и клеточной линии BHK,
(ii) выделение/повышение концентрации вирусных частиц из данных клеток и
(iii) анализ того, будет ли полученный вирус иметь, по меньшей мере, одно из желаемых биологических свойств, как указано выше,
где указанные выше стадии могут необязательно повторяться до тех пор, пока не будет получен вирус с желаемыми репликативными характеристиками. Изобретение дополнительно относится к вирусам, полученным данным способом в соответствии с настоящим изобретением. Способы того, как могут быть определены желаемые биологические свойства, объяснены в других частях настоящего описания.
Применяя данный способ, изобретатели идентифицировали и выделили в результате нескольких циклов очистки клона штамм в соответствии с настоящим изобретением, начиная с пассажа 575 изолята MVA (MVA-575). Данный новый штамм соответствует штамму с депонентным номером ECACC V00883008, указанным выше.
Характер роста вирусов коровьей оспы в соответствии с настоящим изобретением, в частности характер роста MVA-BN, указывает на то, что штаммы в соответствии с настоящим изобретением существенно опережают любой другой охарактеризованный к настоящему времени изолят MVA в отношении ослабленности действия в клеточных линиях человека и отсутствия способности к репликации in vivo. Штаммы в соответствии с настоящим изобретением являются, следовательно, идеальными кандидатами для разработки более безопасных продуктов, таких как вакцины или лекарства, как будет описано ниже.
В одном осуществлении вирус в соответствии с настоящим изобретением, в частности MVA-BN и его производные, применяют в качестве вакцины против вирусных заболеваний человека, сопровождающихся сыпью, таких как оспа. В дополнительном осуществлении вирус в соответствии с настоящим изобретением может быть рекомбинантным, т.е. может экспрессировать гетерологичные гены, такие как, например, антигены или эпитопы, гетерологичные по отношению к вирусу, и может, таким образом, быть пригодным в качестве вакцины для индукции иммунного ответа против гетерологичных антигенов или эпитопов.
Термин "иммунный ответ" обозначает реакцию иммунной системы при поступлении в организм чужеродного вещества или микроорганизма. По определению иммунный ответ подразделяют на специфическую и неспецифическую реакции, хотя обе они тесно переплетаются. Неспецифический иммунный ответ представляет собой немедленную защиту от широкого разнообразия чужеродных веществ и инфекционных агентов. Специфический иммунный ответ представляет собой защиту, возникающую после лаг-периода после первого заражения организма веществом. Специфический иммунный ответ является высокоэффективным и определяет тот факт, что индивидуум, который переболел конкретной инфекцией, становится защищенным против данной конкретной инфекции. Таким образом, повторное инфицирование тем же самым или очень близким инфекционным агентом вызывает намного более сглаженные симптомы или совсем не вызывает симптомов, так как уже имеется "предсуществующий иммунитет" в отношении данного агента. Такой иммунитет и иммунологическая память, соответственно, сохраняется в течение длительного времени, в некоторых случаях даже в течение всей жизни. Соответственно, индукция иммунологической памяти может быть использована при вакцинации.
"Иммунная система" обозначает комплекс органов, вовлеченных в защиту организма от чужеродных веществ и микроорганизмов. Иммунная система включает клеточную составляющую, включающую несколько типов клеток, таких как, например, лимфоциты и другие клетки, происходящие от белых клеток крови, и гуморальную составляющую, включающую небольшие пептиды и факторы комплемента.
"Вакцинация" обозначает то, что организм нагружают инфекционным агентом, например, ослабленной или инактивированной формой указанного инфекционного агента, для индукции специфического иммунитета. Термин вакцинация также охватывает заражение организма рекомбинантными вирусами коровьей оспы в соответствии с настоящим изобретением, в частности, рекомбинантным MVA-BN и его производными, экспрессирующими антигены или эпитопы, которые являются гетерологичными по отношению к вирусу. Примеры таких эпитопов даются в других частях описания и охватывают, например, эпитопы белков, происходящих от других вирусов, таких как вирус Денге, вирус гепатита С, ВИЧ или эпитопы, происходящие от белков, которые ассоциированы с развитием опухолей и рака. После введения рекомбинантного вируса коровьей оспы в организм эпитопы экспрессируются и презентируются иммунной системе и может индуцироваться специфический иммунный ответ против данных эпитопов. Организм, таким образом, является иммунизированным против агента/белка, содержащего эпитоп, который кодируется рекомбинантным вирусом коровьей оспы.
"Иммунитет" обозначает частичную или полную защиту организма от заболеваний, вызываемых инфекционным агентом, обусловленную успешной ликвидацией предшествующего инфицирования указанным инфекционным агентом или его характерной частью. Иммунитет основан на существовании, индукции и активации специализированных клеток иммунной системы.
Как подчеркивалось выше, в одном осуществлении изобретения рекомбинантные вирусы в соответствии с настоящим изобретением, в частности, рекомбинантный MVA-BN и его производные, содержат, по меньшей мере, одну гетерологичную последовательность нуклеиновой кислоты. Термин "гетерологичная" применяют здесь далее для любого сочетания последовательностей нуклеиновой кислоты, которое в обычных условиях не находят в близкой связи с вирусом в природе, такой вирус называют также "рекомбинантный вирус".
В соответствии с дополнительным осуществлением настоящего изобретения гетерологичные последовательности представляют собой предпочтительно антигенные эпитопы, которые выбраны из любого источника, не являющегося вирусом коровьей оспы. Наиболее предпочтительно, чтобы указанный рекомбинантный вирус экспрессировал один или более антигенных эпитопов от Plasmodium falciparum, Mycobacteria, Influenza virus, от вирусов, выбранных из семейства Flaviviruses, Paramyxoviruses, вирусов гепатита, вирусов иммунодефицита человека, или от вирусов, вызывающих геморрагическую лихорадку, таких как Hantaviruses или Filoviruses, т.е. вируса Эбола или Марбург.
В соответствии с еще одним осуществлением, но также в дополнение к указанному выше выбору антигенных эпитопов, гетерологичные последовательности могут быть выбраны из других источников оспы и коровьей оспы. Данные вирусные последовательности могут быть применены для модификации спектра хозяев или иммуногенности вируса.
В дополнительном осуществлении вирус в соответствии с настоящим изобретением может кодировать гетерологичный ген/нуклеиновую кислоту, экспрессирующие терапевтическое соединение. "Терапевтическое соединение", кодируемое гетерологичной нуклеиновой кислотой в вирусе, может представлять собой, например, терапевтическую нуклеиновую кислоту, такую как антисмысловая нуклеиновая кислота, или пептид, или белок с желаемой биологической активностью.
В соответствии с дополнительным предпочтительным осуществлением экспрессия гетерологичной последовательности нуклеиновой кислоты находится предпочтительно, но не исключительно, под транскрипционным контролем промотора вируса оспы, более предпочтительно промотора вируса коровьей оспы.
В соответствии с еще одним осуществлением вставка гетерологичной последовательности нуклеиновой кислоты осуществляется в область вирусного генома, не являющуюся необходимой. В другом предпочтительном осуществлении изобретения гетерологичную последовательность нуклеиновой кислоты вставляют в природно существующий сайт делеции генома MVA (раскрытый в патенте PCT/EP96/02926). Методы вставки гетерологичных последовательностей в геном вируса оспы известны специалистам в данной области техники.
В соответствии с другим дополнительным предпочтительным осуществлением изобретение включает также геном вируса, его рекомбинантные варианты или его функциональные части. Такие вирусные последовательности могут быть использованы для идентификации или выделения вируса или его рекомбинантных вариантов, например, с применением ПЦР, методов гибридизации или с помощью традиционных тестов ELISA. Более того, такие вирусные последовательности могут экспрессироваться экспрессионным вектором с получением кодируемого белка или пептида, которые затем могут дополнять делеционные мутанты вируса, у которых отсутствует вирусная последовательность, содержащаяся в экспрессионном векторе.
"Функциональная часть" вирусного генома обозначает часть полной геномной последовательности, которая кодирует физический объект, такой как белок, домен белка, эпитоп белка. Функциональная часть вирусного генома также описывает части полной геномной последовательности, которые кодируют регуляторные элементы или части таких элементов с индивидуализированной активностью, такие как промотор, энхансер, цис- или транс-действующие элементы.
Рекомбинантный вирус в соответствии с настоящим изобретением может быть применен для введения гетерологичной последовательности нуклеиновой кислоты в клетку-мишень, причем указанная последовательность является либо гомологичной, либо гетерологичной по отношению к клетке-мишени. Введение гетерологичной последовательности нуклеиновой кислоты в клетку-мишень может быть применено для получения in vitro гетерологичных пептидов или полипептидов и/или полных вирусов, кодируемых указанной последовательностью. Данный способ включает инфицирование клетки-хозяина рекомбинантным MVA, культивирование инфицированной клетки-хозяина в подходящих условиях и выделение и/или повышение концентрации пептида, белка и/или вируса, продуцируемых указанной клеткой-хозяином.
Более того, способ введения гомологичной или гетерологичной последовательности в клетки может быть применен для терапии in vitro и предпочтительно in vivo. Для терапии in vitro выделенные клетки, которые предварительно (ex vivo) инфицировали вирусом, вводят в организм живого животного для индукции иммунного ответа. Для терапии in vivo вирус или его рекомбинантные варианты прямо вводят в организм живого животного для индукции иммунного ответа. В данном случае клетки вокруг места инокуляции становятся инфицированными вирусом или его рекомбинантными вариантами непосредственно in vivo.
Так как вирус в соответствии с настоящим изобретением характеризуется крайне ограниченным ростом в клетках человека и обезьян и, таким образом, крайне ослабленным, он является идеальным средством для лечения широкого круга млекопитающих, включая человека. Следовательно, в настоящем изобретении предлагается также фармацевтическая композиция и вакцина, например, для индукции иммунного ответа в организме живого животного, включая человека. Вирус изобретения является также безопасным при любых других протоколах терапии.
Фармацевтическая композиция может обычно включать один или более фармацевтически приемлемых и/или допустимых носителей, добавок, антибиотиков, консервантов, адъювантов, разбавителей и/или стабилизаторов. Такими вспомогательными веществами могут быть вода, физиологический раствор, глицерин, этанол, увлажняющие или эмульгирующие агенты, вещества, буферирующие pH, или тому подобное. Подходящими носителями являются обычно большие, медленно метаболизирующиеся молекулы, такие как белки, полисахариды, полимолочные кислоты, полигликолевые кислоты, полимерные аминокислоты, сополимеры аминокислот, агрегаты липидов или тому подобное.
Для получения вакцин вирус или его рекомбинантные варианты в соответствии с изобретением переводят в физиологически приемлемую форму. Это может быть сделано, основываясь на опыте работы с получением вакцин вируса оспы для вакцинации против натуральной оспы (как описано Stickl, H. et al. [1974] Dtsch. med. Wschr. 99, 2386-2392). Например, очищенный вирус с титром 5х108 TCID50/мл в приблизительно 10 мМ Трис, 140 мМ NaCl, pH 7,4 хранят при -80°С. Для приготовления вакцины для уколов, например, 102-108 вирусных частиц лиофилизуют в 100 мл забуференного фосфатом физиологического раствора (PBS) в присутствии 2% пептона и 1% альбумина человека в ампуле, предпочтительно в стекля