Способ генетической модификации интересующего эндогенного гена или хромосомного локуса (варианты) и его использование
Иллюстрации
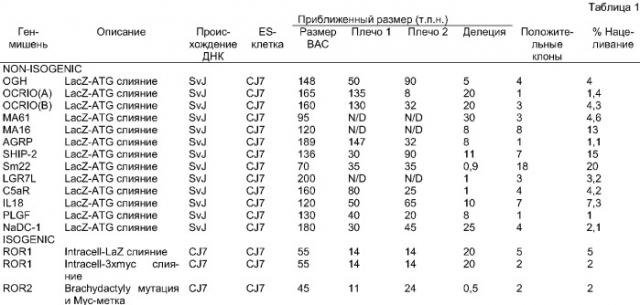
Показать всеИзобретение относится к области генной инженерии. Предложен способ модификации интересующего эндогенного гена или хромосомного локуса в эукариотических клетках. Способ предусматривает получение большого клонированного геномного фрагмента, размером более 20 т.п.н., и создание на его основе с использованием бактериальной гомологичной рекомбинации большого нацеливающего вектора (LTVEC). Далее проводят введение LTVEC в эукариортические клетки для модификации эндогенного гена или хромосомного локуса. В заключение проводят количественный анализ для определения модификации аллеля (МОА) в этих клетках. Способ позволяет осуществлять модификацию большими последовательностями ДНК. Описано также применение этих клеток для генерирования организмов, несущих эту генетическую модификацию. 15 н. и 21 з.п. ф-лы, 6 ил., 2 табл.
Реферат
Данная заявка заявляет приоритет Патентной заявки США №09/732234, поданной 7 декабря 2000 года, и Предварительной заявка США №60/244665, поданной 31 октября 2000 года. Во всей данной заявке делаются ссылки на различные публикации. Описания этих публикаций в их полном виде включены тем самым в качестве ссылки в данную заявку.
Область изобретения
Областью данного изобретения является способ конструирования и использования больших ДНК-векторов для нацеливания, через гомологичную рекомбинацию, на эндогенные гены и хромосомные локусы в эукариотических клетках и модификации этих генов и локусов любым желаемым образом. Эти большие нацеливающие на ДНК векторы для эукариотических клеток, названные LTVEC, получают из фрагментов клонированной геномной ДНК, более крупных, чем фрагменты, обычно используемые в других подходах, предназначенных для выполнения гомологичного нацеливания в эукариотических клетках. Кроме того, область данного изобретения обеспечивает быстрый и удобный способ обнаружения эукариотических клеток, в которых этот LTVEC был правильно нацелен, и модифицировал желательный эндогенный ген (гены) или хромосомный локус (локусы). Эта область включает в себя также применение этих клеток для генерирования организмов, несущих данную генетическую модификацию, сами эти организмы и способы их применения.
Введение
Применение LTVEC обеспечивает существенные преимущества над существующими в настоящее время способами. Например, поскольку их получают из ДНК-фрагментов, более крупных, чем фрагменты, используемые в настоящее время для генерирования нацеливающих векторов, LTVEC могут быть более быстро и более удобным образом генерированы из доступных библиотек больших геномных ДНК-фрагментов (таких как библиотека ВАС, библиотека бактериальных искусственных хромосом и библиотека РАС), чем нацеливающие векторы, полученные с использованием существующих в настоящее время технологий. Кроме того, могут быть генерированы более удобным образом, чем при использовании существующих в настоящее время технологий, большие модификации, а также модификации, охватывающие большие районы генома.
Кроме того, данное изобретение использует преимущество длинных районов гомологии для увеличения частоты нацеливания на "трудные для нацеливания" локусы, а также уменьшает выгоду, если она вообще имеется, использования изогенной ДНК в этих нацеливающих векторах.
Таким образом, данное изобретение обеспечивает быстрый, удобный и улучшенный способ для системной модификации фактически всех эндогенных генов и хромосомных локусов конкретного организма.
Предпосылки изобретения
Было показано, что нацеливание на гены посредством гомологичной рекомбинации между гомологичной экзогенной ДНК и эндогенными хромосомными последовательностями является чрезвычайно ценным путем создания делеций, инсерций, сконструированных мутаций, точных мутаций генов, введения трансгенов или создания других генетических модификаций у мышей. Существующие в настоящее время способы включают в себя применение стандартных нацеливающих векторов, причем их районы гомологии относительно эндогенной ДНК обычно имеют общую длину менее чем 10-20 т.п.н., для введения желаемой генетической модификации в мышиные эмбриональные стволовые (ES) клетки с последующей инъекцией этих измененных ES-клеток в мышиные эмбрионы для передачи этих сконструированных генетических модификаций в мышиную зародышевую линию (Smithies et al., Nature, 317:230-234, 1985; Thomas et al., Cell, 51:503-512, 1987; Koller et al., Proc Natl Acad Sci USA, 86:8927-8931, 1989; Kuhn et al., Science, 254:707-710, 1991; Thomas et al., Nature, 346:847-850, 1990; Schwartzberg et al., Science, 246:799-803, 1989; Doetschman et al., Nature, 330:576-578, 1987; Thomson et al., Cell, 5:313-321, 1989; DeChiara et al., Nature, 345:78-80, 1990; U.S. Patent No. 5789215, issued August 4, 1998 in the name of GenPhann International). В этих существующих в настоящее время способах обнаружение редких ES-клеток, в которых стандартные нацеливающие векторы были правильно нацелены и модифицировали желаемый эндогенный ген (гены) или хромосомный локус (локусы), требует информации последовательности вне гомологичных нацеливающих последовательностей, содержащихся в данном нацеливающем векторе. Анализы на успешное нацеливание включают в себя стандартный блоттинг по Саузерну или продолжительную ПЦР (Cheng, et al., Nature, 369:684-5, 1994; Foord and Rose, PCR Methods Appl, 3:S149-61, 1994; Ponce and Micol, Nucleic Acids Res, 20:623, 1992; U.S. Patent No. 5436149 issued to Takara Shuzo Co., Ltd.) от последовательностей вне нацеливающего вектора и простирающихся на все плечо гомологии (см. раздел Определения); таким образом, вследствие соображений по поводу размеров, которые ограничивают эти способы, размеры плеч гомологии ограничиваются размерами, меньшими, чем 10-20 т.п.н., в целом (Joyner, The Practical Approach Series, 293, 1999).
Чрезвычайно полезной была бы возможность использовать нацеливающие векторы с плечами гомологии, большими, чем используемые в существующих способах. Например, такие нацеливающие векторы можно было бы более быстро и более удобным образом генерировать из доступных библиотек, содержащих большие геномные инсерты (например, библиотек ВАС или РАС), чем нацеливающие векторы, получаемые с использованием существующих в настоящее время технологий, в которых такие геномные инсерты должны быть широко охарактеризованы и приведены в порядок ("подрезаны") перед применением. Кроме того, большие модификации, а также модификации, включающие в себя большие геномные районы, могли бы быть более легко генерированы и с меньшим количеством стадий, чем при использовании существующих в настоящее время технологий. Кроме того, применение длинных районов гомологии могло бы увеличивать частоту нацеливания на "трудные для нацеливания" локусы в эукариотических клетках, так как нацеливание гомологичной рекомбинации в эукариотических клетках является, по-видимому, связанным с общей гомологией, содержащейся в нацеливающем векторе (Deng and Capecchi, Mol Cell Biol, 12:3365-71, 1992). Кроме того, увеличенная частота нацеливания, получаемая с использованием длинных плеч гомологии, могла бы уменьшать любую потенциальную пользу, которая может быть получена из использования изогенной ДНК в этих нацеливающих векторах.
Проблема конструирования точных модификаций в очень больших геномных фрагментах, таких как фрагменты, клонированные в библиотеках ВАС, была в значительной степени решена посредством использования гомологичной рекомбинации в бактериях (Zhang, et al., Nat Genet, 20:123-8, 1998; Yang, et al., Nat Biotechnol, 15:859-65, 1997; Angrand, et al., Nucleic Acids Res, 27:e16, 1999; Muyrers, et al., Nucleic Acids Res, 27:1555-7, 1999; Narayanan, et al., Gene Ther, 6:442-7, 1999), позволяющей конструирование векторов, содержащих большие районы гомологии относительно эукариотических эндогенных генов или хромосомных локусов. Однако, после их конструирования, эти векторы обычно не были применимы для модификации эндогенных генов или хромосомных локусов посредством гомологичной рекомбинации вследствие трудности детектирования редких правильных событий нацеливания, когда плечи гомологии имеют больший размер, чем 10-20 т.п.н. (Joyner, The Practical Approach Series, 293, 1999). Таким образом, векторы, генерируемые с использованием бактериальной гомологичной рекомбинации из геномных фрагментов ВАС, должны быть все еще приведены в порядок ("подрезаны") для применения в качестве нацеливающих векторов (Hill et al., Genomics, 64:111-3, 2000). Таким образом, все еще существует потребность в быстрой и удобной методологии, которая обеспечивает возможность применения нацеливающих векторов, содержащих большие районы гомологии, таким образом, чтобы модифицировать эндогенные гены или хромосомные локусы в эукариотических клетках.
В соответствии с данным изобретением, заявители обеспечивают новые способы, которые позволяют применять нацеливающие векторы, содержащие большие районы гомологии, таким образом, чтобы модифицировать эндогенные гены или хромосомные локусы в эукариотических клетках посредством гомологичной рекомбинации. Такие способы преодолевают вышеописанные ограничения существующих в настоящее время технологий. Кроме того, специалисту с квалификацией в данной области будет понятно, способы данного изобретения легко адаптируются для применения с любой геномной ДНК любого эукариотического организма, в том числе, но не только, животных, таких как мышь, крыса, другой грызун, или человека, а также растений, таких как соя, кукуруза и пшеница.
Сущность изобретения
Согласно данному изобретению, заявители разработали новый, быстрый, улучшенный и эффективный способ для создания и скрининга эукариотических клеток, которые содержат модифицированные эндогенные гены или хромосомные локусы. Эти новые способы впервые объединяют:
1. Бактериальную гомологичную рекомбинацию для точного конструирования желаемой генетической модификации в большом клонированном геномном фрагменте, с получением таким образом большого нацеливающего вектора для применения в эукариотических клетках (LTVEC).
2. Прямое введение этих LTVEC в эукариотические клетки для модификации представляющего интерес эндогенного хромосомного локуса в этих клетках.
3. Анализ для определения редких эукариотических клеток, в которых аллель-мишень был модифицирован желательным образом, предусматривающий анализ на модификацию аллеля (МОА) исходного аллеля, не требующий информации последовательности вне нацеливающей последовательности, такой как, например, количественная ПЦР.
Предпочтительным вариантом данного изобретения является способ генетической модификации эндогенного гена или хромосомного локуса в эукариотических клетках, предусматривающий: а) получение большого клонированного геномного фрагмента, содержащего представляющую интерес ДНК-последовательность; b) использование бактериальной гомологичной рекомбинации для генетической модификации этого большого клонированного геномного фрагмента (а) для создания большого нацеливающего вектора для применения в эукариотических клетках (LTVEC); с) введение LTVEC (b) в эукариотические клетки для модификации эндогенного гена или хромосомного локуса в этих клетках; и d) использование количественного анализа для детектирования модификации аллеля (МОА) в эукариотических клетках (с) для идентификации тех эукариотических клеток, в которых этот эндогенный ген или хромосомный локус был генетически модифицирован.
Другим вариантом данного изобретения является способ, в котором генетическая модификация в отношении эндогенного гена или хромосомного локуса включает в себя делецию кодирующей последовательности, генного сегмента или регуляторного элемента; изменение кодирующей последовательности, генного сегмента или регуляторного элемента; инсерцию новых кодирующей последовательности, генного сегмента или регуляторного элемента; создание условного аллеля; или замену кодирующей последовательности или генного сегмента из одного вида гомологичной или ортологичной кодирующей последовательностью из другого вида.
Альтернативным вариантом данного изобретения является способ, в котором изменение кодирующей последовательности, генного сегмента или регуляторного элемента предусматривает замену, добавление или слияние, где это слияние включает в себя эпитопную метку (тэг) или бифункциональный белок.
Еще одним вариантом данного изобретения является способ, в котором количественный анализ включает в себя количественную ПЦР, сравнительную геномную гибридизацию, изотермическую амплификацию ДНК, количественную гибридизацию с иммобилизованным зондом, Invader Probes®, или ММР-анализы®, или в котором количественная ПЦР включает в себя технологию с использованием зондов TaqMan®, Molecular Beacon или Eclipse™.
Другим предпочтительным вариантом данного изобретения является способ, в котором эукариотической клеткой является эмбриональная стволовая клетка млекопитающего и, в частности, в котором эта эмбриональная стволовая клетка является эмбриональной стволовой клеткой мыши, крысы или другого грызуна.
Другим предпочтительным вариантом данного изобретения является способ, в котором эндогенным геном или хромосомным локусом является ген или хромосомный локус млекопитающего, предпочтительно ген или хромосомный локус человека или ген или хромосомный локус мыши, крысы или другого грызуна.
Дополнительным предпочтительным вариантом является вариант, в котором LTVEC способен вмещать в себя большие ДНК-фрагменты величиной, большей, чем 20 т.п.н., и, в частности, большие ДНК-фрагменты величиной, большей, чем 100 т.п.н.
Другим предпочтительным вариантом является генетически модифицированный эндогенный ген или хромосомный локус, который получают по способу данного изобретения.
Еще одним предпочтительным вариантом является генетически модифицированная эукариотическая клетка, которую получают по способу данного изобретения.
Предпочтительным вариантом данного изобретения является организм (не человек), содержащий генетически модифицированный эндогенный ген или хромосомный локус, полученный по способу данного изобретения.
Предпочтительным также является организм (не человек), полученный из генетически модифицированных эукариотических клеток или эмбриональных стволовых клеток, полученных по способу данного изобретения.
Предпочтительным вариантом является организм (не человек), содержащий генетически модифицированный эндогенный ген или хромосомный локус, полученный по способу, предусматривающему стадии: а) получения большого клонированного геномного фрагмента, содержащего представляющую интерес ДНК-последовательность; b) использования бактериальной гомологичной рекомбинации для генетической модификации большого клонированного геномного фрагмента (а) для создания большого нацеливающего вектора (LTVEC) для применения в эмбриональных стволовых клетках; с) введения LTVEC (b) в эмбриональные стволовые клетки для модификации эндогенного гена или хромосомного локуса в этих клетках; d) использования количественного анализа для детектирования модификации аллеля (МОА) в эмбриональных стволовых клетках (с) для идентификации тех эмбриональных стволовых клеток, в которых этот эндогенный ген или хромосомный локус был генетически модифицирован; е) введения эмбриональной стволовой клетки (d) в бластоцисту; и f) введения бластоцисты (е) в суррогатного родителя женского пола для вынашивания плода.
Дополнительным предпочтительным вариантом данного изобретения является организм (не человек), содержащий генетически модифицированный эндогенный ген или хромосомный локус, полученный по способу, предусматривающему стадии: а) получения большого клонированного геномного фрагмента, содержащего представляющую интерес ДНК-последовательность; b) использования бактериальной гомологичной рекомбинации для генетической модификации большого клонированного геномного фрагмента (а) для создания большого нацеливающего вектора для применения в эукариотических клетках (LTVEC); с) введения LTVEC (b) в эукариотические клетки для генетической модификации эндогенного гена или хромосомного локуса в этих клетках; и d) использования количественного анализа для детектирования модификации аллеля (МОА) в эукариотических клетках (с) для идентификации тех эукариотических клеток, в которых этот эндогенный ген или хромосомный локус был генетически модифицирован; (е) удаления ядра из эукариотической клетки (d); f) введения ядра (е) в ооцит; и g) введения ооцита (f) в суррогатного родителя женского пола для вынашивания плода.
Еще одним предпочтительным вариантом является организм (не человек), содержащий генетически модифицированный эндогенный ген или хромосомный локус, полученный по способу, предусматривающему стадии: а) получения большого клонированного геномного фрагмента, содержащего представляющую интерес ДНК-последовательность; b) использования бактериальной гомологичной рекомбинации для генетической модификации большого клонированного геномного фрагмента (а) для создания большого нацеливающего вектора для применения в эукариотических клетках (LTVEC); с) введения LTVEC (b) в эукариотические клетки для генетической модификации эндогенного гена или хромосомного локуса в этих клетках; d) использования количественного анализа для детектирования модификации аллеля (МОА) в эукариотических клетках (с) для идентификации тех эукариотических клеток, в которых этот эндогенный ген или хромосомный локус был генетически модифицирован; е) слияния эукариотической клетки (d) с другой эукариотической клеткой; f) введения слитой эукариотической клетки (е) в суррогатного родителя женского пола для вынашивания плода.
В предпочтительных вариантах организмом (не человеком) является мышь, крыса или другой грызун; бластоцистой является бластоциста мыши, крысы или другого грызуна; ооцитом является ооцит мыши, крысы или другого грызуна; и суррогатным родителем является мышь, крыса или другой грызун.
Другим предпочтительным вариантом является вариант, в котором эмбриональная стволовая клетка является эмбриональной стволовой клеткой млекопитающего, предпочтительно эмбриональной стволовой клеткой мыши, крысы или другого грызуна.
Дополнительным предпочтительным вариантом является применение генетически модифицированных эукариотических клеток данного изобретения для получения организма (не человека) и, в частности, применение генетически модифицированной эмбриональной стволовой клетки данного изобретения для получения организма (не человека).
Предпочтительным вариантом данного изобретения является способ генетической модификации представляющего интерес эндогенного гена или хромосомного локуса в мышиных эмбриональных стволовых клетках, предусматривающий стадии: а) получения большого клонированного геномного фрагмента, большего, чем 20 т.п.н., который содержит представляющую интерес ДНК-последовательность, где этот большой клонированный ДНК-фрагмент является гомологичным эндогенному гену или хромосомному локусу; b) использования бактериальной гомологичной рекомбинации для генетической модификации большого клонированного геномного фрагмента (а) для создания большого нацеливающего вектора для применения в мышиных эмбриональных стволовых клетках, где генетическая модификация является делецией кодирующей послеовательности, генного сегмента или регуляторного элемента; с) введения большого нацеливающего вектора (b) в мышиные эмбриональные стволовые клетки для модификации эндогенного гена или хромосомного локуса в этих клетках; d) использования количественного анализа для детектирования модификации аллеля (МОА) в мышиных эмбриональных стволовых клетках (с) для идентификации тех эмбриональных стволовых клеток, в которых этот эндогенный ген или хромосомный локус был генетически модифицирован, где количественным анализом является количественная ПЦР. Предпочтительным вариантом является также генетически модифицированная мышиная эмбриональная стволовая клетка, полученная этим способом; мышь, содержащая генетически модифицированный эндогенный ген или хромосомный локус, полученная этим способом; и мышь, полученная из генетически модифицированной мышиной эмбриональной стволовой клетки.
Другим предпочтительным вариантом является мышь, содержащая генетически модифицированный представляющий интерес эндогенный ген или хромосомный локус, полученная по способу, предусматривающему стадии: а) получения большого клонированного геномного фрагмента, большего, чем 20 т.п.н., который содержит представляющую интерес ДНК-последовательность, где этот большой клонированный ДНК-фрагмент является гомологичным эндогенному гену или хромосомному локусу; b) использования бактериальной гомологичной рекомбинации для генетической модификации большого клонированного геномного фрагмента (а) для создания большого нацеливающего вектора для применения в мышиных эмбриональных стволовых клетках, где генетическая модификация является делецией кодирующей последовательности, генного сегмента или регуляторного элемента; с) введения большого нацеливающего вектора (b) в мышиные эмбриональные стволовые клетки для модификации эндогенного гена или хромосомного локуса в этих клетках; d) использования количественного анализа для детектирования модификации аллеля (МОА) в мышиных эмбриональных стволовых клетках (с) для идентификации тех мышиных стволовых клеток, в которых этот эндогенный ген или хромосомный локус был генетически модифицирован, где количественным анализом является количественная ПЦР; е) введения мышиной эмбриональной стволовой клетки (d) в бластоцисту; и f) введения бластоцисты (е) в суррогатного роддителя женского пола для вынашивания плода.
Предпочтительным является также применение генетически модифицированной мышиной эмбриональной стволовой клетки, описанной выше, для получения мыши.
Предпочтительными являются также способы, в которых приблизительно 1-5 мкг большого нацеливающего ДНК-вектора вводят в приблизительно 1х107 эукариотических клеток.
Краткое описание чертежей
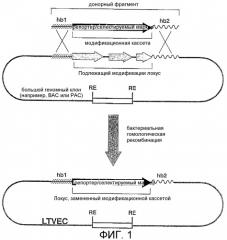
Фигура 1: Схематическая диаграмма генерирования типичного LTVEC с использованием бактериальной гомологичной рекомбинации.
(hb1 = блок гомологии 1; hb2 = блок гомологии 2; RE - сайт рестриктазы).
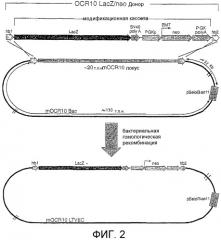
Фигура 2: Схематическая диаграмма донорного фрагмента и LTVEC для мыши OCR10.
(hb1 = блок гомологии 1; lacZ = ORF β-галактозидазы; SV40 polyA = ДНК-фрагмент, полученный из обезьяньего вируса 40, содержащий сайт и сигнал полиаденилирования; PGKp = промотор мышиной фосфоглицераткиназы (PGK); ЕМ7 = бактериальный промотор; neo = неомицинфосфотрансфераза; PGK polyA = 3'-нетранслируемый район, полученный из гена PGK и содержащий сайт и сигнал полиаденилирования; hb2 = блок гомологии 2).
Фигура 3А-3D: Последовательность кДНК OCR10 мыши, блок гомологии 1 (hb1), блок гомологии 2 (hb2) и зонды TaqMan® и праймеры, используемые в количественном ПЦР-анализе для детектирования модификации аллеля (МОА) в ES-клетках с использованием LTVEC mOCR10.
hb1: пары оснований 1-211
hb2: пары оснований 1586-1801
Зонд TaqMan® и соответствующий набор ПЦР-праймеров, полученных из экзона 3 mOCR10:
Зонд TaqMan®: нуклеотиды 413-439 - верхняя цепь
Праймер ех3-5': нуклеотиды 390-410 - верхняя цепь
Праймер ех3-3': нуклеотиды 445-461 - нижняя цепь
Зонд TaqMan® и соответствующий набор праймеров, полученных из экзона 4 mOCR10:
Зонд TaqMan®: нуклеотиды 608-639 - верхняя цепь
Праймер ех4-5': нуклеотиды 586-605 - верхняя цепь
Праймер ех4-3': нуклеотиды 642-662 - нижняя цепь
Определения
"Нацеливающий вектор" представляет собой ДНК-конструкцию, которая содержит последовательности, "гомологичные" эндогенным хромосомным последовательностям нуклеиновых кислот, фланкирующие желаемую генетическую модификацию (модификации). Фланкирующие последовательности гомологии, называемые "плечами гомологии", направляют нацеливающий вектор в специфическое хромосомное местоположение в геноме вследствие гомологии, которая существует между плечами гомологии и соответствующей эндогенной последовательностью, и вводят желаемую генетическую модификацию посредством процесса, называемого "гомологичной модификацией".
"Гомологичные" означает две или более последовательностей нуклеиновых кислот, которые являются либо идентичными, либо достаточно сходными, чтобы быть способными гибридизоваться друг с другом или подвергаться межмолекулярному обмену.
"Нацеливание на ген" является модификацией эндогенного хромосомного локуса инсерцией в него, делецией из него или заменой эндогенной последовательности посредством гомологичной рекомбинации с использованием нацеливающего вектора.
"Нокаут гена" является генетической модификацией, происходящей из разрушения генетической информации, кодируемой в хромосомном локусе.
"Присоединение ("вбивание гена") является генетической модификацией, происходящей из замены генетической информации в хромосомном локусе отличающейся ДНК-последовательностью.
"Организм с нокаутом" является организмом, в котором значительная доля клеток организма несет нокаут гена.
"Организм с присоединенным ("вбитым") геном" является организмом, в котором значительная доля клеток организма несет присоединенный ("вбитый") ген.
"Маркер" или "селектируемый маркер" является маркером отбора, который позволяет выделить редкие трансфицированные клетки, экспрессирующие этот маркер, из большинства обработанных клеток в популяции. Гены таких маркеров включают в себя, но не ограничиваются ими, гены неомицинфосфотрансферазы и гигромицин В-фосфотрансферазы или флуоресцирующих белков, таких как GFP.
"ES-клетка" является эмбриональной стволовой клеткой. Эту клетку обычно получают из внутренней клеточной массы эмбриона на стадии бластоцисты.
"Клон ES-клеток" является субпопуляцией клеток, полученных из единственной клетки популяции ES-клеток после введения ДНК и последующего отбора.
"Фланкирующая ДНК" является сегментом ДНК, который является колинеарным и смежным с конкретной точкой ссылочной последовательности.
"LTVEC" являются большими нацеливающими векторами для эукариотических клеток, которые получают из фрагментов клонированной геномной ДНК большего размера, чем фрагменты, обычно используемые другими подходами, предназначенными для выполнения гомологичного нацеливания в эукариотических клетках.
"Организм (не человек)" является организмом, который обычно не воспринимается публично как являющийся человеком.
"Модификация аллеля" (МОА) означает модификацию точной ДНК-последовательности одного аллеля гена (генов) или хромосомного локуса (локусов) в геноме. Эта модификация аллеля (МОА) включает в себя, но не ограничивается ими, делеции, замены или инсерции всего лишь одного нуклеотида или делеции многих т.п.н., включающих в себя представляющий интерес ген (гены) или хромосомный локус (локусы), а также любые и все возможные модификации между этими двумя крайностями.
"Ортологичная последовательность" обозначает последовательность из одного вида, которая является функционально эквивалентной этой последовательности в другом виде.
Описание и примеры, представленные infra, обеспечены для иллюстрации данного изобретения. Специалисту с квалификацией в данной области будет понятно, что эти примеры обеспечены только в качестве иллюстрации и не предназначены для ограничения данного изобретения.
Подробное описание изобретения
Заявители разработали новый, быстрый, улучшенный и эффективный способ для создания и скрининга эукариотических клеток, которые содержат модифицированные эндогенные гены или хромосомные локусы. В этих клетках модификацией могут быть нокауты гена (генов), присоединения (вбивания) генов, точковые мутации или большие геномные инсерции или делеции или другие модификации. В качестве неограничивающего примера, эти клетки могут быть эмбриональными стволовыми клетками, которые применимы в создании организмов с нокаутом или присоединением генов и, в частности, мышей с нокаутом или присоединением генов, для цели определения функции гена (генов), которые были изменены, делетированы и/или инсертированы.
Эти новые способы впервые объединяют:
1. Бактериальную гомологичную рекомбинацию для точного конструирования желаемой генетической модификации в большом клонированном геномном ДНК-фрагменте, с получением таким образом большого нацеливающего вектора для применения в эукариотических клетках (LTVEC);
2. Прямое введение этих LTVEC в эукариотические клетки для модификации представляющего интерес соответствующего эндогенного гена (генов) или хромосомного локуса (локусов) в эти клетки; и
3. Анализ для определения редких эукариотических клеток, в которых аллель-мишень был модифицирован желательным образом, включающий в себя количественный анализ на модификацию аллеля (МОА) исходного аллеля.
Следует подчеркнуть, что предыдущие способы для детектирования успешной гомологичной рекомбинации в эукариотических клетках не могут быть использованы вместе с LTVEC изобретения авторов, так как в этих LTVEC присутствуют длинные плечи гомологии. Использование LTVEC для преднамеренной модификации эндогенных генов или хромосомных локусов в эукариотических клетках посредством гомологичной рекомбинации становится возможным с использованием нового применения анализа для определения редких эукариотических клеток, в которых аллель-мишень был модифицирован желательным образом, причем такой способ предусматривает количественный анализ на модификацию аллеля (МОА) исходного аллеля, с применением, например, количественной ПЦР или других подходящих количественных анализов на МОА.
Возможность использования нацеливающих векторов с плечами гомологии, большими, чем плечи гомологии, используемые в существующих в настоящее время способах, является чрезвычайно ценной по следующим причинам:
1. Нацеливающие векторы являются более быстро и легко генерируемыми из доступных библиотек, содержащих большие геномные инсерты (например, библиотек ВАС или РАС), чем нацеливающие векторы, получаемые предыдущими технологиями, в которых геномные инсерты должны быть широко охарактеризованы и "приведены в порядок" (подрезаны) перед использованием (что объяснено более подробно ниже). Кроме того, должна быть известна лишь минимальная информация последовательности о представляющем интерес локусе, т.е. необходимо только знать приблизительно 80-100 нуклеотидов, которые требуются для генерирования блоков гомологии (описанных подробно ниже) и для генерирования зондов, которые могут быть использованы в количественных анализах на МОА (описанных подробно ниже).
2. Модификации большего размера, а также модификации, включающие в себя большие геномные районы, являются более легко и с меньшими стадиями генерируемыми, чем с использованием предыдущих технологий. Например, способ данного изобретения позволяет производить точную модификацию больших локусов, которые не могут быть вмещены традиционными нацеливающими векторами на основе плазмид вследствие ограничений их размеров. Он позволяет также модифицировать любой конкретный локус во множественных точках (например, введение специфических мутаций в различных экзонах мультиэкзонного гена) в одной стадии, уменьшая необходимость конструирования множественных нацеливающих векторов и выполнения множественных раундов нацеливания и скрининга на гомологичную рекомбинацию в ES-клетках.
3. Применение длинных районов гомологии (длинных плеч гомологии) увеличивает частоту нацеливания на "трудные для нацеливания" локусы в эукариотических клетках, что согласуется с прежними открытиями того, что нацеливание гомологичной рекомбинации в эукариотических клетках связано, по-видимому, с общей гомологией, содержащейся в нацеливающем векторе.
4. Увеличенная частота нацеливания, получаемая с использованием длинных плеч гомологии, по-видимому, уменьшает полезность, если она имеется, использования изогенной ДНК в этих нацеливающих способах.
5. Применение количественных анализов МОА для скрининга эукариотических клеток на гомологичную рекомбинацию не только дает возможность использования LTVEC в качестве нацеливающих векторов (преимущества, очерченные выше), но также уменьшает время, требующееся для идентификации точно модифицированных эукариотических клеток, с обычных нескольких дней до нескольких часов. Кроме того, применение количественных МОА не требует применения зондов, локализованных вне эндогенного гена (генов) или хромосомного локуса (локусов), которые модифицируются, устраняя таким образом необходимость знания последовательности, фланкирующей модифицированный ген (гены) или локус (локусы). Это представляет собой важное улучшение в способе, которым выполняли скрининг в прошлом, и делает его гораздо менее трудоемким и гораздо более экономически эффективным подходом к скринингу на события гомологичной рекомбинации в эукариотических клетках.
Способы
Многие из способов, используемых для конструирования ДНК-векторов, описанных здесь, являются стандартными способами молекулярной биологии, хорошо известными специалисту с квалификацией в данной области (см., например, Sambrook, J., E. F. Fritsch And T. Maniatis. Molecular Cloning: A Laboratory Manual, Second Edition, Vols 1, 2, and 3, 1989; Current Protocols in Molecular Biology, Eds. Ausubel et al., Greene Publ. Assoc., Wiley Interscience, NY). Все секвенирования ДНК выполняются стандартными способами с использованием ДНК-секвенатора ABI 373A и набора для секвенирования Taq Dideoxy Terminator Cycle Sequencing Kit (Applied Biosystems, Inc., Foster City, CA).
Стадия 1. Получение клона большой геномной ДНК, содержащий представляющий интерес ген (гены) или хромосомный локус (локусы).
Представляющие интерес ген (гены) или локус (локусы) могут быть выбраны на основании специфических критериев, таких как подробные структурные или функциональные данные, или он может быть выбран в отсутствие такой подробной информации, так как потенциальные гены или генные фрагменты становятся прогнозируемыми в результате усилий различных проектов секвенирования генома.
Важно отметить, что не является необходимым знание полной последовательности и структуры представляющих интерес гена (генов) для применения способа данного изобретения для получения LTVEC. Фактически, единственной информацией о последовательности, которая требуется, являются приблизительно 80-100 нуклеотидов, так чтобы получить представляющий интерес геномный клон, а также генерировать блоки гомологии, используемые в получении LTVEC (описанные подробно ниже), и изготовить зонды для применения в количественных анализах МОА.
После отбора представляющих интерес гена (генов) или локуса (локусов) получают большой геномный клон (клоны), содержащий этот ген (гены) или локус (локусы). Этот клон (клоны) может быть получен любым из нескольких путей, в том числе, но не только, скринингом подходящих библиотек ДНК (например, библиотек ВАС, РАС, YAC или космид) стандартными способами гибридизации или ПЦР или любыми другими способами, известными специалисту с квалификацией в данной области.
Стадия 2. Присоединение блоков гомологии 1 и 2 к модификационной кассете и генерирование LTVEC.
Блоки гомологии маркируют сайты бактериальной гомологичной рекомбинации, которые используют для генерирования LTVEC из больших клонированных геномных фрагментов (фигура 1). Блоки гомологии являются короткими сегментами ДНК, обычно двухцепочечными и имеющими длину по меньшей мере 40 нуклеотидов, которые являются гомологичными районам в большом клонированном геномном фрагменте, фланкируя "район, который подлежит модификации". Блоки гомологии присоединяют к модификационной кассете, так что после гомологичной рекомбинации в бактериях эта модификационная кассета заменяет район, подлежащий модификации (фигура 1). Способ создания нацеливающего вектора с использованием бактериальной гомологичной рекомбинации может выполняться в различных системах (Yang et al, Nat Biotechnol, 15:859-65, 1997; Muyrers et al, Nucleic Acids Res, 27:1555-7, 1999; Angrand et al., Nucleic Acids Res, 27:e16, 1999; Narayanan et al., Gene Ther, 6:442-7,1999; Yu, et al., Proc Natl Acad Sci USA, 97:5978-83, 2000). Одним из примеров предпочтительной используемой в настоящее время технологии является ЕТ-клонирование (Zhang et al., Nat Genet, 20:123-8, 1998; Narayanan et al., Gene Ther, 6:442-7, 1999) и вариации этой технологии (Yu, et al., Proc Natl Acad Sci USA, 97:5978-83, 2000). ЕТ обозначает белки recE (Hall and Kolodner, Proc Natl Acad Sci USA, 91:3205-9, 1994) и recT (Kusano et al., Gene,138:17-25,1994), которые осуществляют реакцию гомологичной рекомбинации. RecE является экзонуклеазой, которая разрезает одну цепь линейной двухцепочечной ДНК (по существу донорный ДНК-фрагмент, описанный infra) 5' → 3', оставляя позади себя линейный двухцепочечный фрагмент с 3'-одноцепочечным выступом. Этот одноцепочечный выступ покрывается белком recT, который имеет активность связывания одноцепочечной ДНК (ssDNA) (Kovall and Matthews, Science, 277:1824-7, 1997). ЕТ-клонирование выполняют с использованием E. coli, которая временно экспрессирует продукты гена recE и recT E. coli (Hall and Kolodner, Froc Natl Acad Sci USA, 91:3205-9, 1994; Clark et al., Cold Spring Harb Symp Quant Biol, 49:453-62, 1984; Noirot and Kolodner, J Biol Chem, 273:12274-80, 1998; Thresher et al., J Mol Biol, 254:364-71, 1995; Kolodner et al., Mol Microbiol, 11:23-30, 1994; Hall et al., J Bacteriol, 175:277-87, 1993), и белка λgam бактериофага лямбда (λ) (Murphy, J Bacteriol,173:5808-21, 1991; Poteete et al., J Bacteriol, 170:2012-21, 1988). Белок λgam необходим для защиты донорного ДНК-фрагмента от деградации системой экзонуклеазы recBC (Myers and Stahl, Annu Rev Genet, 28:49-70, 1994), и он необходим для эффективного ЕТ-клонирования в recBC+-хозяевах, таких как часто используемый штамм E. coli DH10b.
Район, подлежащий модификации и заменяемый с использованием бактериальной гомологичной рекомбинации, может на