Способ микроклонального размножения листовой бегонии
Иллюстрации
Показать всеИзобретение относится к цветоводству и биотехнологии и может быть использовано, в частности, для размножения ценных декоративных сортов и гибридов листовой бегонии. Проводят индукцию почкообразования на эксплантах, полученных из листовых черешков бегонии, на среде с кинетином 0,5 мг/л и кокосовой водой 10 мл/л, при этом культивирование осуществляют в темноте, укоренение производят на питательной среде с НУК 0,5 мг/л, а акклиматизацию полученных регенерантов осуществляют, помещая высаженные в грунт регенеранты в прозрачные закрывающиеся контейнеры. Изобретение упрощает процесс микроклонального размножения листовой бегонии, а также повышает воспроизводимость растений. 4 ил., 2 табл.
Реферат
Изобретение относится к цветоводству и биотехнологии и может быть использовано в для массового размножения ценных декоративных сортов и гибридов бегонии, освобождения их от системных патогенов, создания новых гибридов и сортов с помощью мутационной селекции и генной инженерии.
Известен способ клонального размножения растений листовой бегонии (Begonia x hiemalis Fotsch.) (Гартман Х.Т., Тестер Д.Е. Размножение садовых растений. - М.: Изд-во сельскохозяйственной литературы, 1963. - С.206-208) с помощью стеблевых и листовых черенков. При таком способе черенки срезают с материнского растения и укореняют во влажной почве или песке.
Этот способ позволяет размножать отдельные растения бегонии, выделяющиеся окраской и формой листьев. Однако из-за низкого коэффициента размножения и низкой способности черенков многих ценных декоративных генотипов бегонии к укоренению он не имеет практической ценности и не может быть использован для массового размножения многих селекционно-ценных форм и гибридов.
Известен также способ клонального размножения сортов и гибридов листовой бегонии (De Klerk G.J., Ter Brigge J., Bouman H. An assay to measure the extent of somaclonal variation in micropropagated plants of Begonia hiemalis // Acta Bot. Neerl. - 1990. - V.39. - P. 145-151), основанный на индукции стеблевого органогенеза в условиях культуры in vitro, согласно которому листовые экспланты после стерилизации культивируют на питательной среде Мурасиге и Скуга (MS) с половинной концентрацией минеральных солей (1/2 MS), содержащей 6 г/л агара, 100 мг/л мезоинозита, 0.4 мг/л тиамина, 20 г/л сахарозы и фитогормоны: 0.1 мг/л НУК (1-нафтил-уксусную кислоту) и 2.0 мг/л БАП (6-бензиламинопурин). После 10 дней инкубации в темноте при 25°С экспланты пересаживают на безгормональную среду того же состава и культивируют на свету при 16-часовом фотопериоде. Через 6-8 недель побеги, развившиеся из эксплантов, вырезают и пересаживают для укоренения в стеклянные банки на среду того же состава, которые инкубируют при 20°С. Через 3 недели полученные растения переносят в почву.
Недостатком известного способа (аналога) является, по нашим данным, его слабая воспроизводимость, сильная зависимость от генотипа донорных растений и их физиологического состояния.
Наиболее близким к предлагаемому является способ микроклонального размножения бегоний (Simmonds J. Micropropagation of Begonia spp.- In: Biotechnology in Agriculture and Forestry, V.20. High-Tech and Micropropagation IV. Ed. Y.P.S. Bajaj. Springer-Verlag. 1992. - P.34-48) на основе индукции развития адвентивных почек из листовых черешков в культуре in vitro, в соответствии с которым от растений-доноров, выращиваемых в условиях длинного светового дня и находящихся на вегетативной стадии развития, берут экспланты - молодые растущие листья, которые промывают в проточной воде (1-2 часа), разрезают на сегменты (2×2 см), стерилизуют в течение 30 сек этанолом (95%) и затем 15 мин 7% гипохлоритом кальция с добавкой нескольких капель Tween-20, после чего промывают троекратно 3 порциями стерильной дистиллированной воды. Стерильные экспланты нарезают на сегменты (длиной 5-10 мм) и помещают на питательную среду MS, содержащую 30 г/л сахарозы, фитогормоны 0.1 мг/л НУК и 0.1 мг/л БАП, и 8 г/л агара. Культивируют на свету при 16-часовом фотопериоде, при 25°С. Для увеличения числа крупных (>1 см длиной) почек экспланты после 6 мес. культивирования на данной среде переносят в жидкую среду того же состава (без агара) и культивируют на свету на качалке в течение 3 месяцев. Для укоренения побеги, развившиеся на эксплантах, окунают в 0.4% раствор изо-бутиловой кислоты (ИБК) и высаживают в стаканчики со мхом, которые помещают в теплицу с туманом с обогревом дна (21°С), в котором туманообразование контролируется электронным сенсором. В первую неделю туманообразование осуществляют в течение 24 час/день, в течение последующих двух недель - 16 час/день.
Такой способ укоренения позволяет преодолеть наиболее критический этап микроклонального размножения бегонии - акклиматизацию полученных в культуре in vitro регенерантов в условиях in vivo.
Данный способ (прототип) позволяет получать до 27 крупных (>1 см длиной) почек на эксплант, 93% которых укореняются. Число регенерантов, выживших после пересадки в почву, составляет 19.7 в расчете на один эксплант.
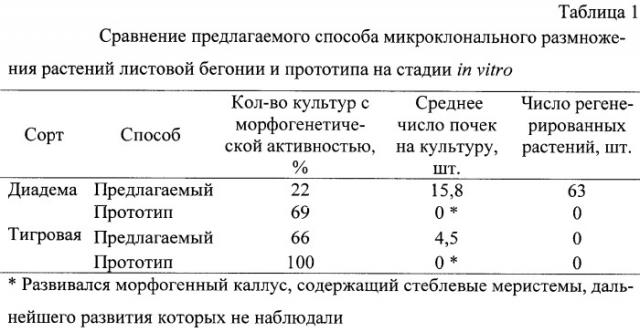
Недостатками данного способа (прототипа) является сложность процессов укоренения и адаптации в почве регенерированных растений и его низкая эффективность на разнообразных генотипах бегонии. В наших экспериментах при использовании данного способа были получены только морфогенные каллусы, в которых происходила закладка стеблевых почек, развитие побегов из которых в дальнейшем тормозилось (см. Табл.1).
Известно устройство для микроклонального размножения растений бегонии (Simmonds J. Micropropagation of Begonia spp. - In: Biotechnology in Agriculture and Forestry, V. 20. High-Tech and Micropropagation IV. Ed. Y.P.S. Bajaj. Springer-Verlag. 1992. - P.34-48), включающее теплицу с туманом с устройствами донного подогрева и туманообразования, в которую помещаются блоки ячеек, наполненных мхом, для высадки, укоренения и акклиматизации выращенных в культуре in vitro побегов. Такая теплица снабжена электронным сенсором, определяющим время туманообразования по влажности листьев.
Недостатком этого устройства, взятого в качестве прототипа, является его конструктивная сложность. Теплица с туманом представляет собой дорогостоящее стационарное сооружение, требующее специальных узлов для автоматической регуляции биопараметров выращиваемых растений (свет, влажность, температура). В производстве такое сооружение привязано к специализированному цветоводческому хозяйству. Стационарный характер, конструкционная сложность и дороговизна данного устройства ограничивает его использование мелкими производителями, малыми предприятиями, фермерами, неспециализированными внедренческими фирмами при научно-исследовательских институтах и университетах.
Техническая задача, решаемая предлагаемым изобретением, - повышение эффективности микроклонального размножения растений листовой бегонии при его упрощении.
Поставленная задача решается тем, что по предлагаемому способу микроклонального размножения растений листовой бегонии, включающему индукцию почкообразования из эксплантов, взятых от листовых черешков, культивируемых на питательной среде с регуляторами роста, укоренение полученных в условиях культуры тканей растений и их акклиматизацию, для индукции почкообразования используют среду с кинетином и кокосовой водой, при этом культивирование осуществляют в темноте, укоренение побегов производят на питательной среде с НУК, а акклиматизацию полученных регенерантов осуществляют, помещая высаженные в грунт регенеранты в прозрачный закрывающийся контейнер, который является устройством для осуществления предлагаемого способа.
Для осуществления предлагаемого способа микроклонального размножения листовой бегонии предлагается использовать устройство в виде прозрачного закрывающегося, например, пластикового контейнера, в который для акклиматизации помещаются стаканчики с грунтом с высаженными в них регенерантами. Такой контейнер состоит из нижней части со стенками, на которую помещаются стаканчики, и крышки, которая может быть съемной или стационарной и соединяться в последнем случае, например, петлями со стенками нижней части и снабжена, как и стенки, рантом с заклепками, позволяющими плотно прикрывать ее. Для предлагаемого устройства выбирается прозрачный материал, например стекло, пластик и т.п., из которого и изготовляется контейнер, что должно гарантировать свободное поступление светового потока к растениям-регенерантам. В любом случае крышка должна плотно прикрываться и обеспечивать в контейнере необходимый для развития регенерантов микроклимат (влажность, газовый состав атмосферы). Возможность периодического открытия крышки оператором позволяет постепенно адаптировать растения к внешней среде. Предлагаемое устройство должно быть автономным и переносным для обеспечения возможности его помещения в температурную среду, оптимальную для развития размножаемой культуры.
Предлагаемое изобретение иллюстрируется четырьмя фигурами (фиг.1-4). На фиг.1 представлены почки, развивающиеся из тканей листового черешка бегонии на среде MS с кинетином и кокосовой водой. На фиг.2 представлены растения-регенеранты бегонии с корнями на среде 1/2 MS+НУК. На фиг.3 представлены растения-регенеранты бегонии в прозрачном закрывающемся контейнере, адаптировавшиеся к условиям in vivo. На фиг.4 представлено изображение предлагаемого устройства для осуществления предлагаемого способа.
В известной научно-технической литературе не обнаружено решений с совокупностью признаков, аналогичных заявленным. Таким образом, предлагаемое решение соответствует критерию «изобретательский уровень».
Предлагаемый способ микроклонального размножения листовой бегонии осуществляют следующим образом.
С растений срезают молодые растущие листья, которые промывают в проточной воде, и затем стерилизуют, например, 70° этиловым спиртом (30 сек), диацидом (5-7 мин) и промывают стерильной водой. После стерилизации от листьев отделяют черешки, которые затем нарезают на сегменты, например, длиной 0.5-0.7 см и помещают на поверхность питательной среды, например, в пробирки или чашки Петри и культивируют в темноте при оптимальной для бегонии температуре, например, при t=26°C для образования адвентивных почек. Используют питательную среду для индукции почкообразования (среда 1), которая содержит, например, макро- и микроэлементы и витамины по Мурасиге и Скугу (MS), сахарозу (3%), мезо-инозит (100 мг/л), агар (6 г/л), кинетин (0,5 мг/л) и кокосовую воду (10 мл/л). Для последующего развития побегов из почек, образовавшихся на сегментах черешков, эти экспланты вместе с формирующимися из них почками пересаживают в пробирки на среду 2, отличающуюся от среды 1 заменой кинетина и кокосовой воды на ауксин, например на ИУК (0,2 мг/л), и культивируют на свету (например, при фотопериоде 16/8 час, t=26°C). Для развития корневой системы сформировавшиеся побеги пересаживают в емкости большего объема, например в стеклянные сосуды объемом 200 мл, содержащие 30-50 мл среды 3, отличающейся от среды 2 половинным содержанием минеральных солей (1/2 MS) и заменой ИУК (0,2 мг/л) на более сильный синтетический ауксин - НУК (0,5 мг/л). Полученные регенеранты с развитой корневой системой для доращивания и акклиматизации пересаживают в грунт в пластиковые стаканчики объемом, например, 50 мл, которые помещают в прозрачные закрывающиеся, например, пластиковые контейнеры и выращивают в растильной комнате или теплице. Крышки таких контейнеров ежедневно приоткрывают для полива и адаптации растений к окружающей среде.
Пример конкретного осуществления предлагаемого способа микроклонального размножения листовой бегонии и применения устройства для его осуществления.
В работе использовали растения листовой бегонии (Begonia×hiemalis Fotsch.) сортов Диадема и Тигровая. В качестве эксплантов использовали черешки развивающихся листьев. При культивировании фрагментов черешков на среде 1 (MS с кинетином, 0.5 мг/л, и кокосовой водой, 10 мл/л) наблюдали массовое развитие стеблевых почек непосредственно из тканей экспланта, минуя каллусную стадию (фиг.1). Наиболее интенсивно этот процесс наблюдали у сорта Диадема, у которого один эксплант продуцировал более 15 почек (Табл.1).
После пересадки стеблевых почек, развившихся непосредственно из тканей экспланта, на среду 2 (MS+ИУК, 0.2 мг/л) от их основания наблюдали развитие корней. Для более интенсивного развития корневой системы и получения более мощных жизнеспособных растений полученные регенеранты были пересажены далее в стеклянные 200-мл банки на среду 3 (с половинным содержанием солей MS и добавкой ПУК, 0.5 мг/л), что способствовало развитию у них мощной корневой системы и образованию новых побегов, пригодных для последующего укоренения в условиях in vitro (фиг.2). Наибольшей интенсивности данный процесс был достигнут у сорта Диадема, у которого от черешка одного листа, введенного в культуру in vitro, получено более 60 регенерантов (Табл. 1).
При пересадке в стаканчики с почвой, которые помещали в прозрачные пластиковые закрывающиеся контейнеры, в качестве которых использовали стандартные упаковки для тортов объемом ≈0.03 м3, эти регенеранты успешно проходили акклиматизацию и давали полноценные растения бегонии (Фиг.3). При таких условиях достигли свыше 70%-ной частоты приживаемости регенерантов, тогда как в контрольном варианте (в отсутствии прозрачных пластиковых контейнеров) наблюдали массовую гибель регенерантов и не получили ни одного растения (Табл. 2).
Устройство для осуществления предлагаемого способа включало прозрачный закрывающийся пластиковый контейнер объемом ≈0.03 м3. Такой контейнер состоит из нижней части со стенками (1) и стационарной крышки (2), которая соединяется пластиковыми петлями со стенками нижней части и снабжена, как и стенки, рантом с заклепками (3), позволяющими плотно прикрывать ее.
Предлагаемое устройство работает следующим образом. На нижнюю часть со стенками (1) помещаются стаканчики с грунтом с высаженными в них регенерантами. Крышка устройства (2) плотно прикрывается с помощью заклепок, находящихся на рантах нижней и верхней частей (3). Периодически крышку открывают для полива регенерантов и их постепенной адаптации к внешней среде.
Таким образом, предлагаемое изобретение позволяет проводить микроклональное размножение ценных декоративных сортов и гибридов листовой бегонии в условиях культуры in vitro. При этом данное изобретение оказывается эффективным для испытанных нами сортов (частота культур, продуцирующих стеблевые почки, составляет 66%, а число почек на один эксплант варьирует от 4.5 до 15.8), тогда как при использовании способа по прототипу у данных сортов нами не было получено ни одной культуры с развитыми почками (см. Табл.1).
Необходимо отметить значительную простоту и дешевизну предлагаемого нами изобретения в сравнении с прототипом, предусматривающим использование для укоренения и акклиматизации регенерантов специальную влажную теплицу с донным подогревом, электронным датчиком влажности и автоматическим круглосуточным увлажнением. В предлагаемом нами изобретении такая установка без значительного снижения эффективности заменяется прозрачным, например пластиковым, закрывающимся контейнером, при этом приживаемость регенерантов - один из ключевых этапов микроклонального размножения бегонии - сохраняется на высоком уровне (71%).
Предлагаемое нами устройство помимо дешевизны и простоты конструкции имеет ряд значительных преимуществ, таких как автономность и переносной характер, которые позволяют его размещать в условиях температурного и светового режимов, благоприятных для развития той или иной культуры; кроме того, оно увеличивает сохранность растений на ранних стадиях их адаптации, ограничивая проникновение инфекции. Предлагаемое устройство позволяет расширить круг производителей декоративных культур и может быть использовано малыми предприятиями, в НИИ, университетах, не имеющих средств на сооружение дорогостоящих теплиц с регулируемым увлажнением. При этом масштаб производства определяется мультиплицированием предлагаемого устройства.
Способ микроклонального размножения растений листовой бегонии, включающий индукцию почкообразования из эксплантов, взятых от листовых черешков, культивируемых на питательной среде с регуляторами роста, укоренение полученных в условиях культуры тканей растений и их акклиматизацию, отличающийся тем, что для индукции почкообразования используют среду с кинетином 0,5 мг/л, и кокосовой водой 10 мл/л, при этом культивирование осуществляют в темноте, укоренение производят на питательной среде с НУК 0,5 мг/л, а акклиматизацию полученных регенерантов осуществляют помещая высаженные в грунт регенеранты в прозрачные закрывающиеся пластиковые контейнеры.