Выделение внутренней клеточной массы для создания линий эмбриональных стволовых клеток человека (hesc)
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к эмбриологии, и касается выделения внутренней клеточной массы для создания линий эмбриональных стволовых клеток человека. Способ выделения внутренней клеточной массы включает стадии иммобилизации эмбриона на стадии бластоцисты, имеющего блестящую оболочку, трофобласт и внутреннюю клеточную массу, создания отверстия в эмбрионе на стадии бластоцисты путем лазерной абляции и удаления внутренней клеточной массы из эмбриона на стадии бластоцисты через отверстие. Отверстие проходит через блестящую оболочку и трофобласт. Лазерную абляцию проводят с применением бесконтактного диодного лазера. Внутреннюю клеточную массу, выделенную из эмбриона на стадии бластоцисты, применяют для создания линий эмбриональных стволовых клеток человека. Преимущество изобретения заключается в упрощении способа выделения внутренней клеточной массы. 3 н. и 27 з.п. ф-лы, 2 табл., 5 ил.
Реферат
Связанная заявка
Данная заявка заявляет приоритет предварительной заявки Сер. № 60/314323, опубликованной 23 августа 2001 г. в США.
Область изобретения
Настоящее изобретение относится к способу выделения внутренней клеточной массы (ICM), извлеченной из эмбриона млекопитающего на стадии бластоцисты, для создания линий эмбриональных клеток человека (hESC), с применением бесконтактной диодно-лазерной методики.
Предпосылки изобретения
Выделение стволовых клеток человека обеспечивает перспективу целого ряда новых терапевтических возможностей. Считается, что возможности биологического лечения при помощи таких клеток через регенерацию и восстановление тканей, также как через направленную доставку генетического материала, окажутся эффективными в лечении широкого диапазона медицинских состояний. Усилия в отношении анализа и оценки безопасности применяемых стволовых клеток человека в клинических условиях являются жизненно необходимыми для данной попытки.
Эмбриональные стволовые (ES) клетки представляют собой особенный вид клеток, которые могут как размножаться сами по себе (самообновляться), так и образовывать функционально дифференцированные специализированные типы клеток. Данные стволовые клетки могут становиться практически любыми специализированными клетками организма и, следовательно, могут иметь потенциальные возможности образовывать замещающие клетки для широкого ряда тканей и органов, таких как сердце, поджелудочная железа, нервная ткань, мышцы, хрящ и подобные.
Стволовые клетки обладают способностью неограниченно делиться и пролиферировать в культуре. Ученые используют оба этих качества стволовых клеток для получения практически неограниченного запаса большинства типов клеток человека из стволовых клеток, обеспечивая предпосылки лечения заболеваний путем замены клеток. Фактически, клеточная терапия имеет потенциальные возможности в лечении любых заболеваний, которые связаны с дисфункцией клеток или их повреждением, включая инсульт, диабет, инфаркт, повреждение спинного мозга, рак и СПИД. Возможность манипулирования стволовыми клетками в отношении восстановления или замены больных или поврежденных тканей является актуальной темой в научных, медицинских и биотехнологических инвестиционных кругах.
ES клетки различных эмбрионов млекопитающих успешно выращивают в лабораториях. Evans и Kaufman (1981) и Martin (1981) показали, что является возможным получить постоянные линии эмбриональных клеток непосредственно из бластоцист мышей. Thomson et al. (1995 и 1996) успешно получили постоянные клеточные линии от макак-резус и мартышек. Полипотентные клеточные линии также были получены из пре-имплантированных эмбрионов некоторых домашних и лабораторных животных, таких как коровы (Evans et al., 1990), свиньи (Evans et al., 1990, Notarianni et al. 1990), овцы и козы (Meinecke-Tillmann and Meinecke, 1996, Notarianni et al., 1991), кролики (Giles et al., 1993, Graves et al., 1993), норки (Sukoyan et al., 1992), крысы (Iannacona et al., 1994) и хомячки (Doetschman et al., 1988). Недавно Thomson et al. (1998) и Reubinoff et al. (2000) сообщили о выведении линий ES клеток человека. Данные ES клетки человека похожи на линии ES клеток макак-резус.
ES клетки обнаружены в ICM бластоцисты человека, ранней стадии развития эмбриона, продолжающейся с 4-го по 7-й день после оплодотворения. Бластоциста представляет собой стадию эмбрионального развития до имплантации, которая содержит два типа клеток, а именно
1) трофобласт: наружный слой, дающий начало наружным мембранам эмбриона;
2) внутренняя клеточная масса (ICM), которая создает собственно эмбрион.
При нормальном эмбриональном развитии ES клетки исчезают после 7-го дня и начинают образовывать три слоя эмбриональной ткани. ES клетки, выделяемые из ICM на стадии бластоцисты, однако, могут быть культивированы в лаборатории и при правильных условиях пролиферируют неограниченно. Выращивание ES клеток в таком недифференцированном состоянии сохраняет потенциальную возможность их дифференцировки в клетки всех трех слоев эмбриональных тканей. В конечном счете, клетки внутренней клеточной массы дают начало всем эмбриональным тканям. На этой стадии эмбриогенеза, около конца первой недели развития, такие ES клетки могут быть получены из ICM бластоцисты.
Возможность выделять ES клетки из бластоцисты и выращивать их в культуре, видимо, зависит в большой степени от сохранности и состояния бластоцисты, из которой получают клетки. Вкратце, бластоциста, которая является большой и имеет отдельную внутреннюю клеточную массу, позволяет выделять ES клетки наиболее эффективно. Применяют несколько способов выделения внутренней клеточной массы (ICM) для создания линий эмбриональных стволовых клеток. Наиболее употребительными способами являются следующие:
1. Естественное выведение бластоцисты
В данной методике бластоциста выводится естественно после высевания на питательный слой. Бластоциста обычно выводится на 6 день. Внутренняя клеточная масса (ICM) выведенной бластоцисты образует вырост. Данный вырост удаляют механически и впоследствии выращивают для создания линий эмбриональных стволовых клеток. Однако данная методика имеет несколько недостатков. Во-первых, клетки трофобласта очень быстро пролиферируют в заданных условиях культивирования и часто подавляют рост внутренней клеточной массы. Во-вторых, при удалении выроста внутренней клеточной массы механически, существует возможность выделить клетки трофобласта. В-третьих, процент самопроизвольно выводящихся бластоцист у людей является очень низким.
2. Микрохирургия
Другим способом выделения внутренней клеточной массы является механическая аспирация, называемая микрохирургией. Во время данной процедуры бластоцисту держат удерживающей пипеткой с применением системы микроманипулятора и располагают таким образом, чтобы внутренняя клеточная масса (ICM) находилась в положении 9 часов. Внутреннюю клеточную массу (ICM) аспирируют с использованием биопсийной иглы, которая имеет коническую форму и вставляется в полость бластоцисты. Данная методика также является очень невыгодной, т.к. вероятность выделения целой внутренней клеточной массы низка и часто нарушается целостность клетки. Данная методика является очень кропотливой и может вызывать серьезное повреждение эмбриона. Манипуляция на клеточном уровне требует применения инструментария с микрометровой точностью, чтобы таким образом минимизировать повреждение и загрязнение.
3. Иммунохирургия
Данная методика представляет собой обычно применяемую методику выделения внутренней клеточной массы (ICM). Внутреннюю клеточную массу (ICM) выделяют комплементопосредованным лизисом. В данной методике бластоцисту подвергают воздействию кислого раствора тирода или раствора фермента проназы с целью удаления блестящей оболочки бластоцисты. Эмбрион без оболочки затем подвергают воздействию поверхностных антител человека в течение около 30 минут - 1 часа. После этого эмбрионы подвергают воздействию комплемента морской свинки для лизирования трофобласта. Полученные после комплементопосредованного лизиса клетки трофобласта отделяют от внутренней клеточной массы (ICM) путем повторного механического вбирания пипеткой с помощью неглубокого погружения пипетки Пастера. Все клеточные линии эмбриональных стволовых клеток, известные к настоящему времени в литературе, были выделены таким способом. Однако данный способ имеет несколько недостатков. Во-первых, эмбрион подвергают в течение длительного времени воздействию кислого тирода или проназы, что оказывает вредное воздействие на эмбрион, вследствие этого, уменьшая жизнеспособность собственно эмбриона. Во-вторых, данная методика требует времени, т.к. она занимает около 1,5-2 часов (Narula et al., 1996). В-третьих, выход внутренней клеточной массы (ICM) на бластоцисту является низким. В-четвертых, требуются критические условия хранения антител и комплемента, применяемых в данной методике. Наконец, возникает риск передачи вируса или бактерии животного происхождения людям, т.к. в данной методике применяют антитела и комплемент, полученные от животных. В данной методике применяют две сыворотки животных. Одна представляет собой античеловеческую антисыворотку кролика, а другая - комплементарную сыворотку морской свинки.
Клеточные линии человека, изученные к настоящему моменту, главным образом выделяют с применением способа иммунохирургии, где применяют антисыворотку и комплемент животных.
Другими возможными недостатками существующих клеточных линий являются следующие:
1. Применение питающих клеток для культивирования клеточных линий эмбриональных стволовых клеток человека (hESC) способствует образованию смешанной клеточной популяции, которая требует отделения эмбриональных стволовых клеток (ESK) от компонентов питающих клеток, и данный процесс нарушает выход.
2. Эмбриональные стволовые клетки (ESK) могут быть загрязнены транскриптами питающих клеток и не могут применяться в коммерческом масштабе. Они могут применяться только для исследовательских целей.
Geron создал методику, в которой линии эмбриональных стволовых клеток человека (hESC) могут культивироваться в отсутствии питающих клеток (XU et al., 2001). hESC культивировали на внеклеточном матриксе в определенной среде, и они развивались в таких условиях выращивания в недифференцированном состоянии. hESC не содержали ксеногенных компонентов ракового происхождения из других клеток в культуре. Также, продукция hESC и их производных была более подходящей для коммерческого производства. В данной методике не было необходимости в получении питающих клеток на постоянной основе для поддержания культуры, и пассаж клеток мог производиться механически. Однако главным недостатком данной методики является то, что внутреннюю клеточную массу (ICM) выделяют способом иммунохирургии, где исходное выведение эмбриональных стволовых клеток проводят с использованием питающего слоя, содержащего ксеногенные компоненты. Данный факт повышает вероятность возможного заражения вирусами и бактериями животного происхождения.
С целью упростить методику выделения внутренней клеточной массы и сделать ее безопасной, авторы настоящего изобретения разработали новый способ выделения внутренней клеточной массы с использованием бесконтактного лазера, где исключено применение животных антисыворотки и комплемента.
Применение лазерной методики в искусственном оплодотворении
При появлении методик искусственного оплодотворения (ЭКО (ART)) применяли несколько способов для улучшения оплодотворения, облегчения выведения бластоцисты (Cohen et al., 1990) и проведения биопсии бластомеров (Tarin and Handyside, 1993). Обычные используемые методы являются химическими (Gordon and Talansky, 1986), механическими (Depypere et al., 1988) и лазерными (Feichtinger et al., 1992) способами создания отверстий в блестящей оболочке (Gordon, 1988). В последнее время было показано, что инфракрасный 1,48 мкм диодный лазер, сфокусированный через объектив микроскопа, позволяет быстро, легко и бесконтактно просверлить микроотверстие в мышиной и человеческой блестящей оболочке, и с его помощью была достигнута высокая точность в обычных условиях культивирования (Rink et al., 1994). Показанный эффект сверления был обусловлен высоколокализованным теплозависимым разрывом гликопротеиновой матрицы блестящей оболочки (Rink et al., 1996). Вопреки вредному воздействию на компактизированные мышиные эмбрионы, вызываемому 308 нм ксенон-хлорным эксимерным лазером (Neev et al., 1993), процесс сверления в инфракрасной области не влиял на выживаемость эмбрионов мышей (Germond et al., 1995) или человека (Antinori et al., 1994).
В настоящее время лазеры изучают в виде средства для помощи в оплодотворении и для облегчения выведения. В недавних сообщениях было показано, что применение 1,48 мкм диодного лазера для микросверления мышиной блестящей оболочки является достаточно безопасным и не влияет на нейроанатомические и нейрохимические свойства у мышей, а также улучшает оплодотворение (Germond et al., 1996). Obruca и коллеги первыми сообщили об успешном применении лазера при выведении при IVF у человека в 1994. В данном исследовании в блестящей оболочке (ZP) проделывали отверстие 20-30 микрон, когда эмбрионы находились на стадии двух или четырех клеток, и эмбрионы переносили немедленно. В настоящее исследование включали пациентов с предыдущими неудачными попытками ЭКО. Степень имплантации на эмбрион была выше в группе с применением лазера при выведении эмбриона (14,4%) по сравнению с контрольной группой (6%). Доля беременностей на перенос также была выше (40% по сравнению с 16,2%).
В отдельном исследовании применяли Er:YAG лазер для утончения ZP эмбрионов, полученных у пациентов, подвергающихся повторному ЭКО. Применяя лазер для утончения ZP, эмбриологи смогли достичь точного уменьшения ZP на 50%, что является труднодостижимым при применении кислого раствора тирода. Присутствие кислого раствора тирода вблизи эмбриона также может быть вредным. Доля клинических беременностей в группе с лазерным выведением составила 42,7% по сравнению с 23,1% в контрольной группы без выведения. Так как эти данные выглядят многообещающими, показания к выведению с помощью лазера были расширены. Женщины, впервые подвергающиеся процедуре ЭКО, имели долю клинических беременностей 39,6% в группе, леченной лазером, по сравнению с долей 19% в контрольной группе, без выведения (Parikh et al. 1996).
В течение последнего десятилетия проводились исследования по выделению внутренней клеточной массы (ICM), т.к. она является полезной для создания линий эмбриональных стволовых клеток, которые, в свою очередь, могут развиваться в большинстве специализированных клеток организма человека, включая кровь, кожу, мышцы и нервные клетки. Также они способны неограниченно делиться и пролиферировать в культуре.
Настоящее изобретение включает выделение внутренней клеточной массы (ICM), с использованием методики лазерной абляции, без проведения громоздкой процедуры иммунохирургии. Следовательно, в настоящем изобретении исключено применение животных антител или сыворотки, а методика является безопасной, простой, быстрой и коммерчески возможной.
Настоящее изобретение исключает недостатки, связанные с традиционными способами выделения внутренней клеточной массы (ICM). Было обнаружено, что внутренняя клеточная масса, выделенная при помощи настоящего изобретения, является интактной и не имеет деструкции или повреждения клеток. Следовательно, настоящее изобретение обеспечивает быстрый, надежный и неинвазивный способ выделения внутренней клеточной массы (ICM). Также он полностью разрывает трофобласт, вследствие этого минимизируя загрязнение внутренней клеточной массы (ICM), таким образом, обеспечивая чистоту внутренней клеточной массы (ICM).
ССЫЛКИ
1. Antinori S, Versaci C, Fuhrberg P et al (1994). Seventeen live birth after the use of erbium-yytrium aluminum garnet laser in the treatment of male factor infertility. Hum Reprod. 9:1891-1896.
2. Cohen J, Eisner C, Kort H et al (1990). Impairment of the hatching process following IVF in the human and improvement of implantation by assisting hatching using micromanipulation. Hum Reprod. 5:7-13.
3. Depypere HT, McLaughlin KJ, Seamark RF et al (1988). Comparison of zona cutting and zona drilling as techniques for assisted fertilization in the mouse. J. Reprod Fertil. 84:205-211.
4. Doetschman T, Williams P and Maeda N (1988) Establishment of hamster blastocyst derived embryonic stem (ES) cell. Developmental Biology 127:224-227.
5. Evans MJ and Kaufman MH (1981). Establishment in culture of pluripotential cells from mouse embryo. Nature 292:154-156.
6. Evans MJ, Notarianni E, Laurie S and Moor RM (1990) Derivation and preliminary characterization of pluripotent cell lines from porcine and bovine blastocyst. Theriogenology 33:125-128.
7. Feichtinger W, Strohmer H, Fuhrberg P et al (1992). Photoablation of oocyte zona pellucida by erbium-yag laser for in-vitro fertilization in severe male infertility Lancet. 339, 811.
8. Gordon JW (1988). Use of micromanipulation for increasing the efficiency of mammalian fertilization in vitro. Ann. N.Y. Acad.Sci. 541:601-613.
9. Gordon JW and Talansky BE (1986). Assisted fertilization by zona drilling: a mouse model for correction of oligospermia. J. Exp Zool. 239:347-354.
10. Germond M, Nocera D, Senn A. Rink K. et al (1995). Microdissection of mouse and human zona pellucida using 1.48 microns diode laser beam: efficacy and safety of the procedure. Fertil Steril. 64:604-611.
11. Germond M, Nocera D, Senn A, Rink A et al (1996). Improved fertilization and implantation rates after non-touch zona pellucida microdrilling of mouse oocytes with a 1.48 micron diode laser beam. Hum Reprod. 11:1043-1048.
12. Giles JR, Yang X, Mark X and Foot RH (1993). Pluripotency of cultured rabbit inner cell mass cells detected by isozyme analysis and eye pigmentation of fetus following injection into blastocysts or morula. Molecular Reproduction and Development 36:130-138.
13. Graves KH and Moreadith RW (1993). Derivation and characterization of putative pluripotential embryonic stem cells from pre-implantation rabbit embryo. Molecular reproduction and Development 36:424-433.
14. Iannaccone PM, Taborn GU, Garton RL et al (1994). Pluripotent embryonic stem cells from the rat are capable of producing chimeras. Developmental Biology 163:288-292.
15. Martin GR (1981) Isolation of pluripotent cell lines from early mouse embryos cultured in medium conditioned with teratocarcinoma stem cells. Proceeding of National Academy of Sciences USA 72:1441-1445.
16. Meinecke-Tillmann S and Meinecke B (1996). Isolation of ES like cell lines from ovine and caprine pre-implantation embryo. J Animal Breeding and Genetics 113:413-426.
17. Narula A, Taneja, Totey SM (1996) Morphological cells to trophectoderm and inner cell mass of in vitro fertilized and parthenogenetically developed buffalo embryo: the effect of IGF-I. Mol. Reprod. Dev. 44(3):343-51.
18. Neev J, Gonzales A, Lucciardi F et al (1993). Opening of the mouse zona pellucida by laser without a micromanipulator. Hum Reprod. 8:939-944.
19. Obruca A, Strohmer H, Sakkas D (1994). Use of laser in assisted fertilization and hatching. Hum Reprod. 9:1723-1726.
20. Parikh FR, Kamat SA, Nadkarni S et al (1996). Assisted hatching in an in vitro fertilization program. J Reprod Fertil Suppl 50:121-125.
21. Reubinoff BE, Per MF, Fong CY, Trounson A and Bongso A (2000) Embryonic stem cell lines from human blastocysts: Somatic differentiation in vivo. Nat Biotechnol. 18:299-304.
22. Rink K, Delacretaz G, Salathe RP et al (1994). Proceedings SPIE. 2134A, 412-422.
23. Rink K, Delacretaz G, Salathe RP et al (1996). Non-contact microdrilling of mouse zona pellucida with an objective delivered 1.48 microns diode laser. Lasers Surg Med. 18:52-62.
24. Sukoyan MA, Golublitsa AN, Zhelezova Al et al (1992) Isolation and cultivation of blastocyst derived stem cell lines from American Mink. Molecular Reproduction and Development 33:418-431.
25. Tarin JJ and Handyside AH (1993). Embryo biopsy strategies for preimplantation diagnosis. Fertil Steril 59:943-952.
26. Thomson JA, Itskovitz-Eldor J, Shapiro SS. et al. (1998). Embryonic stem cell lines derived from human blastocyst. Science 282:1145-1147.
27. Thomson JA, Kalishman J, Golos TG et al (1996). Pluripotent cell line derived from common marmoset blastocyst. Biology of Reproduction. 55:254-259.
Цели изобретения
1. Целью настоящего изобретения является разработка способа выделения внутренней клеточной массы с использованием методики лазерной абляции, без проведения громоздкой процедуры иммунохирургии.
2. Другой целью настоящего изобретения является выделение ICM с применением методики лазерной абляции без использования любых животных антител и сывороток, тем самым предотвращается возможность передачи животного организма человеку и поэтому имеется возможность использования в коммерческих масштабах.
3. Другой целью настоящего изобретения является выделение внутренней клеточной массы (ICM) из эмбриона млекопитающего на стадии бластоцисты с применением бесконтактного диодного лазера.
4. Другой целью настоящего изобретения является выделение внутренней клеточной массы (ICM) простым, более коротким и легко выполнимым путем без разрушения внутренней клеточной массы (ICM).
5. Еще одной целью настоящего изобретения является обеспечение чистоты внутренней клеточной массы (ICM) путем полного разрушения трофобласта, тем самым минимизируя загрязнение внутренней клеточной массы (ICM).
6. Еще одной целью настоящего изобретения является выделение внутренней клеточной массы (ICM) с высоким выходом и чистотой по сравнению с внутренней клеточной массой (ICM), выделенной обычными способами.
Эти и другие цели изобретения станут более ясными из последующего описания.
Подробное описание изобретения
Настоящее изобретение относится к выделению внутренней клеточной массы с применением лазерной абляции блестящей оболочки (ZP) и трофобласта (ТЕ) и аспирации внутренней клеточной массы для создания линий эмбриональных стволовых клеток. В настоящем изобретении, применяемый бесконтактный диодный лазер является высокоточным и надежным инструментом для клеточной микрохирургии. Система включает новейшие оптиковолоконные технологии для обеспечения наиболее компактной лазерной системы, доступной на настоящий момент. 1,48 мкм диодная бесконтактная лазерная система Сатурн (Saturn) является установленной/имплантированной через эпифлуоресцентный порт в обращенный микроскоп, снабженный микроманипуляторами. Контрольный лазер используют для нацеливания главного абляционного лазера и ряд СИД уведомляют пользователя о зарядке лазера и его готовности выстрелить. Двухсекундный интервал для манипуляций применяют для уменьшения возможности случайного выстрела лазера. Диаметр светового пятна лазера может варьироваться в зависимости от требуемого размера отверстия.
Пары, подвергающиеся лечению ЭКО, добровольно отдают лишние человеческие эмбрионы. Данные эмбрионы используют для исследовательских целей после получения письменного добровольного согласия от таких пар. В настоящем изобретении, брали эмбрионы на стадии бластоцисты для выделения внутренней клеточной массы. Бластоцисту помещали в 35 мм чашку Петри в 50 микролитровые капли среды для биопсии эмбрионов, свободной от Са++/Mg++, и покрывали минеральным маслом. Микроманипулятор устанавливали для проведения процедуры биопсии эмбриона. Бластоцисту помещали в среду для биопсии эмбриона и чашку Петри, содержащую бластоцисту, помещали на подогреваемый столик микроскопа. Бластоцисту располагали в центре поля зрения. Бластоцисту иммобилизировали на удерживающей пипетке таким образом, чтобы внутренняя клеточная масса находилась в позиции 3 часа. Блестящую оболочку и трофобласт, близлежащие к внутренней клеточной массе, располагали в пятне прицела лазерного пучка. Небольшую часть блестящей оболочки и трофобласта подвергали лазерной абляции. Затем биопсийную пипетку аккуратно вставляли в отверстие в блестящей оболочке и трофоэктодерме и осторожно аспирировали внутреннюю клеточную массу. После выделения всей внутренней клеточной массы клетки несколько раз промывали средой для эмбриональных стволовых клеток (ESC). Затем клетки помещали на питающий слой со средой для эмбриональных стволовых клеток для создания линий эмбриональных стволовых клеток. Затем эмбриональные стволовые клетки характеризовали поверхностными маркерами, такими как SSEA-1, SSEA-3, SSEA-4, TRA-1-60, TRA-1-81, OCT-4 и щелочная фосфатаза. Также линии эмбриональных стволовых клеток кариотипировали.
а) Развитие бластоцисты in vitro
Разрешение этического комитета было получено до начала настоящего исследования. От каждого донора, прежде всего, получали письменное согласие на дачу лишних эмбрионов после завершения лечения бесплодия для данного исследования.
Протокол, обычно используемый для пациентов с бесплодием, для получения жизнеспособных эмбрионов был следующий.
Суперовуляцию яичников начинали с использования супрессии аналогами агонистов ГТ-РГ ежедневно, начиная со средней лютеиновой фазы, и их вводили в дозах 500-900 мг в течение 9-12 дней. Стимуляцию яичников начинали после адекватной супрессии яичников менопаузальными гонадотропинами человека (hMG) или рекомбинантным фолликулостимулирующим гормоном (FSH) (Gonal-F, Recagon) в соответствующих дозах в зависимости от возраста и объема яичников. Также дозу корригировали при необходимости для получения контролируемой стимуляции яичников. При необходимости проводили измерения бета-ESтрадиола сыворотки (Е2). Трансвагинальное ультразвуковое исследование проводили ежедневно, начиная с 7 дня цикла. Хорионический гонадотропин человека в дозе 5000-10000 МЕ вводили, когда три или более фолликула имели, по меньшей мере, 17 мм в наибольшем диаметре. Трансвагинальную аспирацию проводили спустя 34-36 часов. Затем ооциты подвергали внутрицитоплазматической инъекции сперматозоидов.
Для закрепления яйцеклетки применяли стеклянную удерживающую пипетку 40-60 мкм в диаметре. Подвижные сперматозоиды помещали в каплю раствора поливинилпирролидона (ПВП) и покрывали минеральным маслом. Инъекционную иглу с наружным диаметром приблизительно 5-6 мкм и внутренним диаметром 3-4 мкм применяли для прокалывания прозрачной зоны в позиции около 3 часов. Выбранный сперматозоид иммобилизировали путем обрезания хвоста при помощи инъекционной микропипетки. Удерживающая пипетка фиксировала ооцит и сперматозоид вводили непосредственно в центр ооцита.
Ооциты оценивали через 16-18 часов культивирования в отношении оплодотворения. В этой точке оплодотворенный ооцит имеет пронуклеус (также называется одноклеточным эмбрионом). Затем одноклеточные эмбрионы переносили в заранее уравновешенную свежую среду ISM-1 и инкубировали при 37°С при 5% СО2 в воздухе. На следующий день эмбрионы переносили в среду ISM-2. Каждый следующий день эмбрионы переносили в свежую среду ISM-2. С 5-го дня эмбрионы оценивали в отношении развития бластоцисты. После окончания лечения лишние бластоцисты отдавались парами для данной исследовательской работы.
b) Настройка лазера
Настоящее изобретение относится к описанию уникального способа выделения внутренней клеточной массы для создания эмбриональных стволовых клеток с применением бесконтактного диодного лазера. Лазер является высокоточным и надежным инструментом для клеточной микрохирургии. Система включает новейшие оптоволоконные технологии для обеспечения наиболее компактной лазерной системы, доступной в настоящее время. 1,48 мкм диодную бесконтактную лазерную систему Сатурн устанавливали через эпифлуоресцентный порт к обращенному микроскопу Цейса, снабженному микроманипуляторами.
Применяли контрольный лазер для нацеливания главного абляционного лазера и ряд СИД информировали пользователя, когда лазер был установлен и готов разрядиться лазерным пучком. Двухсекундный интервал для манипуляций применяли для уменьшения возможности случайного выстрела лазера. Диаметр светового пятна лазера может варьироваться в соответствии с требуемым размером отверстия.
с) Лазерная абляция и выделение внутренней клеточной массы
Эмбрион на стадии бластоцисты отдельно помещали в 50 мкл каплю среды для биопсии (свободной от Са++/Mg++) в 35 мм чашке Петри. Эмбрион иммобилизировали на удерживающей пипетке таким образом, чтобы внутренняя клеточная масса находилась в положении 3 часа, а блестящая оболочка и трофобласт, близлежащие к внутренней клеточной массе, располагались в пятне нацеливания. Непрерывный 1,48 мкм диодный лазер применяли для создания отверстия в блестящей оболочке (ZP), которая представляет собой гликопротеиновый слой, защищающий ооцит. При данной длине волны отверстие производят путем местного термораспада гликопротеиновой матрицы. Когда блестящая оболочка растворена, клетки трофобласта подвергали абляции путем 3 импульсов, индуцирующих фотолиз. После абляции блестящей оболочки и трофобласта аспирационную пипетку помещали через отверстие, полученное при лазерной абляции, и ICM удаляли путем легкой аспирации, при внутреннем диаметре 30-35 микрон.
d) Культивирование эмбриональных стволовых клеток человека (hESC)
Перед культивированием аспирированную ICM тщательно промывали в ES среде, которая является предпочтительной для выделения линий эмбриональных стволовых клеток.
Представленное ниже является методикой применения изобретения с использованием питающего слоя. В данной методике внутреннюю клеточную массу культивировали в 96-луночном планшете в присутствии питающего слоя мышиных инактивированных эмбриональных фибробластов. Питающий слой эмбриональных фибробластов предпочтительно получают от мышей линии C57BL/6 или C57BL/6XSJL F1 в возрасте 12,5-13,5 дней или вторично выведенных мышей линии CD1 или из амниотической жидкости человека и применяют в качестве питающего слоя. Питающий слой эмбриональных фибробластов инактивировали гамма-излучением (3500 рад). Питающий слой мышиных эмбриональных фибробластов культивировали в планшете, покрытом 0,5% желатином с ES средой, состоящей из модифицированной по Дульбекко среды Игла без пирувата натрия с высоким содержанием глюкозы (70-90%), эмбриональной бычьей сывороткой (10-30%), бета-меркаптоэтанолом (0,1 мМ), не-незаменимыми аминокислотами (1%), L-глютамином 2 мМ, основным фактором роста фибробластов (4 нг/мл). Затем внутреннюю клеточную массу помещали на инактивированные мышиные эмбриональные фибробласты. Через 4-7 дней полученные массы ICM удаляли с выростов с помощью стерильной оплавленной пипетки и механически разобщали и сеяли на свежие питающие клетки. Последующее разделение проводили с помощью 0,5% трипсин-ЭДТА с добавлением 1% куриной сыворотки.
Стабильные клеточные линии кариотипировали и характеризовали по нескольким поверхностным маркерам, таким как SSEA-1, SSEA-3, SSEA-4, OCT-4, щелочная фосфатаза, TRA-1-81, TRA-1-60, как описано у Thomson et al., (1998), Reubinoff et al., (2000).
Примеры
Следующие примеры предназначены для иллюстрации данного изобретения, но не ограничивают его рамки.
Пример 1
Все 24 эмбриона человека на стадии бластоцисты применяли для выделения внутренней клеточной массы. Эмбрионы промывали несколько раз в среде для культивирования бластоцист (среды ISM-2, Medicult, Denmark). Отдельные бластоцисты затем помещали в 50 мкл каплю среды для биопсии эмбрионов без Са++/Mg++ (среда EB 10, Scadinavian). Микрокапли покрывали минеральным маслом. Устанавливали микроманипулятор. Стеклянную удерживающую пипетку с внешним диаметром 75 мкм и внутренним диаметром 15 мкм применяли для закрепления эмбриона. Биопсийную пипетку с внешним диаметром приблизительно 49 мкм и внутренним диаметром 35 мкм применяли для аспирации внутренней клеточной массы. Контрольный лазер применяли для нацеливания главного абляционного лазера. Эмбрион иммобилизировали на удерживающей пипетке таким образом, чтобы внутренняя клеточная масса оставалась в положении 3 часа, а блестящая оболочка и трофобласт, близлежащие к внутренней клеточной массе, располагались в пятне нацеливания. Отверстие производили путем местного термораспада оболочки. Клетки трофобласта подвергались абляции путем применения 3 импульсов, способствующих фотолизу. После абляции блестящей оболочки и трофобласта биопсийную пипетку вводили через отверстие, образованное при лазерной абляции и удаляли внутреннюю клеточную массу.
Затем внутреннюю клеточную массу промывали несколько раз в ES среде и помещали в 96-луночный планшет в присутствии или отсутствии питающего слоя. Следующие данные представлены в виде таблицы.
| Таблица 1Краткое описание линий hESC, полученных с применением методики лазерной абляции по настоящему изобретению с применением мышиного питающего слоя | |||
| Число бластоцист, применяемых для лазерной абляции | Общее количество выделенной внутренней клеточной массы | С мышиными питающими клетками | |
| Число применяемых ICM | Число полученных линий ES клеток | ||
| 24 | 18 | 14 | 4 |
Похожим образом проводили эксперимент с применением обычного способа выделения внутренней клеточной массы, т.е. с применением иммунохирургии, и он был представлен следующим образом.
Пример 2
Целью было определить эффективность выделения внутренней клеточной массы при помощи обычного способа, т.е. иммунохирургии, и сравнить с новым изобретенным способом лазерной абляции.
Использовали 21 эмбрион человека на стадии бластоцисты для выделения внутренней клеточной массы. Эмбрионы несколько раз промывали средой для культивирования бластоцист (средой ISM-2) и затем ES средой. Отдельные эмбрионы на стадии бластоцисты затем помещали в 50 мкл микрокапли 1:50 античеловеческих антител (Sigma) на 30 минут при 37°С и 5% СО2 в воздухе. Эмбрионы на стадии бластоцисты затем промывали четыре раза после инкубации ES средой. Затем бластоцисты опять помещали в 50 мкл микрокапли комплемента морской свинки в концентрации 1:10 на 10 минут при 37°С и 5% СО2 в воздухе. После инкубации эмбрионы на стадии бластоцисты промывали несколько раз в ES среде с применением тонко заточенной стеклянной пипетки для удаления трофобласта. Затем выделенную внутреннюю клеточную массу промывали ES средой и культивировали в 96-луночном планшете в присутствии или отсутствии питающих клеток. Данные представлены в таблице.
| Таблица 2Краткая характеристика линий hESC, полученных с применением иммунохирургии с/без мышиных питающих клеток | |||||
| Число бластоцист, применяемых для лазерной абляции | Общее количество удаленной внутренней клеточной массы | С мышиными питающими клетками | Без мышиных питательных клеток | ||
| Число используемых ICM | Число полученных линий ES клеток | Число используемых ICM | Число полученных линий ES клеток | ||
| 21 | 14 | 12 | 3 | 2 | 0 |
Хотя выделение внутренней клеточной массы с применением обоих способов не показало значительных различий, однако, выделение внутренней клеточной массы с применением лазерной абляции имеет явные преимущества. Данный способ исключает применение антител и сыворотки животного происхождения. Выделенная внутренняя клеточная масса при помощи способа лазерной абляции может дополнительно культивироваться в присутствии или отсутствии питающего слоя. Однако культивирование внутренней клеточной массы в условиях без питающего слоя дополнительно исключает возможность загрязнения линий ES клеток вирусами или бактериями животных и может применяться коммерчески для трансплантологических исследований у человека. В последних экспериментах были предприняты попытки создать линии ES клеток в отсутствии питающих клеток.
Подробное описание предпочтительных вариантов воплощения изобретения
Предпочтительные варианты воплощения изобретения проиллюстрированы в приложенных микрофотоснимках.
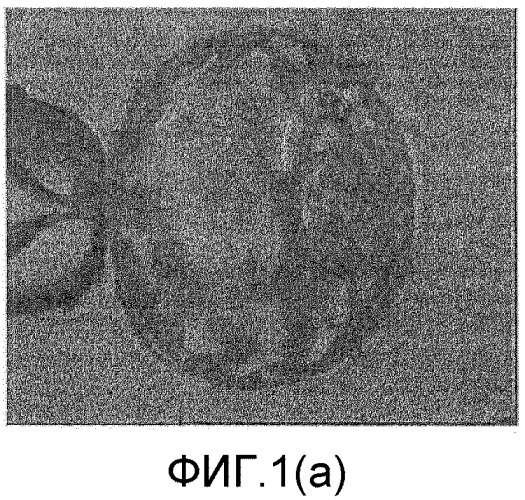
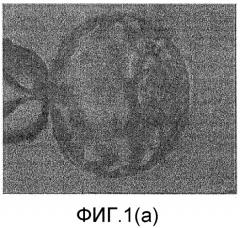
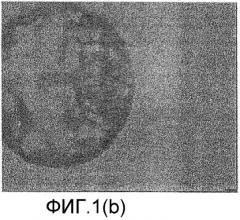
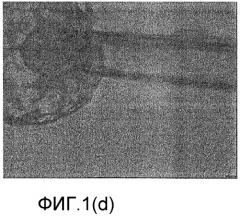
Фиг.1(а)-1(g) настоящего изобретения относятся к выделению внутренней клеточной массы (ICM) из бластоцисты одного эмбриона, а фиг.2(а)-2(g) относятся к выделению внутренней клеточной массы (ICM) из бластоцисты другого эмбриона. Фиг.3, 4 и 5 относятся к культивированию ICM на питающих клетках на различных стадиях.
На фиг.1(а) показан микрофотоснимок бластоцисты человека, закрепленной с помощью стеклянной удерживающей пипетки таким образом, что ICM располагается в положении 3 часа.
На фиг.1(b) показан микрофотоснимок, где часть блестящей оболочки и трофобласта подвергалась абляции лазером (стрелка).
На фиг.1(с) показан микрофотоснимок аспирационной пипетки, приближенной к бластоцисте после абляции оболочки и трофобласта.
На фиг.1(d) показан микрофотоснимок начала аспирации ICM аспирационной пипеткой.
На фиг.1(е) показан микрофотоснимок большой части ICM в аспирационной пипетке во время процесса аспирации.
На фиг.1(f) показан микрофотоснимок ICM после удаления из бластоцисты.
На фиг.1(g) показан микрофотоснимок трофобласта и блестящей оболочки, оставшихся после выделения ICM.
На фиг.2(а) показан микрофотоснимок другой бластоцисты человека, закрепленной с помощью стеклянной удерживающей пипетки таким образом, чтобы ICM находилась в положении 3 часа.
На фиг.2(b) показан микрофотоснимок незначительного выступания внутренней клеточной массы после лазерной абляции оболочки и трофобласта.
На фиг.2(с) показан микрофотоснимок аспирационной пипетки, расположенной вблизи от ICM после абляции оболочки и соседних клеток трофобласта с помощью лазера.
На фиг.2(d) показана микрофотография аспирации ICM при помощи аспирационной пипетки путем аккуратного всасывания.
На фиг.2(е) показан микрофотоснимок большой части ICM в аспирационной пипетке.
На фиг.2(f) показан микрофотоснимок ICM после удаления из бластоцисты.
На фиг.2(g) показан микрофотоснимок трофобласта и блестящей оболочки, оставшихся после выделения ICM из бластоцисты.
На фиг.3(а) показан микрофотоснимок выделенной внутренней клеточной массы в культуре, посеянной на питающие клетки первичных мышиных эмбриональных фибробластов (день 3).
На фиг.3(b) показан микрофотоснимок выделенной внутренней клеточной массы в культуре, посеянной на первичные питающие клетки мышиных эмбриональных фибробластов (день 7).
На фиг.4 показан микрофотоснимок выделенной ICM в культуре, посеянной на первичные питающие клетки мышиных эмбриональных фибробластов (день 5) другого эмбриона.
На фиг.5 показан микрофотоснимок линии эмбриональных стволовых клеток, полученных из внутренней клеточной массы, выделенной при помощи способа лазерной абляции.
Специалист в данной области должен понимать, что настоящее изобретение хорошо приспособлено для достижения целей и получения результатов и преимуществ, упомянутых выше в данном описании. Настоящее изобретение было раскрыто и описано с точки зрения наиболее практичного и предпочтительного варианта воплощения. Следует понимать, что в рамках изобретения возможны отклонения. Важно понимать, что изобретение не ограничено описанными деталями и распространяется на все аналоги в рамках формулы изобретения.
1. Способ получения линии клеток из внутренней клеточной массы бластоцисты человека, включающий стадии:
(a) выделения блас