Четвертичные аммониевые соли омега-аминоалкиламидов r-2-арилпропионовых кислот и содержащие их фармацевтические составы
Иллюстрации
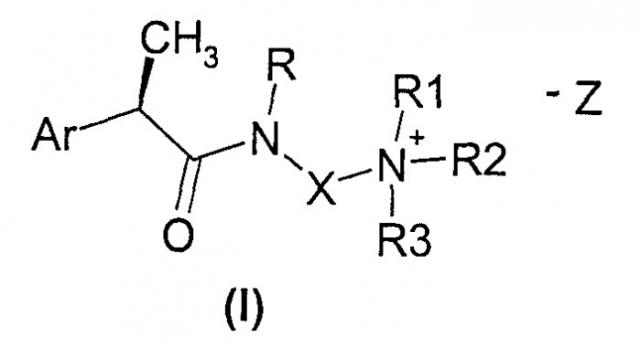
Показать всеИзобретение относится к соединениям (R)-2-арилпропионамида формулы (I):
где Ar означает арил формулы (IIIb): Ф-Arb, где Arb означает фенил, моно- или полизамещенный группами: хлор, фтор; Ф означает водород, линейный или разветвленный С1-С5алкильный остаток, бензоил, 2,6-дихлорфениламино, 2,6-дихлор-3-метилфениламино; R означает водород, C1-С4-алкил; Х означает: - линейный или разветвленный C1-С6-алкилен, необязательно замещенный группой CO2R4, где R4 означает водород или линейную или разветвленную C1-С6-алкильную группу, фенил или группу фенилметилена; R1, R2 и R3 означают независимо линейный или разветвленный C1-С6-алкил, С3-С7 циклоалкил, С3-С6-алкенил, арил, арил-С1-С3-алкил; или R1 и R2 вместе с атомом N, к которому они присоединены, образуют азотсодержащее 6-членное гетероциклическое кольцо формулы (II) и R3 независимо имеет значения, как указано выше,
где Y означает простую связь, группу метилена, атом кислорода, атом азота или атом серы, и р означает целое число 2; Z- означает фармацевтически приемлемый противоион четвертичных аммониевых солей. Изобретение относится к применению соединения формулы (I) для лечения псориаза, пемфигуса и пемфигоида, ревматоидного артрита, хронических воспалительных патологий кишечника, включая язвенный колит, острого респираторного дистресс-синдрома, идиопатического фиброза, муковисцидоза, хронической обструктивной болезни легких и гломерулонефрита, а также для профилактики и лечения поражения, вызываемого ишемией и реперфузией. Изобретение относится к фармацевтическому составу, обладающему ингибирующей активностью в отношении хемотаксиса полиморфноядерных лейкоцитов и моноцитов, индуцируемых фракциями комплемента С5а, содержащему соединение формулы (I) в смеси с подходящим для них носителем. Также изобретение относится к способу получения соединений (R)-2-арилпропионамида формулы (I), включающего взаимодействие амидов формулы (IV) с соединениями формулы R3Z, где Z означает обычную уходящую группу, такую как хлорид, бромид, иодид, метансульфонат, п-толуолсульфонат, сульфат. Технический результат - четвертичные аммониевые соли омега-аминоалкиламидов R-2-арилпропионовых кислот, применяемые в ингибирование хемотаксической активации, индуцируемой компонентом С5а комплемента. 5 н. и 12 з.п. ф-лы, 1 табл.
Реферат
Введение и предпосылки к созданию изобретения
Данное изобретение относится к соединениям, применимым в ингибировании хемотаксической активации, индуцируемой компонентом С5а комплемента и от других хемотаксических протеинов (хемокинов), которые оказывают свое действие путем активации рецептора 7-трансмембранного домена (7-ТМ). Указанные соединения являются четвертичными аммониевыми солями R-2-арилпропионамидов, применимыми в лечении патологий, зависимых от хемотаксической активации нейтрофилов и моноцитов, индуцируемой компонентом С5а комплемента. В частности, соединения по изобретению применимы в лечении псориаза, ревматоидного артрита, язвенного колита, острого респираторного дистресс-синдрома, идиопатического фиброза, гломерулонефрита и в профилактике поражения, вызываемого ишемией и реперфузией.
Подробное описание изобретения
Данное изобретение относится к (R)-2-арилпропионамидам формулы (I):
где
Ar означает замещенную или незамещенную арильную группу;
R означает водород, C1-C4-алкил, C2-C4-алкенил, C2-C4-алкинил, необязательно замещенный группой CO2R4, где R4 означает водород, или линейную или разветвленную C1-C6-алкильную группу, или линейную или разветвленную C2-C6-алкенильную группу;
Х означает:
линейный или разветвленный C1-C6-алкилен, C4-C6-алкенилен, C4-C6-алкинилен, необязательно замещенный группой CO2R4 или группой CONHR5, где R5 означает водород, линейный или разветвленный C2-C6-алкил или группу OR4, где R4 определен выше;
фенил или группу фенилметилена формулы:
группу (CH2)m-B-(CH2)n, необязательно замещенную группой CO2R4 или CONHR5, как определено выше, где В означает атом кислорода или серы, m означает ноль или целое число от 2 до 3 и n означает целое число от 2 до 3; или В означает группу СО, SO или CONH, m означает целое число от 1 до 3 и n означает целое число от 2 до 3;
или Х вместе с атомом азота, к которому он присоединен, и с группой R1 образует азотсодержащее 3-7-членное гетероциклическое моноциклическое или полициклическое кольцо;
R1, R2 и R3 означают независимо линейный или разветвленный C1-C6-алкил, необязательно замещенный атомом кислорода или серы, C3-C7 циклоалкил, C3-C6-алкенил, C3-C6-алкинил, арил, арил-C1-C3-алкил, гидрокси-C2-C3-алкильную группу;
или R1 и R2 вместе с атомом N, к которому они присоединены, образуют азотсодержащее 3-7-членное гетероциклическое кольцо формулы (II) и R3 независимо имеет значения, как указано выше.
В общей формуле (II)
Y означает простую связь, группу метилена, атом кислорода, атом азота или атом серы,
р означает целое число от 0 до 3;
Z означает стандартные анионы, используемые в качестве противоионов четвертичных аммониевых солей, которые являются фармацевтически приемлемыми, такие как, например, галогенид-ионы Cl-, I-, Br-, сульфат-анион или анионы, происходящие от сульфоновых кислот, такие как метансульфонат или п-толуолсульфонат.
В соединениях общей формулы (I) арильная группа Ar предпочтительно выбрана из таких, как
а) моно- или полизамещенная арильная группа Ara наиболее распространенных (±)2-арилпропионовых кислот в терапевтическом применении в настоящее время: алминопрофен, беноксапрофен, карпрофен, фенбуфен, фенопрофен, флурбипрофен, ибупрофен, индопрофен, кетопрофен, локсопрофен, R-напроксен, пирпрофен, и их дегидро- и дигидропроизводные, пранопрофен, сурпрофен, тиапрофеновая кислота, залтопрофен;
b) арил-гидроксиметил-арильная группа формулы (IIIa) как в виде смеси диастереоизомеров, так и в виде отдельных диастереоизомеров,
где, когда Ar2 означает фенил, Ar1 выбран из группы, состоящей из фенила и тиен-2-ила, а когда Ar1 означает фенил, Ar2 выбран из группы, состоящей из фенила, 4-тиенила, пиридила;
с) арил формулы (IIIb):
где:
Arb означает фенил, моно- или полизамещенный группами: гидрокси, меркапто, C1-C3-алкокси, C1-C3-алкилтио, хлор, фтор, трифторметил, нитро, амино, необязательно замещенная C1-C7-ациламино;
Φ означает водород; линейный или разветвленный остаток C1-C5-алкила, C2-C5-алкенила или C2-C5-алкинила, необязательно замещенный C1-C3-алкоксикарбонилом, замещенным или незамещенным фенилом, 2-, 3- или 4-пиридилом, хинолин-2-илом; C3-C6-циклоалкил; 2-фурил; 3-тетрагидрофурил; 2-тиофенил; 2-тетрагидротиофенил или C1-C8-(алканоил, циклоалканоил, арилалканоил)-C1-C5-алкиламиногруппу, например, ацетил-N-метиламино, пивалоил-N-этиламино;
d) 2-(фениламино)фенил формулы (IIIc):
где заместители Р1 и Р2 означают, что две фенильные группы несут заместители, а именно, каждая независимо моно- или полизамещена группами C1-C4-алкил, C1-C3-алкокси, хлор, фтор и/или трифторметил.
Предпочтительными соединениями по изобретению являются такие, где
R означает водород;
Х означает
- линейный C1-C6-алкилен, предпочтительно C2-C4, необязательно замещенный при C1 группой -CO2R4, как определено выше;
- линейный C1-C6-алкилен, необязательно замещенный при C1 группой -CONHR5, где R5 означает ОН;
- 2-бутинилен, цис-2-бутенилен, транс-2-бутенилен;
- 3-оксапентилен, 3-тиопентилен, 3-оксагексилен, 3-тиогексилен;
- (CH2)m-СО-NH-(CH2)n, где m и n, каждый независимо, означают целое число от 2 до 3;
- (CHR')-CONH-(CH2)n, где n означает целое число от 2 до 3 и R' означает метил, с абсолютной конфигурацией R или S;
- фенил или группа фенилметилена формулы:
- или Х вместе с N-атомом образует азоциклоалифатическое кольцо, предпочтительно 1-метилпиперидин-4-ил или 1,5-тропан-3-ил.
Предпочтительными соединениями являются, кроме того, такие, где группа NR1R2R3 означает группу триметиламмония, триэтиламмония, N-метил-N,N-диэтиламмония, N-метил-N,N-диизопропиламмония, N-циклогексилметил-N,N-диметиламмония, N-циклопентиламино-N,N-диметиламмония, N-метил-1-пиперидиния, N-этил-1-пиперидиния, N-метил-4-морфолиния, N-метил-4-тиоморфолиния, N-бензил-N,N-диметиламмония, N-аллил-1-пиперидиния, 4-окси-N-метилпиперидиния.
Примеры особенно предпочтительных арильных групп содержат:
4-изобутилфенил, 4-циклогексилметилфенил, 4-(2-метил)аллилфенил, 3-феноксифенил, 3-бензоилфенил, 3-ацетилфенил, отдельные (R)- и (S)-диастереоизомеры и смесь диастереоизомеров (R,S) 3-С6Н5-СН(ОН)-фенила, 3-СН3-СН(ОН)-фенила, 5-С6Н5-СН(ОН)-тиенила, 4-тиенил-СН(ОН)-фенила, 3-(пирид-3-ил)-СН(ОН)-фенила, 5-бензоилтиен-2-ила, 4-тиеноилфенила, 3-никотиноилфенила, 2-фтор-4-фенила, 6-метокси-2-нафтила, 5-бензоил-2-ацетоксифенила, 5-бензоил-2-гидроксифенила, 4-циклопентилфенила, 4-(2-оксоциклопентил)фенила, 4-(2-оксоциклогексил)фенила.
Особенно предпочтительными арильными группами формулы (IIIb) являются фенильные группы, 3-замещенные группами: изопроп-1-ен-1-ил, изопропил, пент-2-ен-3-ил, пент-3-ил, 1-фенилэтилен-1-ил, α-метилбензил.
Предпочтительными арилами формулы (IIIc) являются 2-(2,6-дихлорфениламино)фенил, 2-(2,6-дихлорфениламино)-5-хлорфенил, 2-(2,6-дихлор-3-метилфениламино)фенил, 2-(3-трифторметилфениламино)фенил. Примеры замещенных фенильных групп Р2 содержат фенильные группы, замещенные одним-тремя атомами галогена, C1-C4-алкильными группами, метокси, трифторметилом, нитро, циано, галогеналкокси.
Особенно предпочтительными соединениями по изобретению являются:
иодид (R)-{3-[2-(4-изобутилфенил)пропиониламино]пропил}триметиламмония;
иодид (R)-{3-[2-(3-бензоилфенил)пропиониламино]пропил}триметиламмония;
иодид (R)-{3-[2-(4-изобутилфенил)пропиониламино]пропил}-N-этил-N,N-диметиламмония;
иодид (R)-{3-[2-(4-изобутилфенил)пропиониламино]пропил}-N-циклогексилметил-N,N-диметиламмония;
иодид (R)-{3-[2-(4-циклопентилметилфенил)пропиониламино]пропил}триметиламмония;
иодид (R)-{3-[2-(3-бензоилфенил)пропиониламино]пропил}-N-изопропил-N,N-диметиламмония;
иодид (R)-{3-[2-(4-изобутилфенил)пропиониламино]бутил}триметиламмония;
иодид (R)-{3-[2-(4-изобутилфенил)пропиониламино]пропил}-1-метилпиперидиния;
иодид (R)-{3-[2-(3-бензоилфенил)пропиониламино]пропил}-1-метилпиперидиния;
иодид (R)-{3-[2-(4-изобутилфенил)пропиониламино]пропил}-4-метилморфолиния;
метансульфонат (R)-{3-[2-(3-изопропилфенил)пропиониламино]пропил}-4-метилтиоморфолиния;
бромид (R)-{2-[2-(4-изобутилфенил)пропиониламино]этил}триметиламмония;
п-толуолсульфонат (R)-{2-[(4-изобутилфенил)пропиониламино]-1,1-диметил}пиперидиния;
метансульфонат (R),(S')-2-(4-изобутилфенил)-N-[(1-карбокси-2"-N,N,N-триметиламмоний)этил]пропионамида;
иодид R(-)-2-[(4-изобутилфенил)-N-(триметиламмонийэтил)метиламид]пропионамида;
метансульфонат (R)-(3-{2-[2-(2,6-дихлорфениламино)фенил]пропиониламино}пропил)триметиламмония;
иодид (2R),(4"S)-1-{4-карбокси-4-[2-(4-изобутилфенил)пропиониламино]бутил}-1-метилпиперидиния;
иодид R(-)-{3-[2-(4'-изобутилфенил)пропиониламино]пропил}-(N-бензил)-N,N-диметиламмония;
иодид 2R-{3-[2-(4'-изобутилфенил)пропиониламино]пропил}-(1"-метил-4"-карбоксамид)пиперидиния;
иодид (2R)-{3-[2-(4'-изобутилфенил)пропиониламино]пропил}-(1"-метил-4"-карбонил)пиперидиния;
иодид R(-)-{3-[2-(4'-изобутилфенил)пропиониламино]пропил}триэтиламмония;
бромид R(-)-{3-[2-(4'-изобутилфенил)пропиониламино]пропил}-1-аллилпиперидиния;
иодид R(-)-2-[(4'-изобутил)фенил]-N-[4"-N,N,N-триметиламинофенил]пропионамида;
иодид R(-)-2-[(4'-изобутил)фенил]-N-[4"-N,N,N-триметиламинометилфенил]пропионамида.
Известные способы алкилирования третичных аминогрупп (реакция Меншуткина) используют для получения соединений формулы (I), соединения формулы (IV), где Ar, R, R1, R2 и Х являются такими, как определено выше, подвергают реакции с соединениями формулы R3Z, где R3 определен выше и Z означает обычную уходящую группу, такую как хлорид, бромид, иодид, метансульфонат, п-толуолсульфонат или сульфат.
Реакции алкилирования обычно проводят при комнатной температуре, используя обычные протонные или апротонные обычно безводные растворители или их смеси, необязательно в присутствии сильного ненуклеофильного основания. Альтернативно, некоторые соединения формулы (I) могут быть получены исходя из соединений формулы (IV) путем взаимодействия с ненасыщенными субстратами типа Михаэля, катализируемого минеральными кислотами, такими как HCl или HNO3.
Получение соединений формулы (IV) описано в международной патентной заявке РСТ/ЕР02/01974. Некоторые соединения формулы (IV) являются новыми по отношению к конкретным соединениям, описанным в указанной патентной заявке, и они получены способами, описанными ниже в разделе "Синтезы".
Понятно, что синтез соединений формулы (I), исходя из амидов формулы (IV), где заместители R1 и R2 могут независимо представлять собой -Н, включают в процесс. Если желательно, первичные и вторичные амины могут быть подвергнуты взаимодействию в условиях исчерпывающего алкилирования с соединениями формулы R3Z, чтобы получить соединения по изобретению формулы (I), где по меньшей мере два остатка, определенные как R1, R2 и R3, являются одними и теми же. Реакцию проводят в тех же условиях, что описаны для превращения амидов формулы (IV) в соединения формулы (I) по изобретению.
В качестве варианта, первичные или вторичные амиды формулы (IV) могут быть превращены в соединения формулы (I) в две последовательные стадии. На первой стадии моно- или диалкилирования реакцию проводят при комнатной температуре или путем нагревания в присутствии одного или двух эквивалентов агента алкилирования R3Z в зависимости от степени замещения исходной аминогруппы. Реакции проводят в обычных протонных или апротонных, предпочтительно безводных растворителях или их смесях, необязательно в присутствии сильного ненуклеофильного основания.
Соединения формулы (I) по изобретению оценивают in vitro по их способности ингибировать хемотаксис полиморфноядерных лейкоцитов (обозначаемых далее как PMN) и моноцитов, индуцируемый фракциями комплемента С5а и C5a-desArg. Для этой цели, чтобы изолировать PMN из гепаринизированной крови человека, взятой у здоровых взрослых добровольцев, удаляют одноядерные клетки посредством седиментации на декстране (согласно процедуре, раскрытой W.J. Ming et al., J. Immunol., 138, 1469, 1987) и красные кровяные клетки посредством гипотонического раствора. Жизнеспособность клеток рассчитывают путем исключения с помощью трипанового синего, тогда как отношение циркулирующих полиморфноядерных клеток определяют на центрифугате клеток после окрашивания Diff Quick.
Рекомбинантные фракции С5а и C5a-desArg (Sigma) человека используют в качестве стимулирующих агентов в хемотаксических экспериментах, получая практически идентичные результаты.
Лиофилизованную фракцию С5а растворяют в объеме сбалансированного солевого раствора Хэнкса HBSS, содержащем 0,2% бычьего сывороточного альбумина BSA, так чтобы исходный раствор, имеющий концентрацию 10-5 М, был разбавлен в HBSS до концентрации 10-9 М, для анализов хемотаксиса.
В хемотаксических экспериментах PMN инкубируют с соединениями по изобретению формулы (I) в течение 15 минут при 37°С в атмосфере, содержащей 5% СО2.
Хемотаксическую активность С5а оценивают на циркулирующих полиморфноядерных лейкоцитах (PMN), повторно суспендированных в HBSS при концентрации 1,5×106 PMN на мл.
Во время анализа хемотаксиса (согласно W. Falket et al., J. Immunol. Methods 33, 239, 1980) используют не содержащие поливинилпирролидона (PVP) фильтры с пористостью 5 мкм и микрокамеры подходящие для репликации.
Соединения формулы (I) по изобретению оценивают при концентрации в пределах от 10-6 до 10-10 М; для этой цели их добавляют при одной и той же концентрации как в нижние поры, так и в верхние поры микрокамеры. Лунки в нижней части содержат раствор С5а или простой носитель, лунки в верхней части содержат суспензию PMN.
Ингибирование С5а-индуцируемой хемотаксической активности отдельными соединениями формулы (I) по изобретению оценивают путем инкубирования микрокамеры для хемотаксиса в течение 60 мин при 37°С в атмосфере, содержащей 5% СО2.
Оценку способности соединений формулы (I) по изобретению ингибировать С5а-индуцируемый хемотаксис моноцитов человека проводят согласно методу, раскрытому Van Damme J. et al. (Eur. J. Immunol., 19, 2367, 1989). Ингибирование С5а-индуцируемой хемотаксической активности отдельными соединениями формулы (I) по изобретению по отношению к моноцитам человека оценивают при концентрации в пределах между 10-6 и 10-10 М путем инкубирования микрокамеры для хемотаксиса в течение 120 мин при 37°С в атмосфере, содержащей 5% СО2.
Для примера данные ингибирования хемотаксиса PMN (С=10-6 М) некоторых примеров соединений по изобретению представлены в следующей таблице:
| СОЕДИНЕНИЕ | % ИНГИБИРОВАНИЯ(С=10-6 М) |
| Иодид (R)-(3-{2-[2-(2,6-дихлорфениламино)фенил]пропиониламино}пропил)-триметиламмония | 62±3 |
| Иодид (R)(-)-{3-[2-(4'-изобутилфенил)пропиониламино]пропил}триметиламмония | 53±6 |
| Иодид (R)(-)-2-[(4'-изобутилфенил)пропиониламино]-1,1-диметилпиперидиния | 18±9 |
| Иодид (R)(-)-{3-[2-(4'-изобутилфенил)пропиониламино]пропил}-1-метилпиперидиния | 24±4 |
| Метансульфонат (R)(-)-{3-[2-(4'-изобутилфенил)пропиониламино]пропил}-N-циклогексилметил-N,N-диметиламмония | 57±4 |
| Иодид (R)(-)-{3-[2-(4'-изобутилфенил)пропиониламино]пропил}-(N-бензил)-N,N-диметиламмония | 22±4 |
Соединения формулы (I), оценку которых проводили ex vivo в крови в целом согласно процедуре, раскрытой Patrignani et al., в J. Pharmacol. Exper. Ther., 271, 1705, 1994, были найдены совершенно неэффективными в качестве ингибиторов ферментов циклооксигеназ (СОХ).
Почти во всех случаях соединения формулы (I) не влияли на продуцирование PGE2, индуцируемое в мышиных макрофагах стимуляцией липополисахаридами (LPS, 1 мкг/мл) при концентрации в интервале от 10-5 до 10-7 М. Ингибирование продуцирования PGE2, которое может быть зарегистрировано, находится обычно на пределе статистической значимости, а более часто на 15-20% ниже базовой величины.
Поэтому дополнительным предметом данного изобретения является применение соединений по изобретению в качестве медикаментов.
Ввиду экспериментальных доказательств, обсуждавшихся выше, и роли, выполняемой каскадом комплемента, а именно его фракции С5а, в процессах, которые касаются активации и инфильтрации нейтрофилов, соединения по изобретению особенно применимы в лечении таких болезней, как псориаз (R.J. Nicholoff et al., Am. J. Pathol., 138, 129, 1991), пемфигус и пемфигоид, ревматоидный артрит (M. Selz et al., J. Clin. Invest., 87, 463, 1981), хронические воспалительные патологии кишечника, такие как язвенный колит (Y.R. Mahida et al., Clin. Sci., 82, 273, 1992), острый респираторный дистресс-синдром и идиопатический фиброз (E.J. Miller, упоминавшийся ранее, и P.C. Carry et al., J. Clin. Invest., 88, 1882, 1991), муковисцидоз, хроническая обструктивная болезнь легких, гломерулонефрит (T. Wada et al., J. Exp. Med., 180, 1135, 1994), и в профилактике и лечении поражения, вызываемого ишемией и реперфузией.
Соединения формулы (IV) для их применения в качестве медикаментов описаны в международной патентной заявке РСТ/ЕР02/01974. Новые амиды формулы (IV), описанные ниже в разделе "Синтезы", имеют биологическую активность, сравнимую с активностью амидов, описанных в указанной патентной заявке, и могут быть использованы для лечения тех же патологий.
Для этой цели соединения формулы (I) по изобретению обычно готовят в виде фармацевтических составов, используя обычные методики и разбавители, такие как описано в "Remington's Pharmaceutical Sciences Handbook" MACK Publishing, Нью-Йорк, 18-е изд., 1990.
Соединения по изобретению могут быть введены внутривенной инъекцией, в виде болюса, в виде дерматологических препаратов (кремов, лосьонов, спреев и мазей), путем ингаляции, а также перорально в виде капсул, таблеток, сиропа, составов с регулируемым высвобождением и тому подобного.
Средняя суточная доза зависит от различных факторов, таких как тяжесть болезни, состояние, возраст, пол и масса пациента. Доза будет изменяться, как правило, от 1 до 1500 мг соединений формулы (I) в сутки, которая может быть разделена на несколько приемов. Более высокие дозы могут быть введены на длительные периоды времени, благодаря низкой токсичности соединений по изобретению.
Следующие примеры и синтезы служат для пояснения изобретения.
Для удобства верхние индексы (например, R', S', S" и т.п.) показывают абсолютные конфигурации, присутствующие в заместителе R1 в соединениях формулы (I) по изобретению. Аббревиатуры: THF: тетрагидрофуран, DMF: диметилформамид, EtAc: этилацетат, HOBZ: гидроксибензотриазол, DCC: дициклогексилкарбодиимид.
Материалы и способы
Амины, используемые в качестве реагентов в синтезе соединений формулы (IV), являются известными продуктами, обычно коммерчески доступными, или они могут быть получены согласно способам, описанным в литературе.
Синтез 2-арилпропионовых кислот формулы Φ-Ar3-C(CH3)H-CO2H и их R-энантиомеров раскрыт в международной патентной заявке РСТ/ЕР01/01285.
Разрешение оптических изомеров проводят посредством образования соли с R(+)-N-метилбензиламином согласно способу, описанному Akguen и др. в Arzneim. Forsch., 46:9 891-894, 1996.
СИНТЕЗЫ
Получение омега-аминоалкиламидов R-2-арилпропионовой кислоты
в качестве промежуточных соединений
Получение соединений формулы (IV) раскрыто в международной патентной заявке РСТ/ЕР02/01974. Некоторые соединения формулы (IV) являются новыми и описаны впервые в данной патентной заявке.
Примеры получения новых амидов формулы (IV) представлены ниже.
СИНТЕЗ 1
R(-)-2-[(3-бензоил)фенил]-N-[3"-(N',N'-диметиламино)пропил]пропионамид
Гидроксибензотриазол (0,604 г, 3,93 ммоль) и N,N-дициклогексилкарбодиимид (0,81 г, 3,93 ммоль) добавляют к раствору R(-)-кетопрофена (1 г, 3,93 ммоль) в безводном дихлорметане (25 мл). Смесь перемешивают при комнатной температуре в течение 30 мин; к полученной суспензии добавляют N,N-диметил-1,3-пропандиамин (0,49 мл, 3,93 ммоль). Полученную суспензию перемешивают при комнатной температуре в течение ночи. Дициклогексилмочевину (DCU) затем отфильтровывают под вакуумом и фильтрат упаривают при пониженном давлении, сырой маслянистый остаток поглощают ацетонитрилом (20 мл) и смесь оставляют на ночь при Т=4°С. После отфильтровывания дополнительной аликвоты DCU фильтрат снова упаривают при пониженном давлении и остаток очищают посредством хроматографии на силикагеле (элюент CHCl3/CH3OH 8:2); R(-)-2-[(3'-бензоил)фенил]-N-[3"-(N',N'-диметиламино)пропил]пропионамид (0,997 г, 2,94 ммоль) получают в виде прозрачного масла.
Выход 75%
[α]D = -20(c = 0,9; CH3OH)
1H-ЯМР (CDCl3) δ 7,90-7,40 (м, 9H); 7,25 (с, 1H, CONH); 3,65 (м, 1H); 3,36 (м, 2H); 2,38 (м, 2H); 2,20 (с, 6H); 1,62 (м, 5H).
Аналогичным образом получают также следующие соединения:
R(-)-2-[(3'-бензоил)фенил]-N-(3"-N"-пиперидинопропил]пропионамид
Выход 80%
[α]D = -47,5(c = 0,3; CH3OH)
1H-ЯМР (CDCl3) δ 7,85-7,42 (м, 9H + CONH); 3,80 (м, 1H); 3,57-3,28 (м, 4H); 2,85 (м, 2H); 2,10 (м, 2H); 1,65 (м, 11H).
R(-)-2-[(4'-изобутил)фенил]-N-[3"-N'-(4",4"-пиперидиндиол)пропил]пропионамид
[α]D = -19,5(c = 1; CH3OH)
1H-ЯМР (ДМСО-d6) δ 8,05 (т, 1H, J=6 Гц, CONH); 7,25 (д, 2H, J=8 Гц); 7,08 (д, 2H, J=8 Гц); 3,55 (м, 1H); 3,40 (м, 2H); 3,35-3,25 (м, 6H); 2,38 (д, 2H, J=7 Гц); 2,05 (м, 4H); 1,85 (м, 1H); 1,50 (м, 2H); 1,35 (д, 3H, J=7 Гц); 0,87 (д, 6H, J=7 Гц).
R(-)-2-[(4'-изобутил)фенил]-N-[3"-N'-(4"-карбоксиамидопиперидин)пропил]пропионамид
[α]D = -28,5(c = 1; CH3OH)
1H-ЯМР (ДМСО-d6) δ 8,45 (д, 2H, J=8 Гц, CONH2); 8,10 (т, 1H, J=6 Гц, CONH); 7,35 (д, 2H, J=8 Гц); 7,20 (д, 2H, J=8 Гц); 3,65 (м, 1H); 3,42 (м, 2H); 3,15-2,90 (м, 6H); 2,35 (д, 2H, J=7 Гц); 2,15 (м, 1H); 1,80 (м, 1H); 1,55 (м, 6H); 1,35 (д, 3H, J=7 Гц); 0,85 (д, 6H, J=7 Гц).
R(-)-2-[(4'-изобутил)фенил]-N-[4"-N,N-диметиламинометилфенил]пропионамид
[α]D = -35(c = 1; CH3OH)
1H-ЯМР (CDCl3): δ 7,82 (дд, 1H, J1=8,4 Гц; J2=2 Гц); 7,55 (д, 1H, J=2 Гц); 7,20 (м, 2H); 7,10 (м, 2H); 6,85 (д, 2H, J=8,4 Гц); 6,15 (уш.с, 1H, CONH); 3,70 (с, 2H); 3,50 (м, 1H); 3,20 (с, 6H); 2,45 (д, 2H, J=7 Гц); 1,88 (м, 1H); 1,50 (д, 3H, J=7 Гц); 0,85 (д, 6H, J=7 Гц).
ПРИМЕРЫ
ЧЕТВЕРТИЧНЫЕ СОЛИ ОМЕГА-АМИНОАЛКИЛАМИДОВ
R-2-АРИЛПРОПИОНОВЫХ КИСЛОТ
Пример 1
Иодид R(-)-{3-[2-(4'-изобутилфенил)пропиониламино]пропил}-1-метилпиперидиния
R(-)-2-[(4'-изобутил)фенил]-N-[3"-N'-(N'-метил)пиперидинопропил]пропионамид (0,095 г, 0,287 ммоль) растворяют в безводном тетрагидрофуране (6 мл) в инертной атмосфере. К раствору добавляют метилиодид (0,1 мл, 1,61 ммоль), раствор перемешивают при комнатной температуре в течение 18 часов, пока исходный реагент невозможно будет далее обнаружить. Растворитель затем испаряют при пониженном давлении, и остаток поглощают простым изопропиловым эфиром. Образуется белый осадок, который перемешивают в течение 6 часов. Осадок отфильтровывают и сушат в вакууме при Т=40°С с получением иодида R(-)-{3-[2-(4'-изобутилфенил)пропиониламино]пропил}-1-метилпиперидиния (0,114 г, 0,24 ммоль) в виде светло-желтого восковидного твердого вещества.
Выход 84%
[α]D = -12(c = 0,7; CH3OH)
1H-ЯМР (ДМСО-d6) δ 8,05 (т, 1H, J=6 Гц, CONH); 7,25 (д, 2H, J=8 Гц); 7,08 (д, 2H, J=8 Гц); 3,55 (м, 1H); 3,25-3,02 (м, 8H); 2,90 (с, 3H); 2,38 (д, 2H, J=7 Гц); 1,85-1,55 (м, 7H); 1,50 (м, 2H); 1,35 (д, 3H, J=7 Гц); 0,88 (д, 6H, J=7 Гц).
Следующие соединения получают, используя приведенный выше способ:
Иодид R(-)-{3-[2-(4'-изобутилфенил)пропиониламино]пропил}триметиламмония
т.пл. 105-110°С
[α]D = -17 (c = 1,0; CH3OH)
1H-ЯМР (CDCl3) δ 7,42 (д, 2H, J=8 Гц); 7,20 (т, 1H, J=6 Гц, CONH); 7,07 (д, 2H, J=8 Гц); 3,83 (м, 1H); 3,77 (м, 2H); 3,55-3,20 (м, 2H); 3,18 (с, 9H); 2,40 (д, 2H, J=7 Гц); 2,05 (м, 2H); 1,83 (м, 1H); 1,45 (д, 3H, J=7 Гц); 0,9 (д, 6H, J=7 Гц).
Иодид R(-)-{3-[2-(4'-изобутилфенил)пропиониламино]бутил}триметиламмония
т.пл. 100-103°С
[α]D = -25(c = 1,0; CH3OH)
1H-ЯМР (CDCl3) δ 7,25 (д, 2H, J=8 Гц); 7,09 (д, 2H, J=8 Гц); 6,18 (с, 1H, CONH); 3,61 (м, 1H); 3,28 (м, 2H); 3,12 (м, 2H); 3,08 (с, 9H); 2,44 (д, 2H, J=7 Гц); 1,81 (м, 1H); 1,75 (м, 4H); 1,50 (д, 3H, J=7 Гц); 0,88 (д, 6H, J=7 Гц).
Иодид R(-)-2-[(4'-изобутилфенил)пропиониламино]-1,1-диметилпиперидиния
т.пл. 80-85°С
[α]D = -7(c = 1,2; CH3OH)
1H-ЯМР (ДМСО-d6) δ 7,91 (д, 1H, J=7 Гц, CONH); 7,22 (д, 2H, J=8 Гц); 7,08 (д, 2H, J=8 Гц); 3,80 (м, 1H); 3,53 (м, 1H); 3,35-3,30 (м, 4H); 3,08 (с, 3H); 3,00 (с, 3H); 2,40 (д, 2H, J=7 Гц); 1,95-1,65 (м, 5H); 1,3 (д, 3H, J=7 Гц); 0,87 (д, 6H, J=7 Гц).
Иодид R(-)-{3-[2-(4'-изобутилфенил)пропиониламино]пропил}-4-метилморфолиния
т.пл. 84-87°С
[α]D = -17(c = 0,5; CH3OH)
1H-ЯМР (CDCl3) δ 7,45 (д, 2H, J=8 Гц); 7,02 (м, 3H, CONH + 2Har.); 4,25 (м, 2H); 3,92 (м, 1H); 3,88 (м, 1H); 3,80 (м, 1H); 3,53 (м, 1H); 3,35 (м, 2H); 3,15 (м, 1H); 3,00 (с, 3H); 2,92-2,70 (м, 4H); 2,40 (д, 2H, J=7 Гц); 2,15 (м, 2H); 1,88 (м, 1H); 1,45 (д, 3H, J=7 Гц); 0,92 (д, 6H, J=7 Гц).
Иодид R(-)-2-[(4'-изобутилфенил)-N-(триметиламмонийметил)метиламид]пропионамида
т.пл. 70-72°С
[α]D = -18(c = 1,0; CH3OH)
1H-ЯМР (ДМСО-d6) δ 7,22 (д, 2H, J=8 Гц); 7,11 (д, 2H, J=8 Гц); 6,25 (уш.с, 2H, CONH); 3,57 (м, 1H); 3,30 (м, 2H); 3,10 (с, 9H); 2,45 (д, 2H, J=7 Гц); 2,40 (м, 2H); 1,88 (м, 1H); 1,75 (м, 2H); 1,52 (д, 3H, J=7 Гц); 0,92 (д, 6H, J=7 Гц).
Иодид R(-)-{3-[2-(3'-бензоилфенил)пропиониламино]пропил}триметиламмония
т.пл. 62-65°С
[α]D = -16,3(c = 1,0; CH3OH)
1H-ЯМР (ДМСО-d6) δ 8,20 (т, 1H, J=7 Гц, CONH); 7,81-7,47 (м, 9H); 3,75 (м, 1H); 3,27-3,05 (м, 4H); 3,00 (с, 9H); 1,85 (м, 2H); 1,37 (д, 3H, J=7 Гц).
Иодид R(-)-{3-[2-(3-бензоилфенил)пропиониламино]пропил}-1-метилпиперидиния
т.пл. 69-73°С
[α]D = -10(c = 0,6; CH3OH)
1H-ЯМР (ДМСО-d6) δ 8,18 (т, 1H, J=7 Гц, CONH); 7,80-7,47 (м, 9H); 3,70 (м, 1H); 3,28-3,05 (м, 8H); 2,92 (с, 3H); 1,87-1,53 (м, 6H); 1,42 (м, 2H); 1,38 (д, 3H, J=7 Гц).
Иодид R(-)-{3-{2-[2-(2,6-дихлорфениламино)фенил]пропиониламино}пропил}триметиламмония
[α]D = -15(c = 1,0; CH3OH)
1H-ЯМР (ДМСО-d6) δ 8,48 (м, 1H, CONH); 8,27 (с, 1H, NH); 7,52 (д, 2H, J=8 Гц); 7,18 (кв, 2H, J1=8 Гц, J2=16 Гц); 7,05 (т, 1H, J=7 Гц); 6,88 (т, 1H, J=7 Гц); 6,30 (д, 1H, J=8 Гц); 3,75 (м, 1H); 3,30 (м, 11H); 3,21 (м, 2H); 1,88 (м, 2H); 1,64 (д, 3H, J=7 Гц).
Иодид (2R),(4"S) 1-{4-карбокси-4-[2-(4-изобутилфенил)пропиониламино]бутил}-1-метилпиперидиния
[α]D = -9,5(c = 1,0; CH3OH)
1H-ЯМР (ДМСО-d6) δ 8,66 (уш.с, 1H, CONH); 7,22 (д, 2H, J=8 Гц); 7,5 (д, 2H, J=8 Гц); 4,00 (м, 1H); 3,80 (м, 1H); 2,95 (м, 6H); 2,90 (с, 3H); 2,45 (д, 2H, J=7 Гц); 1,82 (м, 1H); 1,70-1,33 (м, 10H); 1,31 (д, 3H, J=7 Гц); 0,89 (д, 6H, J=7 Гц).
Иодид (2R)-{3-[2-(4'-изобутилфенил)пропиониламино]пропил}-(1"-метил-4"-карбонил)пиперидиния
[α]D = -39(c = 1; CH3OH)
1H-ЯМР (ДМСО-d6) δ 8,15 (т, 1H, J=6 Гц, CONH); 7,28 (д, 2H, J=8 Гц); 7,12 (д, 2H, J=8 Гц); 3,80 (м, 1H); 3,70 (м, 2H); 3,35-3,25 (м, 6H); 3,18 (с, 3H); 2,35 (д, 2H, J=7 Гц); 2,12 (м, 4H); 1,85 (м, 1H); 1,50 (м, 2H); 1,37 (д, 3H, J=7 Гц); 0,87 (д, 6H, J=7 Гц).
Иодид 2R-{3-[2-(4'-изобутилфенил)пропиониламино]пропил}-(1"-метил-4"-карбоксиамид)пиперидиния
[α]D = -25(c = 1; CH3OH)
1H-ЯМР (ДМСО-d6) δ 8,74 (д, 2H, J=8 Гц, CONH2); 8,18 (т, 1H, J=6 Гц, CONH); 7,30 (д, 2H, J=8 Гц); 7,22 (д, 2H, J=8Гц); 3,75 (м, 1H); 3,45 (м, 2H); 3,35 (с, 3H); 3,20-3,00 (м, 6H); 2,38 (д, 2H, J=7 Гц); 2,15 (м, 1H); 1,90 (м, 1H); 1,75 (м, 6H); 1,35 (д, 3H, J=7 Гц); 0,85 (д, 6H, J=7 Гц).
Иодид R(-)-2-[(4'-изобутил)фенил]-N-[4"-N,N,N-триметиламинометилфенил]пропионамида
[α]D = -23(c = 1; CH3OH)
1H-ЯМР (ДМСО-d6) δ 7,80 (дд, 1H, J1=8,4 Гц, J2=2 Гц); 7,55 (д, 1H, J=2 Гц); 7,24 (м, 2H); 7,10 (м, 2H); 7,00 (д, 2H, J=8,4 Гц); 6,20 (уш.с, 1H, CONH); 3,70 (с, 2H); 3,50 (м, 1H); 3,20 (с, 9H); 2,45 (д, 2H, J=7 Гц); 1,88 (м, 1H); 1,50 (д, 3H, J=7 Гц); 0,85 (д, 6H, J=7 Гц).
Пример 2
Следующее соединение получают согласно способу, описанному в примере 1, но используя в качестве реагента этилиодид:
Иодид R(-)-{3-[2-(4'-изобутилфенил)пропиониламино]пропил}триэтиламмония
т.пл. 100-102°С
[α]D = -19,5(c = 1,0; CH3OH)
1H-ЯМР (CDCl3) δ 7,43 (д, 2H, J=8 Гц); 7,22 (т, 1H, J=6 Гц, CONH); 7,10 (д, 2H, J=8 Гц); 3,83 (м, 1H); 3,77 (м, 2H); 3,55-3,35 (м, 2H); 3,15 (кв, 6H, J=7 Гц); 2,95 (т, 9H, J=7 Гц); 2,42 (д, 2H, J=7 Гц); 2,05 (м, 2H); 1,85 (м, 1H); 1,45 (д, 3H, J=7 Гц); 0,9 (д, 6H, J=7 Гц).
Пример 3
Следующее соединение получают согласно способу, описанному в примере 1, но используя в качестве реагента бензилиодид:
Иодид R(-)-{3-[2-(4'-изобутилфенил)пропиониламино]пропил}-(N-бензил)-N,N-диметиламмония
т.пл. 97-100°С
[α]D = -12(c = 1,0; CH3OH)
1H-ЯМР (CDCl3) δ 7,42 (д, 2H, J=8 Гц); 7,30-7,25 (м, 5H); 7,20 (т, 1H, J=6 Гц, CONH); 7,07 (д, 2H, J=8 Гц); 3,85 (м, 1H); 3,72 (м, 2H); 3,68 (с, 2H); 3,55-3,32 (м, 2H); 3,20 (с, 6H); 2,40 (д, 2H, J=7 Гц); 2,05 (м, 2H); 1,83 (м, 1H); 1,45 (д, 3H, J=7 Гц); 0,9 (д, 6H, J=7 Гц).
Пример 4
Следующее соединение получают согласно способу, описанному в примере 1, но используя в качестве реагента циклогексилметилметансульфонат:
Метансульфонат R(-)-{3-[2-(4'-изобутилфенил)пропиониламино]пропил}-N-циклогексилметил-N,N-диметиламмония
[α]D = -23(c = 1,0; CH3OH)
1H-ЯМР (ДМСО-d6) δ 7,44 (д, 2H, J=8 Гц); 7,20 (т, 1H, J=6 Гц, CONH); 7,08 (д, 2H, J=8 Гц); 3,83 (м, 1H); 3,77 (м, 2H); 3,55-3,20 (м, 4H); 3,18 (с, 6H); 3,00 (с, 3H); 2,40 (д, 2H, J=7 Гц); 2,05 (м, 2H); 1,83 (м, 1H); 1,75 (м, 5H); 1,48 (м, 1H); 1,45 (д, 3H, J=7 Гц); 1,22 (м, 3H); 0,95 (м, 2H); 0,9 (д, 6H, J=7 Гц).
Пример 5
Следующее соединение получают согласно способу, описанному в примере 1, но используя аллилбромид вместо метилиодида:
Бромид R(-)-{3-[2-(4'-изобутилфенил)пропиониламино]пропил}-1-аллилпиперидиния
[α]D = -14,5(c = 0,5; CH3OH)
1H-ЯМР (ДМСО-d6) δ 8,05 (т, 1H, J=6 Гц, CONH); 7,25 (д, 2H, J=8 Гц); 7,08 (д, 2H, J=8 Гц); 6,05 (м, 1H); 5,35 (д, 1H, J=2 Гц); 5,15 (д, 1H, J=2Гц); 3,80 (д, 2H, J=7 Гц); 3,55 (м, 1H); 3,25-3,02 (м, 8H); 2,38 (д, 2H, J=7 Гц); 1,85-1,55 (м, 7H); 1,50 (м, 2H); 1,35 (д, 3H, J=7 Гц); 0,88 (д, 6H, J=7 Гц).
Пример 6
Следующее соединение получают, исходя из гидрохлорида иодида (4-аминофенил)триметиламмония (коммерческий реагент):
иодид R(-)-2-[(4'-изобутил)фенил]-N-[4"-N,N,N-триметиламинофенил]пропионамида
Гидроксибензотриазол (0,62 г, 4,58 ммоль) добавляют при Т=0°С к раствору (R)(-)ибупрофена (1,01 г, 5 ммоль) в DMF (4,5 мл). Раствор перемешивают при Т=0°С в течение 30 мин, затем к смеси добавляют гидрохлорид иодида (4-аминофенил)триметиламмония (1,433 г, 4,56 ммоль). Постепенно небольшими порциями добавляют N,N-дициклогексилкарбодиимид (1,02 г, 4,95 ммоль). После перемешивания при Т=0°С в течение 2 ч смесь оставляют нагреваться до комнатной температуры, затем ее перемешивают в течение 24 ч. DCU, который образуется, отфильтровывают и DMF отгоняют при пониженном давлении. Остаток растворяют в Н2О и перемешивают в диизопропиловом эфире (30 мл) в течение ночи при комнатной температуре, образовавшийся осадок фильтруют в вакууме и сушат в печи при Т=40°С в течение 6 часов, получая белое твердое вещество (1,67 г, 3,58 ммоль).
[α]D = -31(c = 1; CH3OH)
1H-ЯМР (ДМСО-d6): δ 7,85 (дд, 1H, J1=8,4 Гц, J2=2 Гц); 7,62 (д, 1H, J=2 Гц); 7,24 (м, 2H); 7,10 (м, 2H); 7,02 (д, 2H, J=8,4 Гц); 6,15 (уш.с, 1H, CONH); 3,50 (м, 1H); 3,25 (с, 9H); 2,45 (д, 2H, J=7 Гц); 1,85 (м, 1H); 1,52 (д, 3H, J=7 Гц); 0,90 (д, 6H, J=7 Гц).
1. Соединения (R)-2-арилпропионамида формулы (I):
где Ar означает арил формулы (IIIb):
где Arb означает фенил, моно- или полизамещенный группами: хлор, фтор, Ф означает водород, линейный или разветвленный С1-С5алкильный остаток, бензоил, 2,6-дихлорфениламино, 2,6-дихлор-3-метилфениламино;
R означает водород, С1-С4-алкил;
Х означает линейный или разветвленный C1-С6-алкилен, необязательно замещенный группой СО2R4, где R4 означает водород или линейную или разветвленную C1-С6-алкильную группу;
фенил или группу фенилметилена формулы
R1, R2 и R3 означают независимо линейный или разветвленный C1-С6-алкил, С3-С7 циклоалкил, С3-С6-алкенил, арил, арил-С1-С3-алкил;
или R1 и R2 вместе с атомом N, к которому они присоединены, образуют азотсодержащее 6-членное гетероциклическое кольцо формулы (II) и R3 независимо имеет значения, как указано выше,
где Y означает простую связь, группу метилена, атом кислорода или атом серы;
р означает целое число 2;
Z- означает фармацевтически приемлемый противоион четвертичных аммониевых солей при условии, что, когда Ar означает бифенил, R2 и R3 не означают этил.
2. Соединения по п.1, где Ar означает арил формулы (IIIb):
где Arb означает фенил, моно- или полизамещенный группами: хлор, фтор, Ф означает водород, линейный или разветвленный С1-С5алкильный остаток.
3. Соединения по п.2, где R означает водород;
Х означает линейный C1-С6-алкилен, предпочтительно С2-С4, необязательно замещенный при C1 группой -CO2R4, как определено выше;
фенил или группа фенилметилена формулы
4. Соединения по п.3, где Х означает линейный С2-С4-алкилен.
5. Соединения по п.1, где группа NR1R2R3 означает группу триметиламмония, триэтиламмония, N-метил-N,N-диэтиламмония, N-метил-N,N-диизопропиламмония, N-циклогексилметил-N,N-диметиламмония, N-циклопентиламино-N,N-диметиламмония, N-метил-1-пиперидиния, N-этил-1-пиперидиния, N-метил-4-морфолиния, N-метил-4-тиоморфолиния, N-бензил-N,N-диметиламмония, N-аллил-1-пиперидиния.
6. Соединения по п.2, где группа NR1R2R3 означает группу триметиламмония, триэтиламмония, N-метил-N,N-диэтиламмония, N-метил-N,N-диизопропиламмония, N-циклогексилметил-N,N-диметиламмония, N-циклопентиламино-N,N-диметиламмония, N-метил-1 -пиперидиния, N-этил-1-пиперидиния, N-метил-4-мрфолиния, N-метил-4-тиоморфолиния, N-бензил-N,N-диметиламмония, N-аллил-1-пиперидиния.
7. Соединения по любому из пп.1-6, где Z- означает галогенид, выбранный из Cl-, I-, Br-, сульфат-анион, метансульфонат или п-толуолсульфонат.
8. Соединения по любому из пп.1-6, где Ar выбран из таких значений, как 4-изобутилфенил, 3-бензоилфенил.
9. Соединения по п.2, где Ar представляет собой 2-(2,6-дихлорфениламино)фенил, 2-(2,6-дихлорфениламино)-5-хлорфенил, 2-(2,6-дихлор-3-метилфениламино)фенил.
10. Соединения по п.9, где Z- означает галогенид, выбранный из Cl-, I-, Br-, сульфат-анион, метансульфонат или п-толуолсульфонат.
11. Соединения по п.1, выбранные из числа следующих:
иодид (R)-{3-[2-(4-изобутилфенил)пропиониламино]пропил}-триметиламмония;
иодид (R)-{3-[2-(3-бензоилфенил)пропиониламино]пропил}-триметиламмония;
иодид (R)-{3-[2-(4-изобутилфенил)пропиониламино]пропил}-N-этил-N,N-диметиламмония;
иодид (R)-{3-[2-(4-изобутилфенил)пропиониламино]пропил}-N-циклогексилметил-N,N-диметиламмония;
иодид (R)-{3-[2-(4-циклопентилметилфенил)пропиониламино]пропил}-триметиламмония;
иодид (R)-{3-[2-(3-бензоилфенил)пропиониламино]пропил}-N-изопропил-N,N-диметиламмония;
иодид (R)-{3-[2-(4-изобутилфенил)пропиониламино]бутил}-триметиламмония;
иодид (R)-{3-[2-(4-изобутилфенил)пропиониламино]пропил}-1-метилпиперидиния;
иодид (R)-{3-[2-(3-бензоилфенил)пропиониламино]пропил}-1-метилпиперидиния;
иодид (R)-{3-[2-(4-изобутилфенил)пропиониламино]пропил}-4-метилморфолиния;
метансульфонат (R)-{3-[2-(3-изопропилфенил)пропиониламино]пропил}-4-метилтиоморфолиния;
бромид (R)-{2-[2-(4-изобутилфенил)пропиониламино]этил}-триметиламмония;
п-толуолсульфонат (R)- {2-[(4-изобутилфенил)пропиониламино]-1,1-диметил}пиперидиния;
метансульфонат (R),(S')-2-(4-изобутилфенил)-N-[(1-карбокси-2''-N,N,N-триметиламмоний)этил]пропионамида;
иодид R(-)-2-[(4-изобутилфенил)-N-(триметиламмонийэтил)метиламид]-пропионамида;
метансульфонат (R)-(3-{2-[2-(2,6-дихлорфениламино)фенил]пропиониламино}пропил)-триметиламмония;
иодид (2R),(4''S)-1-{4-карбокси-4-[2-(4-изобутилфенил)пропиониламино]бутил}-1-метилпиперидиния;
иодид R(-)-{3-[2-(4'-изобутилфенил)пропиониламино]пропил}-(N-бензил)-N,N-диметиламмония;
иодид 2R-{3-[2-(4'-изобутилфенил)пропиониламино]пропил}-(1''-метил-4''-карбоксамид)пиперидиния;
иодид (2R)-{3-[2-(4'-изобутилфенил)пропиониламино]пропил}-(1''-метил-4''-карбонил)пиперидиния;
иодид R(-)-{3-[2-(4'-изобутилфенил)пропиониламино]пропил}-триэтиламмония;
бромид R(-)-{3-[2-(4'-изобутилфенил)пропиониламино]пропил}-1-аллилпиперидиния;
иодид R(-)-2-[(4'-изобутил)фенил]-N-[4''-N,N,N-триметиламинофенил]-пропионамида;
иодид R(-)-2-[(4'-изобутил)фенил]-N-[4''-N,N,N-триметиламинометилфенил]-пропионамида.
12. Соединения по любому из пп.1-6, 11 для применения в качестве лекарственного средства, обладающего ингибирующей активностью в отношении хемотаксиса полиморфноядерных лейкоцитов и моноцитов, индуцируемых фракциями комплемента С5а.
13. Соединения по любому из пп. пп.1-6, 11 для применения в качестве ингибиторов хемотаксиса нейтрофилов и моноцитов, индуцированного С5а.
14. Применение соединения по любому из пп.1-6, 11 для лечения псориаза, пемфигуса и пемфиго