Способ получения производных хинолина
Иллюстрации
Показать всеИзобретение относится к способу получения производных хинолина. Описывается способ получения соединений общей формулы (I):
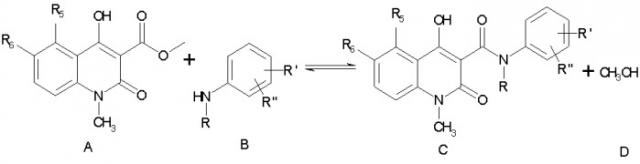
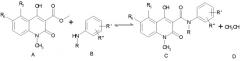
в которой R выбирают из метила, этила, н-пропила, изо-пропила, н-бутила, изо-бутила, втор.-бутила и аллила; R5 выбирают метила, этила, н-пропила, изо-пропила, метокси, этокси, метилтио, этилтио, н-пропилтио, метилсульфинила, этилсульфинила, фтора, хлора, брома, трифторметила и OCHxFy; где х=0-2, y=1-3, при условии, что х+y=3; R6 представляет собой водород; или R5 и R6 совместно образуют метилендиоксигруппу; R1 выбирают из водорода, метила, метокси, фтора, хлора, брома, трифторметила и OCHxFy, где х=0-2, y=1-3, при условии, что х+y=3; R" выбирают из водорода, фтора и хлора, при условии, что R" выбирают из фтора и хлора, если R' выбирают из фтора и хлора; заключающийся в реакции эфирного производного хинолин-3-карбоновой кислоты формулы А с производным анилина формула В
в среде растворителя, выбранного из нормальных или разветвленных алканов и циклоалканов, или их смесей с температурой кипения в интервале 80-200°С. Технический результат - упрощение способа получения конечного соединения, повышение выхода и химической чистоты продукта. 6 з.п. ф-лы, 1 табл.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к способу получения производных хинолина. Более конкретно, настоящее изобретение относится к усовершенствованному и упрощенному способу получения производных хинолин-3-карбоксамида.
Уровень техники
В патенте US 4738971 некоторые производные N-арил-1,2-дигидро-4-замещенный алкил-2-оксохинолин-3-карбоксамида заявляются в качестве усилителей клеточно-опосредованного иммунитета. В указанном патенте описывается четыре способа получения таких соединений. Согласно способу наиболее близкого способу настоящего изобретения, рассматриваемые соединения получают реакцией карбоновой кислоты или ее реакционноспособного производного с амином, или его реакционноспособным производным, в присутствии пиридина или хинолина в качестве инертного растворителя. В патенте US 5912349 описывается усовершенствованный способ получения одного из рассматриваемых соединений, рохинимекса (roquinimex) (Merck Index 12th Ed., No.8418; Linomide®, LS2616, N-фенил-N-метил-1,2-дигидро-4-гидрокси-1-метил-2-оксо-хинолин-3-карбоксамид). В указанном патенте желаемое соединение получают реакцией между ангидридом N-метилизатоиновой (N-methylisatoic acid) кислоты и N-метил-N-фенил-α-карбометоксиацетамидом. В патентах US 6077851, 6133285 и 6121287 описывается получение производных хинолин-3-карбоксамида. Такие производные могут быть получены различными известными способами, например, реакцией эфирного производного хинолин-3-карбоновой кислоты с анилином в среде такого подходящего растворителя как толуол, ксилол и т.п. В представленных примерах приводятся значения выходов ≤80% при использовании толуола в качестве растворителя.
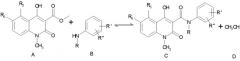
Обсуждаемая ниже известная реакция
представляющая собой N-ацилирование с участием эфирного производного хинолин-3-карбоновой кислоты, как неожиданно установлено в настоящее время, является обратимой реакцией, равновесие которой сильно смещено влево. В приведенном примере, иллюстрирующим протекание обратной реакции, описывается нагревание производного хинолин-3-карбоксамида (соединение С), в котором R5= хлор, R6=Н, R= этил, а R'=R"= водород, с одним эквивалентом метанола, проводимое в закрытом сосуде при 100°С в среде толуола. Через 30 минут наблюдалось почти полное превращение в соответствующий метиловый эфир (соединение А).
Химическая устойчивость желательных продуктов такова, что в условиях проведения реакции происходит их разложение.
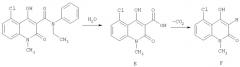
Деградация производного хинолин-3-карбоксамида.
Выше приведен пример, иллюстрирующий реакцию разложения. Продукт процесса деградации (соединение F) представляет собой декарбоксилированную хинолин-3-карбоновую кислоту (соединение Е). Соединение Е образуется в реакции производного хинолин-3-карбоксамида с водой. В реакционной смеси неизбежно присутствуют небольшие количества воды. Незначительные количества воды также присутствуют в исходных материалах и растворителе, а кроме этого вода образуется в реакционной смеси в результате протекания химической реакции. Так, например, при использовании толуола, желаемый продукт растворяется в растворителе и подвергается воздействию с водой. Хинолин-3-карбоновая кислота, образующаяся в реакции производного хинолин-3-карбоксамида с водой, подвергается декарбоксилированию с образованием декарбоксилированного продукта (соединение Е). В сыром продукте реакции практически отсутствует хинолин-3-карбновая кислота. Эфир хинолин-3-карбоновой кислоты (соединение А) также реагирует с водой, однако со значительно меньшей скоростью.
Раскрытие изобретения
Основная цель настоящего изобретения состоит в разработке усовершенствованного способа получения производных хинолин-3-карбоксамида, фармакологический профиль которых вместе с высокой активностью и незначительными побочными эффектами, позволяет считать эти соединения ценными веществами для лечения патологических воспалительных и аутоиммунных заболеваний, а также большого числа злокачественных опухолей. Если говорить более конкретно, то настоящее изобретение относится к существенно упрощенному способу получения производного хинолин-3-карбоксамида из анилина с помощью реакции N-ацилирования эфирного производного хинолин-3-карбоновой кислоты, в результате чего повышается выход и химическая чистота желаемого продукта.
Неожиданно было установлено, что соединения общей формулы (I):
в которой R выбирают из метила, этила, н-пропила, изо-пропила, н-бутила, изо-бутила, втор.-бутила и аллила; R5 выбирают метила, этила, н-пропила, изопропила, метокси, этокси, метилтио, этилтио, н-пропилтио, метилсульфинила, этилсульфинила, фтора, хлора, брома, трифторметила и OCHxFy;
где х=0-2, y=1-3, при условии что x+y=3;
R6 представляет собой водород; или
R5 и R6 совместно образуют метилендиоксигруппу;
R' выбирают из метила, метокси, фтора, хлора, брома, трифторметила и OCHxFy, где х=0-2, y=1-3, при условии,, что x+y=3;
R" выбирают из водорода, фтора и хлора, при условии, что R" выбирают из фтора и хлора, если R' выбирают из фтора и хлора;
могут быть получены с помощью значительно усовершенствованного и упрощенного заявленного способа, заключающегося в реакции эфирного производного хинолин-3-карбоновой кислоты формулы А с производным анилина формулы В:
в среде растворителя, выбранного из нормальных и разветвленных алканов и циклоалканов или их смесей с температурой кипения 80-200°С.
В соответствие с предпочтительным воплощением растворитель представляет собой н-гептан, н-октан или их смеси.
Согласно более предпочтительному воплощению растворитель представляет собой цис,транс-декагидронафталин (Декалин®).
Способ настоящего изобретения особенно предпочтительно использовать для получения N-этил-N-фенил-5-хлор-1,2-дигидро-4-гидрокси-1-метил-2-оксохинолин-3-карбоксамида с использованием н-гептана в качестве растворителя; N-метил-N-(4-трифторметилфенил)-1,2-дигидро-4-гидрокси-5-метокси-1-метил-2-оксохинолин-3-карбоксамида с использованием смеси н-гептана и н-октана в качестве растворителя; N-этил-N-фенил-1,2-дигидро-5-этил-4-гидрокси-1-метил-2-оксохинолин-3-карбоксамида с использованием цис,транс-декагидронафталина в качестве растворителя.
Авторы изобретения неожиданно установили, что выход и чистота желаемого продукта могут быть существенно повышены по сравнению со значениями, полученными при использовании в качестве растворителей толуола, ксилола и т.п. Используя растворитель, в котором желаемый продукт не растворяется даже при температуре дефлегмации и, удаляя образовавшийся спирт, можно достичь почти 100% выхода целевого продукта, содержащего лишь незначительное количество примесей. Осаждение целевого продукта еще больше повышает скорость реакции и препятствует его разложению, например, в результате подавления реакции целевого продукта с водой. Растворители, улучшающие процесс, представляют собой нормальные и разветвленные алканы и циклоалканы или их смеси с температурой кипения в интервале 80-200°С. Для удаления образующегося в реакции спирта может применяться пониженное давление.
ПРИМЕРЫ
Предполагается, что на основании представленного описания, специалист в данной области техники без проведения дополнительных исследований, сможет эффективно реализовать настоящее изобретение на практике. Следующие ниже примеры, подробно описывающие способы получения различных соединений и/или приемы их реализации, носят чисто иллюстративный характер и никоим образом не ограничивают предшествующее описание.
Пример 1
Метиловый эфир 1,2-дигидро-4-гидрокси-5-хлор-1-метил-2-оксохинолин-3-карбоновой кислоты
2-Амино-6-хлорбензойную кислоту (30 г) суспендировали в 1,4-диоксане (225 мл) и добавляли хлорформиат (75 мл). Смесь нагревали и кипятили с обратным холодильником в течение 1 часа, после чего охлаждали до 50°С и добавляли хлористый ацетил (75 мл). Полученную смесь перемешивали в течение 10 часов, после чего осажденный продукт отфильтровывали и промывали толуолом. В результате сушки в вакууме получали 5-хлоризатоиновый ангидрид (33 г, выход 97%). 5-Хлоризатоиновый ангидрид (30 г) растворяли в диметилацетамиде (300 мл) и смесь охлаждали до 5°С в атмосфере азота. Порциями добавляли гидрид натрия (5,8 г, 70%) после чего добавляли йодистый метил (11,5 мл). Реакционную смесь в течение 18 часов перемешивали при комнатной температуре и откачивали (40 мбар) в течение 1 часа для удаления избытка йодистого метила. Последовательно добавляли гидрид натрия (5,8 г, 70%) и диметилмалонат (20 мл) и полученную смесь нагревали до 85°С. Через три часа нагревания при 85°С смесь охлаждали и разбавляли холодной водой (2,4 литра). Продукт осаждали добавлением 5 М водного раствора HCI до рН=1,5-2. В результате фильтрации осажденного продукта и его перекристаллизации из метанола получали указанное в заглавии вещество (29 г, выход 70%).
Аналогичным образом из соответствующих исходных материалов получали этиловый эфир.
Пример 2
N-Этил-N-фенил-5-хлор-1,2-дигидро-4-гидрокси-1-метил-2-оксохинолин-3-карбоксамид
Метиловый эфир 5-хлор-1,2-дигидро-4-гидрокси-1-метил-2-оксохинолин-3-карбоновой кислоты (3,0 г), N-этиланилин (2 экв., 2,88 мл) и гептан (60 мл) нагревали и в течение 6 часов 35 минут отгоняли летучие вещества, главным образом гептан и образовавшийся метанол (32 мл). После охлаждения до комнатной температуры образовавшуюся кристаллическую суспензию фильтровали, кристаллы промывали гептаном и сушили в вакууме с получением сырого целевого соединения (3,94 г, выход 98%) в виде белых или светлых кристаллов.
Пример 3
N-Этил-N-фенил-5-хлор-1,2-дигидро-4-гидрокси-1-метил-2-оксохинолин-3-карбоксамид (реакция в толуоле, не является частью изобретения)
Метиловый эфир 5-хлор-1,2-дигидро-4-гидрокси-1-метил-2-оксохинолин-3-карбоновой кислоты (3,0 г), N-этиланилин (2 экв., 2,88 мл) и толуол (60 мл) нагревали и в течение 6 часов 35 минут отгоняли летучие вещества, главным образом толуол и образовавшийся метанол (32 мл). После охлаждения до комнатной температуры и осаждения продукта гептаном (40 мл) образовавшиеся кристаллы фильтровали и промывали гептаном, после чего сушили в вакууме с получением сырого целевого продукта (3,58 г, выход 90%) в виде светлых кристаллов.
Сырые продукты анализировали методом HPLC (ЖХВР), используя стандарты, см. табл.1. В сырых продуктах были обнаружены только два побочных продукта. Пики с площадью ниже 0,02% не учитывались.
| Таблица 1.Содержание целевых и побочных продуктов в сыром веществе | |||
| Растворитель - гептан | 99.4 | 0.02 | 0.03 |
| Растворитель - толуол | 94.0 | 4.55 | 0.54 |
Из таблицы видно, что в среде гептана реакция протекает с высокой скоростью. При использовании толуола в качестве растворителя в сыром продукте остается большее количество непревращенного эфира, чем при использовании в качестве растворителя гептана. Различие в скоростях реакции может быть большим, чем следует из данных, представленных в табл.1, поскольку реакция в среде толуола осуществляется при более высокой температуре, чем в среде гептана (толуол имеет температуру кипения 110-112°С, а гептан - 98°С). Эфир обладает большей растворимостью в алканах, чем продукт реакции, что положительно влияет на равновесие реакции и благоприятствует образованию продукта.
При использовании толуола выход сырого продукта (90%) ниже, чем при использовании гептана (98%). Этот факт может быть приписан более высокой растворимости продукта и эфира в толуоле, чем в гептане. Действительный выход при использовании гептана близок к 100%. Образование продукта декарбоксилирования хинолинкарбоновой кислоты (0,54% в толуоле и 0,03% в гептане, табл.1) является следствием протекания реакции между водой и целевым продуктом.
1. Способ получения соединений общей формулы (I):
в которой
R выбирают из метила, этила, н-пропила, изо-пропила, н-бутила, изо-бутила, втор.-бутила, и аллила; R5 выбирают метила, этила, н-пропила, изо-пропила, метокси, этокси, метилтио, этилтио, н-пропилтио, метилсульфинила, этилсульфинила, фтора, хлора, брома, трифторметила и OCHxFy;
где х=0-2, y=1-3, при условии, что х+y=3;
R6 представляет собой водород; или
R5 и R6 совместно образуют метилендиоксигруппу;
R' выбирают из водорода, метила, метокси, фтора, хлора, брома, трифторметила и OCHxFy, где х=0-2, y=1-3, при условии, что х+y=3;
R" выбирают из водорода, фтора и хлора при условии, что R" выбирают из фтора и хлора, если R' выбирают из фтора и хлора;
заключающийся в реакции эфирного производного хинолин-3-карбоновой кислоты формулы А с производным анилина формулы В
в среде растворителя, выбранного из нормальных или разветвленных алканов и циклоалканов, или их смесей с температурой кипения в интервале 80-200°С.
2. Способ по п.1, в котором растворитель представляет собой н-гептан, н-октан или их смеси.
3. Способ по п.1, в котором растворитель представляет собой цис,транс-декагидронафталин (Декалин®).
4. Способ по п.1, предназначенный для получения N-этил-N-фенил-5-хлор-1,2-дигидро-4-гидрокси-1-метил-2-оксохинолин-3-карбоксамида с использованием н-гептана в качестве растворителя.
5. Способ по п.1, предназначенный для получения N-этил-N-(4-трифторметилфенил)-1,2-дигидро-4-гидрокси-5-метокси-1-метил-2-оксохинолин-3-карбоксамида с использованием смеси н-гептана и н-октана в качестве растворителя.
6. Способ по п.1, предназначенный для получения N-этил-N-фенил-1,2-дигидро-5-этил-4-гидрокси-1-метил-2-оксохинолин-3-карбоксамида с использованием цис,транс-декагидронафталина (Декалин®) в качестве растворителя.
7. Способ по п.1, предназначенный для получения N-этил-N-фенил-1,2-дигидро-5-этил-4-гидрокси-1-метил-2-оксохинолин-3-карбоксамида с использованием н-гептана и н-октана в качестве растворителя.