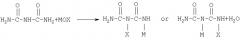Способ и устройство для получения гидразодикарбонамида с использованием мочевины в качестве исходного продукта
Иллюстрации
Показать всеНастоящее изобретение относится к способу получения гидразодикарбонамида и устройству для его осуществления. Процесс включает получение в пиролизной печи биурета и аммиака путем пиролиза мочевины, очистку полученного биурета в реакторе перекристаллизации, получение соли металла моногалогенбиурета путем взаимодействия биурета с соединением металла гипогалогена или с галогеном и основанием в первом реакторе. Взаимодействие во втором реакторе полученной соли металла моногалогенбиурета с аммиаком, в том числе аммиаком, полученным в процессе пиролиза мочевины, при мольном соотношении соли металла моногалогенбиурета и общего количества аммиака, составляющем 1:1-1:1000. Отделение избытка аммиака из гидразодикарбонамида в аммиачном испарителе, который направляют к аммиачному концентратору. При этом аммиачный концентратор предназначен для концентрации избытка аммиака и аммиака, полученного в пиролизной печи, и для доставки концентрированного аммиака во второй реактор. Технический результат - разработка экономически выгодного непрерывного процесса с высокой эффективностью, использование легко доступного исходного продукта, снижение количества побочных продуктов. 2 н. и 12 з.п. ф-лы, 12 табл., 1 ил.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к способу и устройству для получения гидразодикарбонамида из мочевины в качестве исходного продукта, более предпочтительно - к выгодному с экономической и экологической точки зрения способу и устройству для получения гидразодикарбонамида, включающему получение биурета из мочевины и взаимодействие полученного биурета с аммиаком, образующимся во время синтеза биурета.
Уровень техники
Гидразодикарбонамид (HDCA) представляет собой соединение, пригодное для использования в качестве сырого продукта с целью получения азодикарбонамида, который широко применяется как пенообразующий агент. Как показано в уравнении реакции 1, азодикарбонамид (2) может быть получен путем окисления гидразодикарбонамида (1) соответствующим агентом окисления.
[уравнение 1]
Традиционные способы получения гидразодикарбонамида включают способы, в основе которых лежит (i) применение гидразина в качестве исходного продукта, (Н) прямой синтез из мочевины, (iii) получение семикарбазида из мочевины с последующим превращением полученного семикарбазида в гидразодикарбонамид и (iv) применение биурета в качестве исходного продукта.
В способе, в котором используют гидразин в качестве исходного продукта (уравнение реакции 2), гидразодикарбонамид получают взаимодействием одного моля гидразина (3) с двумя моль мочевины (4).
[уравнение 2]
Указанная выше реакция имеет то преимущество, что процесс является простым, но в то же время он имеет и недостатки, заключающиеся в том, что гидразин, используемый в качестве исходного продукта, синтезируется с трудом и является дорогим продуктом. Типичные способы получения гидразина включают процесс по Рашигу и способ получения из кетазина. Однако существует ряд проблем, заключающихся в том, что гидразин, полученный с помощью указанных способов, требует проведения стадий концентрирования и гидролиза, в связи с чем энергетические затраты и затраты на оборудование являются слишком высокими, и, соответственно, стоимость продукции возрастает. Более того, гидразин может также быть получен из мочевины при взаимодействии мочевины с гипохлоритом натрия и гидроксидом натрия. Но такой способ требует избытка гидроксида натрия и влечет за собой очень высокие расходы, связанные с удалением карбоната натрия, как побочного продукта, при этом требуется большое количество химических реагентов для удаления указанного побочного продукта. Таким образом, этот способ рассматривается как нежелательный с экономической и экологической точки зрения.
Уравнение реакции 3 иллюстрирует способ прямого синтеза гидразодикарбонамида из мочевины. Как показано в уравнении 3, три моля мочевины взаимодействуют с четырьмя моль гидроксида натрия и одним молем хлора, при этом получают один моль гидразодикарбонамида. Но такой способ также является непригодным, поскольку из-за необходимости использования избыточных количеств реагентов его стоимость является высокой и, кроме того, процесс является очень сложным. Существует и другая важная проблема, заключающаяся в том, что образуется большое количество аммиака в качестве побочного продукта, что является экологически нежелательным.
[уравнение 3]
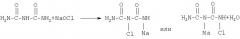
Уравнение реакции 4 иллюстрирует еще один способ синтеза гидразодикарбонамида. Указанный способ включает стадии получения семикарбазида из мочевины и последующего превращения полученного семикарбазида в гидразодикарбонамид. Как показано в уравнении реакции 4, натриевую соль монохлормочевины получают путем взаимодействия мочевины с гипохлоритом натрия, и затем натриевую соль монохлормочевины подвергают взаимодействию с избытком аммиака в присутствии катализатора для получения промежуточного соединения (семикарбазида), а затем полученный семикарбазид реагирует с мочевиной с образованием конечного продукта (гидразодикарбонамида).
[уравнение 4]
Однако указанная реакция также является экономически невыгодной, поскольку требует более чем 500-кратного избытка аммиака на натриевую соль монохлормочевины или семикарбазид получают с помощью дорогого катализатора. Существует еще одна проблема, заключающаяся в том, что полный цикл процесса удлиняется, поскольку должны осуществляться дополнительные реакции по превращению семикарбазида в гидразодикарбонамид.
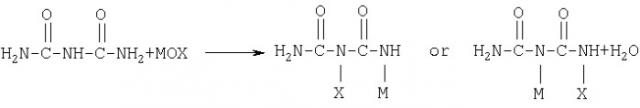
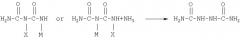
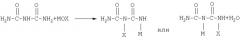
Уравнение реакции 5 иллюстрирует синтез гидразодикарбонамида из биурета (PCT/KR00/00180). Способ включает стадию получения соли металла моногалогенбиурета взаимодействием биурета с гипогалогеном металла (МОХ) и стадию последующего взаимодействия полученной соли металла моногалогенбиурета с аммиаком для получения гидразодикарбонамида.
[уравнение 5]
Однако указанный выше способ получения гидразодикарбонамида с использованием в качестве исходного продукта биурета имеет недостатки, заключающиеся в том, что в целом процесс является неэкономичным и экологически нежелательным, поскольку биурет, применяемый в качестве исходного продукта, является либо очень дорогим, либо содержит массу примесей, и, кроме того, при взаимодействии биурета с аммиаком в синтезе гидразодикарбонамида необходимо дополнительное количество аммиака.
Раскрытие изобретения
Объектом настоящего изобретения является способ получения гидразодикарбонамида, экономически выгодный и удовлетворяющий экологическим требованиям, с использованием в качестве исходного продукта мочевины, которая является дешевой и легкодоступной.
Кроме того, объектом настоящего изобретения является способ и устройство для получения гидразодикарбонамида, который может снизить количество образующихся побочных продуктов и используемых исходных соединений.
Объектом настоящего изобретения также является способ и устройство для получения гидразодикарбонамида с высоким выходом при осуществлении всего процесса в непрерывном режиме.
Для достижения указанных целей в соответствии с настоящим изобретением предложен способ получения гидразодикарбонамида, который включает следующие стадии: получение биурета формулы 1 и аммиака путем пиролиза мочевины; получение соли металла моногалогенбиурета формулы 2 или 3 взаимодействием полученного биурета с металлическим гипогалогеном или с галогеном и основанием; взаимодействие полученной соли металла моногалогенбиурета с аммиаком.
[формула 1]
[формула 2]
[формула 3]
В указанных выше формулах 2 и 3 M представляет собой металл, и Х представляет собой галоген. Предпочтительно температура пиролиза мочевины составляет 100˜300°С, пиролиз осуществляют до прекращения выделения аммиака, и выделяемый аммиак реагирует с солью металла моногалогенбиурета.
Настоящее изобретение, кроме того, относится к устройству для получения гидразодикарбонамида, которое включает пиролизную печь для получения биурета и аммиака путем пиролиза мочевины; реактор перекристаллизации для очистки биурета, полученного в пиролизной печи; первый реактор для получения соли металла моногалогенбиурета путем взаимодействия биурета с соединением металла гипогалогена или с галогеном и основанием; второй реактор для синтеза гидразодикарбонамида путем взаимодействия соли металла моногалогенбиурета с аммиаком; и аммиачный испаритель для отделения избытка аммиака от гидразодикарбонамида и направления выделенного аммиака в аммиачный концентратор.
Предпочтительно, аммиачный концентратор служит для концентрации избытка аммиака и аммиака, полученного из пиролизной печи, а также для доставки концентрированного аммиака во второй реактор. Пиролизная печь может включать газовый инжектор для подачи инертного газа, который не взаимодействует с изоциановой кислотой в пиролизной печи и может включать приспособления для снижения давления, чтобы удалить аммиак из пиролизной печи.
Краткое описание чертежей
Более полное понимание изобретения и многие из сопутствующих его преимуществ будут легко видны, из последующего детального описания в совокупности с представленным чертежом, где представлена схематическая диаграмма, иллюстрирующая систему аппаратов для получения гидразодикарбонамида, в соответствии с воплощением настоящего изобретением.
Осуществление изобретения
Настоящее изобретение становится более понятным из следующего детального описания со ссылкой к сопровождающему чертежу.
Чтобы получить гидразодикарбонамид в соответствии с настоящим изобретением, сначала с помощью пиролиза мочевины при температуре выше температуры плавления мочевины получают биурет, представленный формулой 1, и аммиак. Как правило, биурет широко используют как исходное соединение для получения фармацевтических препаратов, гербицидов и реактивов для анализа, также его используют в большом количестве в качестве пищи для жвачных животных, а также применяют в различных областях, связанных с пластическими смолами. Кроме того, известно, что некоторые производные биурета могут быть использованы в качестве физиологического агента заживления ран или химического терапевтического агента. Приведенное ниже уравнение реакции 6 иллюстрирует способ синтеза биурета путем пиролиза мочевины.
[уравнение 6]
Уравнение реакции 6 показывает, что пиролиз 2 молей мочевины дает биурет при отщеплении молекулы аммиака. Более строго, как показано в уравнении 7, предполагается, что вначале при пиролизе мочевины образуется изоциановая кислота и аммиак, а затем изоциановая кислота реагирует с еще одной молекулой мочевины, которая дает целевой продукт - биурет.
[уравнение 7]
Синтез биурета путем пиролиза мочевины имеет преимущества, заключающиеся в том, что реакция является простой и ее проведение является легким, но также имеются и недостатки, заключающиеся в том, что коэффициент конверсии мочевины в биурет является низким из-за наличия достаточного количества примесей, подобных триурету, циануровой кислоте, которые образуются при взаимодействии биурета с изоциановой кислотой в процессе образования биурета. При повышении температуры и увеличении времени реакции коэффициент конверсии растет, но также растет количество примесей, подобных триурету и циануровой кислоте. Однако при понижении температуры с целью уменьшения количества примесей скорость реакции резко снижается, что делает процесс неэкономичным. Согласно настоящему изобретению для увеличения выхода биурета и снижения количества примесей, температуру реакции предпочтительно поддерживают в интервале 100˜300°С и, более предпочтительно, в интервале 130-170°С.
Более того, если инертный газ, такой как воздух и азот, которые не реагируют с изоциановой кислотой, вводят в реактор и/или давление в реакторе снижают, аммиак, побочный продукт, образующийся в процессе реакции, может быть эффективно удален из реактора, после чего скорость реакции увеличивается и образование примесей может быть также снижено. Кроме того, в качестве источника инертного газа может быть использовано жидкофазное органическое соединение, которое может заменить инертный газ в реакторе с высокой температурой.
В случае необходимости для увеличения скорости пиролиза может быть применен катализатор. В качестве катализатора предпочтительно могут быть использованы неорганический кислотный катализатор, такой как азотная кислота, соляная кислота и серная кислота, а также кислотный тип катализатора, такой как тионилхлорид и фосфорсодержащие соединения, такие как фосфат натрия. Предпочтительное количество катализатора составляет 0,001˜0,5 моль на 1 моль мочевины, и более предпочтительное количество составляет 0,01˜0,3 моль на 1 моль мочевины.
Соль металла моногалогенбиурета формулы 2 или формулы 3 может быть получена путем взаимодействия полученного биурета с соединением металла гипогалогена или галогена и основания.
[формула 2]
[формула 3]
В указанных выше формулах 2 и 3 М представляет собой металл, и Х представляет собой галоген.
Прямой способ получения соли металла моногалогенбиурета путем взаимодействия биурета с соединением металла гипогалогена проиллюстрирован уравнением 8. Конкретный пример иллюстрирует уравнение 9.
[уравнение 8]
В указанном выше уравнении M представляет собой металл, и Х представляет собой галоген.
[уравнение 9]
В уравнении 9 биурет реагирует с гипохлоритом натрия с образованием натриевой соли хлорбиурета. Поскольку реакция является экзотермической, реакционная система предпочтительно должна поддерживаться при низкой температуре. Но полученная натриевая соль хлорбиурета является стабильной при умеренном нагревании, она может быть получена при комнатной температуре. Предпочтительная температура реакции должна быть меньше 60°С, более предпочтительная температура находится в интервале -10˜60°С, и наиболее предпочтительная температура находится в интервале -5˜35°С. Для обеспечения наибольшей экономической эффективности и эксплуатационной мощности мольное соотношение металла гипогалогена на 1 моль мочевины при проведении реакции предпочтительно составляет от 0,1 до 2. Когда мольное соотношение составляет меньше чем 1 моль, избыточный биурет может быть возвращен и многократно использован. В том случае, когда мольное соотношение при проведении реакции составляет меньше 0,1 или температура реакции составляет меньше -10°С, время реакции будет увеличиваться. В том случае, если мольное соотношение при проведении реакции составляет больше 2, себестоимость продукта увеличивается и может пойти побочная реакция. Если температура реакции составляет больше 60°С, полученная соль металла моногалогенбиурета может разложиться, поскольку она неустойчива при высокой температуре. Натриевая соль хлорбиурета, полученная при вышеупомянутых условиях, может быть непосредственно использована или может быть сохранена для следующей стадии процесса.
Способ получения металлической соли моногалогенбиурета вышеуказанных формул 2 или 3, путем взаимодействия биурета с галогеном и основанием проиллюстрирован уравнением 10. В соответствии с уравнением 10 соль металла моногалогенбиурета может быть получена путем добавления основания, такого как гидроксид металла (например, гидроксид натрия, гидроксид калия, гидроксид кальция) к моногалогенбиурету (5), полученному при взаимодействии биурета с галогеном, таким как хлор, или производным галогена.
[уравнение 10]
В уравнении 10 М представляет собой металл, и Х представляет собой галоген.
Принимая во внимание тот факт, что реакция получения моногалогенбиурета (5) является экзотермической, благоприятно, чтобы температура реакции поддерживалась на более низком уровне, в частности, ниже 60°C, предпочтительно - в интервале -10˜60°С и наиболее предпочтительно - в интервале -5-30°С, для обеспечения достаточной скорости реакции и стабильности ее протекания. Альтернативно, соль металла моногалогенбиурета может быть получена путем смешивания гидроксида металла с биуретом с последующим взаимодействием галогена с полученным продуктом. Из-за того, что такая реакция является также экзотермической, температура реакции должна поддерживаться на более низком уровне, в частности, - в интервале -10˜60°С и более предпочтительно - в интервале -5-30°С. При проведении указанной реакции в том случае, когда температура реакции опускается ниже 10°С, время проведения реакции должно быть намного увеличено, а в том случае, когда температура реакции находится выше 60°С, соль металла моногалогенбиурета может разложиться, так как она неустойчива при нагревании. Как проиллюстрировано уравнением 11, полученная соль металла моногалогенбиурета может быть солью металла 3-моногалогенбиурета (6) или солью металла 1-моногалогенбиурета (7).
[уравнение 11]
Чтобы получить гидразодикарбонамид, образующуюся соль металла моногалогенбиурета подвергают взаимодействию с аммиаком, который выделяется при пиролизе мочевины. Механизм реакции, как предполагается, является подобным механизму реакции по Фаворскому, проиллюстрированной уравнением 12, или реакции перегруппировки по Гоффману, проиллюстрированной уравнением 13.
[уравнение 12]
[уравнение 13]
В указанном выше уравнении 12 за счет межмолекулярной реакции анионных атомов азота в соли металла моногалогенбиурета (8) при образовании азот-азотной связи получается нестабильное производное диазиридинона (9), при этом соединение галогенметалла отщепляется. Производное диазиридинона (9) легко реагирует с реакционноспособным аммиаком с образованием гидразодикарбонамида. Кроме того, согласно указанному выше уравнению 13, предполагается, что соль металла моногалогенбиурета превращается в соединение, которое содержит изоцианатную группу, и образованное изоцианатное соединение взаимодействует с реакционноспособным аммиаком с образованием гидразодикарбонамида.
Для проведения реакции соли металла моногалогенбиурета с аммиаком, который является побочным продуктом пиролиза мочевины, с оптимальной скоростью и эффективностью предпочтительной температурой реакции является температура, находящаяся в интервале между 0 и 150°C, более предпочтительно - между 30 и 150°С. Когда температура реакции опускается ниже 0°С, скорость реакции замедляется, и реакция становится экономически неэффективной. В том случае, когда температура реакции поднимается выше 150°С, повышается стоимость оборудования, поскольку оно должно быть предназначено для того, чтобы выдерживать внутреннее давление, вызываемое испарением аммиака.
Аммиак может быть использован как в газообразной, так и в жидкой форме или в виде гидрата аммония. Чтобы увеличить скорость реакции, предпочтительно использовать аммиак в избытке. Количество аммиака может находиться между 1 и 1000 моль на 1 моль соли металла моногалогенбиурета, более предпочтительно - между 2 и 500 моль, наиболее предпочтительно - между 5 и 100 моль. Избыток аммиака, за исключением 1 моля аммиака, который взаимодействует с 1 моль соли металла моногалогенбиурета, может быть отделен и повторно использован в следующем цикле процесса. Когда температура реакции высокая, в том случае, когда используют большое количество аммиака, давление в реакционной системе может быть поднято, чтобы предотвратить выпаривание аммиака. Такой режим позволяет повысить скорость реакции и ее эффективность, при этом предпочтительный интервал давления находится между 1 и 100 кгс/см2.
В соответствии с настоящим изобретением высокий выход может быть достигнут без использования катализатора. Однако использование катализатора является очень полезным, поскольку позволяет сократить время проведения реакции и повысить ее эффективность. Примеры катализаторов включают, по крайней мере, одно соединение, выбранное из группы, состоящей из сульфатов, хлоридов, карбонатов или гидроксидов основного металла или амфотерного металла и металлоорганических соединений. Предпочтительное количество катализатора находится в интервале между 0,001 и 1 моль, более предпочтительно - в интервале 0,01˜0,5 молей на 1 моль соли металла моногалогенбиурета. Неорганическая кислота, такая как серная кислота, соляная кислота или азотная кислота, в качестве катализатора может быть добавлена в количестве 0,05˜3,0 моль на 1 моль соли металла моногалогенбиурета.
В качестве растворителя реагента (биурета) или внутренней реакционной среды может быть использована вода. В случае необходимости в качестве второго растворителя может быть добавлен, по крайней мере, один растворитель, выбранный из группы, состоящей из полярного растворителя, такого как метанол, этанол, пропанол, изопропанол, тетрагидрофуран, ацетонитрил и апротонный растворитель, такой как диметилформамид, диметилсульфоксид, диметилацетамид. Количество второго растворителя особенно не ограничено, но предпочтительное количество составляет от 0,1 до 50-кратного по отношению к общему весу воды, более предпочтительное количество составляет 0,2-3,0. Второй растворитель может быть введен вначале реакции, как растворитель для биурета, или после смешивания раствора биурета с раствором гипохлорита натрия.
Реакция получения гидразодикарбонамида из мочевины в качестве исходного продукта в соответствии с настоящим изобретением целиком проиллюстрирована уравнением 14. Устройство для получения гидразодикарбонамида в соответствии с воплощением настоящего изобретения приведено на чертеже.
[уравнение 14]
Как показано на чертеже, аппаратура для получения гидразодикарбонамида в соответствии с воплощением настоящего изобретения включает пиролизную печь 10 для получения биурета и газообразного аммиака путем пиролиза мочевины. Пиролизная печь 10 предпочтительно включает газовый инжектор 12 для подачи инертного газа в пиролизную печь 10 или может включать устройства (не показано) для снижения давления в печи 10, чтобы легко удалять аммиак из пиролизной печи 10. Примеры инертного газа включают, но не ограничиваются таковыми, воздух, азот и жидкофазное органическое соединение, которое заменяет инертный газ в пиролизной печи 10, поскольку не взаимодействует с изоциановой кислотой.
Аммиак, удаленный из пиролизной печи 10, предпочтительно подают в аммиачный концентратор 20, функцией которого является концентрирование аммиака, подаваемого из пиролизной печи 10, и избыточного количества аммиака, остающегося после образования гидразодикарбонамида. Примеси, такие как циануровая кислота и триурет, присутствующие в биурете, полученном в пиролизной печи 10, отделяют с помощью устройств для перекристаллизации, которые включают реактор перекристаллизации 30 и дегидратор 32, такой как центрифуга, а затем подают в первый реактор 40.
Очищенный биурет, который подают в первый реактор 40, реагирует с соединением металла гипогалогена (например, NaOCl) или галогеном (например, хлором) и основанием с образованием соли металла моногалогенбиурета, а затем полученную соль металла моногалогенбиурета подают во второй реактор 50. Соль металла моногалогенбиурета подвергают взаимодействию с аммиаком с получением гидразодикарбонамида, при этом аммиак предпочтительно подают из аммиачного концентратора 20. Полученный гидразодикарбонамид и избыток аммиака подают в аммиачный испаритель 52. Аммиачный испаритель 52 испаряет избыток аммиака, и испаренный аммиак подают в аммиачный концентратор 20. Гидразодикарбонамид, отделенный от избыточного аммиака, очищают с помощью дегидратора 54, такого как фильтр.
Как показано в уравнении 13 и на чертеже, гидразодикарбонамид в соответствии с настоящим изобретением может быть получен в одном непрерывном процессе из мочевины, используемой в качестве исходного продукта. Поскольку весь процесс осуществляют непрерывно, его эффективность может быть повышена. Кроме того, себестоимость продукта может быть существенно снижена за счет значительного снижения количества сырья вследствие того, что соль металла моногалогенбиурета реагирует с аммиаком, который получен в качестве побочного продукта в процессе образования биурета. Таким образом, гидразодикарбонамид может быть получен с желательной экологичностью за счет использования экологически нежелательного аммиака, как побочного продукта.
Для лучшего понимания настоящего изобретения ниже представлены предпочтительные примеры и примеры получения. Однако представленные примеры приведены лишь для иллюстрации и никоим образом не должны быть восприняты как ограничивающие объем изобретения.
[Производственные примеры 1-4: получение биурета]
В четырехгорлую круглодонную колбу помещают 500 г (8,33 моль) мочевины, энергично перемешивают и на дно колбы подают воздух со скоростью, указанной в таблице 1. Реакцию ведут в течение 5 часов при температуре, поддерживаемой на уровне 140°С путем нагревания. После завершения реакции полученную твердую композицию анализируют с помощью жидкостной хроматографии, результат анализа приведен в таблице 1.
| таблица 1 | ||||
| Пример | Скорость | Содержание | Содержание | Содержание циануровой |
| подаваемого | мочевины | биурета | кислоты и другого | |
| воздуха | (вес.%) | (вес.%) | твердого вещества | |
| (л/минут) | (вес.%) | |||
| 1 | 0 | 62 | 35 | 3 |
| 2 | 1 | 41 | 55 | 4 |
| 3 | 2 | 38 | 60 | 2 |
| 4 | 4 | 37 | 61 | 2 |
[Производственные примеры 5-7: получение биурета]
Биурет получают аналогично тому, как описано в примере 1, за тем исключением, что реакцию проводят в течение 3 часов при различных температурах и скорости подачи воздуха, равной 2 л/минуту. После завершения реакции композицию полученного твердого вещества анализируют путем жидкостной хроматографии, результат анализа приведен в таблице 2.
| таблица 2 | ||||
| Пример | Температура реакции (°С) | Содержание мочевины (вес.%) | Содержание биурета (вес.%) | Содержание циануровой кислоты и другого твердого вещества (вес.%) |
| 5 | 150 | 47 | 50 | 3 |
| 6 | 160 | 38.5 | 57 | 4.3 |
| 7 | 170 | 28 | 65 | 7 |
[Производственные примеры 8-10: получение биурета]
Биурет получают аналогично тому, как описано в примере 1, за тем исключением, что реакцию проводят при пониженных значениях давления, достигаемых с помощью вакуумного насоса, как указано в таблице 3, вместо подачи воздуха. После завершения реакции композицию полученного твердого вещества анализируют с помощью жидкостной хроматографии, результат анализа приведен в таблице 3.
| таблица 3 | ||||
| Пример | Давление (мм рт. ст.) | Содержание мочевины (вес.%) | Содержание биурета (вес.%) | Содержание циануровой кислоты и другого твердого вещества (вес.%) |
| 8 | 380 | 56 | 50 | 4 |
| 9 | 190 | 41,5 | 55 | 3.5 |
| 10 | 100 | 40 | 57 | 3 |
[Производственные примеры 11-13: получение биурета]
Биурет получают аналогично тому, как описано в примере 1, за тем исключением, что реакцию проводят в присутствии 0,05 моль катализатора на 1 моль мочевины, и скорость подачи воздуха устанавливают равной 2 л/минуту. После завершения реакции композицию полученного твердого вещества анализируют с помощью жидкостной хроматографии, результат анализа приведен в таблице 4.
| таблица 4 | ||||
| Пример | Катализатор | Содержание | Содержание | Содержание циануровой |
| мочевины | биурета | кислоты и другого твердого | ||
| (вес.%) | (вес.%) | вещества (вес.%) | ||
| 11 | Серная кислота | 34 | 62 | 4 |
| 12 | Фосфат натрия | 36 | 61 | 3 |
| 13 | Тионилхлорид | 35 | 62 | 3 |
[Производственный пример 14: синтез соли хлорбиурета натрия]
В стеклянный реактор объемом 2 л помещают 423,1 г (0,287 моль) 7% шламового раствора биурета и охлаждают до температуры 5°С при перемешивании. В указанный реактор добавляют 12% водный раствор гипохлорита натрия и температуру реакционной системы поддерживают на уровне ниже 5°С. После завершения добавления реакционный раствор анализируют с помощью иодометрии и с использованием жидкостной хроматографии. Количество хлора составляет 3,37%, что соответствует выходу 98%.
[Производственный пример 15: синтез соли хлорбиурета натрия]
В стеклянный реактор объемом 2 л помещают 423,1 г (0,287 моль) шламового раствора 7% биурета и при перемешивании охлаждают до температуры 5°С. В реактор добавляют 223 г (0,575 моль) 10,3% водного раствора гидроксида натрия и 20,3 г (0,287 моль) газообразного хлора, поддерживая температуру реакционной системы ниже 10°С. После завершения добавления реакционный раствор анализируют с помощью иодометрии и с использованием жидкостной хроматографии. Количество хлора составляет 3,0%, что соответствует выходу 98%.
[Производственный пример 16: синтез соли хлорбиурета натрия]
В стеклянный реактор объемом 2 л помещают 423,1 г (0,287 моль) 7% шламового раствора биурета и охлаждают до температуры 5°С при перемешивании. В реактор добавляют 20,3 г (0,287 моль) газообразного хлора, поддерживая температуру реакционной системы на уровне ниже 10°С, после чего при энергичном перемешивании добавляют 223 г (0,575 моль) 10,3% водного раствора гидроксида натрия, при этом температуру реакции поддерживают на уровне ниже 5°С. После завершения добавления реакционный раствор анализируют с помощью иодометрии и с использованием жидкостной хроматографии. Количество хлора составляет 3,0%, что соответствует выходу 98%.
[Примеры 1-9: синтез гидразодикарбонамида]
В автоклав объемом 2 л помещают 593,1 г соли хлорбиурета натрия, полученной с помощью указанного выше производственного примера 14, и охлаждают до температуры 10°С при перемешивании. Поддерживая температуру реакционного раствора на уровне ниже 10°С, при энергичном перемешивании добавляют 600 г (8,8 моль) 25% водного раствора аммиака. Реакцию проводят, изменяя температуру и время. После завершения реакции непрореагировавший аммиак удаляют, и реакционный раствор фильтруют, чтобы получить нерастворимый в воде гидразодикарбонамид. Выход гидразодикарбонамида рассчитан и приведен в таблице 5.
| таблица 5 | ||
| Пример | Условия реакции (температура, время) | Выход (%) |
| 1 | 30°С, 1 час | 85 |
| 2 | 30°С, 2 часа | 90 |
| 3 | 30°С, 3 часа | 89 |
| 4 | 60°С, 1 час | 91 |
| 5 | 60°С, 2 часа | 89 |
| 6 | 60°С, 3 часа | 90 |
| 7 | 90°С, 1 час | 88 |
| 8 | 90°С, 2 часа | 89 |
| 9 | 90°С, 3 часа | 90 |
[Примеры 10-18: синтез гидразодикарбонамида]
Реакцию проводят аналогично тому, как описано в примере 4, за тем исключением, что добавляют 0,05 моль катализатора, указанного в таблице 6. После завершения реакции непрореагировавший аммиак удаляют, и реакционный раствор фильтруют, чтобы получить нерастворимый в воде гидразодикарбонамид. Выход гидразодикарбонамида рассчитан и приведен в таблице 6.
| таблица 6 | ||
| Пример | Применяемый катализатор | Выход (%) |
| 10 | ZnCl2 | 94 |
| 11 | Zn(OH)2 | 92 |
| 12 | AlCl3 | 90 |
| 13 | BaCl2 | 91 |
| 14 | CdCl2 | 92 |
| 15 | ZnSO4 | 93 |
| 16 | ZnCl2+AlCl3 (0,025 моль каждого) | 96 |
| 17 | ZnCl2+BaCl2 (0,025 моль каждого) | 94 |
| 18 | ZnCl2+CdCl2 (0,025 моль каждого) | 96 |
[Примеры 19-27: синтез гидразодикарбонамида]
В автоклав объемом 2 л загружают 593,1 г соли хлорбиурета натрия, полученной с помощью производственного примера 15, и охлаждают до температуры 10°С при перемешивании. Поддерживая температуру реакционного раствора ниже 10°С, при энергичном перемешивании добавляют 600 г (8,8 моль) 25% водного раствора аммиака. Реакцию проводят, изменяя ее температуру и время. После завершения реакции непрореагировавший аммиак удаляют и реакционный раствор фильтруют, чтобы получить нерастворимый в воде гидразодикарбонамид. Выход гидразодикарбонамида рассчитан и приведен в таблице 7.
| таблица 7 | ||
| Пример | Условия реакции (температура, время) | Выход (%) |
| 19 | 30°С, 1 час | 78 |
| 20 | 30°С, 2 часа | 89 |
| 21 | 30°С, 3 часа | 89 |
| 22 | 60°С, 1 час | 88 |
| 23 | 60°С, 2 часа | 90 |
| 24 | 60°С, 3 часа | 90 |
| 25 | 90°С, 1 час | 87 |
| 26 | 90°С, 2 часа | 86 |
| 27 | 90°С, 3 часа | 89 |
[Примеры 28-36: синтез гидразодикарбонамида]
Реакцию проводят аналогично тому, как описано в примере 22, за тем исключением, что добавляют 0,05 моль катализатора, приведенного в таблице 8. После завершения реакции непрореагировавший аммиак удаляют и реакционный раствор фильтруют, чтобы получить нерастворимый в воде гидразодикарбонамид. Выход гидразодикарбонамида рассчитан и приведен в таблице 8.
| таблица 8 | ||
| Пример | Применяемый катализатор | Выход (%) |
| 28 | ZnCl2 | 94 |
| 29 | Zn(OH)2 | 91 |
| 30 | AlCl3 | 89 |
| 31 | BaCl3 | 91 |
| 32 | CdCl3 | 93 |
| 33 | ZnSO4 | 92 |
| 34 | ZnCl2+AlCl3 (0,025 моль каждого) | 97 |
| 35 | ZnCl2+BaCl2 (0,025 моль каждого) | 93 |
| 36 | ZnCl2+CdCl2 (0,025 моль каждого) | 96 |
[Примеры 37-45: синтез гидразодикарбонамида]
В автоклав объемом 2 л загружают 593,1 г соли хлорбиурета натрия, полученной с помощью указанного выше производственного примера 16, и охлаждают до температуры 10°С при перемешивании. Поддерживая температуру реакционного раствора ниже 10°С, при энергичном перемешивании добавляют 600 г (8,8 моль) 25% водного раствора аммиака. Реакцию проводят при различных температурных и временных режимах. После завершения реакции непрореагировавший аммиак удаляют и реакционный раствор фильтруют, чтобы получить нерастворимый в воде гидразодикарбонамид. Выход гидразодикарбонамида рассчитан и приведен в таблице 9.
| таблица 9 | ||
| Пример | Условия реакции (температура, время) | Выход (%) |
| 37 | 30°С, 1 час | 79 |
| 38 | 30°С, 2 часа | 88 |
| 39 | 30°С, 3 часа | 89 |
| 40 | 60°С, 1 час | 89 |
| 41 | 60°С, 2 часа | 90 |
| 42 | 60°С, 3 часа | 91 |
| 43 | 90°С, 1 час | 88 |
| 44 | 90°С, 2 часа | 88 |
| 45 | 90°С, 3 часа | 89 |
[Примеры 46-54: синтез гидразодикарбонамида]
Реакцию проводят аналогично тому, как описано в примере 40, за тем исключением, что добавляют 0,05 моль катализатора, указанного в таблице 10. После завершения реакции непрореагировавший аммиак удаляют и реакционный раствор фильтруют, чтобы получить нерастворимый в воде гидразодикарбонамид. Выход гидразодикарбонамида рассчитан и приведен в таблице 10.
| таблица 10 | ||
| Пример | Применяемый катализатор | Выход (%) |
| 46 | ZnCl2 | 93 |
| 47 | Zn(OH)2 | 90 |
| 48 | AlCl3 | 90 |
| 49 | BaCl2 | 90 |
| 50 | CdCl2 | 92 |
| 51 | ZnSO4 | 89 |
| 52 | ZnCl2+AlCl3 (0,025 моль каждого) | 95 |
| 53 | ZnCl2+BaCl2 (0,025 моль каждого) | 93 |
| 54 | ZnCl2+CdCl2 (0,025 моль каждого) | 94 |
[Примеры 55-58: синтез гидразодикарбонамида]
В автоклав объемом 2 л помещают 593,1 г соли хлорбиурета натрия, полученной с помощью указанного выше производственного примера 14, и охлаждают до температуры 10°С при перемешивании. Поддерживая температуру реакционного раствора ниже 10°С, при энергичном перемешивании в течение часа добавляют водный раствор аммиака в количестве, приведенном в таблице 11. После завершения реакции непрореагировавший а