Производные бензимидазола и их применение в качестве пролекарств ингибиторов протонного насоса
Иллюстрации
Показать всеИзобретение относится к новым соединениям Формулы 1, Формулы 2, Формулы 3 или Формулы 4
или изомерам соединений Формул 2 и 3, где значения символов определены в формуле изобретения, и к их фармацевтически приемлемым солям, обладающим улучшенной растворимостью в водных средах и улучшенной биодоступностью, где указанные соединения обладают ингибирующей активностью в отношении секреции желудочной кислоты. 3 н. и 32 з.п. ф-лы, 4 табл.
Реферат
Предпосылки создания изобретения
Область изобретения
Настоящее изобретение направлено на усовершенствованные пролекарства ингибиторов протонного насоса, которые могут использоваться в качестве противоязвенных средств. Более конкретно, настоящее изобретение направлено на пролекарства, которые медленно гидролизуются с образованием ингибиторов протонного насоса бензимидазольного типа, экзогенно или эндогенно ингибирующих секрецию желудочной кислоты, которые имеют лучшую растворимость в физиологических жидкостях и могут быть использованы для предупреждения и лечения воспалительных желудочно-кишечных заболеваний у млекопитающих, включая человека.
Краткое описание уровня техники
Производные бензимидазола, предназначенные для ингибирования секреции желудочного сока, раскрыты в патентах США 4045563; 4255431; 4628098; 4686230; 4758579; 4965269; 5021433; 5430042, 5708017, 6093734 и 6599167. В общих чертах, ингибиторы секреции желудочной кислоты бензимидазольного типа действуют посредством перегруппировки с образованием тиофильного фрагмента, который затем ковалентно связывается с желудочной Н,К-АТФазой, ферментом, участвующим в конечной стадии выделения протона в париетальной клетке, и тем самым ингибирует данный фермент. Соединения, ингибирующие желудочный фермент Н,К-АТФазу, большей частью известны как "ингибиторы протонного насоса" (ИПН).
Некоторые бензимидазолы, ингибирующие желудочный фермент Н,К-АТФазу, широко используются в качестве лекарственных препаратов при лечении человека и известны под такими наименованиями как LANSOPRAZOLE (лансопразол) (патент США 4628098), OMEPRAZOLE (омепразол) (патенты США 4255431 и 5693818), PANTOPRAZOLE (пантопразол) (патент США 4758579) и RABEPRAZOLE (рабепразол) (патент США 5045552). Заболевания, при лечении которых используются ингибиторы протонного насоса, и в частности четыре упомянутых выше лекарственных препарата, включают наряду с прочими пептическую язву, изжогу, рефлюкс-эзофагит, эрозивный эзофагит, неязвенную диспепсию, инфекцию Helicobacter pylori, ларингит и астму.
Несмотря на то что лекарственные препараты типа ингибиторов протонного насоса представляют собой значительный прогресс в области медицины человека и в ветеринарии, они все же не лишены недостатков. Недостатки используемых в настоящее время лекарственных препаратов типа ингибиторов протонного насоса (ИПН) проще всего можно объяснить при более подробном описании способа их действия, заболеваний или состояний, при лечении которых они используются, и условий их применения. Итак, кислотозависимые заболевания включают, не ограничиваясь перечнем, эрозивный эзофагит, рефлюкс-эзофагит, желудочную и дуоденальную язву, неязвенную диспепсию, инфекцию Helicobacter pylori. Обычная терапия всех этих заболеваний, за исключением инфекции, вызванной бактерией Н.pylori, включает лечение препаратами, подавляющими секрецию кислоты, одним из типов которых являются упомянутые выше ингибиторы протонного насоса.
Используемые в настоящее время ингибиторы протонного насоса представляют собой пиридилметилсульфинилбензимидазолы (или соединения, имеющие аналогичную структуру) с установленной величиной рКа от 4,0 до 5,0. Механизм их действия заключается в аккумуляции в кислой области париетальной клетки (секреторном канальце, рН около 1,0) и последующем, катализируемым ионами водорода, превращении в реакционноспособные тиофильные соединения, способные ингибировать желудочный фермент АТФазу, приводя к эффективному ингибированию желудочной секреции со значительным терапевтическим индексом. Благодаря такому механизму используемые в настоящее время лекарственные препараты типа ИПН нуждаются в специальной желудочной защите для того, чтобы оставаться активными при дуоденальной абсорбции. По этой причине, а также из-за легкости разложения в кислой среде желудка лекарственные препараты типа ИПН, предназначенные для перорального приема, покрывают энтеросолюбильной оболочкой. Необходимость в энтеросолюбильном покрытии является недостатком ввиду его высокой стоимости и чувствительности к влаге.
Из-за потребности аккумулирования в кислой области париетальной клетки для эффективного действия лекарственных препаратов типа ИПН необходима секреция кислоты. Было установлено, что период полувыведения из плазмы таких препаратов составляет от 60 до 90 минут. Все кислотные насосы являются неактивными в течение этого времени, вернее, лишь около 75%, в среднем, являются активными в течение времени, которое лекарственный препарат находится в крови после перорального введения. В ходе медицинских исследований также было установлено, что при повседневном пероральном одноразовом приеме максимальное ингибирование стимулированного высвобождения кислоты составляет приблизительно 66%. Это происходит благодаря сочетанию короткого периода полувыведения вещества из плазмы, ограниченного числа кислотных насосов, активных в момент присутствия вещества, и обороту кислотных насосов. В повседневной практике зачастую невозможно при помощи вечернего перорального приема препарата надлежащим образом контролировать секрецию кислоты в ночное время, поскольку к моменту секреции кислоты, происходящей после полуночи, препарат исчезает из плазмы. Для терапии кислотозависимых заболеваний и лечения инфекции Н.pylori (в сочетании с антибиотиками), а также для ослабления симптомов неязвенной диспепсии идеальным было бы полное ингибирование секреции кислоты. При помощи используемых в настоящее время лекарственных препаратов типа ИПН это достижимо лишь при внутривенной инфузии; в случае препарата омепразол требуются внутривенные инфузии по 8 мг/час. Очевидно, что существует необходимость в препарате или препаратах, действующих по механизму лекарственных препаратов типа ИПН, но способных достигать или приближаться к полному ингибированию секреции кислоты при пероральном применении.
Из-за неполного и продолжающегося менее 24 часов ингибирования секреции кислоты при пероральном введении лекарственых форм современных препаратов типа ИПН лечение желудочных и дуоденальных изъязвлений занимает от 4 до 8 недель. Это происходит несмотря на то, что время воспроизведения поверхностных клеток пищевода, желудка и двенадцатиперстной кишки составляет приблизительно 72 часа. Несомненно, что столь длительное лечение существующими препаратами обусловлено неадекватным подавлением кислоты и вызванным кислотой разрушением. Все вышесказанное подчеркивает необходимость создания препарата или препаратов, действующих по механизму лекарственных средств типа ИПН, способных достигать или приближаться к полному ингибированию секреции кислоты при пероральном применении.
В качестве дополнительных предпосылок, имеющих отношение к настоящему изобретению, заявители отмечают концепцию пролекарства, хорошо известную в данной области. Вообще говоря, пролекарства по существу являются производными лекарственных соединений, которые превращаются в физиологически активные соединения после введения в организм. Превращение может протекать самостоятельно, как, например, гидролиз в физиологической среде, либо быть катализируемым ферментами. Из значительного объема научной литературы, посвященной общим сведениям о пролекарствах, можно привести следующие примеры: Design of Prodrugs (Создание пролекарств) (Bundgaard H. ed.) 1985 Elsevier Science Publishers B.V. (Biomedical Division), Chapter 1; Design of Prodrugs: Bioreversible derivatives for various functional groups and chemical entities (Создание пролекарств: Биообратимые производные для различных функциональных групп и химических объектов) (Hans Bundgaard); Bundgaard et al. Int. J. of Pharmaceutics 22 (1984) 45-56 (Elsevier); Bundgaard et al. Int. J. of Pharmaceutics 29 (1986) 19-28 (Elsevier); Bundgaard et al. J. Med. Chem. 32 (1989) 2503-2507 Chem. Abstracts 93, 137935y (Bundgaard et al.); Chem. Abstracts 95, 138493f (Bundgaard et al.); Chem. Abstracts 95, 138592n (Bundgaardet al.); Chem. Abstracts 110, 57664p (Alminger et al.); Chem. Abstracts 115, 64029s (Buur et al.); Chem. Abstracts 115, 189582y (Hansen et al.); Chem. Abstracts 117, 14347q (Bundgaard et al.); Chem. Abstracts 117, 55790x (Jensen et al.), и Chem. Abstracts 123, 17593b (Thomsen et al.).
Насколько известно настоящим заявителям, в данное время не используют пролекарства ингибиторов протонного насоса. Однако отдельные патенты США описывают соединения, которые могут действовать как пролекарства некоторых ингибиторов протонного насоса. В частности, Патент США 4686230 (Rainer et al.) описывает производные пиридилметилсульфинилбензимидазолов, содержащие при одном из атомов азота бензимидазольного кольца группу, обозначенную как R5. Предполагается, что группа R5 будет отщепляться в условиях физиологической среды или под воздействием фермента с образованием соответствующего соединения со свободной связью N-H (см. раздел 3 Патента США 4686230). Патенты США 5021433 (Alminger et al.), 4045563 (Berntsson et al.) и 4965269 (Brändström et al.) также описывают пиридилметилсульфинилбензимидазолы, в которых один из атомов азота бензимидазольного фрагмента содержит заместитель, способный отщепляться в физиологических или ферментных условиях. Патент США 4045563 (Berntsson et al.) описывает производные N-алкоксикарбонилбензимидазола.
В публикации Sih. et al. Journal of Medicinal Chemistry, 1991, vol.34, pp.1049-1062, дано описание N-ацилоксиалкильных, N-алкоксикарбонильных, N-аминоэтильных и N-алкоксиалкильных производных бензимидазолсульфоксида в качестве пролекарств ингибиторов протонного насоса. Согласно этой статье такие пролекарства проявляли лучшую химическую стабильность в твердом состоянии и в водных растворах, но обладали такой же или меньшей активностью, чем соответствующие исходные соединения, содержащие в имидазольной части свободную группу N-H. В указанной публикации не приводятся данные о длительности ингибирующей активности таких пролекарств.
В патенте США 6093734 и публикации РСТ WO 00109498 (опубликованной 24 февраля 2000 г.) описаны пролекарства ингибиторов протонного насоса, содержащие замещенный арилсульфонильный фрагмент, присоединенный к одному из атомов азота бензимидазольного кольца ингибиторов протонного насоса, имеющие структуру, идентичную структуре лекарственных препаратов - ингибиторов протонного насоса, известных под названиями лансопразол, омепразол, пантопразол и рабепразол.
В публикации РСТ WO 02/30920 описаны бензимидазольные соединения, заявленные как ингибирующие секрецию желудочной кислоты и обладающие действием против Н.pylori. В публикации РСТ WO 02/00166 описаны соединения, заявленные как высвобождающие окись азота (NO) производные ингибиторов протонного насоса с бензимидазольной структурой.
Настоящее изобретение является еще одним шагом в данной области, поскольку представляет пролекарства ингибиторов протонного насоса, обладающие лучшей растворимостью в физиологических средах и лучшим проникновением в клетку, и представляет доказательства применимости пролекарств изобретения в качестве пролекарств ингибиторов протонного насоса с улучшенной эффективностью при терапии кислотозависимых заболеваний за счет пролонгирования присутствия ингибиторов протонного насоса в организме.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к соединениям Формулы 1, Формулы 2, Формулы 3 или Формулы 4
или изомерам соединений Формул 2 и 3, в которых группы ОСН3 и HF2CO, соответственно, находятся в 6 положении бензимидазольного кольца, где R представляет собой группу (i)
пунктирная линия означает связь, соединяющую группу R с группой SO2, R1 и R2 независимо означают Н, прямой или разветвленный насыщенный углеводород, содержащий не более 12 атомов углерода, включающую одну или две группы R5, и необязательно дополнительно включающую от одной до трех групп X, где Х независимо выбран из группы, состоящей из -О-, -NHCO-, -CONH-, или группа R5 без участия групп R1 или R2 напрямую присоединена к ароматическому кольцу;
R3 и R4 независимо представляют собой Н, алкил, содержащий от одного до трех атомов углерода, или O-алкил, содержащий от одного до трех атомов углерода, R5 независимо означает Н или СООН;
при условии, что
по меньшей мере, одна из групп R1 и R2 не является Н и
по меньшей мере, один заместитель R5 не является Н и не более двух групп R5 представляют собой СООН, так что соединение содержит, по меньшей мере, одну, но не более двух групп СООН;
и к фармацевтически приемлемым солям указанных соединений.
Предпочтительными примерами соединений Формул 1-4 или изомеров соединений Формул 2 и 3, в которых группы ОСН3 и HF2CO, соответственно, находятся в 6 положении бензимидазольного кольца, являются соединения, включающие, по меньшей мере, одну группу X, где, по меньшей мере, один из заместителей X означает О или CONH, и соединения, содержащее две группы R5, означающие СООН, или фармацевтически приемлемые соли указанных соединений. Также предпочтительными примерами соединений по изобретению являются соединения Формул 1-4 или указанные выше изомеры соединений Формул 2 и 3 содержащие, по меньшей мере, одну, но не более двух групп СООН, как описано выше, или их фармацевтически приемлимые соли, а также соединение по изобретению, в котором заместители R2, R3 и R4 представляют собой водород, a R1 представляет собой группу OCH2COOH, присоединенную к 4-положению фенильного кольца относительно сульфонильной группы, или его фармацевтически приемлемая соль.
Особенно предпочтительными примерами соединений Формулы 1, Формулы 2, Формулы 3 или Формулы 4, а также изомеров соединений Формул 2 и 3, в которых группы ОСН3 и HF2CO, соответственно, находятся в 6 положении бензимидазольного кольца, являются соединения, где R означает группы, выбранные из Формул (а)-(s), пунктирная линия представляет собой связь, соединяющую группу R с группой SO2,
или фармацевтически приемлемые соли указанных соединений.
Наиболее предпочтительными примерами соединений по изобретению являются
- Соединение, имеющее формулу
или фармацевтически приемлемая соль указанного соединения.
- Соединение, имеющее формулу
или его фармацевтически приемлемая соль.
- Соединение, имеющее формулу
или фармацевтически приемлемая соль указанного соединения.
Также изобретение относится к фармацевтической композиции, обладающей ингибирующей активностью в отношении секреции желудочной кислоты и включающей фармацевтически приемлемый наполнитель и любое из соединений по изобретению.
Также изобретение относится к указанной фармацевтической композиции, дополнительно включающей лекарственное средство - ингибитор протонного насоса, выбранный из группы, состоящей из формул (w), (x), (y) и (z)
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Определения
Термин «алкил» означает и включает в себя все группы, известные как нормальный алкил, разветвленный алкил, циклоалкил, а также циклоалкилалкил.
Фармацевтически приемлемая соль может быть приготовлена для любого соединения данного изобретения, содержащего функциональную группу, способную к образованию соли, как, например, карбоксильная группа, или основная (например, аминная) функциональные группы соединений настоящего изобретения. Фармацевтически приемлемой солью является любая соль, сохраняющая активность исходного соединения и не оказывающая никакого пагубного или неблагоприятного воздействия на субъекта, которому она введена, и в тех условиях, в которых она введена.
Фармацевтически приемлемые соли могут быть производными органических или неорганических оснований. Соль может представлять собой моно- или поливалентный ион. Особый интерес представляют соли с неорганическими ионами, такими как ионы лития, натрия, калия, кальция и магния. Органические соли могут быть образованы с аминами, в частности, аммониевые соли, такие как моно-, ди- и триалкиламины или этаноламины. Соли также могут быть образованы с кофеином, трометамином и аналогичными молекулами. Соляная кислота или некоторые другие фармацевтически приемлемые кислоты могут образовывать соль с соединением изобретения, если оно содержит основную группу, такую как аминогруппа или пиридиновое кольцо.
Некоторые из соединений настоящего изобретения могут содержать один или более хиральных центров и, следовательно, могут существовать в энантиомерных или диастереомерных формах. Объем настоящего изобретения охватывает все изомеры, смеси диастереомеров и рацемические смеси энантиомеров (оптических изомеров).
Основные осуществления
Химическая структура соединений изобретения представлена и описана общими терминами в разделе «Сущность изобретения» в связи с Формулами 1-4. Как можно видеть из этих формул, соединения изобретения представляют собой пиридилметилсульфинилбензимидазолы, замещенные по пиридиновому и бензимидазольному фрагментам аналогично хорошо известным лекарственным препаратам - ингибиторам протонного насоса - лансопразолу (Патент США 4628098), омепразолу (Патент США 4255431 и 5693818), пантопразолу (Патент США 4758579) и рабепразолу (Патент США 5045552). Описания Патентов США 4628098, 4255431, 5693818, 4758579 и 5045552 специально приведены здесь в качестве ссылки.
Кроме того, как видно из Формул 1-4, в соединениях изобретения один из атомов азота бензимидазольного фрагмента замещен группой (обозначенной как R в Формулах 1-4), которая постепенно отщепляется в физиологических условиях и тем самым образует пиридилметилсульфинилбензимидазольное соединение, содержащее свободную функцию NH в бензимидазольном фрагменте. Соединения, образующиеся при таком отщеплении группы R, подвергаются далее перегруппировке при кислотном катализе и превращаются в тиофильные соединения, которые ингибируют фермент Н,К-АТФазу, участвующий в секреции желудочной кислоты. Таким образом, новые соединения настоящего изобретения, содержащие группу R, являются пролекарствами соединений - ингибиторов протонного насоса, которые также могут быть представлены Формулами 1-4, в которых, помимо всего, группа R может быть водородом. Для дополнительного описания пролекарств пиридилметилсульфинилбензимидазольного типа препаратов - ингибиторов протонного насоса, содержащих замещенный арилсульфонил или замещенный арилсульфонильный фрагмент, присоединенный к одному из бензимидазольных атомов азота, делается ссылка на Патент США 6093734, 6599167 и публикацию РСТ WO 00109498, описания которых специально приведены в данной заявке посредством ссылки. Как показано на примере растворимости и аналогичных данных, приведенных ниже, соединения настоящего изобретения представляют собой значительное усовершенствование по сравнению с известными соединениями, поскольку обладают большей растворимостью в физиологической среде и, следовательно, как можно предположить, будут более биодоступны.
Что касается группы, обозначенной как R, в настоящее время наиболее предпочтительными являются соединения, в которых R представляет собой замещенный фенил (формула (i)).
Обратимся теперь к переменным, обозначенным как R3 и R4 в формуле (i); в настоящее время предпочтительными будут соединения изобретения, в которых эти переменные независимо выбраны из Н, метила, этила, изопропила, метокси, этокси, CF3, СН3О и OCF3. Предпочтительно, чтобы, по меньшей мере, один из этих заместителей не был водородом, и предпочтительно, чтобы эти заместители находились при атоме или атомах углерода, которые расположены смежно с атомом углерода, связанным с сульфонильной группой. Во многих предпочтительных соединениях изобретения, в которых R означает фенил, эти атомы углерода находятся в орто-положении относительно сульфонильной группы. Специалисты в данной области согласятся, что заместители R3 и R4 могут оказывать электронное и стерическое влияние на скорость отрыва или гидролиза сульфонильной группы от бензимидазольного ядра и тем самым влиять на биодоступность пролекарств настоящего изобретения. Если, как в некоторых предпочтительных осуществлениях, заместители R3 и R4 находятся в орто- (или аналогичном) положении относительно сульфонильной группы, то наличие или отсутствие у таких заместителей стерического объема будет особенно сильно влиять на скорость гидролиза сульфонильной группы от бензимидазольного фрагмента. В некоторых из предпочтительных в настоящее время соединений изобретения R означает фенил (формула (i)), а оба заместителя R3 и R4 являются метилами и занимают в фенильном кольце орто- и орто'-положения. Согласно другим примерам предпочтительных соединений изобретения, R означает фенил, одна из групп R3 и R4 является Н, а другая - изопропилом. Орто- и орто'-метильные и орто-изопропильные заместители замедляют скорость гидролиза по сравнению с соединением, обладающим аналогичной во всех отношениях структурой, но в котором отсутствуют такие орто- и орто'-заместители.
Что касается переменных R1 и R2, важной особенностью соединений изобретения является то, что одна или обе эта группы содержат карбоксильную функцию. Назначение карбоксильной группы, входящей в состав этих переменных в соединениях изобретения, заключается в увеличении растворимости соединений в водных физиологических средах при физиологическом значении рН по сравнению с известными пролекарствами пиридилметилсульфинилбензимидазольных ингибиторов протонного насоса. Вообще говоря, желательно, чтобы величина рКа фрагмента карбоновой кислоты (или тетразола) соединений изобретения лежала в интервале от 2 до 6, еще более предпочтительно, чтобы величина рКа была в интервале от 2 до 4, и еще более предпочтительно, чтобы рКа равнялась приблизительно 3. Один или два фрагмента карбоновой кислоты, присоединенных к заместителям R1 и/или R2, обеспечивают требуемую величину рКа и, следовательно, требуемую растворимость для соединений изобретения. Специалисты в данной области согласятся, что на кислотность фрагмента карбоновой кислоты влияют электронные эффекты других групп, находящихся по соседству, особенно если карбоксильная группа присоединена непосредственно к ароматическому ядру. Один или два фрагмента карбоновой кислоты могут быть заменены тетразольным кольцом, и, кроме того, физиологически приемлемые соли соединений настоящего изобретения могут иметь такую же или даже лучшую растворимость в физиологических средах, чем соответствующие свободные кислоты.
Требование настоящего изобретения, чтобы одна или обе группы R1 и R2 содержали, по меньшей мере, один, но, в общей сложности, не более двух фрагментов карбоновых кислот (или их фармацевтически приемлемых солей), может быть удовлетворено целым рядом групп R1 и R2 или их комбинацией. Например, одна из этих двух групп может представлять собой Н, при этом другая группа будет содержать одну или две карбоксильные группы. Или же каждая из групп R1 и R2 может содержать по одной карбоксильной группе. Карбоксильные группы, обозначенные R5 в формуле (i), могут быть присоединены непосредственно к ароматическим или гетероароматическим ядрам, либо одна или обе группы R1 и R2 могут содержать углеводородный "скелет" или "каркас", который присоединен непосредственно к ароматическим ядрам. Или же углеводородный "скелет" или "каркас" может быть сам присоединен к ароматическим или гетероароматически ядрам через промежуточную эфирную, тиоэфирную, аминную, сложноэфирную или амидную группу. Эти группы обозначены переменной Х при описании соединений в разделе «Сущность изобретения» данной заявки.
Кроме того, эфирная, тиоэфирная, аминная, сложноэфирная или амидная группа или группы могут быть включены в одно или несколько мест углеводородного "скелета" или "каркаса", при этом карбоксильная (или тетразольная) группа или группы присоединены к R1 и/или R2 или "содержатся" в R1 и/или R2, которые сами содержат эфирные, тиоэфирные, амино, сложноэфирные или амидные звенья. Любая комбинация таких звеньев может быть приемлема для получения соединения в объеме изобретения. Кроме того, "скелет" или "каркас" сам по себе может быть прямой или разветвленной цепью, и ответвление может осуществляться за счет углерод-углеродных связей или связей углерод-группа X.
Понимая, что группы R1 и R2 могут быть выбраны независимо и таким образом, чтобы, по меньшей мере, одна, но не более двух, карбоксильных (или тетразольных) групп присутствовала в соединении изобретения, предпочтительными значениями групп R1 и R2 являются следующие:
(1) Н,
(2)(CH2)mR5.
(3)(CH2)mCH(R5)(CH2)n[CH(R5)]q(CH2)oCH3,
(4) X(CH2)mR5,
(5) X(CH2)mCH(R5)[(CH2)nCH(R5)]q(CH2)oCH3,
(6) (CH2)mX(CH2)pCH(R5)[(CH2)nCH(R5)]q(CH2)oCH3,
(7) (CH2)mCH(R5)(CH2)nX[(CH2)pCH(R5)]q(CH2)oCH3,
(8) (СН2)mХ[(СН2)рСН(R5)]q(СН2)nСН(R5)(СН2)оСН3,
(9) (CH2)m[CH(R5)(CH2)n]qХ(СН2)рСН(R5)(СН2)оСН3,
(10) Х(СН2)mХСН(R5)[(СН2)nСН(R5)]q(СН2)оСН3,
(11) (CH2)m[CH(CH2)s(R5)](CH2)n[CH(CH2)s(R5)]q(CH2)oCH3,
(12) X[CH(CH2)s(R5)]mR5,
(13) Х(СН2)m[CH(CH2)s(R5)][CH(CH2)s(R5)]q(CH2)oCH3,
(14) (CH2)mX(CH2)p[CH(CH2)s(R5)][CH(CH2)s(R5)]q(CH2)oCH3,
(15) (CH2)m[CH(CH2)s(R5)](CH2)nX[CH(CH2)s(R5)]q(CH2)oCH3,
(16) (CH2)mX[(CH2)p[CH(CH2)s(R5)]]q(CH2)n[CH(CH2)s(R5)](CH2)oCH3,
(17) (CH2)m[[CH(CH2)s(R5)](CH2)n]qX(CH2)p[CH(CH2)s(R5)](CH2)oCH3,
(18) X(CH2)mX[CH(CH2)s(R5)][(CH2)n[CH(CH2)s(R5)]]q(CH2)oCH3
(19) Х(СН2)mС(СН3)2R5
(20) X(CH2)mX(CH2)nR5,
где m означает целое число от 0 до 6;
n означает целое число от 0 до 5;
q означает целое число - 0 или 1,
о означает целое число от 0 до 5,
s означает целое число от 0 до 5,
сумма чисел m, n, q, о и s не превышает 12 и
где остальные переменные имеют значения, определенные выше для Формул 1-4, с учетом изложенного для Формул 1-4, а также при условии, что группа R5 не связана напрямую с О, NHCO или CONH.
Используя замещенную фенилсульфонильную группу и СООН (для R5) в качестве предпочтительных фрагментов в соединениях настоящего изобретения, далее представлены структурные формулы, изображающие, не ограничиваясь перечнем, а лишь иллюстрируя в качестве примеров, предпочтительные группы R1 или R2, перечисленные выше (2), (3), (4), (5), (10), (11), (12), (19) и (20).
Наиболее предпочтительные группы R, входящие в соединения изобретения, изображены ниже. Для облегчения ссылки на них эти предпочтительные группы обозначены R с соответствующими индексами, как, например, "R11, R12 и т.д."
В настоящее время наиболее предпочтительными являются соединения изобретения, в которых одна из групп R11-R34 присоединена к бензимидазольному фрагменту, изображенному в Формулах 1-4. Структуры частных примеров наиболее предпочтительных соединений изобретения представлены ниже в экспериментальной части вместе с описанием получения конкретных примеров.
Методики синтеза
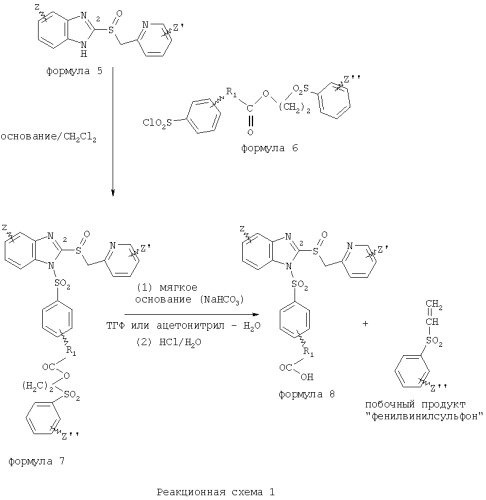
Вообще говоря, соединения изобретения могут быть получены основным гидролизом замещенных или незамещенных фенилсульфонилэтиловых эфиров моно- или дикарбоновых кислот, которые составляют соединения изобретения. Общий способ предпочтительного в настоящее время способа синтеза представлен на Реакционной схеме 1, где для простоты иллюстрации пиридилметилсульфинилбензимидазольные фрагменты, соответствующие Формулам 1-4, изображены в общем виде Формулой 5, арильные, гетероарильные или алкильные группы Формулы (i) представлены фенильной группой, и показаны только одна группа R1 (как определено выше) и только одна монокарбоновая кислота. Однако специалист в данной области легко поймет, что описанная здесь методика синтеза может быть использована для получения всех соединений в объеме изобретения, но с такими модификациями, которые очевидны для специалиста с точки зрения настоящего раскрытия.
Обратимся теперь непосредственно к Формуле 5на Реакционной схеме 1, данная формула изображает пиридилметилсульфинилбензимидазолы, известные как лансопразол, омепразол, пантопразол и рабепразол. Переменная Z означает Н или такой заместитель, который может присутствовать в бензимидазольной части любого из этих соединений, а Z′ означает заместитель или заместители, присутствующие в пиридиновой части этих препаратов - ингибиторов протонного насоса. Соединение Формулы 5 взаимодействует с хлорсульфонильным соединением Формулы 6 в присутствии основания, такого как гидрид натрия, триэтиламин и ди(изопропил)метиламин, либо другого подходящего основания, в апротонном растворителе, таком как СН2Cl2. Соединение Формулы 6 содержит фрагмент замещенного или незамещенного фенилсульфонилэтилового эфира карбоновой кислоты, включенного в соединения изобретения.
Заместитель в фенилсульфонилэтильной части обозначен символом Z", который во многих предпочтительных примерах означает метильную группу в пара-положении или нитрогруппу в мета-положении фенильного кольца. Предпочтительные способы синтеза хлорсульфонильных соединений Формулы 6 проиллюстрированы ниже схемами реакций, а также подробно описаны в разделе «Конкретные примеры». Но помимо этого и в общем случае, хлорсульфонильные соединения в объеме Формулы 6 могут быть получены такими модификациями представленных здесь реакций, которые очевидны для специалиста в данной области в свете широко доступной химической патентной и научной литературы.
Реакция пиридилметилсульфинилбензимидазолов Формулы 5 с хлорсульфонильными соединениями Формулы 6 приводит к образованию полупродуктов Формулы 7. Полупродукты Формулы 7 гидролизуются в присутствии мягкого основания, такого как NaHCO3, с образованием натриевой соли соединений изобретения. Побочным продуктом этой реакции является замещенный или незамещенный фенилвинилсульфон, изображенный на Реакционной схеме 1. Натриевая соль может быть легко превращена в соединение изобретения в форме свободной кислоты, представленное (в упрощенном виде) Формулой 8.
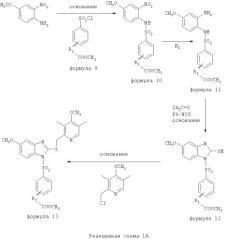
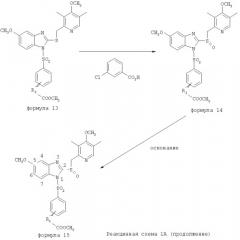
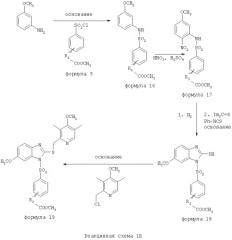
Соединения изобретения, обозначенные Формулами 2 и 3, содержат заместитель в бензимидазольном фрагменте, а именно группу СН3О (Формула 2, производные омепразола) или группу HF2CO (Формула 3, производные пантопразола). По этой причине реакция омепразола и пантопразола (представленных в упрощенном виде Формулой 5) с хлорсульфонильными соединениями Формулы 6 приводит к двум изомерным соединениям, каждое из которых охватывается объемом изобретения. Обычно, но не обязательно, эти два изомера образуются при реакции приблизительно в отношении 1: 1, и для данного изобретения было установлено, что биологическая активность, растворимость и особенно стабильность при этом могут различаться, в некоторых случаях значительно. Хотя при необходимости изомеры могут быть отделены один от другого с помощью современных методов разделения, таких как жидкостная хроматография высокого давления (ЖХВД), разработан также более эффективный синтетический подход к синтезу конкретного изомера таких соединений. Реакционные схемы 1А и 1В раскрывают общие синтетические подходы к получению двух конкретных изомеров производных омепразола данного изобретения. Подробные схемы синтеза предпочтительных конкретных изомеров производных омепразола согласно изобретению показаны и описаны в разделе конкретных примеров.
Согласно Реакционной схеме 1А 2-нитро-4-метоксианилин (доступный из Aldrich) взаимодействует с хлорсульфонильным соединением Формулы 9. Как и на Реакционной схеме 1, на Реакционных схемах 1А и 1В для простоты иллюстрации реагент Формулы 9 изображает арильную, гетероарильную или алкильную части Формулы (i) - на примере фенильной группы, и показывает одну группу R1 (как определено выше) и один эфир, приводящий к монокарбоновой кислоте. Однако специалистам в данной области нетрудно пон