Производные оксазолидинона
Иллюстрации
Показать всеНастоящее изобретение относится к некоторым замещенным оксазолидинонам. Описываются конкретные соединения, которые могут быть использованы в качестве противомикробных препаратов. Эти соединения могут быть противомикробными агентами, эффективными против ряда патогенов человека и животных, в том числе грамположительных аэробных бактерий, таких как множественнорезистентные стафилококки, стрептококки и энтерококки, а также анаэробных организмов, например, разновидностей Bacterioides spp.и Clostridia spp., и организмов, устойчивых к кислотам, таких как Mycobacterium tuberculosis, Mycobacterium avium и Mycobacterium spp. 5 табл.
Реферат
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к некоторым замещенным фенилоксазолидинонам и к способам их синтеза. Данное изобретение относится также к фармацевтическим композициям, содержащим соединения по настоящему изобретению, в качестве противомикробных препаратов. Эти соединения являются хорошими противомикробными агентами, эффективными против ряда патогенов человека и животных, в том числе грамположительных аэробных бактерий, таких как множественно-резистентные стафилококки, стрептококки и энтерококки, а также анаэробных организмов, например, разновидностей Bacterioides spp.и Clostridia spp., и организмов, устойчивых к кислотам, таких как Mvcobacterium tuberculosis, Mycobacterium avium и Mycobacterium spp.
УРОВЕНЬ ТЕХНИКИ
Повышение антибактериального сопротивления грамположительных бактерий является значительной проблемой в лечении. Хотя энтерококки обычно не являются вирулентными патогенами, было показано, что в сочетании с сопротивлением ванкомицину они приводят к смертности около 40%. Staphylococcus aureus, обычный послеоперационный патоген, имеет сопротивляемость к пенициллину вследствие вырабатывания пенициллиназы. Эта сопротивляемость была преодолена созданием различных пенициллиназостойких β-лактамов. Однако патоген ответил синтезированием модифицированного целевого протеина-2', связывающего пенициллин и приводящего к меньшему сродству к β-лактамным антибиотикам, и фенотипа, известного как Methicillin Resistant S. aureus (MRSA). Эти штаммы до последнего времени были восприимчивы к ванкомицину, который, несмотря на свои различные недостатки, стал предпочтительным лекарством от MRSA-инфекций. Streptococcus pneumoniae является основным патогеном, вызывающим пневмонию, синусит и менингит. До самого последнего времени он был чрезвычайно восприимчив к пенициллину. Тем не менее, недавно из разных точек земного шара появились сообщения о различных штаммах РВР 2' с различной чувствительностью к пенициллину.
Оксазолидиноны - это новый класс синтетических противомикробных агентов, которые убивают грамположительные патогены путем подавления самой ранней стадии протеинового синтеза. Оксазолидиноны ингибируют образование рибосомного инициирующего комплекса, связывая 30S- и 50S-субъединицы рибосом, что приводит к предотвращению образования инициирующего комплекса. Благодаря своему новому механизму действия эти соединения активны в отношении патогенов, устойчивых к другим клинически пригодным антибиотикам.
В заявке WO 93/23384 описаны фенилоксазолидиноны, содержащие замещенный диазиновый компонент, и их применение в качестве противомикробных препаратов.
В заявке WO 93/09103 описаны замещенные арил- и гетероарил- фенилоксазолидиноны, используемые в качестве противомикробных агентов.
В заявке WO 90/02744 описаны 5-индолинил-5β-амидометилоксазолидиноны, 3-(соединенный кольцо замещенный) фенил-5β-амидометилоксазолидиноны, которые применимы в качестве противомикробных агентов.
В европейской заявке №352781 фенил- и пиридил-замещенные фенилоксазолидиноны.
В европейской заявке №312000 описаны фенилметил- и перидинилметилзамещенные фенилоксазолидиноны.
В патенте США №5254577 описаны азотсодержащие гетероароматические кольца, прикрепленные к фенилоксазолидинону.
В патенте США №5547950 описаны фенилпиперазинилоксазолидиноны. Другие ссылки, описывающие различные оксазолидиноны: патенты США №№4801600 и 4921869; Gregory W.A., et al., J.Med.Chem., 32, 1673-81 (1989); Gregory W.A., et al., J.Med.Chem., 33, 2569-78 (1990); Wang С, et al., Tetrahedron, 45, 1323-26 (1989); Brittelli, et al., J.Med.Chem., 35, 1156 (1992); и Bio-organic and Medicinal Chemistry Letters, 9, pp.2679-2684, 1999.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Целью данного изобретения является синтезирование, идентификация и профилирование молекул оксазолидинона, которые будут обладать достаточной активностью в отношении множественно-резистентных грамположительных патогенов, подобных MRSA, VRE и PRSP. Некоторые из этих молекул обладают активностью в отношении штаммов MDR-TB и MAI, а другие обладают существенной активностью в отношении имеющих большое значение анаэробных бактерий.
Соединения по предлагаемому изобретению относятся по своей замещенной структуре кольца фенилоксазолидинона к соединениям, описанным в вышеуказанных ссылках, за исключением того, что предлагаемые соединения имеют диазиновый компонент, прикрепленный к фенилоксазолидинону, который далее замещен гетероциклическим соединением, арилом, замещенным арилом, гетероароматическим кольцом, поэтому эти соединения уникальны и обладают превосходной антибактериальной активностью.
Другой целью настоящего изобретения является создание способа получения новых производных фенилоксазолидинона, которые показали бы по сравнению с существующими соединениями значительно более высокую антибактериальную активность в отношении множественно-резистентных грамположительных патогенов, подобных MRSA, VRE и PRSP, и штаммов MDR-TB и MAI, чтобы обеспечить безопасное и эффективное лечение бактериальных инфекций.
Для достижения вышеуказанных целей и согласно замыслу описываемого сейчас в общих чертах изобретения предложен способ синтеза новых производных фенилоксазолидинона, представленных формулой I:
где
Т - гетероциклическое кольцо с числом членов от 5 до 7, арил или замещенный арил, связанные с кольцом С посредством мостика W; предпочтительные формы Т выбраны из арила и пятичленного гетероарила, которые имеют замещающую группу R, где R выбран из группы, состоящей из -CN, COR5, COOR5, N(R6, R7), CON(R6, R7), CH2NO2, NO2, CH2R8, CHR9, -CH=N-OR10, -C=CH-R5, где R5 выбран из Н и факультативно замещенных C1-C12алкила, С3-12циклоалкила, арила и гетероарила; R6 и R7 независимо выбраны из Н, факультативно замещенных C1-12алкила, С3-12циклоалкила, C1-6алкокси; R8 и R9 независимо выбраны из Н, C1-6алкила, F, Cl, Br, C1-12алкила, замещенного одним или более F, Cl, Br, I, OR4, SR4, N(R6, R7), где R4 выбран из Н, C1-12алкила, С3-12циклоалкила, C1-6алкокси, C1-6алкила, замещенного одним или более F, Cl, Br, I или ОН, R6 и R7 - те же, что определены ранее, a R10 выбран из Н и факультативно замещенных C1-12алкила, С3-12циклоалкила, C1-6алкокси, C1-6алкила, арила, гетероарила;
n - целое число от 0 до 3;
X - CH, CH-S, CH-O и N;
Y и Z независимо выбраны из группы, состоящей из водорода, C1-6алкила, С3-12циклоалкила, С0-3 мостиковых групп;
U и V независимо выбраны из группы, состоящей из факультативно замещенного C1-6алкила, F, Cl, Br, C1-12алкила, замещенного одним или более F, Cl, Br, I, предпочтительно U и V это водород или фтор;
W выбран из группы, состоящей из CH2, СО, CH2NH, -NHCH2, -CH2NHCH2, -CH2-N(R11)CH2-, CH2(R11)N-, CH(R11), S, CH2(CO), NH, где R11 - факультативно замещенные C1-12алкил, С3-12циклоалкил, C1-6алкокси, C1-6алкил, арил, гетероарил; а
R1 выбран из группы, состоящей из -NHC(=O)R2, где R2 - водород, C1-12алкил, С3-12циклоалкил, C1-6алкокси, C1-6алкил, замещенный одним или более F, Cl, Br, I или ОН; N(R3, R4), -NR2C(=S)R3, -NR2C(=S)SR3, где R2 - то же, что определено ранее, R3 и R4 независимо выбраны из Н, С1-2алкила, С3-12циклоалкила, C1-6алкокси, C1-6алкила, замещенного одним или более F, Cl, Br, I или ОН.
Предпочтительные соединения формулы I имеют R1 в качестве ацетамида, а наиболее предпочтительные соединения этого ряда могут быть получены в качестве оптически чистых энантиомеров, имеющих согласно обозначениям Каха-Ингольда-Прелога (S)-конфигурацию С5-кольца оксазолидинона. (S)-энантиомер этого ряда соединений предпочтителен, так как он обладает в два раза большей антибактериальной активностью по сравнению с соответствующим рацемическим соединением. Отдельные изомеры и композиция энантиомеров структурной формулы I также охватываются данным изобретением.
Еще более предпочтительные соединения формулы I, содержащие кольцо D в качестве кольцевых систем фуранила, тиенила и пирролила и замещенные дополнительно заместителями Q и Р, представлены формулой II:
где
U и V независимо выбраны из группы, состоящей из факультативно замещенного C1-6алкила, F, Cl, Br, C1-12алкила, замещенного одним или более F, Cl, Br, I, предпочтительно U и V это водород или фтор;
X - CH, CH-S, CH-O и N;
Y и Z независимо выбраны из группы, состоящей из водорода, C1-6алкила, С3-12циклоалкила, С0-3 мостиковых групп;
W выбран из группы, состоящей из CH2, CO, CH2NH, -NHCH2, -CH2NHCH2, -CH2-N(R11)CH2-, CH2(R11)N-, CH(R11), S, CH2(CO), NH, где R11 - факультативно замещенные C1-12алкил, С3-12циклоалкил, C1-6алкокси, C1-6алкил, арил, гетероарил.
Предпочтительными соединениями формулы II по настоящему изобретению являются те, в которых Q и Р независимо выбраны из группы, состоящей из -CN, COR5, COOR5, N(R6, R7), CON(R6, R7), CH2NO2, NO2, CH2R8, CHR9, -CH=N-OR10, C=CH-R5, где R5 выбран из группы, состоящей из Н и факультативно замещенных С1-12алкила, С3-12циклоалкила, арила или гетероарила; R6 и R7 независимо выбраны из Н и факультативно замещенных C1-12алкила, С3-12циклоалкила, C1-6алкокси; R8 и R9 независимо выбраны из группы, состоящей из Н, C1-6алкила, F, Cl, Br, C1-12алкила, замещенного одним или более F, Cl, Br, I, OR4, SR4, N(R6, R7), где R10 - H, факультативно замещенные C1-12алкил, С3-12циклоалкил, C1-6алкокси, C1-6алкил, арил, гетероарил, кроме тех случаев, когда W=(СО), a Q и Р=Н.
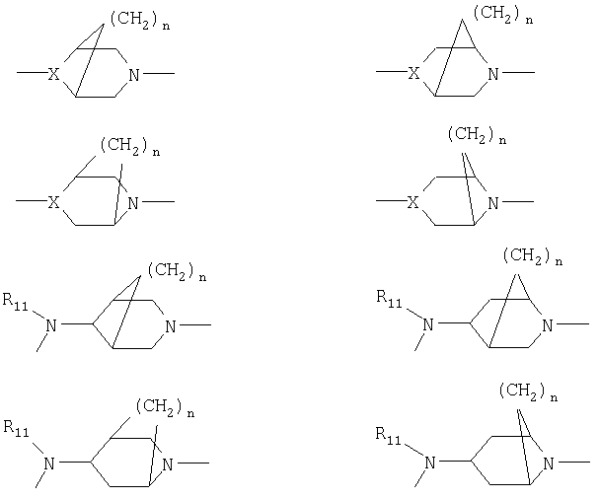
В более предпочтительных соединениях, представленных формулой II, кольцо С может иметь 6-8 членов, а кольца с большим числом членов могут иметь два или три атома углерода между каждым атомом азота, например:
Кольцо С может иметь мостиковые звенья с образованием бициклической системы, как показано ниже:
Варианты, когда кольцо С факультативно замещено в позициях Y и Z алкильными группами, циклоалкильными группами, фторсодержащей группой, карбоксильной группой и соответствующими сложными эфирами, амидами, замещенными алкилами или мостиковыми алкильными группами, показаны ниже:
Когда кольцо С имеет 6 членов, а Х это -CH-(NHR11), то предпочтительны следующие кольца, где R11 - то же, что определено ранее:
Кроме того, кольцо С может включать также следующие структуры:
Еще более предпочтительное соединение формулы II, в котором М является серой, представлено формулой III:
где
U и V независимо выбраны из факультативно замещенного C1-6алкила, F, Cl, Br, C1-12алкила, замещенного одним или более F, Cl, Br, I, предпочтительно U и V это водород или фтор;
Х - CH, CH-S, СН-O и N;
Y и Z независимо выбраны из группы, состоящей из водорода, C1-6алкила, С3-12циклоалкила, С0-3 мостиковых групп;
W выбран из группы, состоящей из СН2, СО, CH2NH, -NHCH2, -CH2NHCH2, -CH2-N(R11)CH2-, CH2(R11)N-, CH(R11), S, СН2(СО), NH, где R11 - факультативно замещенные C1-12алкил, С3-12циклоалкил, C1-6алкокси, C1-6алкил, арил, гетероарил;
a Q и Р независимо выбраны из группы, состоящей из -CN, COR5, COOR5, N(R6, R7), CON(R6, R7), CH2NO2, NO2, CH2R8, CHR9, -CH=N-OR10, C=CH-R5, где R5 выбран из группы, состоящей из Н, и факультативно замещенных C1-12алкила, С3-12циклоалкила, арила или гетероарила; R6 и R7 независимо выбраны из Н и факультативно замещенных C1-12алкила, С3-12циклоалкила и C1-6алкокси; R8 и R9 независимо выбраны из группы, состоящей из Н, C1-6алкила, F, Cl, Br, C1-12алкила, замещенного одним или более F, Cl, Br, I, OR4, SR4, N(R6, R7); R10-Н, факультативно замещенные C1-12алкил, С3-12циклоалкил, C1-6алкокси, C1-6алкил, арил, гетероарил, кроме тех случаев, когда W=(СО), а Q и Р=Н.
Более предпочтительные заместители Q, Р это нитрогруппа, альдегиды и галиды.
Предпочтительно W выбран из группы, состоящей из СН2, С(=O), С(=O)-С(=O), CH2NH, -NHCH2, -CH2NHCH2, -СН2-N(СН3)СН2-, СН2(CH3)N-, СН(СН3), S и СН2(С=O), -NH. Наиболее предпочтительны следующие соединения формулы III:
-(S)-N-[[3-[4-[4-(N-метил-N-2-тиенил(5-нитро)метил)аминопиперидин-1-ил]-3-фторфенил]-2-оксо-оксазолидин-5-ил]метил]ацетамид;
-(S)-N[[3-[3-фтор-4-[N-1[4-{2-(2-тиенил)дикарбонил}]пиперазинил]фенил]2-оксо-5-оксазолидинил]метил]ацетамид;
-(S)-N[[3-[3-фтор-4-[N-1[4-(5-нитро-2-тиеноил)]пиперазинил]фенил]2-оксо-5-оксазолидинил]метил]ацетамид гидрохлорид.
Следующие предпочтительные соединения формулы II, имеющие в кольце D атом кислорода, представлены формулой IV:
где
U и V независимо выбраны из факультативно замещенного C1-6алкила, F, Cl, Br, C1-12алкила, замещенного одним или более F, Cl, Br, I, предпочтительно U и V это водород или фтор;
X - CH, CH-S, CH-O и N;
Y и Z независимо выбраны из группы, состоящей из водорода, C1-6алкила, С3-12циклоалкила, С0-3 мостиковых групп;
W выбран из группы, состоящей из CH2, CO, CH2NH, -NHCH2, -CH2NHCH2, -CH2-N(R11)CH2-, CH2(R11)N-, CH(R11), S, CH2(CO), NH, где R11 - факультативно замещенные C1-12алкил, С3-12циклоалкил, C1-6алкокси, C1-6алкил, арил, гетероарил;
a Q и Р независимо выбраны из группы, состоящей из -CN, COR5, COOR5, N(R6, R7), CON(R6, R7), CH2NO2, NO2, CH2R8, CHR9, -CH=N-OR10, C=CH-R5, где R5 выбран из группы, состоящей из Н, факультативно замещенных C1-12алкила, С3-12циклоалкила, арила или гетероарила; R6 и R7 независимо выбраны из Н и факультативно замещенных C1-12алкила, С3-12циклоалкила и C1-6алкокси; R8 и R9 независимо выбраны из группы, состоящей из Н, C1-6алкила, F, Cl, Br, C1-12алкила, замещенного одним или более F, Cl, Br, I, OR4, SR4, N(R6, R7); R10-Н, факультативно замещенные C1-12алкил, С3-12циклоалкил, C1-6алкокси, C1-6алкил, арил, гетероарил, кроме тех случаев, когда W=(CO), a Q и Р=Н.
Более предпочтительные заместители Q и Р это нитрогруппа, альдегиды и галиды. Предпочтительно W выбран из группы, состоящей из СН2, С(=O), С(=O)-С(=O), CH2NH, -NHCH2, -CH2NHCH2, -СН2-N(СН3)СН2-, СН2(CH3)N-, СН(СН3), S, СН2(С=O) и -NH.
Наиболее предпочтительны следующие соединения формулы IV:
-(S)-N-[[3-фтор-4-[N-1[4-(5-нитро-2-фуроил)пиперазинил]фенил]-2-оксо-5-оксазолидинил]метил]ацетамид;
-(S)-N-[[3-[3-фтор-4-[N-1-[4-{2-фурил-(5-нитро)метил}]пиперазинил]фенил]-2-оксо-5-оксазолидинил]метил]ацетамид;
-(S)-N-[[3-[4-[4-(N-метил-N-(5-нитро-2-фуроил)аминопиперидин-1-ил]-3-фторфенил]-2-оксо-оксазолидин-5-ил]метил]ацетамид;
-(S)-N-[[3-[4-[4-(N-метил-N-2-фурил(5-нитро)метил)аминопиперидин-1-ил]-3-фторфенил]-2-оксо-оксазолидин-5-ил]метил]ацетамид.
Соединения по настоящему изобретению пригодны в качестве антимикробных агентов, эффективных в отношении ряда патогенов человека и животных, в частности аэробных грамположительных бактерий, включая множественно-резистентных к антибиотикам стафилококков и стрептококков, а также анаэробных организмов, например Mycobacterium tuberculosis и других видов микобактерий.
Инертные фармацевтически приемлемые носители для приготовления фармацевтических композиций из соединений по настоящему изобретению могут быть твердыми или жидкими. Твердые формы препаратов включают в себя порошки, таблетки, дисперсные гранулы, капсулы, облатки, суппозитории и мази. Твердый носитель может состоять из одного или нескольких веществ, которые могут действовать как растворители, вкусовые агенты, солюбилизаторы, смазки, суспендирующие агенты, связующие или дезинтегрирующие агенты; он может быть также тонко диспергированным веществом, смешанным с тонко диспергированным активным составом. Для приготовления таблеток активный состав смешивают в соответствующих пропорциях с носителем, обладающим необходимыми связывающими свойствами, и прессуют в форму требуемого вида и размера. Порошки и таблетки содержат предпочтительно около 5-70% активного ингредиента. Подходящими твердыми носителями являются лактоза, пектин, декстрин, крахмал, желатин, трагакант, низкоплавкий воск, масло какао и т.п. Термин «приготовление» означает составление активного соединения с капсулирующим материалом в качестве носителя с получением капсулы, в которой активный компонент (с другими носителями или без них) окружен связанным с ним таким образом носителем. Капсулы можно использовать также в качестве твердых дозовых форм, пригодных для орального применения.
Жидкие препараты включают в себя растворы, суспензии и эмульсии. В качестве примера можно отметить водные или водно-пропиленовые растворы для парентерального введения. Такие растворы готовят приемлемыми для биологических систем (изотоничность, рН, и т.д.). Жидкие препараты можно также составлять в водном полиэтиленгликолевом растворе. Водные растворы, пригодные для орального применения, можно готовить растворением активного компонента в воде с добавлением по желанию и подходящих красителей, ароматизаторов, стабилизаторов и загустителей. Пригодную для орального применения водную суспензию можно получить диспергированием тонко диспергированного компонента в воде с вязким материалом, т.е. натуральными или синтетическими каучуками, смолами, метилцеллюлозой, натриевой солью карбоксиметилцеллюлозы и другими широко известными суспендирующими агентами.
Мазевые препараты имеют в своем составе содержащие тяжелые металлы соли соединения формулы I с физиологически приемлемым носителем. Желательно, чтобы носителем был обычный водно-дисперсный гидрофильный или водомасляный носитель, в частности обычная полумягкая или кремоподобная, водно-дисперсная или растворимая в воде водомасляная эмульсия, поражающая поверхность с минимальным дискомфортом. Подходящие композиции могут быть получены всего лишь введением путем однородного смешивания тонко диспергированных соединений в гидрофильный носитель, основу или мазь.
Фармацевтический препарат предпочтительно готовят в порционной форме, когда он разделен на порции, содержащие целесообразные количества активного компонента. Порционная форма может находиться в упаковке в виде отдельных капсул, порошков в пузырьках или ампулах, мазей в баночках, облаток, таблеток, гелей или кремов и может содержать подходящее количество этих любых расфасованных форм.
Количество активного соединения в порции препарата может варьироваться в диапазоне от менее одного мг до 100 мг в соответствии с конкретным применением и эффективностью активного ингредиента.
При терапевтическом использовании этих соединений в качестве агентов для лечения бактериальных инфекций по фармацевтическому способу согласно данному изобретению эти соединения применяются ежедневно в начальной дозе от около 3 мг до около 40 мг на килограмм. Однако эта дозировка может варьироваться в зависимости от потребности пациента и применяющегося соединения. Правильную дозу для конкретной ситуации устанавливают в пределах меньших доз, которые меньше оптимальной дозы. При небольших увеличениях дневной дозы до получения оптимального эффекта ее можно по желанию разделить и применять частями в течение дня.
Для достижения вышеуказанных целей и согласно замыслу описываемого сейчас в общих чертах изобретения предложен способ синтеза соединений формул I, II, III и IV. Вдобавок широко известными методами с помощью неорганических или органических кислот могут быть получены фармацевтически приемлемые нетоксичные кислые соли соединений формул I, II, III и IV по настоящему изобретению.
Настоящее изобретение охватывает также пролекарства соединений формул I, II, III и IV. В целом, такие пролекарства являются функциональными производными этих соединений, легко преобразуемыми in vivo в определенные соединения. Известны традиционные процедуры выбора и получения подходящих пролекарств.
Изобретение включает в себя также фармацевтически приемлемые соли, энантиомеры, диастереомеры, N-окислы, пролекарства, метаболиты в сочетании с фармацевтически приемлемым носителем и факультативным наполнителем.
Другие цели и преимущества изобретения излагаются в нижеследующем описании и отчасти будут понятны из него или могут быть узнаны при осуществлении изобретения. Задачи и преимущества изобретения могут быть реализованы и получены с помощью механизма и сочетания реакций, раскрытых в прилагаемой формуле изобретения.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Соединения по настоящему изобретению могут быть получены последовательностями реакций, показанных на нижепредставленных схемах.
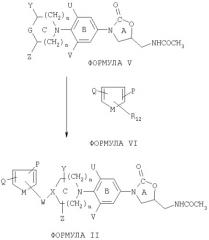
В основном пять различных аминов формулы V
обозначенных как пять разных структур, а именно
-(S)-N-[[3-[3-фтор-4-(N-пиперазинил)фенил]-2-оксо-5-оксазолидинил]метил]ацетамид (структура I);
-(S)-N-[[3-[3-фтор[4-[3-(1α,5α,6α)-6-[N-метил]амино]-3-азабицикло-[3.1.0]гексан]фенил]-2-оксо-5-оксазолидинил]метил]ацетамид (структура II);
-(S)-N-[[3-[3-фтор[4-[3-(1α,5α,6α)-6-[N-метил]аминометил]-3-азабицикло-[3.1.0]гексан]фенил]-2-оксо-5-оксазолидинил]метил]ацетамид (структура III);
-(S)-N-[[3-[4-[4-N-метиламинопиперидин-1-ил]-3-фторфенил}-2-оксо-оксазолидин-5-ил]метилацетамид (структура IV); и
-(S)-N-[[3-[3[фтор-4-(N-1-гомопиперазинил)фенил]-2-оксо-5-оксазолидинил]метил]ацетамид (структура V)
были использованы в целях моделирования.
Ключевые промежуточные амины формулы V для приготовления аналогов были получены из коммерчески доступных реагентов, причем G в аминах формулы V это NH, CH(NHR), -CH-CH2NHR; где R это Н, этил, метил, изопропил, ацетил, циклопропил, алкокси или ацетил, a U, V, Y и Z - то же, что в формуле II. Некоторые амины формулы V уже известны в литературе и на их получение даны ссылки, а если они получены впервые или посредством разных процедур или видоизменением известной процедуры, то они подробно описаны в экспериментальной части описания.
Оптически чистые амины формулы V можно получить одним из асимметричных синтезов или альтернативно выделением соли, получаемой из рацемической смеси путем селективной кристаллизации с помощью подходящей оптически активной кислоты, например тартрата дибензоила или 10-камфорсульфоновой кислоты, с последующей обработкой основанием для обеспечения оптической чистоты амина.
Соединения по настоящему изобретению, представленные общей формулой I, можно получить реакцией по схеме I:
СХЕМА I
Для получения соединения данной формулы I по схеме I гетероароматическая группа с соответствующим радикалом может быть присоединена к атому азота в кольце С соединений формулы V одним из описанных ниже способов, при этом R12 это широко известный специалистам остаток, такой как фтор, хлор, бром, SCH3, -SO2СН3, -SO2CF3 или ОС6Н5 и т.д., a G в аминах формулы V означает NH, CH(NHR13), -СН-CH2NHR13, где R13 это Н, этил, метил, изопропил, ацетил, циклопропил, алкокси или ацетил, a U, V, Y и Z - то же, что в более ранней формуле I.
Имеющий структуру формулы V амин взаимодействует с гетероароматическим соединение формулы R-T-W-R12, где R, Т, W - те же, что в более ранней формуле I. Для получения соединений формулы I, когда W это СН2, в течение процесса гидроаминирования может быть использован и прикреплен к амину формулы V соответствующий альдегид.
Аналогично этому для получения соединения формулы I, когда W это С=O, может быть использована соответствующая кислота, а амин формулы V может быть ацилирован активированным сложным эфиром в присутствии конденсирующих агентов, таких как 1,3-дициклогексилкарбодиимид (DCC) и 1-(3-диметиламинопропил)-3-этилкарбодиимид (EDC). Можно применять и другие методы ацилирования.
Альтернативно соединения с карбонильным звеном можно получить взаимодействием гетероароматического соединения формулы VI, например N-метилпиррола, с промежуточным амином формулы V в присутствии трифосгена или фосгена.
Карбонильные звенья также могут быть введены между гетероароматическим соединением, например 3-бромотиофеном, и амином формулы V при помощи одноокиси углерода и катализатора, например Pd(PPh3)Cl2. Пирролы с удлиненной цепочкой, имеющие дикарбонильные звенья, могут быть получены также взаимодействием оксалилхлорида и амина формулы V.
Восстановление карбонильных звеньев с использованием стандартных восстановителей приводит к образованию метиленовых звеньев.
Получение соединения формулы I, представленной в виде формулы II (где гетероциклическое соединение является пятичленным кольцом), осуществляется по нижеприведенным примерам тремя методами А, В и С, как показано на схеме II:
СХЕМА II
Метод А:
Амин формулы V реагирует с гетероароматическим соединением формулы VI, имеющим R12 в качестве остатка, охарактеризованного ранее для схемы I. Q, Р и М такие же, как для формулы II.
Для получения соединений формулы I реакция проводится в подходящем растворителе, например диметилформамиде, диметилацетамиде, этаноле или этиленгликоле, при соответствующей температуре в диапазоне от -70 до 80°С. В некоторых случаях для повышения выхода реакции полезно присутствие подходящего основания, например триэтиламина, диизопропиламина, карбоната калия, бикарбоната натрия.
Метод В:
Гидроалкилирование промежуточного амина формулы V соответствующими гетероциклическими альдегидами формулы VI, например фуральдегидом (Q, Р=Н, М=О; R12 это СНО), с использованием широко известных специалистам восстановителей, например триацетоксиборогидрида натрия или цианборогидрида натрия, дает продукты формулы II, где W=CH2, как показано на схеме II.
Метод С:
Ацилирование промежуточных аминов формулы V гетероциклической кислотой формулы VI, например 2-фуранкарбоновой кислотой (Q, Р=Н; М=О, R12=СООН) дает продукт формулы II, где W=СО, как показано на схеме II, где U, V, Y, Z, X, W, М, Р, Q и R12 те же.
-(S)-N[[3-[3-фтор-4-[Н-1[4-(5-нитро-2-тиенол)]пиперазинил]фенил]2-оксо-5-оксазолидинил]метил]ацетамид гидрохлорид был получен с использованием этого метода.
Альтернативно соединения, имеющие карбонильные звенья, можно получать взаимодействием гетероароматического соединения формулы VI, например N-метилпиррола, с промежуточным амином формулы V в присутствии трифосгена или фосгена. Карбонильные звенья можно вводить также между гетероаромагическим соединением, например 3-бромтиофеном, и амином формулы V посредством одноокиси углерода и катализатором, например Pd(PPh3)Cl2. Имеющие дикарбонильные звенья пирролы с удлиненной цепочкой можно получать также взаимодействием оксалилхлорида и амина формулы V.
Восстановление карбонильных звеньев с использованием стандартных восстановителей приводит к образованию метиленовых звеньев.
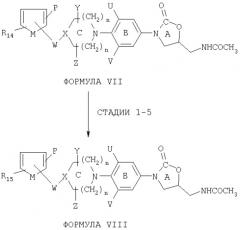
СХЕМА III
Соединения, полученные по схеме I и представленные формулой VII,
были затем использованы в качестве исходных соединений для дальнейшего получения производных, как представлено схемой III, где U, V, Y, Z, X, W, P, Q, n и М те же, как определено ранее. Группа R14 была трансформирована на стадиях 1-5 в преобразованную группу R15 конечных соединений формулы VIII,
где U, V, Y, Z, n, X, W, P и М те же, как определено ранее. В большинстве случаев группа R14 исходных соединений были соединениями, содержащими альдегид и кетоны.
На схемах IIIA, IIIB и IIIC приведены примеры следующих соединений.
СХЕМА III A
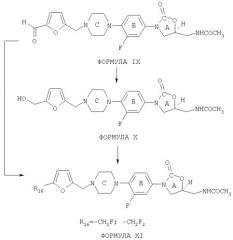
(S)-N[[3-[3-фтор-4-[N-1{2-фурил-[4-(5-гидроксиметил)метил}]пиперазинил]-2-оксо-5-оксазолидинил]метил]ацетамид, представленный формулой X, был получен восстановлением альдегида формулы IX борогидридом натрия.
(S)-N-[[3-[3-фтор-4-[N-1{2-фурил-[4-(5-фторметил)метил}]пиперазинил]-2-оксо-5-оксазолидинил]-метил]ацетамид формулы XI (R16=CH2F) был получен реакцией (S)-N-[[3-[3-фтор-4-[N-1{2-фурил-[4-(5-гидроксиметил)метил}]пиперазинил]-2-оксо-5-оксазолидинил]метил]ацетамида формулы Х с диэтиламиносератрифторидом.
(S)-N-[[3-[3-фтор-4-[N-1{2-фурил-[4-(5-дифторметил)метил}]пиперазинил]-2-оксо-5-оксазолидинил]-метил]ацетамид формулы XI (R16=CH2F2) был получен реакцией (S)-N-[[3-фтор-4-[N-1[4-{2-фурил(5-формил)метил}]пиперазинил]фенил]-2-оксо-5-оксазолидинил]метил]ацетамида формулы IX с диэтиламиносератрифторидом, как показано на схеме IIIA.
СХЕМА III В
(S)-N-[[3-фтор-4-[N-1[4-{2-фурил(5-формил)метил}]пиперазинил]фенил]-2-оксо-5-оксазолидинил]метил]ацетамид формулы IX взаимодействовал с гидроксиламином и гидразингидратом, образуя (S)-N-[[3-[3-фтор-4-[N-1-[4-(2-фурил-(5-альдоксим)метил}]пиперазинил]фенил]-2-оксо-5-оксазолидинил]метил]ацетамид формулы XII и (S)-N-[[3-[3-фтор-4[N-1-[4-{2-фурил-(5-гидразон)метил}]пиперазинил]-фенил]-2-оксо-5-оксазолидинил]-метил]ацетамид формулы XII
(S)-N-[[3-[3-фтор-4-[N-1[4-{2-фурил(5-альдоксим(метил-4-(N-карбоксиаминофенилацетат)метил}]пиперазинил]фенил]-2-оксо-5-оксазолидинил]метил]-ацетамид формулы XII был получен из (S)-N-[[3-[3-фтор-4-[N-1-[4-(2-фурил-(5-альдоксим)метил}]пиперазинил]фенил]-2-оксо-5-оксазолидинил]метил]ацетамида формулы XII и взаимодействовал с изоцианатом.
(S)-N[[3-[3-фтор-4-[N-1[4-{2-фурил(5-циан)метил}]пиперазинил]фенил]-2-оксо-5-оксазолидинил]метил]ацетамид формулы XII (R17=CN) был получен из (S)-N-[[3-[3-фтор-4-[N-1[4-{2-фурил(5-альдоксим)метил}]пиперазинил]фенил]-2-оксо-5-оксазолидинил]метил]ацетамида формулы XII с использованием ангидрида трифторметансульфокислоты и триэтиламина.
(S)-N-[[3-фтор-4-[N-1[5-1,3-диоксан)-2-фурилметил]пиперазинил]фенил]-2-оксо-5-оксазолидинил]метил]ацетамид формулы XII был получен с использованием (S)-N-[[3-фтор-4-[N-1[4-{2-фурил(5-формил)метил}]пиперазинил]фенил]-2-оксо-5-оксазолидинил]метил]ацетамида формулы IX с 1,3-пропандиолом и BF3 эфиратом.
СХЕМА III С
(S)-N[[3-фтор-4-[N-1[4-{2-фурил(5-карбокси)метил}]пиперазинил]фенил]-2-оксо-5-оксазолидинил]метил]ацетамид формулы XIII был получен с использованием (S)-N-[[3-фтор-4-[N-1[4-{2-фурил(5-формил)метил}]пиперазинил]фенил]-2-оксо-5-оксазолидинил]-метил]ацетамида формулы IX путем окисления с помощью Ag2O.
[[3-фтор-4-[N-1[5-(формамидо)-2-фурилметил]пиперазинил]фенил]-2-оксо-5-оксазолидинил]метил]ацетамид формулы XIV () был получен реакцией
(S)-N-[[3-фтор-4-[N-1[4-(2-фурил-(5-карбоксиэтил)метил)пиперазинил]фенил]-2-оксо-5-оксазолидинил]метил]ацетамида с водным аммиаком.
(S)-N[[3-фтор-4-[N-1[5-(4-(трет-бутоксикарбонил)аминопиперидин)-2-фурилметил]пиперазинил]фенил]-2-оксо-5-оксазолидинил]метил]ацетамид формулы XIV () был получен реакцией (S)-N-[[3-фтор-4-[N-1[4-(2-фурил-(5-карбокси)метил)пиперазинил]фенил]-2-оксо-5-оксазолидинил]метил]ацетамида формулы XIII с тионилхлоридом и 4-(трет-бутоксикарбонил)аминопиперидином.
(S)-N-[[3-фтор-4-[N-1[5-(морфолин-1-карбонил)-2-фурилметил]пиперазинил]-фенил]-2-оксо-5-оксазолидинил]метил]ацетамид формулы XIV () был получен реакцией (S)-N-[[3-фтор-4-[N-1[4-(2-фурил-(5-карбокси)метил)пиперазинил]фенил]-2-оксо-5-оксазолидинил]метил]ацетамида формулы XIII с морфолином в присутствии оксалилхлорида.
Осуществленные преобразования описаны в экспериментальной части описания. Должно быть понятно, что в вышеуказанных методах синтеза, для которых были упомянуты конкретные кислоты, основания, растворители, катализаторы, окислители, восстановители и т.д., можно использовать и другие кислоты, основания, растворители, катализаторы, окислители, восстановители и т.д. Температура восстановления и продолжительность реакции могут устанавливаться также в соответствии с потребностями. Пояснительный перечень отдельных соединений по изобретению, которые можно получить по вышеуказанным схемам, включает в себя:
1. (S)-N-[[3-фтор-4-[N-1-[4-(2-фуроил)пиперазинил]]фенил]-2-оксо-5-оксазолидинил] метил]ацетамид
2. (S)-N-[[3-[3-фтор-4-[N-1[4-{2-фурил(5-формил)метил}]пиперазинил]фенил]-2-оксо-5-оксазолидинил]метил]ацетамид
3. (S)-N-[[3-фтор-4-[N-1[4-(2-фурил-(5-карбоксиэтил)метил)пиперазинил]фенил]-2-оксо-5-оксазолидинил]метил]ацетамид
4. (S)-N-[[3-фтор-4-[N-1[4-(5-бром-2-фуроил)]пиперазинил]фенил]-2-оксо-5-оксазолидинил]метил]ацетамид
5. (S)-N-[[3-фтор-4-[N-1[4-(5-хлорметил-2-фуроил)пиперазинил]фенил]-2-оксо-5-оксазолидинил]метил]ацетамид
6. (S)-N-[[3-фтор-4-[N-1[4-(5-нитро-2-фуроил)пиперазинил]фенил]-2-оксо-5-оксазолидинил]метил]ацетамид
7. (S)-N[[3-[3-фтор-4-[N-1[4-{2-(2-тиенил)дикарбонил}]пиперазинил]фенил]2-оксо-5-оксазолидинил]метил]ацетамид
8. (S)-N[[3-[3-фтор-4-[N-1[4-(3-фуроил)]пиперазинил]фенил]2-оксо-5-оксазолидинил]метил]ацетамид
9. (S)-N[[3-[3-фтор-4-[N-1[4-{2-фурил(5-бром)метил}]пиперазинил]фенил]2-оксо-5-оксазолидинил]метил]ацетамид
10. (S)-N[[3-[3-фтор-4-[N-1[4-{2-тиенил(5-хлор)метил}]пиперазинил]фенил]2-оксо-5-оксазолидинил]метил]ацетамид
11. (S)-N[[3-[3-фтор-4-[N-1[4-(2-фурилметил)]пиперазинил]фенил]2-оксо-5-оксазолидинил]метил]ацетамид
12. (S)-N-[[3-[3-фтор-4-[N-1[4-(2-тиенилметил)]пиперазинил]фенил]-2-оксо-5-оксазолидинил]метил]ацетамид
13. (S)-N[[3-[3-фтор-4-[N-1[4-(2-тиенилацетил)]пиперазинил]фенил]2-оксо-5-оксазолидинил]метил]ацетамид
14. (S)-N-[[3-[3-фтор-4-[N-1[4-{2-тиенил(4-бром)метил}]пиперазинил]фенил]-2-оксо-5-оксазолидинил]метил]ацетамид
15. (S)-N-[[3-[3-фтор-4-[N-1-[4-{2-фурил-(5-нитро)метил}]пиперазинил]фенил]-2-оксо-5-оксазолидинил]метил]ацетамид
16. Хлористая соль (S)-N-[[3-фтор-4-[N-1[4-{2-фурил(5-нитро)метил}]пиперазинил]фенил]-2-оксо-5-оксазолидинил]метил]ацетамида
17. Цитрат (S)-N-[[3-фтор-4-[N-1[4-{2-фурил(5-нитро)метил}]пиперазинил]фенил]-2-оксо-5-оксазолидинил]метил]ацетамида
18. (S)-N[[3-[3-фтор-4-[N-1[4-(2-пирролилметил}]пиперазинил]фенил]2-оксо-5-оксазолидинил]метил]ацетамид
19. (S)-N[[3-[3-фтор-4-[N-1[4-{2-тиенил(3-метил)метил}]пиперазинил]фенил]2-оксо-5-оксазолидинил]метил]ацетамид
20. (S)-N[[3-[3-фтор-4-[N-1[4-(3-фурилметил}]пиперазинил]фенил]2-оксо-5-оксазолидинил]метил]ацетамид
21. (S)-N[[3-[3-фтор-4-[N-1[4-{2-тиенил(5-метил)метил}]пиперазинил]фенил]2-оксо-5-оксазолидинил]метил]ацетамид
22. (S)-N[[3-[3-фтор-4-[N-1[4-{2-пиррол(1-метил)метил}]пиперазинил]фенил]2-оксо-5-оксазолидинил]метил]ацетамид
23. (S)-N[[3-[3-фтор-4-[N-1[4-{2-тиенил(5-нитро)метил}]пиперазинил]фенил]2-оксо-5-оксазолидинил]метил]ацетамид
24. (S)-N[[3-[3-фтор-4-[N-1[4-[2-фурил{5-(N-тиоморфолинил)метил}метил]пиперазинил]фенил]2-оксо-5-оксазолидинил]метил]ацетамид
25. (S)-N[[3-[3-фтор-4-[N-1[4-[2-фурил{5-(N-морфолинил)метил}метил]]пиперазинил]фенил]-2-оксо-5-оксазолидинил]метил]ацетамид
26. (S)-N-[[3-фтор-4-[N-1[4-{2-фурил(5-ацетоксиметил)метил}]пиперазинил]фенил]-2-оксо-5-оксазолидинил]метил]ацетамид
27. (S)-N-[[3-фтор-4-[N-1[4-{2-тиенил(5-бром)метил}]пиперазинил]фенил]-2-оксо-5-оксазолидинил]метил]ацетамид
28. (S)-N-[[3-фтор-4-[N-1[4-(5-нитро-2-фурилметил)пиперазинил]фенил]-2-оксо-оксазолидинил]метил]дихлорацетамид
29. (S)-N[[3-[3-фтор-4-[N-1[4-(5-нитро-2-тиенол)]пиперазинил]фенил]2-оксо-5-оксазолидинил]метил]ацетамид гидрохлорид
30. (S)-N[[3-[3-фтор-4-[N-1[4-(2',2'-дифенил-2'-гидроксиацетил)]пиперазинил]фенил]2-оксо-5-оксазолидинил]метил]ацетамид
31. (S)-N-[[3-[3-фтор[4-[3-(1α,5α,6α)-6-[N-(5-нитро-2-фуроил)-N-метил]амино]-3-азабицикло-[3.1.0]гексан]фенил]-2-оксо-5-оксазолидинил]метил]ацетамид
32. (S)-N-[[3-[3-фтор[4-[3-(1α,5α,6α)-6-[N-(3-фуроил)-N-метил]амино]-3-азабицикло-[3.1.0]