Производные сульфонамида, их получение и применение в качестве лекарственных средств
Иллюстрации
Показать всеИзобретение относится к новым производным сульфонамида общей формулы (I)
где А означает заместитель, выбранный из: 5- или 6-членного гетероароматического кольца, содержащего 1 или 2 гетероатома, выбранных из О, N или S, необязательно замещенных 1 или 2 атомами галогена, C1-C4 алкильным или фенильным радикалом или 5- или 6-членным гетероарильным радикалом, содержащим 1 или 2 атома О, N, S; бициклического гетероароматического кольца, содержащего от 1 до 3 гетероатомов, выбранных из О, N, S, необязательно замещенного 1 или 2 атомами галогена или C1-C4 алкилом; R1 означает Н, C1-C4 алкил, бензил; n имеет значение 0, 1, 2, 3 или 4; R2 означает NR4R5 или группу формулы:
, , , , ,
, , , ,
где пунктирная линия обозначает необязательную химическую связь; R3, R4 и R5 независимо означает Н или C1-C4 алкил; или одна из его физиологически приемлемых солей. Соединения 1 обладают антагонитической активностью в отношении 5-HT6 рецептора серотонина, что позволяет использовать их в фармацевтической композиции и для приготовления лекарственного средства. 8 н. и 2 з.п. ф-лы, 2 табл.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к новым производным сульфонамида общей формулы (I), их физиологически приемлемым солям, методикам их получения, а также их применению в качестве лекарственных средств для лечения человека и/или в ветеринарной терапии и фармацевтическим композициям, которые их содержат.
Новые соединения, которые являются объектом настоящего изобретения, могут использоваться в фармацевтической промышленности в качестве промежуточных соединений и для получения лекарственных средств.
Уровень техники
Суперсемейство серотониновых рецепторов (5-НТ) включает 7 классов (5-HT1-5-НТ7), включающих 14 человеческих подклассов [D.Hoyer, et al., Neuropharmacology, 1997, 36, 419]. 5-НТ6 рецептор представляет собой последний из рецепторов серотонина, идентифицированных молекулярным клонированием как у крыс [F.J. Monsma, et al., Mol. Pharmacol., 1993, 43, 320; M. Ruat, et al., Biochem. Biophys. Res. Commun., 1993, 193, 268], так и у человека [R. Kohen, et al., J. Neurochem., 1996, 66, 47]. Соединения с антагонистической активностью к 5-НТ6 рецептору являются полезными для лечения различного рода заболеваний центральной нервной системы и желудочно-кишечного тракта, таких как синдром раздражения кишечника. Соединения с антагонистической активностью к 5-НТ6 рецептору являются полезными при лечении беспокойства, депрессии и когнитивных нарушений памяти [M. Yoshioka, et al., Ann. NY Acad. Sd., 1998, 861, 244; A. Bourson, et al., Br. J. Pharmacol, 1998, 125, 1562; D.C. Rogers, et al., Br. J. Pharmacol. Suppl., 1999, 127, 22P; A. Bourson, et al., J. Pharmacol. Exp. Ther., 1995, 274, 173; A.J. Sleight, et al., Behav. Brain Res., 1996, 73, 245; T.A. Branchek, et al., Annu. Rev. Pharmacol. Toxicol, 2000, 40, 319; С. Routledge, et al., Br. J. Pharmacol., 2000, 130, 1606]. Было показано, что типичные и атипичные антипсихотические лекарственные средства для лечения шизофрении имеют большое сродство к 5-НТ6 рецепторам [B.L. Roth, et al., J. Pharmacol. Exp. Ther., 1994, 268, 1403; C.E. Glatt, et al., Mol. Med., 1995, 1, 398; F.J. Mosma, et al., Mol. Pharmacol., 1993, 43, 320; Т. Shinkai, et al., Am. J. Med. Genet., 1999, 88, 120]. Соединения с антагонистической активностью к 5-НТ6 рецептору являются полезными для лечения инфантильного гиперкинеза (ADHD, дефицита внимания/ гиперфункционального расстройства) [W.D. Hirst, et al., Br. J. Pharmacol., 2000, 130, 1597; С. Gerard, et al., Brain Research, 1997, 746, 207; M.R. Pranzatelli, Drugs of Today, 1997, 33, 379]. В публикации международной заявки WO 01/32646 описаны сульфонамиды с антагонистической активностью к 5-НТ6 рецептору, являющиеся бициклическими производными, где каждый из бициклов является 6-членным ароматическим или гетероароматическим. В ЕР 0733628 описаны сульфонамиды, производные индола, с антагонистической активностью к 5-HT1F рецептору, полезные для лечения мигреней. Таким образом, изучение уровня техники показывает, что небольшие структурные изменения приводят к увеличению количества соединений, являющихся агонистами или антагонистами различных серотониновых рецепторов, которые полезны при лечении различных заболеваний в зависимости от того, к какому из рецепторов наблюдается сродство.
После трудоемких исследований изобретатели осуществили синтез новых соединений общей формулы (I), проявляющих интересные биологические свойства, благодаря которым они являются особенно полезными для использования человеком и/или в ветеринарной терапии.
Детальное описание изобретения
Настоящее изобретение обеспечивает получение новых соединений с антагонистической активностью в отношении 5-НТ6 рецептора серотонина, полезных для производства лекарственных средств для профилактики или лечения различных заболеваний центральной нервной системы и, в частности, беспокойства, депрессии, когнитивных нарушений памяти и сенильной деменции или других процессов деменции, для которых характерен явный дефицит узнавания, психоз, инфантильный гиперкинез (ADHD, дефицит внимания/гиперфункционное расстройство) и другие заболевания, связанные с 5-НТ6 рецептором серотонина у млекопитающих, включая человека.
Соединения, соответствующие настоящему изобретению, имеют общую формулу (I)
где
А представляет собой заместитель, выбранный из:
- 5- или 6-членного гетероароматического кольца, содержащего 1 или 2 гетероатома, выбранных из кислорода, азота или серы, необязательно замещенного 1 или 2 атомами галогена, C1-C4 алкилом или фенилом, или 5- или 6-членным гетероарилом, содержащим 1 или 2 атома кислорода, азота или серы;
- бициклического гетероароматического кольца, содержащего от 1 до 3 гетероатомов, выбранных из кислорода, азота или серы, необязательно замещенного 1 или 2 атомами галогена или C1-C4 алкилом;
- группы, выбранной из:
R1 представляет собой водород, C1-C4 алкильный или бензильный радикал;
n имеет значения 0, 1, 2, 3 или 4;
R2 представляет собой -NR4R5 или группу формулы:
, , , , ,
, , , ,
где пунктирная линия означает необязательную химическую связь;
R3, R4 и R5 независимо представляют собой водород или C1-C4 алкил;
X, Y и Z независимо представляют собой водород, фтор, хлор, бром, C1-C4 алкил, C1-C4 алкокси, C1-C4 алкилтио, трифторметил, циано, нитро и -NR4R5;
W представляет собой связь между двумя кольцами, СН2, О, S и NR4;
m имеет значения 0, 1, 2, 3 или 4;
при условии, что когда m=0, А представляет собой замещенный фенил;
или представляют собой одну из физиологически приемлемых солей таких соединений.
Термин C1-C4 алкил означает линейную или разветвленную углеводородную цепь, содержащую от 1 до 4 атомов углерода, такую как метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил и трет-бутил.
Соединения по настоящему изобретению, которые соответствуют указанной выше формуле, могут быть выбраны из:
[1] N-[3-(2-диэтиламиноэтил)-1Н-индол-5-ил]-5-хлор-3-метилбензо[b]тиофен-2-сульфонамида,
[2] N-[3-(2-диэтиламиноэтил)-1Н-индол-5-ил]нафтален-1-сульфонамида,
[3] гидрохлорида N-[3-(2-диэтиламиноэтил)-1Н-индол-5-ил]нафтален-1-сульфонамида,
[4] N-[3-(2-диэтиламиноэтил)-1Н-индол-5-ил]-3,5-дихлорбензолсульфонамида,
[5] N-[3-(2-диэтиламиноэтил)-1Н-индол-5-ил]-4-фенилбензолсульфонамида,
[6] N-[3-(2-диэтиламиноэтил)-1Н-индол-5-ил]-5-хлортиофен-2-сульфонамида,
[7] N-[3-(2-диметиламиноэтил)-1Н-индол-5-ил]-5-хлор-3-метилбензо[b]тиофен-2-сульфонамида,
[8] N-[3-(2-диметиламиноэтил)-1Н-индол-5-ил]нафтален-1-сульфонамида,
[9] N-[3-(2-диметиламиноэтил)-1Н-индол-5-ил]-6-хлоримидазо[2,1-b]тиазол-5-сульфонамида,
[10] N-[3-(1-метилпиперидин-4-ил)-1Н-индол-5-ил]-5-хлор-3-метилбензо[b]тиофен-2-сульфонамида,
[11] N-[3-(1-метилпиперидин-4-ил)-1Н-индол-5-ил]-5-хлор-3-метилбензо[b]тиофен-2-сульфонамидгидрохлорида,
[12] N-[3-(1-метилпиперидин-4-ил)-1Н-индол-5-ил]нафтален-1-сульфонамида,
[13] N-[3-(1-метилпиперидин-4-ил)-1Н-индол-5-ил]нафтален-1-сульфонамидгидрохлорида,
[14] N-[3-(1-метилпиперидин-4-ил)-1Н-индол-5-ил]-5-хлортиофен-2-сульфонамида,
[15] N-[3-(1-метилпиперидин-4-ил)-1Н-индол-5-ил]-4-фенилбензолсульфонамида,
[16] N-[3-(1-метилпиперидин-4-ил)-1Н-индол-5-ил]хинолин-8-сульфонамида,
[17] N-[3-(2-диэтиламиноэтил)-1Н-индол-5-ил]нафтален-2-сульфонамида,
[18] N-[3-(1-метил-1,2,3,6-тетрагидропиридин-4-ил)-1Н-индол-5-ил]нафтален-1-сульфонамида,
[19] N-[3-(4-метилпиперазин-1-ил)метил-1Н-индол-5-ил]-5-хлор-3-метилбензо[b]тиофен-2-сульфонамида,
[20] N-[3-(2-диметиламиноэтил)-1Н-индол-5-ил]-5-(2-пиридил)тиофен-2-сульфонамида,
[21] N-[3-(2-диметиламиноэтил)-1Н-индол-5-ил]-2,1,3-бензотиадиазол-4-сульфонамида,
[22] N-[3-(2-диметиламиноэтил)-1Н-индол-5-ил]хинолин-8-сульфонамида,
[23] N-[3-(2-диметиламиноэтил)-1Н-индол-5-ил]-5-хлорнафтален-2-сульфонамида,
[24] N-[3-(2-диметиламиноэтил)-1Н-индол-5-ил]-4-феноксибензолсульфонамида,
[25] N-[3-(2-диметиламиноэтил)-1Н-индол-5-ил]-4-фенилбензолсульфонамида,
[26] N-[3-(2-диэтиламиноэтил)-1Н-индол-5-ил]-N-этил-нафтален-2-сульфонамида,
[27] N-{3-[2-(морфолин-4-ил)этил]-1Н-индол-5-ил}-5-хлор-3-метилбензо[b]тиофен-2-сульфонамида,
[28] N-{3-[2-(морфолин-4-ил)этил]-1Н-индол-5-ил}нафтален-1-сульфонамида,
[29] N-[3-(2-диэтиламиноэтил)-1Н-индол-5-ил]нафтален-2-сульфонамида,
[30] N-[3-диметиламинометил-1Н-индол-5-ил]-5-хлор-3-метилбензо[b]тиофен-2-сульфонамида,
[31] N-[3-(2-дипропиламиноэтил)-1Н-индол-5-ил]нафтален-1-сульфонамида,
[32] N-[3-(2-дипропиламиноэтил)-1Н-индол-5-ил]-5-хлор-3-метилбензо[b]тиофен-2-сульфонамида,
[33] N-[3-(2-дибутиламиноэтил)-1Н-индол-5-ил]-5-хлор-3-метилбензо[b]тиофен-2-сульфонамида,
[34] N-[3-(2-дибутиламиноэтил)-1Н-индол-5-ил]нафтален-1-сульфонамида,
[35] N-[3-(2-диэтиламиноэтил)-1Н-индол-5-ил]-5-хлорнафтален-1-сульфонамида,
[36] N-[3-(2-диэтиламиноэтил)-1Н-индол-5-ил]-транс-β-стиролсульфонамида,
[37] N-[3-(4-метилпиперазин-1-ил)метил-1Н-индол-5-ил]-транс-β-стиролсульфонамида,
[38] N-[3-(октагидроиндолизин-7-ил)-1Н-индол-5-ил]-5-хлор-3-метилбензо[b]тиофен-2-сульфонамида,
[39] N-[3-(2-диэтиламиноэтил)-1Н-индол-5-ил]-6-хлоримидазо[2,1-b]тиазол-5-сульфонамида,
[40] N-{3-[2-(морфолин-4-ил)этил]-1Н-индол-5-ил}нафтален-2-сульфонамида,
[41] N-[3-(4-метилпиперазин-1-ил)метил-1Н-индол-5-ил]-α-толуолсульфонамида,
[42] N-[3-(3-диэтиламинопропил)-1Н-индол-5-ил]нафтален-2-сульфонамида,
[43] N-[3-(3-диэтиламинопропил)-1Н-индол-5-ил]-5-хлор-3-метилбензо[b]тиофен-2-сульфонамида,
[44] N-{3-[2-(пирролидин-1-ил)этил]-1Н-индол-5-ил}-5-хлор-3-метилбензо[b]тиофен-2-сульфонамида,
[45] N-{3-[2-(пирролидин-1-ил)этил]-1Н-индол-5-ил}нафтален-1-сульфонамида,
[46] N-{3-[2-(пирролидин-1-ил)этил]-1Н-индол-5-ил}нафтален-2-сульфонамида,
[47] N-[3-(2-дипропиламиноэтил)-1Н-индол-5-ил]нафтален-2-сульфонамида,
[48] N-[3-(2-диметиламиноэтил)-1Н-индол-5-ил]-5-хлорнафтален-1-сульфонамида,
[49] N-[3-(2-диметиламиноэтил)-1Н-индол-5-ил]нафтален-2-сульфонамида,
[50] N-{3-[2-(морфолин-4-ил)этил]-1Н-индол-5-ил}хинолин-8-сульфонамида,
[51] N-{3-[2-(морфолин-4-ил)этил]-1Н-индол-5-ил}-4-фенилбензолсульфонамида,
[52] N-[3-(4-метилпиперазин-1-ил)этил-1Н-индол-5-ил]нафтален-2-сульфонамида,
[53] N-[3-(4-метилпиперазин-1-ил)этил-1Н-индол-5-ил]-5-хлорнафтален-1-сульфонамида.
Настоящее изобретение также относится к физиологически приемлемым солям соединений общей формулы (I), в частности к аддитивным солям неорганических кислот, таких как соляная, бромисто-водородная, фосфорная, серная, азотная кислоты, и органических кислот, таких как лимонная, малеиновая, фумаровая, винная кислота или их производные, п-толуолсульфоновая кислота, метансульфоновая кислота, камфорсульфоновая кислота, и так далее.
Новые производные общей формулы (I), где R1, R2, R3, R4, n и А имеют значения, указанные выше, могут быть получены в соответствии со следующими способами.
СПОСОБ А
Путем взаимодействия соединения общей формулы (II) или одного из его соответствующим образом защищенных производных
где А имеет значение, указанное для общей формулы (I), и Х представляет собой приемлемую уходящую группу, включая атом галогена, в частности хлор; с 5-аминоиндолом общей формулы (III) или одним из его соответствующим образом защищенных производных;
где n, R1, R2 и R3 имеют значения для общей формулы (I);
с получением соответствующего сульфонамида, с удалением при необходимости защитных групп и/или образованием фармакологически приемлемой соли.
Взаимодействие между соединениями общей формулы (II) и (III) осуществляют в присутствии органического растворителя, такого как алкиловый эфир, в частности диэтиловый эфир или циклоалкиловый эфир, в частности тетрагидрофуран или диоксан, галогенированный органический углеводород, в частности хлористый метилен или хлороформ, спирт, в частности метанол или этанол, апротонный диполярный растворитель, в частности ацетонитрил, пиридин или диметилформамид, или любой другой подходящий растворитель.
Взаимодействие предпочтительно осуществляют в присутствии подходящего неорганического основания, такого как гидроксиды и карбонаты щелочных металлов или в присутствии органического основания, в частности триэтиламина или пиридина.
Наиболее подходящий температурный диапазон реакции находится в интервале от 0°С до комнатной температуры, и время реакции находится в интервале между 5 минутами и 24 часами.
Полученный сульфонамид может быть выделен с помощью упаривания растворителя, добавления воды и в конечном счете регулирования значения рН так, чтобы сульфонамид был получен в виде твердого вещества, которое может быть выделено с помощью фильтрования; или он может быть экстрагирован с помощью растворителя, несмешивающегося с водой, таким как хлороформ, и очистки с помощью хроматографии или перекристаллизации из подходящего растворителя.
Соединения общей формулы (II) являются коммерчески доступными или могут быть получены в соответствии с обычными способами или с помощью аналогичных способов, описанных в уровне техники [Е.Е. Gilbert, Synthesis, 1969, 1, 3]. Соединения общей формулы (III) также могут быть получены в соответствии с обычными способами или с помощью аналогичных способов, описанных в уровне техники [J.E. Macor, R. Post и К. Ryan, Synt Comm., 1993, 23, 1, 65-72.; J. Guillaume, С. Dumont, J. Laurent и N. Nedelec, Eur. J. Med. Chem., 1987, 22, 33-43; M.L. Saccarello, R. Stradi, Synthesis, 1979, 727].
СПОСОБ В
Соединения общей формулы (I), где R1, R2, R4, n и А имеют значения, указанные выше, и R3 представляет собой С1-С4 алкил, могут быть получены с помощью алкилирования соединения общей формулы (I), где R1, R2, R4, n и А имеют вышеуказанные значения, и R3 представляет собой атом водорода с алкилгалоидом или диалкилсульфатом.
Взаимодействие предпочтительно осуществляют в присутствии подходящего основания, такого как гидроксиды и карбонаты щелочных металлов, гидриды металлов, алкоксиды, такие как метоксид натрия или трет-бутоксид калия, металлоорганические соединения, такие как бутиллития или трет-бутиллития, в присутствии органического растворителя, такого как алкиловый эфир, в частности диэтиловый эфир или циклоалкиловый эфир, в частности тетрагидрофуран или диоксан, углеводород, в частности толуол, спирт, в частности метанол или этанол, апротонный диполярный растворитель, в частности ацетонитрил, пиридин или диметилформамид, или любого другого подходящего растворителя. Наиболее подходящий интервал температур находится между 0°С и точкой кипения растворителя, и время реакции находится в интервале между 1 и 24 часами.
Полученный сульфонамид может быть выделен с помощью концентрирования фильтрата при пониженном давлении, добавления воды и, в конечном счете, регулирования значения рН так, чтобы сульфонамид был получен в виде твердого вещества, которое может быть выделено с помощью фильтрования, или он может быть экстрагирован растворителем, несмешивающимся с водой, таким как хлороформ, и очистки с помощью хроматографии или перекристаллизации из подходящего растворителя.
СПОСОБ С
При конденсировании соединения общей формулы (I), где R1, R3 и А имеют вышеуказанные значения, n=0 и R2 представляет собой атом водорода, с соответствующим образом замещенным 4-пиперидоном, получают соответствующее соединение общей формулы (I), где R1, R3 и А имеют значения, указанные выше, n=0 и R2 представляет собой соответствующим образом замещенный 1,2,3,6-тетрагидропиридин-4-ил.
Взаимодействие может протекать как в кислотной, так и в основной среде, в подходящем растворителе при температуре, лежащей в интервале между 25 и 150°С.
Подходящие основные условия включают неорганические основания, такие как гидроксид натрия или калия, или органические основания, такие как пирролидин или триэтиламин в растворителе, таком как метанол или этанол. Предпочтительно, растворение метоксида натрия в метаноле проводят при кипении с обратным холодильником. Время реакции находится в диапазоне от 1 до 48 часов.
Подходящие кислотные условия включают соляную кислоту в этаноле или трифторуксусную кислоту в уксусной кислоте при температуре, лежащей в интервале между 50 и 100°С и времени реакции, находящейся в диапазоне от 1 до 48 часов.
Полученный сульфонамид может быть выделен путем разбавления в воде и регулировании значения рН таким образом, чтобы получить сульфонамид в виде твердого вещества, которое может быть выделено с помощью фильтрования; или он может быть экстрагирован растворителем, несмешивающимся с водой, таким как хлороформ, и очищен с помощью хроматографии или с помощью перекристаллизации из подходящего растворителя.
Соединения общей формулы (I), где R1, R3 и А имеют значения, указанные выше, n=0 и R2 представляет собой атом водорода, могут быть получены в соответствии со способом А из 5-аминоиндола.
СПОСОБ D
Соединения общей формулы (I), где R1, R3 и А имеют значения, указанные выше, n=0 и R2, представляет собой соответствующим образом замещенный 4-пиперидинил, могут быть получены с помощью восстановления соединения общей формулы (I), где R1, R3 и А имеют значения, указанные выше, n=0 и R2 представляет собой соответствующим образом замещенный 1,2,3,6-тетрагидропиридин-4-ил, полученный в соответствии со способом С.
Гидрирование происходит с помощью металлического катализатора, такого как палладий, платина или родий, на подложке, такой как уголь, оксид алюминия или сульфат бария, предпочтительно, палладий на угле, с начальным значением давления водорода, находящегося в интервале между 1 и 10 атмосферами, предпочтительно между 2 и 5 атмосферами, в растворителе, таком как метанол или этанол. Время реакции находится в диапазоне от 1 часа до 3 дней.
Полученный сульфонамид может быть выделен путем отфильтровывания катализатора и концентрирования фильтрата при пониженном давлении. Выделенный продукт может быть использован как таковой или он может быть очищен с помощью хроматографии или с помощью перекристаллизации из подходящего растворителя.
СПОСОБ Е
Фармакологически приемлемые соли соединений общей формулы (I) традиционно могут быть получены при взаимодействии с неорганической кислотой, такой как соляная, бромисто-водородная, фосфорная, серная, азотная кислоты, или с органическими кислотами, такими как лимонная, малеиновая, фумаровая, винная кислоты или их производные, п-толуолсульфоновая кислота, метансульфоновая кислота, и так далее, в подходящем растворителе, таком как метанол, этанол, диэтиловый эфир, этилацетат, ацетонитрил или ацетон, и выделены с помощью обычных способов осаждения или кристаллизации соответствующих солей.
Во время любого из описанных путей синтеза или при получении используемых промежуточных соединений может быть необходимо и/или желательно защитить чувствительные или реакционноспособные группы в некоторых из используемых молекул. Это может быть осуществлено с помощью обычных защитных групп, таких как описаны в уровне техники [Protective groups in Organic Chemistry, ed J. F.W. McOmie, Plenum Press, 1973; T.W. Greene & P.G.M. Wuts, Protective Groups in Organic Chemistry, John Wiley & sons, 1991]. Защитные группы могут быть удалены на подходящей последней стадии с помощью известных способов.
Изобретение обеспечивает получение фармацевтических композиций, которые содержат в дополнение к приемлемому фармацевтическому наполнителю, по крайней мере, одно соединение общей формулы (I) или одну из его физиологически приемлемых солей. Изобретение также относится к применению соединения общей формулы (I) и его физиологически приемлемых солей при получении лекарственных средств, имеющих антагонистическую активность по отношению к 5НТ6 рецептору серотонина, полезных для профилактики или лечения различных заболеваний центральной нервной системы, и, в частности, беспокойства, депрессии, когнитивного расстройства памяти и процессов, связанных со старческим слабоумием и рядом других слабоумий, в которых преобладает дефицит узнавания, психозы, инфантильный гиперкинез (ADHD, дефицит внимания/ гиперфункциональное расстройство) и других заболеваний, связанных с 5-НТ6 рецептором серотонина у млекопитающих, включая человека.
Следующие примеры демонстрируют получение новых соединений в соответствии с изобретением. Также описаны сродство к 5НТ6 рецептору серотонина и галеновы составы, приемлемые для соединений в соответствии с настоящим изобретением. Примеры, представленные ниже, приведены только для целей иллюстрации и не должны так или иначе ограничить область изобретения.
СПОСОБ А
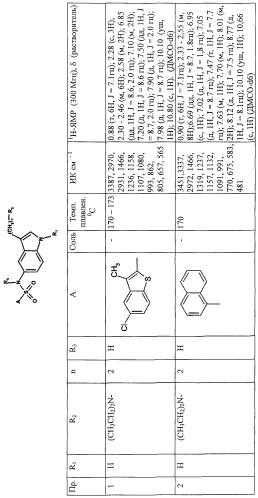
Пример 7. Получение N-[3-(2-диметиламиноэтил)-1Н-индол-5-ил]-5-хлор-3-метил-бензо[b]тиофен-2-сульфонамида
К раствору 3,05 г (15 ммоль) 5-амино-3-(2-диметиламиноэтил)-1Н-индола в 100 мл пиридина добавляют по каплям при комнатной температуре раствор 4,21 г (15 ммоль) 5-хлор-3-метил-бензо[b]тиофен-2-сульфонилхлорида в 20 мл пиридина. Реакционную смесь перемешивают при комнатной температуре в течение 20 часов. Затем ее выпаривают досуха, слегка подщелачивают разбавленным аммиаком и растворяют в этилацетате. Органическую фазу промывают водой и насыщенным раствором бикарбоната натрия, отделяют и высушивают над прокаленным сульфатом натрия. Органическую фазу выпаривают досуха и полученное твердое вещество повторно промывают этиловым эфиром, что дает на выходе 5,5 г (82%) N-[3-(2-диметиламиноэтил)-1Н-индол-5-ил]-5-хлор-3-метил-бензо[b]тиофен-2-сульфонамида в виде твердого вещества с температурой плавления = 226-227°С.
СПОСОБ В
Пример 26. Получение N-[3-(2-диэтиламиноэтил)-1Н-индол-5-ил]-N-этилнафтален-2-сульфонамида
Смесь 285 мг (0,7 ммоль) N-[3-(2-диэтиламиноэтил)-1Н-индол-5-ил]нафтален-2-сульфонамида (пример 17) и 80 мг (0,7 ммоль) трет-бутоксида калия в 3 мл ДМСО перемешивают в течение 30 минут при комнатной температуре. Затем добавляют 105 мг (0,7 ммоль) этилиодида, и раствор оставляют перемешиваться в течение 3 часов. Добавляют воду, и раствор экстрагируют этилацетатом. Органический раствор выпаривают досуха, и полученный сырой продукт очищают с помощью хроматографии на силикагеле, используя в качестве элюента смесь хлористого метилена /метанола/аммиака, получая на выходе N-[3-(2-диэтиламиноэтил)-1Н-индол-5-ил]-N-этилнафтален-2-сульфонамид в виде твердого вещества с температурой плавления = 49-50°С.
СПОСОБ С
Пример 18. Получение N-[3-(1-метил-1,2,3,6-тетрагидропиридин-4-ил)-1Н-индол-5-ил]нафтален-1-сульфонамида
К раствору 712 мг (13,2 ммоль) метоксида натрия в 100 мл метанола добавляют 850 мг (2,64 ммоль) N-[1Н-индол-5-ил]нафтален-1-сульфонамида, затем 596 мг (5,28 ммоль) 1-метил-4-пиперидона, и полученный раствор нагревают до кипения в течение 48 часов. Реакционную смесь концентрируют при пониженном давлении, и полученный осадок очищают с помощью хроматографии на силикагеле, используя в качестве элюента смесь хлористого метилена /метанола/аммиака, что дает на выходе 573 мг (52%) N-[3-(1-метил-1,2,3,6-тетрагидропиридин-4-ил)-1Н-индол-5-ил]нафтален-1-сульфонамида в виде твердого вещества с температурой плавления = 244-245°С.
СПОСОБ D
Пример 12. Получение N-[3-(1-метилпиперидин-4-ил)-1Н-индол-5-ил]нафтален-1-сульфонамида
К раствору 417 мг (1 ммоль) N-[3-(1-метил-1,2,3,6-тетрагидропиридин-4-ил)-1Н-индол-5-ил]нафтален-1-сульфонамида в 50 мл метанола добавляют 100 мг 5% палладия на угле. Смесь гидрируют при комнатной температуре при начальном давлении водорода 3 атмосферы в течение 20 часов. Реакционную смесь отфильтровывают и фильтрат концентрируют при пониженном давлении, чтобы получить сырой продукт, смешивают с этиловым эфиром, получая на выходе 272 мг (65%) N-[3-(1-метил-пиперидин-4-ил)-1Н-индол-5-ил]нафтален-1-сульфонамида в виде твердого вещества с температурой плавления = 254-256°С.
СПОСОБ Е
Пример 3. Получение гидрохлорида N-[3-(2-диэтиламиноэтил)-1Н-индол-5-ил]нафтален-1-сульфонамида
1,05 г (2,5 ммоль) N-[3-(2-диэтиламиноэтил)-1Н-индол-5-ил]нафтален-1-сульфонамида (пример 2) растворяют в 10 мл этанола и добавляют 0,6 мл 4,2 N раствора соляной кислоты в этаноле. Реакционной смеси дают возможность кристаллизоваться при комнатной температуре. Получают гидрохлорид N-[3-(2-диэтиламиноэтил)-1Н-индол-5-ил]нафтален-1-сульфонамида в виде твердого вещества с температурой плавления = 255-257°С.
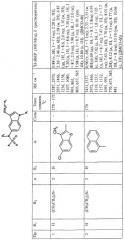
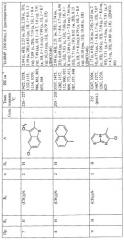
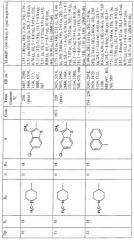
Температура плавления и спектроскопические данные для идентификации некоторых соединений, как объекта настоящего изобретения, приведены в следующей таблице:
БИОЛОГИЧЕСКИЕ ИСПЫТАНИЯ
СВЯЗЫВАНИЕ С 5НТ6 РЕЦЕПТОРОМ СЕРОТОНИНА
Клеточные мембраны НЕК-293 клеток, экспрессирующие рекомбинантный 5НТ6 рецептор человека, были получены с помощью техники рецепторной биологии. В указанных мембранах концентрация рецептора составляет 2,18 пмоль/мг белка, и концентрация белка составляет 9,17 мг/мл. Экспериментальный протокол составляют по методу В.L.Roth et at. [В.L. Roth, S.С. Craigo, M.S. Choudhary, A. Uluer, F.J. Monsma, Y. Shen, H.Y. Meltzer, D.R. Sibley: Binding of Typical and Atypical Antipsychotic Agents to 5-Hydroxytryptamine-6 and Hydroxytriptamine-7 Receptors. The Journal of Pharmacology and Experimental Therapeutics, 1994, 268, 1403] с небольшими изменениями. Коммерческую мембрану разбавляют (1:40 разбавление) связующим буфером: 50 мМ Трис-HCl, 10 мМ MgCl2, 0,5 мМ EDTA (рН 7,4). Используемый радиолиганд представляет собой [3H]-LSD в концентрации 2,7 нМ с окончательным объемом 200 мкл. Инкубирование инициировано путем добавления 100 мкл мембранной суспензии (≈22,9 мкг мембранного белка) и проводится в течение 60 минут при температуре 37°С. Инкубирование заканчивают быстрой фильтрацией в Brandel Cell Harvester через стекловолоконные фильтры, изготовленные фирмой Schleicher & Schuell GF 3362, обработанные 0,5% раствором полиэтиленимина. Фильтры промывают трижды по три миллилитра буфера Tris-HCl 50 мМ рН 7,4. Фильтры перемещают в колбы, и в каждую колбу добавляют по 5 мл Ecoscint Н жидкого коктейля сцинтилляции. Дают возможность достигнуть равновесия в колбах в течение нескольких часов перед подсчетом с помощью счетчиков сцинтилляции Wallac Winspectral 1414. Неспецифическое сродство определяют в присутствии 100 мкм серотонина. Испытания проводят трижды. Константы ингибирования (Кi, нМ) рассчитывают, используя анализ нелинейной регрессии, при помощи программы EBDA/LIGAND [Munson and Rodbard, Analytical Biochemistry, 1980, 107, 220]. В следующей таблице приведены результаты сродства для некоторых соединений настоящего изобретения.
| Таблица | ||
| Пример | % ингибирования 10-6 М | Кi (нМ) |
| 1 | 98.1±4.0 | 0.28 |
| 3 | 96.6±5.2 | 3.5 |
| 4 | 96.2±0.6 | 9.3 |
| 5 | 101.2±0.1 | 1.0 |
| 6 | 97.6±1.8 | 8.7 |
| 7 | 103.0±7.9 | 0.13 |
| 8 | 94.5±7.0 | 0.76 |
| 9 | 96.8±3.7 | 2.2 |
| 11 | 101.3 | 0.98 |
| 13 | 98.3 | 4.7 |
| 14 | 95.7±3.4 | 24.3 |
| 15 | 97.4±0.8 | 6.8 |
| 16 | 94.4±8.6 | 21.2 |
| 17 | 102.0 | 5.3 |
Ежедневная доза при лечении человека находится в интервале 1 миллиграмм - 500 миллиграммов продукта, который можно вводить однократно или многоразово. Композиции получают в формах, совместимых с используемым путем введения, типа таблеток, пилюль в сладких облатках, капсул, свечей, растворов или суспензий. Эти композиции готовят с помощью известных способов, и они содержат от 1 до 60 мас.% активного ингредиента (соединения общей формулы I) и 40-99 мас.% подходящего фармацевтического эксципиента, совместимого с активным ингредиентом и физической формой композиции. В примере приведена формула таблетки, содержащей продукт по изобретению:
Пример состава таблетки:
| Пример 1 | 5 мг |
| Лактоза | 60 мг |
| Кристаллическая целлюлоза | 25 мг |
| К 90 повидон | 5 мг |
| Пептидированный крахмал | 3 мг |
| Коллоидный диоксид кремния | 1 мг |
| Стеарат магния | 1 мг |
| Общий вес таблетки | 100 мг |
Способ С. Получение N-[3-(1-метил-1,2,3,6-тетрагидропиридин-4-ил)-1Н-индол-5-ил]хинолин-8-сульфонамида.
К раствору 712 мг (13,2 ммоль) метоксида натрия в 100 мл метанола добавляют 852 мг (2,64 ммоль) N-[1H-индол-5-ил]хинолин-8-сульфонамида с последующим добавлением 596 мг (5,28 ммоль) 1-метил-4-пиперидона, и полученный раствор кипятят с обратным холодильником в течение 48 часов. Реакционную смесь концентрируют при пониженном давлении и полученный остаток очищают хроматографией на силикагеле, используя в качестве элюента смесь хлористый метилен/метанол/аммиак, с получением 552 мг (50%) N-[3-(1-метил-1,2,3,6-тетрагидропиридин-4-ил)-1H-индол-5-ил]хинолин-8-сульфонамида в виде твердого вещества.
Способ D. Получение N-[3-(1-метил-пиперидин-4-ил)-1H-индол-5-ил]хинолин-8-сульфонамида.
К раствору 418 мг (1 ммоль) N-[3-(1-метил-1,2,3,6-тетрагидропиридин-4-ил)-1H-индол-5-ил]хинолин-8-сульфонамида в 50 мл метанола добавляют 100 мг 5% палладия на угле. Смесь гидрогенизируют при комнатной температуре при давлении водорода 3 атм в течение 20 часов. Реакционную смесь отфильтровывают и фильтрат концентрируют при пониженном давлении для обеспечения неочищенного препарата, который суспендируют в этилацетате, с получением 256 мг (61%) N-[3-(1-метил-пиперидин-4-ил)-1H-индол-5-ил]хинолин-8-сульфонамида в виде твердого вещества.
1. Производное сульфонамида общей формулы (I)
где А представляет собой заместитель, выбранный из
5- или 6-членного гетероароматического кольца, содержащего 1 или 2 гетероатома, выбранных из кислорода, азота или серы, необязательно замещенных 1 или 2 атомами галогена, C1-C4 алкильным или фенильным радикалом или 5- или 6-членным гетероарильным радикалом, содержащим 1 или 2 атома кислорода, азота или серы;
бициклического гетероароматического кольца, содержащего от 1 до 3 гетероатомов, выбранных из кислорода, азота или серы, необязательно замещенного 1 или 2 атомами галогена или C1-C4 алкильным радикалом;
R1 представляет собой водород, C1-C4 алкильный или бензильный радикал;
n имеет значение 0, 1, 2, 3 или 4;
R2 представляет собой -NR4R5 или группу формулы
где пунктирная линия обозначает необязательную химическую связь;
R3, R4 и R5 независимо представляют собой водород или C1-C4 алкил,
или одна из его физиологически приемлемых солей.
2. Соединение по п.1, выбранное из
[1] N-[3-(2-диэтиламиноэтил)-1Н-индол-5-ил]-5-хлор-3-метилбензо[b]тиофен-2-сульфонамида,
[6]] N-[3-(2-диэтиламиноэтил)-1Н-индол-5-ил]-5-хлортиофен-2-сульфонамида,
[7] N-[3-(2-диметиламиноэтил)-1Н-индол-5-ил]-5-хлор-3-метилбензо[b]тиофен-2-сульфонамида,
[9] N-[3-(2-диметиламиноэтил)-1Н-индол-5-ил]-6-хлоримидазо[2,1-b]тиазол-5-сульфонамида,
[10] N-[3-(1-метилпиперидин-4-ил)-1Н-индол-5-ил]-5-хлор-3-метилбензо[b]тиофен-2-сульфонамида,
[11] N-[3-(1-метилпиперидин-4-ил)-1Н-индол-5-ил]-5-хлор-3-метилбензо[b]тиофен-2-сульфонамидгидрохлорида,
[14] N-[3-(1-метилпиперидин-4-ил)-1Н-индол-5-ил]-5-хлортиофен-2-сульфонамида,
[16] N-[3-(1-метилпиперидин-4-ил)-1Н-индол-5-ил]хинолин-8-сульфонамида,
[19] N-[3-(4-метилпиперазин-1-ил)метил-1Н-индол-5-ил]-5-хлор-3-метилбензо[b]тиофен-2-сульфонамида,
[20] N-[3-(2-диметиламиноэтил)-1Н-индол-5-ил]-5-(2-пиридил)тиофен-2-сульфонамида,
[21] N-[3-(2-диметиламиноэтил)-1Н-индол-5-ил]-2,1,3-бензотиадиазол-4-сульфонамида,
[22] N-[3-(2-диметиламиноэтил)-1Н-индол-5-ил]хинолин-8-сульфонамида,
[27] N-{3-[2-(морфолин-4-ил)этил]-1Н-индол-5-ил}-5-хлор-3-метилбензо[b]тиофен-2-сульфонамида,
[30] N-[3-диметиламинометил-1Н-индол-5-ил]-5-хлор-3-метилбензо[b]тиофен-2-сульфонамида,
[32] N-[3-(2-дипропиламиноэтил)-1Н-индол-5-ил]-5-хлор-3-метилбензо[b]тиофен-2-сульфонамида,
[33] N-[3-(2-дибутиламиноэтил)-1Н-индол-5-ил]-5-хлор-3-метилбензо[b]тиофен-2-сульфонамида,
[38] N-[3-(октагидроиндолизин-7-ил)-1Н-индол-5-ил]-5-хлор-3-метилбензо[b]тиофен-2-сульфонамида,
[39] N-[3-(2-диэтиламиноэтил)-1Н-индол-5-ил]-6-хлоримидазо[2,1-b]тиазол-5-сульфонамида,
[43] N-[3-(3-диэтиламинопропил)-1Н-индол-5-ил]-5-хлор-3-метилбензо[b]тиофен-2-сульфонамида,
[44] N-{3-[2-(пирролидин-1-ил)этил]-1Н-индол-5-ил}-5-хлор-3-метилбензо[b]тиофен-2-сульфонамида,
[50] N-{3-[2-(морфолин-4-ил)этил]-1Н-индол-5-ил}хинолин-8-сульфонамида.
3. Способ получения производного сульфонамида общей формулы (I) по п.1, отличающийся тем, что проводят реакцию взаимодействия соединения общей формулы (II) или одного из его соответствующим образом защищенных производных
где А имеет значение, указанное для общей формулы (I) и Х представляет собой приемлемую уходящую группу, включая атом галогена, в частности хлор;
с 5-аминоиндолом общей формулы (III) или одним из его соответствующим образом защищенных производных
где n, R1, R2 и R3 имеют значения, указанные для общей формулы (I),
с получением соответствующего сульфонамида и при необходимости последующим удалением защитных групп.
4. Способ получения производного сульфонамида общей формулы (I) по п.1, где R1, R2, R4, n и А имеют значения, указанные в п.1 и R3 представляет собой C1-C4алкил, отличающийся тем, что проводят реакцию взаимодействия соединения общей формулы (I), где R1, R2, R4, n и А имеют значения, указанные в п.1, и R3 представляет собой атом водорода, с C1-C4 алкилгалоидом или диалкилсульфатом.
5. Способ получения производного сульфонамида общей формулы (I) по п.1, где R1, R3, и А имеют значения, указанные в п.1, n=0 и R2 представляет собой 1,2,3,6-тетрагидропиридин-4-ильный радикал, замещенный в положении 1 радикалом R1, отличающийся тем, что проводят реакцию соединения общей формулы (I), где R1, R3 и А имеют значения, указанные в п.1, n=0 и R3 представляет собой атом водорода, с 4-пиперидоном, замещенным в положении 1 радикалом R1.
6. Способ получения производного сульфонамида общей формулы (I) по п.1, где R1, R3, и А имеют значения, указанные в п.1, n=0 и R2 представляет собой 4-пиперидинильный радикал, замещенный в положении 1 радикалом R1, отличающийся тем, что проводят восстановление соединения общей формулы (I), где R1, R3 и А имеют значения, указанные в п.1, n=0 и R2 представляет собой 1,2,3,6-тетрагидропиридин-4-ильный радикал, замещенный в положении 1 радикалом R1.
7. Способ получения физиологически приемлемой соли соединения общей формулы (I) по п.1, отличающийся тем, что проводят реакцию соединения общей формулы (I) с неорганической или органической кислотой в подходящем растворителе.
8. Фармацевтическая композиция, обладающая антагонистической активностью в отношении 5-НТ6 рецептора серотонина, характеризующаяся тем, что она содержит в дополнение к фармацевтически приемлемым эксципиентам, по меньшей мере, одно соединение общей формулы (I) или одну из его физиоло