Политетрафторэтиленовый имплантат для достижения гемостаза при операциях на паренхиматозных органах
Иллюстрации
Показать всеИзобретение относится к медицине, в частности к материалам, используемым при наложении хирургических швов и лигатуры на кровеносные сосуды. Предложен политетрафторэтиленовый (ПТФЭ) имплантат, включающий по крайней мере два слоя пористого ПТФЭ, причем слои имеют различную пористую структуру. Слой, прилегающий к паренхиматозному органу, включает не менее десяти слоев толщиной 30-120 мкм пористого ПТФЭ, имеющего объемную долю пространства пустот 79-93%, удельную поверхность пространства пустот 0,65-0,80 мкм2/мкм3, среднее расстояние между пустотами в объеме 35-50 мкм, среднюю объемную хорду 25-30 мкм. Внешний слой включает по крайней мере один слой толщиной 40-90 мкм пористого ПТФЭ, имеющего объемную долю пространства пустот 43-50%, удельную поверхность пространства пустот 0,35-0,45 мкм2/мкм3, среднее расстояние между пустотами в объеме 9,0-15,0 мкм, среднюю объемную хорду 8-11 мкм. Общая пористость имплантата составляет не менее 80%, толщина имплантата 1,0-2,0 мм. Технический результат - получение имплантата, позволяющего наложение вазоселективных паренхиматозных швов. 5 з.п. ф-лы, 5 ил., 1 табл.
Реферат
Предлагаемое изобретение относится к медицине, в частности к хирургии, а именно к материалам, используемым при наложении хирургических швов или лигатуры на кровеносные сосуды. Оно может найти применение при операциях на паренхиматозных органах, таких как операции на почках, селезенке или печени (краевые резекции).
При нарушении целостности паренхимы основной проблемой является достижение гемостаза. Физические и химические методы остановки кровотечения недостаточно эффективны. Наиболее надежна и эффективна в данном случае лигатурная методика, но при наложении швов непосредственно на паренхиму хирургическая нить ее прорезывает. Трудности в достижении гемостаза часто приводят к тому, что в случае протяженных разрезов, например при удалении новообразований или крупных коралловидных камней или при обширном ранении, паренхиматозный орган приходилось удалять. Для проведения органосберегающих операций при наложении лигатуры необходимо использование дополнительных прокладок, предотвращающих прорезывание швов.
Известно использование аутотканей, таких как жировая ткань или мышца, которые подкладывали под швы для предотвращения прорезывания нитей на этапе достижения окончательного гемостаза [Айвазян А.В. Гемостаз при операциях на почке. М.: Наука, 1982, 280 с.; Бисенков Л.Н., Зубарев П.Н. Неотложная хирургия груди и живота. СПб: Гиппократ, 2002, 512 с.].
Недостатками аутоткани являются неудовлетворительные манипуляционные качества (сминание, образование неразъемных комков, деформация под швами, недостаточная прочность), вероятность некроза аутоткани под швами, вызванного некрозом нагноения и развития вторичного кровотечения. Кроме того, для получения аутоткани приходится расширить объем оперативного вмешательства.
Также известно использование лиофилизированных аллогенных трансплантатов, таких как перикард, широкая фасция бедра, твердая мозговая оболочка и др., в качестве подкладки под лигатуры при достижении окончательного гемостаза [Шипов А.М., Степанов B.C., Красулин В.В. Резекция почек с применением аллогенных лиофилизированных тканей. Ростов, 1981, 104 с.].
Лиофилизированные трансплантаты размещали на раневой поверхности резецированной почки и по периферии дефекта; швы накладывали через трансплантаты.
Недостатком аллогенных трансплантатов являются их низкие манипуляционные качества, а именно недостаточная прочность и деформация под швами. Заготовка и хранение аллогенных трансплантатов затруднены.
Также известен трикотажный имплантат из карбоксиметилцеллюлозного волокна, используемый для достижения гемостаза при операциях на паренхиматозных органах, в частности почках [опубликованная заявка на патент РФ №2003128431, МКИ7 А 61 В 1/100, опубл.27.03.2005]. Карбоксиметилцеллюлоза подвержена лизису и не обладает достаточной биоинертностью, что может привести к нагноению или отторжению материала. Ее манипуляционные качества также неудовлетворительны: сминается под швами.
Наиболее близким по совокупности существенных признаков к заявляемому является имплантат из пористого политетрафторэтилена (ПТФЭ) для достижения гемостаза при операциях на паренхиматозных органах [Опубликованная заявка на патент РФ №2003128502, МКИ7 А 61 L 2/00, опубл. 27.03.2005]. Применялся разрезанный вдоль протез кровеносного сосуда из ПТФЭ, такой, как описан в патенте РФ №2207825, разрезанный вдоль протез имеет вид ленты. Лента из ПТФЭ имела бислойную структуру: слой, прилегающий к органу, "имеет крупнопористое строение, что создает условия для прорастания в ленту соединительной ткани; слой, обращенный в брюшную полость, имеет микропористое строение, предупреждающее образование спаек". Другие свойства в заявке не указаны.
ПТФЭ в силу своей химической и биологической инертности вызывает минимальную реакцию прилежащих тканей. Пористый растянутый ПТФЭ имеет пространственную структуру в виде микроскопических узлов, соединенных между собой фибриллами длиной 7-8 мкм. Элементы узлов, соединенных фибриллами, и элементы пространства пустот между узлами соединены в единую трехмерную сеть.
Используемый в заявке №2003128502 имплантат по патенту РФ №2207825 имел часть, прилегающую к паренхиматозному органу, в виде слоя толщиной 0,2-2,0 мм, выполненного из пористого растянутого ПТФЭ, полученного экструзией трубки и последующей вытяжкой из эмульсионного ПТФЭ марки Ф-4Д. Внешняя сторона имплантата (первоначально трубки) была сформирована намоткой 2-6 слоев ленты из пористого растянутого ПТФЭ. Такой имплантат в виде имплантируемого полого протеза имеет хорошие упругоэластические свойства, хорошо проводит пульсовую волну, обеспечивает герметичность анастомоза; однако при использовании его в качестве прокладки для достижения гемостаза на паренхиматозных органах он имеет следующие недостатки.
Он недостаточно хорошо адаптируется к форме раны, недостаточно мягок, прокалывается с большим усилием и затрудняет наложение единичных вазоселективных паренхиматозных швов. Успешный гемостаз на паренхиматозных органах достигается тогда, когда на зоны расположения отдельных кровеносных сосудов накладываются узкие (3-4 мм шириной) отдельные швы, пережимающие каждый кровеносный сосуд, но не сдавливающие тотально паренхиму. Тотальное сдавливание паренхимы приводит к нарушению функций органа.
Технический результат, достигаемый в заявляемом изобретении, заключается в получении имплантата, позволяющего наложение вазоселективных паренхиматозных швов.
Указанный технический результат достигается тем, что у политетрафторэтиленового имплантата для достижения гемостаза, включающего по крайней мере два слоя пористого растянутого ПТФЭ, имеющего структуру в виде элементов узлов, соединенных фибриллами, и элементов пространства пустот с соединением указанных элементов в единую трехмерную сеть, причем слой, прилегающий к органу, и внешний слой имеют различную пористую структуру, слой, прилегающий к паренхиматозному органу, включает не менее 10 слоев толщиной 30-120 мкм ПТФЭ, имеющего объемную долю пространства пустот 79-93%, удельную поверхность пространства пустот 0,65-0,80 мкм2/мкм3, среднее расстояние между пустотами в объеме 35-50 мкм, среднюю объемную хорду 25-30 мкм, а внешний слой включает по крайней мере 1 слой толщиной 40-90 мкм ПТФЭ, имеющего объемную долю пространства пустот 43-50%, удельную поверхность пространства пустот 0,35-0,45 мкм2/мкм3, среднее расстояние между пустотами в объеме 9-15 мкм и среднюю объемную хорду 8-11 мкм, причем общая пористость имплантата не менее 80%, а толщина его составляет 1,0-2,0 мм.
Заявляемый имплантат может иметь 11-55 слоев пористой ПТФЭ пленки, из которых 40-50 слоев, прилегающих к органу, выполнены из более пористой пленки, и 1-5 внешних слоев выполнены из менее пористой пленки. На поверхности имплантата, прилегающей к органу, может быть выполнено рифление преимущественно в форме сетки, но может быть и в форме пунктира или хаотично расположенных вмятин. Посредине имплантата может быть выполнена продольная перфорация в виде отдельных круглых отверстий диаметром 0,1-1,0 мм с шагом 3-10 мм.
Известна [патент РФ №2257232] ПТФЭ мембрана для регенерации околозубных тканей, включающая 2-20 слоев ПТФЭ пленки с теми же стереологическими параметрами. Известная мембрана имеет толщину 180-400 мкм, прочность при разрыве 13-19 МПа, прочность на прошив 0,3-1,9 кг и относительное удлинение 210-160%. Она успешно используется для направленной регенерации тканей пародонта, будучи временно, на срок до 3-6 недель подшита к десне пациента. Однако для достижения надежного гемостаза на паренхиматозном органе она не пригодна: недостаточно мягкая, чтобы адаптироваться к форме раны, а ее прочность на прошив недостаточна для выдерживания единичных вазоселективных швов. Кроме того, она морщит при наложении указанных швов, что может привести к нежелательному травматизму.
Создание имплантата для достижения гемостаза на паренхиматозных органах не представляло простую техническую задачу, поскольку этот имплантат должен хорошо адаптироваться к ране, то есть быть более мягким, чем мембрана для регенерации околозубных тканей, но при этом не сминаться под вазоселективными швами и выдерживать указанные швы, не прорезываясь и не разрываясь при их наложении.
Для изготовления имплантата использовались двуосноориентированные ПТФЭ пленки, полученные из сырой каландрированной пленки, например из пленки марки СКЛ (ОСТ 6-05-405-80). Сырую каландрированную пленку подвергают продольной ориентации при температуре 50-300°С и линейной скорости вытяжки до 20 м/мин. Для формирования слоев, прилегающих к паренхиматозному органу, пленку толщиной 70-200 мкм (0,07-0,20 мм) вытягивают до степени вытяжки 300-400% (коэффициент ориентации 1:4-1:5). Для формирования внешнего слоя пленку толщиной 70-110 мкм вытягивают до степени вытяжки 100-200 (коэффициент ориентации 1:2-1:3). Продольно ориентированную пленку в течение 3-10 мин обрабатывают термически при температуре 320-340°С и подвергают поперечной ориентации при температуре 50-200°С и скорости вытяжки до 23 м/мин. При этом пленки для формирования слоя, прилегающего к паренхиматозному органу, вытягивают до степени вытяжки 300-400%, а для внешнего слоя до степени вытяжки 200-250%. После поперечной ориентации полученные двуосноориентированные пленки подвергают термофиксации в термошкафу в течение 15-20 мин. Получают пленки толщиной 30-120 мкм с маркировкой направления продольной вытяжки для внутреннего слоя имплантата и толщиной 40-90 мкм для внешнего слоя имплантата.
Стереоскопические (объемные) параметры пленок определены по известной методике [Пантелеев В.Г., Рамм К.С. Неорганические материалы. 1986, том 22, №12, с.1941-1951; Автангилов Г.Г. и др. Системная стереометрия в изучении патологического процесса. М.: Медицина, 1981; Чернявский К.С. Стереология в металловедении. М.: Металлургия, 1977].
Заявляемый имплантат изготавливают так, как это описано в патенте РФ №2203685, М. кл. A 61 L 27/14, опубликованном 10.05.2003. Для нанесения рифления используют алюминиевую пластину с нанесенным на ее поверхность выпуклым рисунком. Указанной пластиной прижимают стопку пленок, уложенных в определенном порядке, перед спеканием.
Формируют имплантаты длиной 10-25 см и шириной 1,0-5,0 см. Посредине имплантата выполняют перфорацию в форме круглых отверстий диаметром 0,1-1,0 мм; отверстия наносят с шагом 3-10 мм.
На фиг.1 представлена микрофотография поперечного разреза имплантата, включающего 3 внешних слоя. Отчетливо видно различие структур слоев, прилегающих к паренхиматозному органу, и внешнего менее пористого слоя.
На фиг.2-4 представлены микрофотографии поверхностей имплантатов с рифлением различного рисунка.
На фиг.5 представлена фотография имплантата с продольной перфорацией.
Нижеследующие примеры иллюстрируют настоящее изобретение.
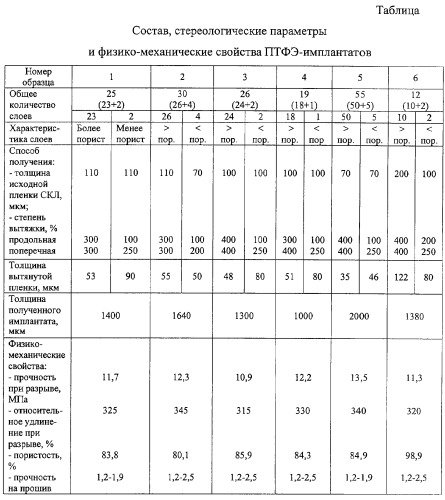
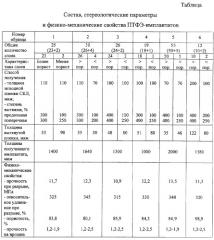
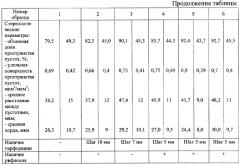
Пример 1. Для получения имплантата берут 23 образца ПТФЭ пленки толщиной 50 мкм, имеющей степень вытяжки в продольном и поперечном направлении 300%, и 2 образца ПТФЭ пленки толщиной 90 мкм со степенью вытяжки в продольном направлении 100% и в поперечном 250%. Обе пленки получены из исходной сырой каландрированной пленки толщиной 110 мкм. Стереологические параметры пленок указаны в таблице. Пленки укладывают на алюминиевую пластину так, что направления продольной вытяжки в смежных слоях перпендикулярны друг другу. Сначала укладывают 2 слоя менее пористой пленки, затем также во взаимно перпендикулярных направлениях к смежному слою укладывают 23 слоя более пористой пленки. Собранный пакет накрывают другой алюминиевой пластиной и ламинируют в термошкафу при температуре 350-360°С под нагрузкой 38 г/см3 в течение 1 часа.
Полученный имплантат исследовали по следующим методикам:
1. Прочность при разрыве и относительное удлинение по ГОСТ 11262-80.
2. Прочность на прошив по разработанной нами методике, которая измеряет усилие, необходимое для разрыва имплантата в месте прокола.
Примеры 2-6. Имплантаты изготовлены как в примере 1, но использовали различное число слоев пленки различной толщины и степени вытяжки с различными стереологическими параметрами.
Состав, стереологические параметры используемых пленок и физико-механические свойства полученных имплантатов представлены в таблице.
Были проведены исследования эффективности достижения гемостаза в органосохраняющих операциях на паренхиматозных органах - почке, печени и селезенке, с использованием заявленного ПТФЭ имплантата.
Эксперимент по резекции почки проведен на 18 крупных беспородных собаках массой 20-25 кг. Под внутривенным наркозом выполнялся межреберный доступ к почке. После мобилизации органа на сосудистую ножку накладывался турникет. Выполнялась поперечная резекция почки. Окончательный гемостаз достигался наложением узких (4-5 мм) П-образных швов нитью Vicryl rapid через ленточный имплантат, капсулу и паренхиму почки, при этом в зону максимальной компрессии, создаваемую швом, попадали визуально определяемые при раскрытии турникета точки расположения крупных сосудов. В качестве имплантата использовались образцы, представленные на примерах 1, 3 и 4, в виде лент длиной 150 мм и шириной 15 мм. Дополнительные методы гемостаза не использовались.
Для гистологического исследования брали материал через 7, 14 и 30 суток. Из зоны резекции отбирали гистологические образцы в местах контакта ленточных имплантатов и капсулы органа, а также из зоны, непосредственно прилегающей к зоне резекции. Гистологические исследования показали, что на 7 сутки наблюдается умеренная нейтрофильная инфильтрация ткани почки, интенсивность которой заметно снижается к 14 суткам. На 30 сутки на резецированной поверхности органа сформировалась соединительно-тканная псевдокапсула толщиной 300-400 мкм. Тонким слоем соединительной ткани (50-100 мкм) имплантат инкапсулировался, морфологическая структура паренхимы не нарушена.
Были проведены также 6 опытов краевой резекции печени на собаках с наложением П-образных швов через заявляемый имплантат для достижения окончательного гемо- и холестаза и 5 опытов краевой резекции селезенки с наложением аналогичных швов. В этих случаях, как и в опытах по резекции почки, гемостаз (а в случае печени и холестаз) достигался без использования дополнительных средств и методов. Гистологические исследования показали сходную с почками картину.
В урологической клинике Военно-медицинской академии (г.Санкт-Петербург) в период 2002-2004 гг. были прооперированы 16 пациентов по поводу новообразований почки величиной до 4 см. Были произведены резекции в пределах здоровых тканей не менее 5-10 мм от капсулы опухоли. Целостность органа восстанавливали узловатыми швами материалом Vicryl 1-0. На этапе достижения окончательного гемостаза накладывали узкие (3-5 мм) П-образные вазоселективные швы через ленту ПТФЭ имплантата, размещенную по периферии дефекта так же, как и в эксперименте.
Дополнительные методы гемостаза не потребовались. Во всех случаях понадобилось не более 5 швов.
Для проверки функциональных результатов резекции почки через 6, 12 и 24 месяца после операции выполнялось радиоизотопное исследование с внутривенным введением РФП ДТПА Тс99. Обследование показало, что после операции функция почки сохранена.
1. Политетрафторэтиленовый имплантат для достижения гемостаза при операциях на паренхиматозных органах, включающий по крайней мере два слоя пористого растянутого политетрафторэтилена, имеющего структуру в виде элементов узлов, соединенных фибриллами, и элементов пространства пустот с соединением указанных элементов в единую трехмерную сеть, причем слой, прилегающий к паренхиматозному органу, и внешний слой имеют различную пористую структуру, отличающийся тем, что слой, прилегающий к паренхиматозному органу, включает не менее десяти слоев толщиной 30-120 мкм пористого растянутого политетрафторэтилена, имеющего объемную долю пространства пустот 79-93%, удельную поверхность пространства пустот 0,65-0,80 мкм2/мкм3, среднее расстояние между пустотами в объеме 35-50 мкм, среднюю объемную хорду 25-30 мкм, а внешний слой включает по крайней мере один слой толщиной 40-90 мкм пористого растянутого политетрафторэтилена, имеющего объемную долю пространства пустот 43-50%, удельную поверхность пространства пустот 0,35-0,45 мкм2/мкм3, среднее расстояние между пустотами в объеме 9-15 мкм и среднюю объемную хорду 8-11 мкм, причем общая пористость имплантата составляет не менее 80%, а толщина имплантата составляет 1,0-2,0 мм.
2. Политетрафторэтиленовый имплантат по п.1, отличающийся тем, что слой, прилегающий к паренхиматозному органу, включает 10-50 слоев пористого растянутого политетрафторэтилена.
3. Политетрафторэтиленовый имплантат по п.1, отличающийся тем, что его внешний слой включает 1-5 слоев пористого растянутого политетрафторэтилена.
4. Политетрафторэтиленовый имплантат по п.1, отличающийся тем, что на поверхности имплантата, прилегающей к паренхиматозному органу, выполнено рифление.
5. Политетрафторэтиленовый имплантат по п.4, отличающийся тем, что рифление поверхности выполнено в форме сетки.
6. Политетрафторэтиленовый имплантат по п.1, отличающийся тем, что посредине его выполнена продольная перфорация в форме отдельных круглых отверстий, размещенных с шагом 3-10 мм.