Производные вариолина в, способ их получения, промежуточные продукты и фармацевтическая композиция
Иллюстрации
Показать всеИзобретение относится к новым производным вариолина. В общей формулы (I) или их фармацевтически приемлемым солям, обладающим противоопухолевой активностью. В общей формулы (I)
где R1 означает ароматическую группу, представляющую собой ароматическую группу, представляющую собой фенил, необязательно замещенный нитрогруппой, аминогруппой или алкилзамещенной аминогруппой, или ароматическая группа представляет собой 5-6-членный гетероцикл с двумя атомами азота или атомом серы, в качестве гетероатомов, необязательно замещенный С1-12алкилом, ОН, незамещенным амино или амино, замещенным C1-4-ацилом, фенил-С1-4алкилом, в котором фенильная группа может быть замещена OR1; или С1-12алкилтиогруппой, С1-12алкил- или фенилсульфонилом, С1-12алкил- или фенилсульфинилом или OR1, где R1 выбирают из С1-12алкила или фенила, R2 представляет собой водород; R3 представляет собой оксогруппу, когда пунктирная линия между азотом, к которому присоединен R2, и углеродом, к которому присоединен R3 отсутствует, или R2 отсутствует, когда R3 представляет собой необязательно защищенную аминогруппу, где заместитель выбран из C1-4-ацила, фенилсульфонила и С1-4-алкилфенилсульфонила, когда пунктирная линия образует двойную связь между азотом, к которому присоединен R2, и углеродом, к которому присоединен R3, R4 представляет водород. Изобретение также относится к способу получения соединений изобретения и к промежуточным продуктам для их осуществления. Изобретение также относится к фармацевтической композиции на основе производных вариолина В. 4 н. и 18 з. п. ф-лы, 2 табл.
Реферат
Настоящее изобретение относится к производным вариолина В.
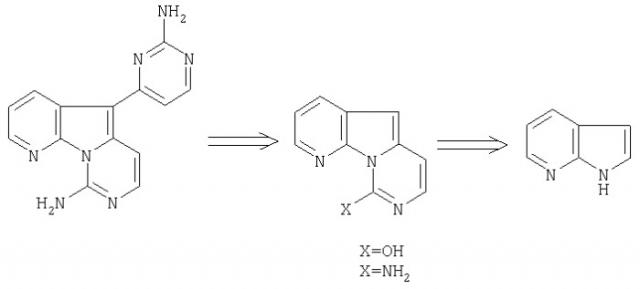
Вариолин А (1), вариолин В (2), вариолин D (3) и N(3')-метилтетрагидровариолин В (4) представляют собой небольшую группу гетероциклических веществ морского происхождения, выделенных из арктической губки Kirkpatrickia varialosa в 1994, см. Tetrahedron, 1994, 50, 3987-3992, и Tetrahedron, 1994, 50, 3993-4000. Они имеют обычную трициклическую структуру пиридо-[3',2':4,5]пирроло[1,2-c]пиримидина. Такая структура не имеет прецедента в природных продуктах ни наземного, ни морского происхождения. Ранее опубликованы две работы, описывающие синтетические родственные структуры, см. Chem. Ber., 1974, 107, 929-936, и Tetrahedron Lett., 2000, 41, 4777-4780.
Важной особенностью таких соединений является их биологическая активность: вариолин В является наиболее активным, обладающим цитотоксической активностью против клеточной линии Р388, и также является эффективным против Herpes simplex; он неактивен в отношении ряда других микроорганизмов, см. Tetrahedron, 1994, 50, 3987-3992. Вариолин А также показывает существенную цитотоксическую активность против клеточной линии Р388. N(3')-Метилтетрагидровариолин В ингибирует рост Sacharomyces cerevisae и показывает in vitro активность против клеточной линии НСТ 116. Вариолин D неактивен при всех анализах. Полагают, что различная активность указанных алкалоидов показывает биологическое значение аминопиримидинового цикла в (2), окисленной формы в (1) и восстановленного пиримидина в (4), в противоположность метоксикарбонильному заместителю в вариолине D.
Данное изобретение относится к дезоксивариолинам, обладающим цитотоксической активностью и, как ожидается, полезным в качестве противоопухолевых средств.
Краткое изложение сущности изобретения
В одном аспекте изобретение относится к соединениям формулы (I)
где R1 представляет собой ароматический заместитель;
R2 представляет собой водород или заместитель, когда пунктирная линия отсутствует, или R2 отсутствует, когда пунктирная линия представляет связь, и образуется двойная связь между азотом, к которому присоединен R2, и углеродом, к которому присоединен R3;
R3 представляет собой оксогруппу =О, когда пунктирная линия отсутствует, или представляет собой заместитель, когда пунктирная линия представляет связь, и образуется двойная связь между азотом, к которому присоединен R2, и углеродом, к которому присоединен R3;
R4 представляет собой водород или заместитель;
и их фармацевтически приемлемым солям.
Группа R1, как правило, представляет собой ароматический цикл с 4-10 циклическими атомами, предпочтительнее - 5, 6 или циклическими атомами, и наиболее предпочтительно - 6 циклическими атомами. Настоящее изобретение допускает конденсированные циклические системы. Цикл может содержать один или несколько гетероатомов, и подходящий вариант включает 1-3 циклических гетероатома, выбранных среди атомов азота, кислорода или серы, в особенности - 2 гетероатома. Особенно предпочтительны гетероатомы азота, и примером R1 является пиримидиновый цикл, в особенности, заместитель 4-пиримидил, т.е. группа формулы
Ароматический цикл может быть замещенным, например, одной или несколькими группами, выбранными из алкила, алкокси, тиоалкила, галогена, амино, замещенного амино, галогеналкила, алкоксиалкила, арила, гидрокси, карбокси, алкоксикарбонила или других обычных групп, включая мезильные группы. Далее в тексте указаны другие группы, которые можно использовать в качестве заместителей.
R2, когда присутствует, представляет собой, предпочтительно, водород, защитную группу для азота или какой-то другой заместитель. Примеры защитных групп для азота, такие как метоксиметил или тозил, хорошо известны, и нет необходимости приводить подробности. Примерами других заместителей являются любые группы, которые можно замещать в данном положении путем взаимодействия соединения, где R1 представляет собой водород. Более широко ссылка на другие группы дается в данном описании далее.
R3 представляет собой оксогруппу или может представлять собой заместитель, который можно ввести путем реакции оксосоединения, включая амино, замещенный амино, в том числе, защищенный амино, и тиоалкил. Более широко ссылка на другие группы дается в данном описании далее.
R4 представляет собой водород или заместитель, такой как алкокси, в особенности метокси, гидрокси, галоген, в особенности хлор, или другую группу, которую можно ввести нуклеофильным замещением или другим методом дериватизации, включая тиоалкил или мезил. Когда R4 представляет собой водород, соединения представляют собой производные дезоксивариолина В. Когда R4 представляет собой гидрокси, соединения представляют собой производные вариолина В. Более широко ссылка на другие группы дается в данном описании далее.
R1 представляет собой, предпочтительно, 4-пиримидильную группу, замещенную в положении 2. Подходящими заместителями являются аминогруппа и ее производные, такие как N-ацил, в особенности, N-ацетил. Предполагаются и другие заместители, такие как алкокси или алкилтио, в особенности, метилтиогруппа.
R2, предпочтительно, отсутствует.
R3 представляет собой, предпочтительно, аминогруппу и ее производные, такие как N-ацил, в особенности, N-ацетил.
R4, предпочтительно, представляет собой водород.
Пунктирная линия, предпочтительно, представляет связь.
Особенно предпочтительным классом соединений являются такие соединения формулы (I), в которых
R1 представляет собой, предпочтительно, 4-пиримидильную группу, замещенную в положении 2 амино, N-ацилом, в особенности, N-ацетилом, алкилтио, в особенности, метилтиогруппой, алкил- или арилсульфинилом, в особенности, метансульфинилом, или алкил- или арилсульфонилом, в особенности, метансульфонилом;
R2 отсутствует;
R3 представляет собой необязательно защищенную аминогруппу или N-ацил, в особенности, N-ацетил; и
R4 представляет собой водород, гидрокси или метокси.
Изобретение также относится к фармацевтически приемлемым солям.
Примерами заместителей, которые можно использовать в настоящем изобретении, являются ОН, OR', SH, SR', SOR', SO2R', NH2, NHR', N(R')2, NHCOR', NH(COR')2, NHSO2R', C(=O)R', CO2H, CO2R', (С1-С12)-алкил и (С1-С12)-галогеналкил, причем каждую группу R' выбирают, независимо, из группы, состоящей из ОН, (С1-С12)-алкила, (С1-С12)-галогеналкила, арила (который может быть, необязательно, замещен группой, выбранной из числа (С1-С6)-алкила, (С1-С6)-алкокси, (С1-С6)-алкилтио, NH2, (С1-С6)-алкиламино, ди-(С1-С6)-алкиламино, NO2, CN и галогена), аралкила или арилалкенила (арильная группа которого может быть, необязательно, замещена группой, выбранной из числа (С1-С6)-алкила, (С1-С6)-алкокси, (С1-С6)-алкилтио, NH2, (С1-С6)-алкиламино, ди-(С1-С6)-алкиламино, NO2, CN и галогена), и где группа R1 представляет собой группу формулы N(R')2 или NH(COR')2, группы R' могут быть одинаковыми или разными, или две группы R', вместе с атомом азота, к которому они присоединены, образуют 5-12-членный гетероцикл.
В определениях, используемых в настоящем изобретении, алкильные группы могут представлять собой группы с линейными или разветвленными цепями и, предпочтительно, содержат от 1 до примерно 12 атомов углерода, предпочтительнее - от 1 до примерно 8 атомов углерода, еще предпочтительнее - от 1 до примерно 6 атомов углерода, и наиболее предпочтительно - 2, 3 или 4 атома углерода. Особенно предпочтительными алкильными группами в соединениях настоящего изобретения являются метил, этил и пропил, включая изопропил. Используемый в данном описании термин "алкил", если нет иных указаний, относится как к циклическим, так и к ациклическим группам, хотя циклические группы содержат по меньшей мере три циклических атома углерода.
Галогеналкильные группы представляют собой алкильные группы (в том числе, циклоалкильные группы), имеющие указанные выше значения, замещенные одним или несколькими атомами галогена (предпочтительно, фтора, хлора, брома или йода) и содержащие, предпочтительно, от 1 до примерно 12 атомов углерода, предпочтительнее - от 1 до примерно 8 атомов углерода, еще предпочтительнее - от 1 до примерно 6 атомов углерода, и наиболее предпочтительно - 1, 2, 3 или 4 атома углерода. Особенно предпочтительными галогеналкильными группами в соединениях настоящего изобретения являются метильные, этильные и пропильные, включая изопропильные, группы, замещенные 1, 2 или 3 атомами галогена, которые могут быть одинаковыми или разными, в особенности, фторметил, фторхлорметил, трифторметил и трихлорметил.
Предпочтительные алкенильные и алкинильные группы в соединениях настоящего изобретения содержат одну или несколько ненасыщенных связей и от 2 до примерно 12 атомов углерода, предпочтительнее - от 2 до примерно 8 атомов углерода, еще предпочтительнее - от 2 до примерно 6 атомов углерода, и даже еще предпочтительнее - 2, 3 или 4 атома углерода. Термины "алкенил" и "алкинил", используемые в данном описании, относятся как к циклическим, так и к ациклическим группам, хотя, как правило, более предпочтительны линейные и разветвленные ациклические группы.
Предпочтительные алкоксильные группы в соединениях настоящего изобретения включают группы, содержащие одну или несколько (но предпочтительно, только одну) кислородных связей и от 1 до примерно 12 атомов углерода, предпочтительнее - от 1 до примерно 8 атомов углерода, еще предпочтительнее - от 1 до примерно 6 атомов углерода, и наиболее предпочтительно - 1, 2, 3 или 4 атома углерода.
Предпочтительные алкилтиогруппы в соединениях настоящего изобретения содержат одну или несколько (но предпочтительно, только одну) простых тиоэфирных связей и от 1 до примерно 12 атомов углерода, предпочтительнее - от 1 до примерно 8 атомов углерода, и еще предпочтительнее - от 1 до примерно 6 атомов углерода. Алкилтиогруппы с 1, 2, 3 или 4 атомами углерода особенно предпочтительны.
Предпочтительные алкилсульфинильные группы в соединениях настоящего изобретения включают группы, содержащие одну или несколько сульфоксидных (SO) групп и от 1 до примерно 12 атомов углерода, предпочтительнее - от 1 до примерно 8 атомов углерода, и еще предпочтительнее - от 1 до примерно 6 атомов углерода. Особенно предпочтительными являются алкилсульфинильные группы с 1, 2, 3 или 4 атомами углерода.
Предпочтительные алкилсульфонильные группы в соединениях настоящего изобретения включают группы, содержащие одну или несколько сульфонильных (SO2) групп и от 1 до примерно 12 атомов углерода, предпочтительнее - от 1 до примерно 8 атомов углерода, и еще предпочтительнее - от 1 до примерно 6 атомов углерода. Особенно предпочтительными являются алкилсульфонильные группы с 1, 2, 3 или 4 атомами углерода.
Предпочтительные алканоильные группы в соединениях настоящего изобретения включают группы, содержащие одну или несколько карбонильных (СО) групп и от 1 до примерно 12 атомов углерода, предпочтительнее - от 1 до примерно 8 атомов углерода, и еще предпочтительнее - от 1 до примерно 6 атомов углерода (включая углерод карбонила). Особенно предпочтительными являются алканоильные группы с 1, 2, 3 или 4 атомами углерода, в особенности, формильная, ацетильная, пропионильная, бутирильная и изобутирильная группы.
Предпочтительные алкиламиногруппы в соединениях настоящего изобретения содержат одну или несколько (но предпочтительно, только одну) NH-связей и от 1 до примерно 12 атомов углерода, предпочтительнее - от 1 до примерно 8 атомов углерода, и еще предпочтительнее - от 1 до примерно 6 атомов углерода. Особенно предпочтительными являются алкиламингруппы с 1, 2, 3 или 4 атомами углерода, в особенности, группы метиламино, этиламино, пропиламино и бутиламино.
Предпочтительные диалкиламиногруппы в соединениях настоящего изобретения содержат один или несколько (но предпочтительно, только один) атомов азота, связанных с двумя алкильными группами, каждая из которых может содержать от 1 до примерно 12 атомов углерода, предпочтительнее - от 1 до примерно 8 атомов углерода, и еще предпочтительнее - от 1 до примерно 6 атомов углерода. Алкильные группы могут быть одинаковыми или разными. Особенно предпочтительными являются диалкиламингруппы, где каждая алкильная группа содержит 1, 2, 3 или 4 атома углерода, в особенности, группы диметиламино, диэтиламино, N-метилэтиламино, N-этилпропиламино, дипропиламино, дибутиламино и N-метилбутиламино.
Предпочтительные алканоиламиногруппы в соединениях настоящего изобретения содержат одну связь NH-CO-, присоединенную к алкильной группе, содержащей от 1 до примерно 12 атомов углерода, предпочтительнее - от 1 до примерно 8 атомов углерода, и еще предпочтительнее - от 1 до примерно 6 атомов углерода. Особенно предпочтительными являются алканоиламингруппы с 1, 2, 3 или 4 атомами углерода, в особенности, группы формиламино, ацетиламино, пропиониламино и бутириламино. Группа ацетиламино является особенно предпочтительной.
Предпочтительные диалканоиламиногруппы в соединениях настоящего изобретения содержат один атом азота, связанный с двумя алканоильными группами, имеющими указанное выше значение, которые могут быть одинаковыми или разными, и каждая из которых содержит от 1 до примерно 12 атомов углерода, предпочтительнее - от 1 до примерно 8 атомов углерода, и еще предпочтительнее - от 1 до примерно 6 атомов углерода. Особенно предпочтительными являются диалканоиламингруппы, где каждая алканоильная группа содержит 1, 2, 3 или 4 атома углерода, в особенности, группы диформиламино, формилацетиламино, диацетиламино, дипропиониламино и дибутириламино. Группа диацетиламино является особенно предпочтительной.
Предпочтительные алкилсульфониламиногруппы в соединениях настоящего изобретения содержат одну связь NH-SO2-, присоединенную к алкильной группе, содержащей от 1 до примерно 12 атомов углерода, предпочтительнее - от 1 до примерно 8 атомов углерода, и еще предпочтительнее - от 1 до примерно 6 атомов углерода. Особенно предпочтительными являются алкилсульфониламингруппы с 1, 2, 3 или 4 атомами углерода, в особенности, группы метансульфониламино, этансульфониламино, пропансульфониламино и бутансульфониламино.
Примеры конкретных соединений по данному изобретению включают соединения (1), (2), (5), (16), (18) и (21) на последующих страницах, а также соединение, обозначенное (20а), которое на схеме 4 является промежуточным соединением между соединениями (20) и (21), где R2 отсутствует, R3 представляет собой ацетамидо, R4 представляет собой водород, и R1 представляет собой 2-метилтиопиримидин-4-ил, являющееся соединением формулы
Настоящее изобретение также относится к фармацевтическим композициям, содержащим соединение по данному изобретению и фармацевтически приемлемый носитель, и к применению соединений по данному изобретению при получении лекарственного средства. Оно также относится к способам лечения.
Примеры фармацевтических композиций включают любые твердые формы (таблетки, пилюли, капсулы, гранулы и т.п.) или жидкие формы (растворы, суспензии или эмульсии) подходящего состава для перорального, местного или парентерального введения, и они могут содержать чистое соединение или его сочетание с любым носителем или другими фармакологически активными соединениями. Может потребоваться стерильность таких композиций, когда их вводят парентерально.
Введение таких соединений или композиций можно осуществить любым подходящим способом, таким как внутривенная инфузия, в виде препаратов для перорального введения, интраперитонеальным и внутривенным способом. Предпочтительно применять инфузию длительностью до 24 часов, предпочтительнее - в течение 2-12 часов, наиболее предпочтительно - в течение 2-6 часов. Особенно желательны кратковременные инфузии, позволяющие осуществлять лечение без оставления в госпитале на ночь. Однако инфузия может продолжаться 12-24 часа или даже дольше, если это необходимо. Инфузию можно осуществлять с подходящими интервалами, например, в 2-4 недели. Фармацевтические композиции, содержащие соединения изобретения, можно доставлять с помощью инкапсулирования в липосомах или наносферах, с помощью композиций с отсроченным высвобождением или любым другим способом доставки.
Точная дозировка соединений будет изменяться в зависимости от конкретной композиции, способа применения и конкретных ситуации, хозяина и опухоли, от которой лечат. Следует принимать во внимание и другие факторы, такие как возраст, масса тела, пол, питание, время введения, скорость экскреции, состояние пациента, комбинации лекарственных средств, чувствительность к воздействию и серьезность заболевания. Введение можно осуществлять непрерывно или периодически в пределах переносимой дозы.
Настоящее изобретение также относится к фармацевтическим композициям для комбинированной терапии, включающим соединение по данному изобретению и по меньшей мере одно другое терапевтически активное соединение. Другое соединение может обладать противоопухолевой активностью или может обладать некоторой другой активностью для применения в сочетании с противоопухолевой активностью соединений по данному изобретению.
Другие лекарственные средства могут составлять часть той же композиции или могут представляться в виде отдельной композиции для введения в то же или другое время. Особенности другого лекарственного средства специально не ограничиваются, и подходящими кандидатами являются
а) лекарственные средства с антимитотическим действием, в особенности, направленные на элементы цитоскелета, включая модуляторы микротрубочек, такие как таксановые лекарственные средства (такие как таксол, паклитаксел, таксотер, доцетаксел), подофилотоксины или алкалоиды барвинка (винкристин, винбластин);
b) антиметаболические лекарственные средства, такие как 5-флуорурацил, цитарабин, гемцитабин, аналоги пурина, такие как пентостатин, метотрексат;
с) алкилирующие средства, такие как азотсодержащие производные иприта (такие как циклофосфамид или ифосфамид);
d) лекарственные средства, направленные на ДНК, такие как антрациклиновые лекарственные средства адриамицин, доксорубицин, фарморубицин или эпирубицин;
е) лекарственные средства, направленные на топоизомеразы, такие как этопозид;
f) гормоны и агонисты или антагонисты гормонов, такие как эстроген, антиэстрогены (тамоксифен и родственные соединения) и андрогены флутамид, лейпрорелин, гозерлин, ципротрон или октреотид;
g) лекарственные средства, направленные на сигнальную трансдукцию в опухолевых клетках, включая производные антител, такие как герцептин;
h) алкилирующие лекарственные средства, такие как содержащие платину, лекарственные средства (цисплатин, карбонплатин, оксаплатин, параплатин), или нитрозомочевины;
i) лекарственные средства, потенциально воздействующие на метастаз опухолей, такие как ингибиторы матрикс-металлопротеиназ;
j) средства генной терапии и антисмысловые средства;
k) терапевтические препараты на основе антител;
l) другие биологически активные соединения морского происхождения, особенно, дидемнины, такие как аплидин, или эктеинасцидины, такие как Et 743;
m) противорвотные лекарственные средства, в частности, дексаметазон.
Цитотоксичность соединений по данному изобретению, полученных по схеме 4, иллюстрируется приведенными далее данными по IC50 в мкМ.
| Соединение | Р-388 | А-549 | НТ-29 |
| 5 | 0,36 | 0,04 | 0,04 |
| 21 | >3 | 0,16 | 0,16 |
| 20а | >3 | 0,29 | 0,29 |
| вариолин В | 0,85 | 0,17 | 0,09 |
Изобретение также относится к синтезу соединений, исходя из 7-азаиндола, или на более поздней стадии. Получения трициклических пиридопирролопиримидонов (11), исходя из 7-азаиндола, достигают путем литиирования по углероду 2, введения боковой цепи С2 и последующей циклизации. Реакцию гетероарильного сочетания используют для введения четвертого ароматического цикла.
Таким образом, настоящее изобретение относится к способу получения соединений по данному изобретению, включающему взаимодействие необязательно замещенного 5-галогенпиридо[3',2':4,5]-пирроло[1,2-c]пиримидина или 8,9-дигидро-5-галогенпиридо-[3',2':4,5]пирроло[1,2-c]пиримид-9-она с дериватизированным ароматическим соединением, таким как станниларильное соединение, особенно, триметилстанниларильное соединение, в особенности, производное триметилстаннилпиримидина. Затем полученный продукт можно ввести во взаимодействие для замены заместителей. Амино или другие реакционноспособные заместители в исходном соединении можно защитить, а затем удалить защитные группы.
Таким образом, предпочтительными промежуточными соединениями по данному изобретению являются соединения формул
где Х представляет собой галоген, и R2, R3 и R4 имеют указанные выше значения, в частности, когда Х представляет собой йод, R2 представляет собой защитную группу, R3 представляет собой защищенную аминогруппу, и R4 представляет собой водород, гидрокси или метокси.
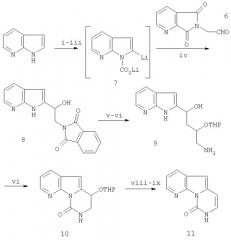
Подход к синтезу вариолина В разработан с использованием в качестве мишени дезоксивариолина В (5). Ранее синтез основывался на получении обычной трициклической системы пиридопирролопиримидина из 7-азаиндола. Ключевой стадией является гетероарильное сочетание с целью введения пиримидинового заместителя, катализированное Pd(0).
Введение содержащей функциональные группы цепи с двумя углеродами во 2-е положение 7-азаиндола, см. J. Org. Chem., 1965, 30, 2531-2533, достигают путем взаимодействия 2-литийпроизводного с 2-фталимидоацетальдегидом (6), который сам получают с выходом 75% из диметилацеталя 2-аминоацетальдегида, защищая аминогруппу путем взаимодействия с фталевым ангидридом в CH2Cl2 при 140°С в течение 15 минут, с последующим гидролизом ацетальной группы с помощью 10% HCl при кипячении с обратным холодильником. Литиирование 7-азаиндола ранее описано только для его N-фенилсульфонильного производного, см. Tetrahedron, 1997, 53, 3637-3648. Используют способ, описанный Katritzky, см. J. Am. Chem. Soc., 1986, 108, 6808-6809, включающий 2-литиирование литиевой соли 1-карбоновой кислоты, полученной in situ, поскольку превосходный выход найден с использованием 1-фенилсульфонил-7-азаиндола, и, кроме того, исключаются две отдельные стадии введения и удаления N-защитной группы. Таким образом, взаимодействие бислитий-производного (7) с альдегидом (6) дает спирт (8) с выходом 44%. Защита спирта в виде простого тетрагидропиранильного эфира дает смесь диастереомеров, которая не разделяется, поскольку оба центра симметрии позднее при синтезе утрачиваются. Гидразинолиз фталимидного остатка дает амин (9) с количественным выходом, который преобразуют в тетрагидропиримидон (10) с выходом 76% при обработке трифосгеном в CH2Cl2 с диизопропилэтиламином (DIEPA) в качестве основания. Дигидропиримидон (11) получают после удаления защищающей гидрокси группы посредством кислотного гидролиза с последующей дегидратацией спирта через мезилат (схема 1).
Схема 1. Синтез пиридо[3',2':4,5]пирроло[1,2-с]пиримидин-1-она (11)9
i: н-BuLi, ТГФ, от -78оС до комнатной температуры (кт);
ii: СО2, -78оС;
iii: трет-BuLi, ТГФ, -78оС;
iv: 5 ТГФ, от -78оС до кт, 44%;
v: DHP, HCl-бензол, CHCl3 (87%);
vi: NH2NH2·H2O, EtOH (100%);
vii: (Cl3O)2CO, DIPEA, CH2Cl2, кт (76%);
viii: 4Н HCl, CH2Cl2 (100%);
ix: MsCl, TEA, CH2Cl2, 0oC (95%).
На основе ранее осуществленных экспериментов по гетероарильному сочетанию с 7-азаиндолом, см. Synthesis, 1999, 615-620, и литиирования дигидропирроло[1,2-c]пиримидин-1-онов, см. J. Soc. Chem. Perkin Trans., I, 1999, 249-255, разрабатывается получение производного (14) из галогенпроизводного с защитной группой (13). Защиты трициклического пиримидона (11) достигают с помощью метилхлорметилового эфира в ДМФА с использованием гидрида натрия в качестве основания с получением (12). Галогенирование (12) с использованием N-бромсукцинимида (NBS) или йода с гидроксидом калия дает (13а) (80%) и (13b) (62%), соответственно. То, что галоген введен по С-5, подтверждают, сравнивая спектры 1Н-ЯМР: синглет Н-5 при (6,41 м.д. присутствует в (12), но не присутствует в спектрах (13а) и (13b). К сожалению, не удается выделить производное олова (14), например, обработка (13а) бутиллитием с последующим гашением хлоридом триметилолова, см Synthesis, 1999, 615-620, дает сложную смесь, которую невозможно разделить. Попытки осуществить взаимообмен йода и олова путем обработки (13b) гексаметилдиоловом в диоксане с катализатором Pd(PPh3)4 приводят к смеси (14) и (12) в соотношении 7:3, но выделить (14) методом колоночной хроматографии не удается.
Схема 2
i: MOMCl, NaH, ДМФА, 0°C (87%);
ii: NBS, CH2CI2, 0°C (80%);
ii: I2, КОН, ДМФА, 0°C (62%).
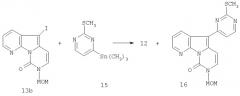
Изменяют стратегию реакции сочетания, и на этот раз используют триметилстаннилпиримидин (15) и йод-7-азаиндол (13b). Получение пиримидина (15), см. Tetrahedron, 1989, 45, 993-1006, улучшается с использованием Pd(OAc)2 и PPh3 в ТГФ, и сокращаются количество TBAF и время реакции по сравнению с тем, что описано в более ранней работе.
Раствор йодсодержащего производного (1 ммоль), (15) (3 ммоль), катализатора А или В и LiCl (3 ммоль) в диоксане (20 мл) кипятят с обратным холодильником в течение 5 часов. Растворитель выпаривают и остаток очищают колоночной флэш-хроматографией. Реакция сочетания между (13b) и (15) во всех условияхэксперимента дает смесь (12) и (16), которые невозможно разделить (табл.1).
| Таблица 1.Реакция сочетания между (13b) и (15) в диоксане | ||||
| (15)/(13b)а | Катал./лиг.b | LiCl/CuIc | 16/12d | %е |
| 1,1 | А | 3/-- | 2:1 | 56 |
| 1,2 | В | 3/-- | 2:1 | 52 |
| 2 | В | 3/0,1 | 3:1 | 53 |
| а: молярное соотношение;b: A=Pd(PPh3)4, 0,1 эквивалента; В=Pd2(dba)3, 0,1 эквивалента, и PPh3, 0,2 эквивалента;с: относительно 1 эквивалента 13b;d: отношение измеряют методом 1Н-ЯМР;е: выход (16) вычисляют методом 1Н-ЯМР на сырую реакционную смесь. |
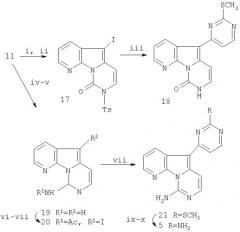
Из-за трудностей очистки (16) предпринимается введение новой защитной группы. Йодсодержащее соединение (17), отличающееся от (13b) защитной группой, синтезируют посредством взаимодействия (11) с тозилхлоридом и гидридом натрия в ДМФА с последующим йодированием с помощью NIS.
Реакция сочетания между (17) и триметилстаннилпиримидином (15) дает тетрациклическое соединение (18), но с выходом только 10% даже при использовании условий реакции, указанных в табл.1 для сочетания (13b) и (15).
Схема 4. Синтез дезоксивариолина В
Схема 2
i: TsCl, NaOH, ДМФА (40%);
ii: NIS, CHCl3, кт (80%);
iii: 15, Pd2(dba)3, PPh3, LiCl, CuI (10%);
iv: TMSCl, HMDSA, 2,6-лутидин;
v: NH3, 150oC, 60 ф/д2 (30% в двух стадиях);
vi: Ac2О, ТГФ (75%);
vii: NIS, CHCl3 (95%);
viii: iii, затем HCl-МеОН (45%);
ix: м-CPBA, CH2Cl2, 0оС (90%);
х: NH4OH, диоксан, 80оС (90%).
Следующим приближением является изменение функциональности С-цикла путем превращения пиримидона (11) в йодамидопиримидин (20). Аминопроизводное 19 получают О-силилированием (11) TMSCl и гексанэтилдисилазаном (HMDSA) в качестве силилирующего агента с последующим нуклеофильным замещением аммиаком, см. Lebgs Ann. Chem., 1975, 988-1002. Ацилирование амина (19) и галогенирование по свободному положению π-обогащенного цикла проходят с превосходным выходом.
Гетероарильное сочетание (20) и (15) в одних и тех же условиях реакции и с тем же катализатором, что и ранее, дает смесь ацилированных и лишенных защитных групп аминов, которые при метанолизе с сухим HCl в метаноле дают амин (21) с выходом 45%. Дезоксивариолин В (5) получают путем замены метилтиогруппы нового пиримидинового цикла на аминогруппу. Окисление (21) с использованием м-хлорпербензойной кислоты с последующей заменой полученного сульфона на аминогруппу с использованием гидроксида аммония дает (5) с высоким выходом, см. Tetrahedron, 1989, 45, 993-1006, и Katrizky A.R., Rees C.W., Comprehensive Heterocyclic Chemistry, Pergamon Press, Oxford, 1984, vol.3, page 111.
Более общая схема синтеза имеет следующий вид.
Реагенты
i: н-BuLi, ТГФ, от -78оС до кт;
ii: СО2, -78оС;
iii: трет-BuLi, ТГФ, -78оС;
iv: 6, ТГФ, от -78оС до кт;
v: DHP, HCl, бензол, CHCl3, Δ;
vi: NH2NH2·H2O, EtOH, Δ;
vii: (Cl3CO)2CO, DIPEA, CH2Cl2, кт;
viii: 4Н HCl, CH2Cl2;
ix: MsCl, ТЕА, CH2Cl2, 0оС;
х: MOMCl или TsCl, NaH, ДМФА, 0оС;
xi: NBS/NIS, CH2Cl2, 0оС, или I2, KOH, 0оС;
xii: 15, Pd2(dba)3, PPh3, LiCl, CuI, диоксан, Δ;
xiii: TMSCl, HDMSA, лутидин, D;
xiv: NH3, 150oC, 60 ф/д2;
xv: Ac2O, ТГФ, кт;
xvi: NIS, CHCl3, 0оС;
xvii: TsN=CCl2, DIPEA, CH2Cl2, кт;
xviii: 4н. HCl, CHCl3, кт;
xix: MsCl, ТЕА, CH2Cl2, кт;
хх: NIS, CHCl3, -30оС;
xxi: сухой МеОН-HCl или 48% HBr, Δ.
Бициклическое соед. 11b (Х=ОМе) получают из 4-метокси-7-азаиндола, см. J. Heterocyclic Chem., 1989, 26, 317, с теми же последующими взаимодействими, что и в случае 11а. Превращение 11b в 19b осуществляют с выходом только 22% посредством О-силилирования триметилсилилхлоридом (TMSCl) и гексаметилдисилазаном (HMDSA) с последующим нуклеофильным замещением аммиаком. Ацилирование 19b и йодирование полученного ацетилпроизводного дают йодацетамид 20b. 1Н-ЯМР 20b показывает две независимые АВ-ароматические системы из-за пар протонов Н3-Н4 и Н7-Н8. Катализируемое палладием сочетание 20b и 2-ацетиламино-4-триметилстаннилпиримидина (27) с последующей обработкой кислотой дает О-метилвариолин В (5b). Станнилпиримидин (27) получают с выходом 40% из 4-хлор-2-метансульфонилпиримидина, см. Heterocycles, 1977, 8, 229, путем нуклеофильного замещения метансульфонильной группы аммиаком в изо-PrOH с последующим ацилированием Ас2О и взаимообменом галогена и металла в диоксане с использованием гексаметилдиолова и Pd(PPh3)4 в качестве катализатора.
Образование пиримидонового цикла не включает улучшение получения трициклических систем 19. Трициклические соединения 22а-с получают из 9а-с посредством взаимодействия с N-дихлорметилен-4-метилбензолсульфонамидом, см. Chem. Ver., 1966, 99, 1252, и DIPEA в CH2Cl2 с последующими удалением О-защитной группы и дегидратацией. N-Тозилпроизводные 23 получают подобным образом из 22 посредством катализируемого кислотой удаления О-защитной группы с последующей дегидратацией, как описывается для превращения 10→11. Удаление N-тозилзащитной группы из 23 осуществляют с использованием Na в аммиаке или Na в нафталине, причем получают 19 с умеренным выходом.
Реакция гетероарильного сочетания 23 и станнилпроизводного 27 в условиях, подобных описанным ранее, дает 25 с очень хорошим выходом.
Удаление защитной группы для N-ацетила можно осуществить метанолизом МеОН в HCl, катализируемым кислотой. Переход 25а→26 можно осуществить путем обработки HBr. Соединение 26 является новым производным вариолина В, защищенным только по одному азоту.
Получено несколько производных вариолина В, три из которых только с одним изменением: 5а представляет собой дегидроксивариолин В, 5b представляет собой метилвариолин В и 26 представляет собой тозилвариолин В.
Удаление тозила из 26 можно осуществить в тех же условиях, что и в случае 23, и будет получаться вариолин В.
С помощью подобной экспериментальной процедуры из 23 с можно получить соединение 25с, а из него - производные, образованные по пиримидиновому циклу.
Предыдущий эксперимент показывает предвидимые хорошие результаты при сочетании гетероароматических оловосодержащих производных и 13b, 17 и 24, причем в общей формуле получают различные R1.
Разработана универсальная процедура синтеза, которую можно использовать не только для синтеза производных указанной группы алкалоидов морского происхождения, но также для получения производных других природных продуктов.
По настоящей заявке испрашивается приоритет по более ранней подаче. То, что при подаче не включено в текст данного описания, включено в него в качестве ссылки.
Примеры изобретения
Пример 1
2-(1-Гидрокси-2-фталимидоэтил)-7-азаиндол (8а)
К охлажденному (-78°С) раствору 7-азаиндола (7,6 г, 64 ммоль) в сухом ТГФ (150 мл), добавляют н-BuLi (44 мл 1,6 М раствора в гексане) и смесь перемешивают в течение 10 мин. Через смесь в течение 40 мин барботируют сухой СО2. Растворитель выпаривают и остаток растворяют в свежей порции сухого ТГФ (400 мл). Раствор охлаждают до -78°С и добавляют трет-BuLi (42 мл 1,7 М раствора в гексане). Смесь перемешивают в течение 20 мин. Добавляют постепенно раствор фталимидоацетальдегида (14 г, 71 ммоль) в ТГФ (400 мл). Через 1,5 часа реакцию гасят насыщенным водн. раствором NH4Cl (100 мл), и органический растворитель выпаривают. Смесь растворяют в CH2Cl2 и промывают водой. Органический раствор сушат и упаривают. Смесь очищают колоночной флэш-хроматографией. Элюирование смесью CH2Cl2 и ацетона (95/5) дает 7-азаиндол (3,8 г, 50%) и смесью CH2Cl2 и МеОН (98/2) дает 8а (8,7 г, 44%) в виде белого твердого вещества.
Т.пл. 231-232°С (CH2Cl2/МеОН).
ИК (KBr) (3200 (m, NH),1760 (s, C=O), 1704 (s, NCO), 1427 (m, C-N), 1395 (m, C-O).
1H-NMR (ДМСО-d6, 200 МГц) δ 3,88 (дд, J 13,6 и 6,0, 1H, H2'), 4,00 (дд, J 13,6 и 7,8, 1H, H2'), 5,06 (ддд, J 7,8, 6,0 и 5,2, 1H, H1'), 5,83 (д, J 5,2, 1H, OH), 6,34 (д, J 1,8, 1H, H3), 6,99 (дд, J 8,0 и 4,8, 1H, H5), 7,81-7,88 (м, 4H, Ph), 7,89 (дд, J 8,0 и 1,4, 1H, H4), 8,14 (дд, J 4,8 и 1,4,1H, H6), 11,75 (ушир.с, 1Н, NH).
13C-NMR (ДМСО-d6, 75 МГц) δ 43,6 (т, C2'), 64,4 (д, С1'), 96,8 (д, C3), 115,4 (д, C5), 119,8 (с, C3a), 123,0 (д, Ph-β), 127,6 (д, C4), 131,6 (с, сам Ph), 134,3 (д, Ph-α), 140,8 (с, C2), 142,1 (д, C6), 148,6 (с, C7a), 167,7 (с, Ph-CO).
MC (EI) m/z 308 (M+l, 6), 307 (M+, 25), 244 (8), 160 (43), 147 (фталимид, 100), 119 (азаиндол, 52).
Элемент. анализ: для C17H13N3O3 вычислено: С (66,44), Н (4,26), N (13,67); найдено: С (65,11), Н (4,26), N (13,37).
Пример 2
2-(1-Гидрокси-2-фталимидоэтил)-4-метокси-7-азаиндол (8b)
Следуя вышеописанному способу, из 4-метокси-7-азаиндола (3,55 г, 24 ммоль) в ТГФ (75 мл), н-BuLi (16,5 мл 1,6 М раствора в гексане), трет-BuLi (16 мл 1,7 М раствора в гексане) и раствора фталимидоацетальдегида (5 г, 26 ммоль) в ТГФ (100 мл) получают сырую смесь, которую очищают колоночной флэш-хроматографией. Элюирование смесью CH2Cl2 и ацетона (95/5) дает 4-метоксиазаиндол (2,06 г, 58%), и смесью CH2Cl2 и МеОН (98/2) дает 8b (3,68 г, 43%) в виде белого твердого вещества.
Т.пл. 225-226°С (CH2Cl2/МеОН).
ИК (KBr) ν 3500 (s, NH/OH), 1702 (s, C=O), 1594 (m), 1395 (m).
1H-NMR (ДМСО-d6, 200 МГц) δ 3,88 (с, 3H, Me), 3,86 (дд, J 13,8 и 6,0, 1H, H2'), 3,95 (дд, J 13,8 и 7,8, 1H, H2'), 5,00 (ддд, J 7,8, 6,0 и 5,1, 1H, H1'), 5,73 (д, J 5,1, 1H, OH), 6,30 (д, J 1,8, 1H, H3), 6,58 (д, J 5,4, 1H, H5), 7,83 (м, 4H, Ph), 8,02 (д, J 5,4, 1H, H6), 11,65 (ушир., 1H, NH).
13C-NMR (ДМСО-d6, 75 МГц) δ 43,6 (т, C2'), 55,3 (кв., Me), 64,2 (д, Cl'), 94,0 (д, C5), 97,8 (д, C3), 109,5 (с, C3a), 123,0 (д, Ph-β), 131,6 (с, сам Ph), 134,1 (д, Ph-α), 138,1 (с, C2), 144,2 (д, C6), 150,3 (с, C7a*), 158,5 (с, C4*), 167,7 (с, Ph-CO),
MC (EI) m/z 338 (M+l, 4), 337 (M+, 20), 319 (M-H2О, 44), 177 (100).
Элемент. анализ: для C18H15N3O4·1/4H2О вычислено: С (63,25), Н (4,57), N (12,29); найдено: С (63,32), Н (4,54), N (12,07).
Пример 3
4-Хлор-2-(1-гидрокси-2-фталимидоэтил)-7-азаиндол (8с)
Следуя вышеописанному способу, из 4-хлор-7-азаиндола (5 г, 33 ммоль) в ТГФ (100 мл), н-BuLi (20 мл 1,6 М раствора в гексане), трет-BuLi (20 мл 1,7 М раствора в гексане) и раствора фталимидоацетальдегида (7,5 г, 39 ммоль) в ТГФ (140 мл) получают сырую смесь, которую очищают колоночной флэш-хроматографией. Элюирование смесью CH2Cl2 и ацетона (95/5) дает 4-хлоразаиндол (4 г, 80%), и смесью CH2Cl2 и МеОН (98/2) дает 8с (1,5 г, 12%) в виде белого твердого вещества.
1H-ЯМР (ДМСО-d6, 200 МГц) δ 3,86 (м, 1H, H2'), 3,95 (м, 1H, H2'), 5,01 (м, 1H, H1'), 5,92 (д, J 5,2, 1H, OH), 6,41 (с, 1H, H3), 7,14 (д, J 5,6, 1H, H5), 7,84 (м, 4H, Ph), 8,11 (д, J 5,6, 1H, H6), 11,75 (ушир., 1H, NH).
13C-ЯМР (ДМСО-d6