Способ получения производного индолиноспиропирана
Иллюстрации
Показать всеИзобретение относится к способу получения производных индолиноспиропирана формулы
где R1 означает C1-C18-алкил, каждый из R2 и R3 независимо означает С1-С4-алкил, R4 означает водород, гидрокси, трихлорметил, трифторметил, формил, С1-С4-алкил, галоген, С1-С4-алкокси, нитро и х равен 1 или 2, включающему стадии:
(i) получения индолина на полимерном носителе формулы
где R1 означает C1-C18-алкил, каждый из R2 и R3 независимо означает C1-C4-алкил;
(ii) обработку несущего индолин полимерного носителя, где данный носитель представляет собой гидроксисмолу, при температуре от 50 до 120°С, в инертной атмосфере, в течение времени от 14 часов до 11 дней, производным салицилальдегида формулы
где R4 означает водород, гидрокси, трихлорметил, трифторметил, формил, C1-C4-алкил, галоген, С1-С4-алкокси, нитро и х равен 1 или 2, с получением соединения индолиноспиропирана формулы (I); и (iii) высвобождение соединения индолиноспиропирана формулы (I). Технический результат - получение новых производных индолиноспиропирана, обладающих фотохромными свойствами. 7 з.п. ф-лы.
Реферат
Область изобретения
Настоящее изобретение касается соединений спиропирана. В частности, настоящее изобретение касается соединений индолиноспиропирана и способов их промышленного получения. Указанные соединения полезны в качестве фотохромных соединений.
Известный уровень техники
Различные классы фотохромных соединений были синтезированы и рекомендованы для применения в изделиях, в которых под воздействием солнечного света вызываются обратимые изменения цвета или затемнение. Например, спиро(индолино)нафтопираны и спиро(индолино)хинопираны описаны в патенте GB 2174711. Спиропираны описаны также в Brown, Glenn H. ed., Photochromism (New York, 1971) and Durr, Heinz and Henri Bouas-Laurent eds., Photochromism (Elsevier, 1990).
Производные спиропирана могут представлять наиболее хорошо известные органические соединения, обладающие эффектом фотохромизма, но структуры описанных спиропиранов в значительной мере ограничены. Таким образом, существует необходимость как в соединениях спиропирана, допускающих дальнейшие несложные модификации, так и в способах синтеза различных соединений спиропирана.
Описание изобретения и предпочтительные варианты воплощения
Настоящее изобретение касается соединений индолиноспиропирана и, в частности, фотохромных соединений индолиноспиропирана, а также способов синтеза указанных соединений. Соединения индолиноспиропирана по изобретению замещены по индольному кольцу сукцинимидом, и указанное замещение позволяет раскрытие цикла сукцинимида и модуляцию объемных и фотохромных свойств соединений.
По одному из вариантов выполнения настоящее изобретение представляет соединение, включающее соединение нижеуказанной формулы, или по существу состоящее из соединения нижеуказанной формулы, или состоящее из соединения следующей нижеуказанной формулы:
где R1 означает C1-C18-алкил, аллил, фенил, моно- или дизамещенный фенил, фенил(C1-C4)алкил или (C1-C4)алкоксикарбонил(C1-C4)алкил, каждый из R2 и R3 независимо означает C1-C4-алкил, фенил, моно- или дизамещенный фенил, бензил или, объединенные вместе, образуют циклическую структуру, которая представляет собой ядро циклогексила, норборнила или адамантила, R4 означает водород, гидрокси, трихлорметил, трифторметил, формил, C1-C4-алкил, галоген, C1-C4-алкокси, нитро, циано, C1-C4-моногалогеналкил, C1-C4-алкоксикарбонил или ароматическую структуру, имеющую два общих смежных атома углерода с бензольной частью бензопиранового цикла, что приводит к образованию конденсированного ароматического цикла, включающего, но без ограничения ими, нафтил, фенантренил и хинолино, x равен 1, 2 или 3, при условии, что когда x=1, R4 может быть локализован на любом из доступных атомов углерода бензольного кольца бензопирановой группы, предпочтительно в положении 6, 7 или 8, и когда x=2, каждый из R4 может быть одинаковым или различным и локализован в положениях 6 и 8 или 5 и 7, предпочтительно в положениях 6 и 8. R1 предпочтительно означает C1-C4-алкил, фенил, бензил, аллил или этоксикарбонилэтил, каждый из R2 и R3 независимо означает метил, этил или фенил и R4 предпочтительно означает C1-C4-алкил, C1-C2-алкокси, хлор, бром, иод, трифторметил или нитро.
В предпочтительном варианте выполнения изобретение представляет соединение, включающее соединение нижеследующей формулы, или по существу состоящее из такого соединения, или состоящее из такого соединения:
где R4 означает водород, гидрокси, трифторметил, формил, метил, этил, метокси, этокси, нитро, фтор, хлор, бром или иод, x равен 1 или 2.
Поскольку соединения формул I и II содержат сукцинимидную группу, свойствами соединений по изобретению, такими как растворимость, чувствительность и тому подобными, можно управлять за счет раскрытия цикла сукцинимида любым из множества известных способов. Подходящие способы описаны, например, в 48 (12) Heterocycles, 2677-2691 (1998).
Соединения формул I и II могут быть получены любым подходящим известным способом и предпочтительно их получают использованием органического синтеза в твердой фазе. Использование твердофазных синтезов имеет преимущества, состоящие в том, что это обеспечивает удобство в выполнении взаимодействия, удобство в очистке продукта и удобство работы с полярными молекулами при осуществлении методик синтеза. Вдобавок, достигается возможность применения промышленно выпускаемых исходных материалов и использования избытка реагента для доведения взаимодействия до завершения и для превышения скорости основной реакции над побочными реакциями. Ключевым моментом синтеза является применение индолина на полимерном носителе формулы
где R1, R2 и R3 имеют те же значения, что для формулы I.
Твердый носитель может быть выбран из ряда гидроксисмол. Подходящие гидроксисмолы включают, но без ограничения ими, гидроксиметилполистирольную смолу, смолу Wang'a (известную также как 4-гидроксиметилфеноксисмола или "ГМФ-смола"), HMPA-PEGA (ГМФУ-ПЭГА) смолу (или 4-гидроксиметилфеноксиуксусная кислота и бисакриламидопроп-1-илполиэтиленгликоль), HMPB-BHA (ГМФБ-БГА) смолу (или 4-гидрокси-3-метоксифеноксимасляная кислота-бензгидриламин), HMPB-MBHA (ГМФБ-МБГА) смолу (4-гидроксиметил-3-метоксифеноксимасляная кислота-метилбензгидриламин) и их сочетания. Теоретическая загрузка смолы может быть или низкой (например, менее приблизительно 0,1 ммоль/г), или высокой (например, больше приблизительно 0,4 ммоль/г), но для получения продукта в большем количестве предпочтительна высокая загрузка, более предпочтительно приблизительно 0,4-1,5 ммоль/г. Можно использовать смолу либо порядка 100-200 меш, либо порядка 200-400 меш. Предпочтительными смолами являются смолы гидроксиметилполистирол или смола Wang'a приблизительно 100-200 меш, при высокой загрузке.
Используемый твердый носитель зависит от выбранных реагентов, используемого растворителя и требуемого продукта. Смола обычно имеет функциональные группы такого типа и количества, которые позволяют эффективное присоединение реагентов, а также эффективное высвобождение продукта. Вдобавок, смола должна быть способной к набуханию в используемом растворителе. Используемое количество смолы зависит от количества используемых реагентов и требуемых масштабов проведения реакции. Обычно можно использовать приблизительно от 1 мг до 100 г смолы.
Соединения формулы III могут быть получены по любой из двух реакционных схем с применением соединения аминоиндолина следующей формулы:
где R1, R2 и R3 принимают те же значения, что для формулы I.
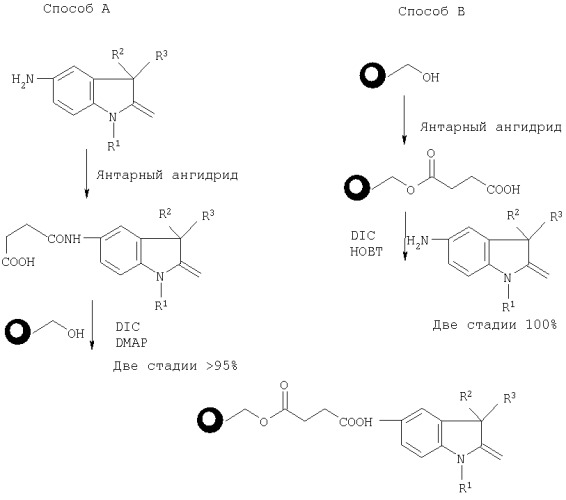
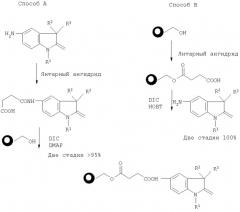
Реакционные схемы получения соединения формулы III с применением аминоиндолиносоединений показаны ниже:
По способу А аминоиндолиновое соединение IV обрабатывают янтарным ангидридом в условиях, подходящих для образования янтарной кислоты. Конкретнее, взаимодействие осуществляют при температуре порядка 0-60°C, предпочтительно при температуре, близкой к комнатной, в инертной атмосфере, включающей, но без ограничения ими, аргон или азот, в течение порядка 3-24 часов. Количество используемых реагентов определяется количеством требуемого продукта и обычно составляет приблизительно от 1 мг до 100 г, предпочтительно примерно от 100 мг до 10 г.Затем к смеси добавляют гидроксисмолу наряду с диизопропилкарбодиимидом ("DIC-ДИК") и диметиламинопиридином ("DMAP-ДМАП") до получения суспензии из гранул полимера. Указанную суспензию из гранул полимера встряхивают в условиях, подходящих для проведения реакции сочетания. Подходящими условиями взаимодействия являются температура порядка 0-60°C, предпочтительно близкая к комнатной, приблизительно 14-24 часа в инертной атмосфере. Протекание реакции сочетания можно контролировать с помощью приборов, используя общепринятые способы, включающие, но не в порядке ограничения, FT-ИК (инфракрасная спектроскопия с Фурье-преобразованием) или однолучевую (single bead) FT-ИК. Обычно взаимодействие, приводящее к образованию несущей индолин смолы, завершается после 24 часов при комнатной температуре.
По способу B гидроксисмолу встряхивают с избытком янтарного ангидрида в условиях, подходящих для проведения реакции сочетания. Подходящими условиями взаимодействия являются температура порядка 60-120°C, предпочтительно порядка 70-100°C, в течение приблизительно 10-60 часов, предпочтительно порядка 24-48 часов. Протекание реакции можно контролировать, используя любые общепринятые способы, и обычно взаимодействие завершается после 48 часов нагревания до температуры кипения с обратным холодильником. После завершения взаимодействия избыток янтарного ангидрида вымывают и смолу, теперь соединенную с янтарной кислотой, обрабатывают аминоиндолином формулы IV наряду с 1-гидроксибензотриазолом ("HOBT-ГОБТ") и ДИК. Подходящими для обработки условиями являются температура порядка 0-60°C, предпочтительно комнатная температура, и инертная атмосфера.
По обоим способам загрузка обычно превышает порядка 95%. Может быть использован любой общепринятый способ проверки загрузки, включая, но без ограничения им, описанный в 63(3) J. Org. Chem., 708-718 (1998). Гексаметилдисилоксан ("HMDSO-ГМДСО") может быть использован в качестве внутреннего стандарта для целей 1H-ЯМР анализа.
Соединения аминоиндолина формулы IV могут быть получены восстановлением производных нитроиндолина формулы
где R1, R2 и R3 принимают те же значения, что для формулы I.
Подходящие производные нитроиндолина формулы V могут быть получены нитрованием производных индолина, как описано в 101 (8) Bull. Soc. Chim. Bdg., 719-739 (1992). Производные индолина можно нитровать азотной кислотой в охлажденной ниже 10°C серной кислоте, предпочтительно ниже 7°C, приблизительно за период 10 часов.
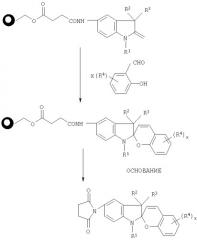
При синтезе в твердой фазе соединений индолиноспиропирана по изобретению смола, несущая индолин в количестве обычно приблизительно 100 мг - 100 г, предпочтительно около 100 мг -10 г, отвечающая формуле III, может быть расщеплена и обработана любым из множества производных салицилальдегида в условиях, подходящих для образования требуемого соединения индолиноспиропирана. Подходящими условиями проведения синтеза являются температура порядка 50-120°C в инертной атмосфере в течение приблизительно 14 часов - 11 дней, предпочтительно приблизительно от 14 часов до 3 дней. Подходящие производные салицилальдегида имеют формулу
где R4 и х принимают те же значения, что для формулы I.
Синтез в твердой фазе протекает следующим образом:
Синтез проводят в любом подходящем растворителе, предпочтительно в диоксане, диметилформамиде ("DMF-ДМФА"), N-метилпирролидоне ("NMP-НМП"), тетрагидрофуране ("THF-ТГФ") или их комбинации. Высвобождение соединения формулы I с твердого носителя может быть выполнено любым удобным способом, таким как способ катализа основанием с применением любого подходящего основания, включающего, но без ограничения ими, пиперидин, DBU-ДБК, метилат натрия, трет-бутилат калия. Обычно используют порядка 3-4 эквивалентов производного салицилальдегида для взаимодействия приблизительно с 1,1-10 эквивалентами, предпочтительно примерно 2-5, более предпочтительно примерно с 3-4 эквивалентами несущей индол смолы.
Соединения по изобретению полезны для широкого ряда возможных вариантов применения, таких как глазные линзы, ветровые стекла, окна и тому подобные изделия, в которых может быть использовано явление фотохромизма. Более конкретно, эффективное количество соединений по изобретению вводят в состав глазных линз, ветровых стекол, окон и тому подобных изделий, или покрывают названные изделия эффективным количеством соединений по изобретению. Изделия, в которые включено соединение или на которые оно нанесено в виде слоя, темнеют под действием ультрафиолетового света и возвращаются к исходной окраске или обесцвечиваются в отсутствие УФ-света при температурах окружающей среды. Эффективным количеством соединения является количество порядка 10-5-10-2 моль/л, предпочтительно порядка 10-5-10-3 моль/л. Способы включения в такие изделия фотохромных соединений или покрытия изделий фотохромными соединениями, такими как соединения по изобретению, хорошо известны из уровня техники.
Изобретение поясняется следующими не ограничивающими примерами.
Пример 1
5-Нитро-1,3,3-триметилиндолин
2,3,4-Триметилиндолин (17,3 г, 0,1 моль) добавляют к 45 мл охлажденной серной кислоты по каплям при температуре ниже 5°C и перемешивании. Затем 7,0 г азотной кислоты (1 моль) в 18 мл серной кислоты добавляют по каплям при перемешивании в течение 1 ч, поддерживая температуру ниже 7°C. Перемешивание продолжают в течение 3 ч при 7°C. Затем оставляют смесь стоять в холодильнике в течение ночи, после чего оранжево-коричневый раствор выливают на колотый лед и осторожно нейтрализуют водным гидроксидом натрия до pH 4-5. Образовавшийся оранжево-красный осадок фильтруют отсасыванием и тщательно промывают водой перед поглощением диэтиловым эфиром. Удаляют растворитель из эфиратного раствора, высушенного безводным сульфатом натрия, и остаток перекристаллизовывают из метиленхлорида, получая 13 г желтовато-коричневого твердого вещества. Выход 5-нитро-1,3,3-триметилиндолина равен 59,6%.
Пример 2
5-Амино-1,3,3-триметилиндолин
5-Нитро-1,3,3-триметилиндолин (8,16 г, 40 ммоль) добавляют к раствору хлорида двухвалентного олова (53 г, 280 ммоль) в 200 мл соляной кислоты при перемешивании. Смесь осторожно нагревают до температуры кипения с обратным холодильником в течение 16 ч. Охлажденную реакционную смесь выливают на колотый лед, подщелачивают концентрированным раствором гидроксида натрия и экстрагируют этилацетатом (4×200 мл). Объединенные этилацетатные растворы сушат безводным сульфатом натрия и обесцвечивают небольшим количеством активированного угля. Растворитель удаляют и остаток перекристаллизовывают из этилацетата, получая 5,96 г желтого твердого вещества, выход 5-амино-1,3,3-триметилиндолина составляет 80%.
Пример 3a
Сложный эфир амида 1,3,3-триметилиндолин-5-ил-
янтарной кислоты и смолы Wang'a
5-Амино-1,3,3-триметилиндолин (1,94 г, 10,3 ммоль) в 5 мл безводного тетрагидрофурана добавляют по каплям в атмосфере азота к 5 мл ТГФ в растворе с 1,0 г (10 ммоль) янтарного ангидрида в течение 1 ч. Смесь перемешивают при комнатной температуре в течение 7 ч. Добавляют смолу Wang'a (теоретическая загрузка 1,28 ммоль/г, 5 г, 6,4 ммоль), диизопропилкарбодиимид (1,26 г, 10 ммоль) и ДМАП (61,1 мг, 0,5 ммоль). Суспензию встряхивают при комнатной температуре 24 ч и затем фильтруют через спеченный стеклянный агломерат, промывают ТГФ (4×15 мл), ДМФА (4×15 мл), дихлорметаном (4×10 мл) и сушат в вакууме. Получают 7,82 г полимерных гранул.
50,9 мг полимерных гранул оставляют набухать в 1 мл ТГФ и выделяют 0,01 M ТГФ раствором трет-бутилата калия (3×0,2 мл, 3×15 мин). Объединенный ТГФ раствор встряхивают с тонко измельченным дигидрофосфатом натрия и безводным сульфатом натрия, фильтруют и промывают ТГФ. Растворитель удаляют в вакууме. К остатку добавляют хлороформ и затем удаляют в вакууме для удаления следов ТГФ. Остаток сушат в вакууме и добавляют 1 мл 0,01 M гексаметилдисилоксана в CDCl3. Из значения интеграла для протона N-Me или сукцинила против соответствующего интеграла для внутреннего стандарта рассчитывают загрузку сложного эфира амида 1,3,3-триметилиндолин-5-илянтарной кислоты на смоле Wang'a, которая равна 95,6%.
Пример 3b
Смолу Wang'a (теоретическая загрузка 1,28 ммоль/г, 3,0 г, 3,84 ммоль), 2,0 г (20 ммоль) янтарной кислоты и 47 мг (0,38 ммоль) ДМАП нагревают до температуры кипения с обратным холодильником в ТГФ в течение 48 ч, охлаждают, фильтруют через спеченный стеклянный агломерат и промывают ТГФ (3×10 мл), ДМФА (3×10 мл), дихлорметаном (2×10 мл), метанолом (3×10 мл) и дихлорметаном (2×10 мл). После высушивания в вакууме получают 3,524 г белой смолы.
1,37 г (1,5 ммоль) суспензии из гранул смолы, 5-амино-1,3,3-триметилиндолина (3,76 г, 2,0 ммоль), ГОБТ (12% воды, 322 мг, 2,1 ммоль) и ДИК (265 мг, 2,1 ммоль) в 15 мл ТГФ встряхивают в течение ночи при комнатной температуре в атмосфере азота, фильтруют через спеченный стеклянный агломерат и промывают ТГФ (3×5 мл), водой (2×5 мл), ДМФА (2×3 мл), ТГФ (3×3 мл) и дихлорметаном (3×3 мл). После высушивания в вакууме получают 1,725 г пурпуровых гранул сложного эфира амида 1,3,3-триметилиндолин-5-илянтарной кислоты на смоле Wang'a. Загрузку определяют количественно, используя способ, описанный в примере 3a.
Пример 4
5-Сукцинимидо-1',3',3'-триметилспиро-[2H-1-бензопиран-2,2'-индолин]
Расщепленный полимер в гранулах по примеру 3a (0,243 г, соответствующие 0,2 ммоль теоретической загрузки) оставляют набухать в 3 мл ДМФА в атмосфере азота в течение 1 ч, затем встряхивают со 100 мг (0,8 ммоль) салицилальдегида при 60°C в течение 14 ч, после чего охлаждают, фильтруют через спеченный стеклянный агломерат и промывают ДМФА (5×3 мл) и оставляют в 3 мл ДМФА на ночь. Снова фильтруют и промывают ДМФА (3×3 мл), дихлорметаном (3×3 мл), ТГФ (3×2 мл) и безводным ТГФ (3×2 мл).
Полимер в гранулах, суспендированный в 2 мл ТГФ, добавляют к 0,25 мл (0,1 M) ТГФ раствора трет-бутилата калия, оставляют на 15-20 минут, фильтруют и промывают 1 мл безводного ТГФ. Процедуру высвобождения повторяют, используя 0,1-0,15 мл (0,1 M) раствора трет-бутилата калия в ТГФ. Объединенный ТГФ раствор встряхивают с небольшим количеством тонко измельченного дигидрофосфата натрия, фильтруют, растворитель удаляют и остаток сушат в вакууме. Получают 80,5 мг вязкого масла, выход 5-сукцинимидо-1',3',3'-триметилспиро-[2H-1-бензопиран-2,2'-индолина] 96,4% чистоты составляет 106,6%.
Пример 5
6-Бром-5'-сукцинимидо-1',3',3'-триметилспиро-[2H-1-бензопиран-2,2'-индолин]
Повторяют методику примера 4 за тем исключением, что используют 5-бромсалицилальдегид (121 мг, 0,6 ммоль). Выход 6-бром-5'-сукцинимидо-1',3',3'-триметилспиро-[2H-1-бензопиран-2,2'-индолина] 94,3% чистоты составляет 118%.
Пример 6
6-Хлор-5'-сукцинимидо-1',3',3'-триметилспиро-[2H-1-бензопиран-2,2'-индолин]
Повторяют методику примера 4 за тем исключением, что используют 5-хлорсалицилальдегид (95 мг, 0,6 ммоль). Выход 6-хлор-5'-сукцинимидо-1',3',3'-триметилспиро-[2H-1-бензопиран-2,2'-индолина 97,6% чистоты составляет 111,8%.
Пример 7
6-F-5'-Сукцинимидо-1',3',3'-триметилспиро-[2H-1-бензопиран-2,2'-индолин]
Повторяют методику примера 4 за тем исключением, что используют 5-F-салицилальдегид (84 мг, 0,6 ммоль). Выход 6-F-5'-сукцинимидо-1',3',3'-триметилспиро-[2H-1-бензопиран-2,2'-индолина] 97,6% чистоты составляет 119,4%.
Пример 8
6-Нитро-5'-сукцинимидо-1',3',3'-триметилспиро-[2H-1-бензопиран-2,2'-индолин]
Повторяют методику примера 4 за тем исключением, что используют 5-нитросалицилальдегид (100 мг, 0,6 ммоль). Выход 6-нитро-5'-сукцинимидо-1',3',3'-триметилспиро-[2H-1-бензопиран-2,2'-индолина] 97,9% чистоты составляет 119,8%.
Пример 9
6,8-Дихлор-5'-сукцинимидо-1',3',3'-триметилспиро-[2H-1-бензопиран-2,2'-индолин]
Повторяют методику примера 4 за тем исключением, что используют 3,5-дихлорсалицилальдегид (115 мг, 0,6 ммоль). Выход 6,8-дихлор-5'-сукцинимидо-1',3',3'-триметилспиро-[2H-1-бензопиран-2,2'-индолина] 97,8% чистоты составляет 107,7%.
Пример 10
6,8-Дибром-5'-сукцинимидо-1',3',3'-триметилспиро-[2H-1-бензопиран-2,2'-индолин]
Повторяют методику примера 4 за тем исключением, что используют 3,5-дибромсалицилальдегид (167 мг, 0,6 ммоль). Выход 6,8-дибром-5'-сукцинимидо-1',3',3'-триметилспиро-[2H-1-бензопиран-2,2'-индолина] 97,6% чистоты составляет 106,6%.
Пример 11
6,8-Дииод-5'-сукцинимидо-1',3',3'-триметилспиро-[2H-1-бензопиран-2,2'-индолин]
Повторяют методику примера 4 за тем исключением, что используют 3,5-дииодсалицилальдегид (225 мг, 0,6 ммоль). Выход 6,8-дииод-5'-сукцинимидо-1',3',3'-триметилспиро-[2H-1-бензопиран-2,2'-индолина] 97,7% чистоты составляет 99,5%.
Пример 12
6-Бром-8-метокси-5'-сукцинимидо-1',3',3'-триметилспиро-[2H-1-бензопиран-2,2'-индолин]
Повторяют методику примера 4 за тем исключением, что используют 5-бром-2-гидрокси-3-метоксибензальдегид (139 мг, 0,6 ммоль). Выход 6-бром-8-метокси-5'-сукцинимидо-1',3',3'-триметилспиро-[2H-1-бензопиран-2,2'-индолина] 98,6% чистоты составляет 96,1%.
Пример 13
8-Формил-6-метил-5'-сукцинимидо-1',3',3'-триметилспиро-[2H-1-бензопиран-2,2'-индолин]
Повторяют методику примера 4 за тем исключением, что используют 2-гидрокси-5-метил-1,3-бензолдикарбоальдегид (99 мг, 0,6 ммоль) и суспензию полимера в гранулах встряхивают 24 ч при 60°C. Выход 8-формил-6-метил-5'-сукцинимидо-1',3',3'-триметилспиро-[2H-1-бензопиран-2,2'-индолина] 96,1% чистоты составляет 98,6%.
Пример 14
8-Гидрокси-5'-сукцинимидо-1',3',3'-триметилспиро-[2H-1-бензопиран-2,2'-индолин]
Повторяют методику примера 13 за тем исключением, что используют 2,3-дигидроксибензальдегид (100 мг, 0,6 ммоль). Выход 8-гидрокси-5'-сукцинимидо-1',3',3'-триметилспиро-[2H-1-бензопиран-2,2'-индолина] составляет 112,6%.
Пример 15
6-Метил-5'-сукцинимидо-1',3',3'-триметилспиро-[2H-1-бензопиран-2,2'-индолин]
Повторяют методику примера 4 за тем исключением, что используют 5-метилсалицилальдегид (82 мг, 0,6 ммоль) и суспензию полимера в гранулах встряхивают при 60°C 24 ч и затем 14 ч при 80°C. Выход 6-метил-5'-сукцинимидо-1',3',3'-триметилспиро-[2H-1-бензопиран-2,2'-индолина] 96,3% чистоты составляет 95,9%.
Пример 16
8-Метил-5'-сукцинимидо-1',3',3'-триметилспиро-[2H-1-бензопиран-2,2'-индолин]
Повторяют методику примера 15 за тем исключением, что используют 3-метилсалицилальдегид (82 мг, 0,6 ммоль). Выход 6-метил-5'-сукцинимидо-1',3',3'-триметилспиро-[2H-1-бензопиран-2,2'-индолина] 96,3% чистоты составляет 103,7%.
Пример 17
6-Метокси-5'-сукцинимидо-1',3',3'-триметилспиро-[2H-1-бензопиран-2,2'-индолин
Повторяют методику примера 4 за тем исключением, что используют 2-гидрокси-5-метоксибензальдегид (91 мг, 0,6 ммоль) и суспензию полимера в гранулах встряхивают при 60°C 18 ч и затем 14 ч при 80°C. Выход 6-метокси-5'-сукцинимидо-1',3',3'-триметилспиро-[2H-1-бензопиран-2,2'-индолина] 96,1% чистоты составляет 97,2%.
Пример 18
8-Этокси-5'-сукцинимидо-1',3',3'-триметилспиро-[2H-1-бензопиран-2,2'-индолин]
Повторяют методику примера 17 за тем исключением, что используют 2-гидрокси-3-этоксибензальдегид (99 мг, 0,6 ммоль). Выход 8-этокси-5'-сукцинимидо-1',3',3'-триметилспиро-[2H-1-бензопиран-2,2'-индолина] 96,4% чистоты составляет 98,8%.
Пример 19
8-Метокси-5'-сукцинимидо-1',3',3'-триметилспиро-[2H-1-бензопиран-2,2'-индолин]
Повторяют методику примера 4 за тем исключением, что используют O-ванилин (91 мг, 0,6 ммоль). Выход 8-метокси-5'-сукцинимидо-1',3',3'-триметилспиро-[2H-1-бензопиран-2,2'-индолина] 96,6% чистоты составляет 110%.
Пример 20
6-Трифторметокси-5'-сукцинимидо-1',3',3'-триметилспиро-[2H-1-бензопиран-2,2'-индолин]
Повторяют методику примера 4 за тем исключением, что используют 2-гидрокси-5-трифторметоксибензальдегид (95 мг, 0,46 ммоль) и суспензию полимера в гранулах встряхивают 18 ч при комнатной температуре и затем 3 ч при 60°C. Выход 6-трифторметокси-5'-сукцинимидо-1',3',3'-триметилспиро-[2H-1-бензопиран-2,2'-индолина] составляет 88%.
Пример 21
6-Гидрокси-5'-сукцинимидо-1',3',3'-триметилспиро-[2H-1-бензопиран-2,2'-индолин]
Повторяют методику примера 4 за тем исключением, что используют 2,5-дигидроксибензальдегид (100 мг, 0,6 ммоль) и суспензию полимера в гранулах встряхивают при 60°C 24 ч и затем 15 ч при 80°C. Выход 6-гидрокси-5'-сукцинимидо-1',3',3'-триметилспиро-[2H-1-бензопиран-2,2'-индолина] составляет 103,2%.
Пример 22
6-трет-Бутил-5'-сукцинимидо-1',3',3'-триметилспиро-[2H-1-бензопиран-2,2'-индолин]
Повторяют методику примера 21 за тем исключением, что используют 5-трет-бутилсалицилальдегид (107 мг, 0,6 ммоль). Выход 6-трет-бутил-5'-сукцинимидо-1',3',3'-триметилспиро-[2H-1-бензопиран-2,2'-индолина] 96,6% чистоты составляет 89,4%.
Пример 23
8-трет-Бутил-5'-сукцинимидо-1',3',3'-триметилспиро-[2H-1-бензопиран-2,2'-индолин]
Повторяют методику примера 21 за тем исключением, что используют 3-трет-бутилсалицилальдегид (107 мг, 0,6 ммоль) и суспензию полимера в гранулах встряхивают при 60°C 18 ч и затем 14 ч при 80°C. Выход 8-трет-бутил-5'-сукцинимидо-1',3',3'-триметилспиро-[2H-1-бензопиран-2,2'-индолина] 96% чистоты составляет 97,7%.
Пример 24
6,8-Ди-трет-бутил-5'-сукцинимидо-1',3',3'-триметилспиро-[2H-1-бензопиран-2,2'-индолин]
Повторяют методику примера 4 за тем исключением, что используют 3,5-ди-трет-бутилсалицилальдегид (180 мг, 0,6 ммоль) и суспензию полимера в гранулах встряхивают при 60°C 18 ч и затем 14 ч при 80°C. Выход 6,8-ди-трет-бутил-5'-сукцинимидо-1',3',3'-триметилспиро-[2H-1-бензопиран-2,2'-индолина] 95% чистоты составляет 101,2%.
Пример 25
7-Метокси-5'-сукцинимидо-1',3',3'-триметилспиро-[2H-1-бензопиран-2,2'-индолин]
Повторяют методику примера 4 за тем исключением, что используют 2-гидрокси-4-метоксибензальдегид (91 мг, 0,6 ммоль) и суспензию полимера в гранулах встряхивают при 60°C 58 ч и затем 14 ч при 80°C. Выход 7-метокси-5'-сукцинимидо-1',3',3'-триметилспиро-[2H-1-бензопиран-2,2'-индолина] составляет 82,1%.
Пример 26
5,7-Диметокси-5'-сукцинимидо-1',3',3'-триметилспиро-[2H-1-бензопиран-2,2'-индолин]
Повторяют методику примера 4 за тем исключением, что используют 2-гидрокси-4,6-диметоксибензальдегид (240 мг, 2,0 ммоль) и суспензию полимера в гранулах встряхивают при 60°C 24 ч и затем 11 дней при 80°C. Выход 5,7-диметокси-5'-сукцинимидо-1',3',3'-триметилспиро-[2H-1-бензопиран-2,2'-индолина] 96,8% чистоты составляет 82,9%.
Пример 27
8-Метокси-6-нитро-5'-сукцинимидо-1',3',3'-триметилспиро-[2H-1-бензопиран-2,2'-индолин]
162 мг расщепленного полимера в гранулах по примеру 3b, соответствующего 0,14 ммоль теоретической загрузки, оставляют набухать в 3 мл ДМФА в атмосфере азота на 1 час, встряхивают с 8-метокси-5-нитросалицилальдегидом (83 мг, 0,42 ммоль) при 60°C 14 ч. Суспензию охлаждают, фильтруют через спеченный стеклянный агломерат, промывают ДМФА (5×1 мл), оставляют в 3 мл ДМФА на ночь, снова фильтруют и промывают ДМФА (3×1 мл), ТГФ (3×1 мл), дихлорметаном (3×2 мл) и ТГФ (3×2 мл). К суспендированному в 1 мл ТГФ полимеру в гранулах добавляют 1 мл 0,1 M раствора ДБК в ТГФ, оставляют на 10 ч, фильтруют и промывают ТГФ (2×1 мл). Процедуру выделения повторяют дважды. Объединенный ТГФ-раствор пропускают через короткую колонку с силикагелем, элюируя ТГФ, для удаления ДБК. Растворитель удаляют и остаток сушат в вакууме, получая выход 8-метокси-6-нитро-5'-сукцинимидо-1',3',3'-триметилспиро-[2H-1-бензопиран-2,2'-индолина] 104,6%.
1. Способ получения соединения - производного индолиноспиропирана формулы
где R1 означает C1-C18-алкил, каждый из R2 и R3 независимо означает C1-C4-алкил, R4 означает водород, гидрокси, трихлорметил, трифторметил, формил, C1-С4-алкил, галоген, С1-С4-алкокси, нитро и х равен 1 или 2,
включающий стадии
(i) получения индолина на полимерном носителе формулы
где R1 означает С1-С18-алкил, каждый из R2 и R3 независимо означает C1-C4-алкил;
(ii) обработку несущего индолин полимерного носителя, где данный носитель представляет собой гидроксисмолу, при температуре от 50 до 120°С, в инертной атмосфере, в течение времени от 14 часов до 11 дней, производным салицилальдегида формулы
где R4 означает водород, гидрокси, трихлорметил, трифторметил, формил, С1-С4-алкил, галоген, С1-С4-алкокси, нитро и х равен 1 или 2,
с получением соединения индолиноспиропирана формулы (I) и
(iii) высвобождение соединения индолиноспиропирана формулы (I).
2. Способ по п.1, где гидроксисмола представляет собой гидроксиметилполистирольную смолу, смолу Wang'a, смолу ГМФУ-ПЭГА, смолу ГМФБ-БГА, смолу ГМФБ-МБГА или их сочетания.
3. Способ по п.1, где используют смолу с размерами гранул около 100-200 меш либо около 200-400 меш.
4. Способ по п.1, где используют гидроксиметилполистирольную смолу или смолу Wang'a с размерами гранул приблизительно 100-200 меш, с высокой загрузкой.
5. Способ по п.1, дополнительно включающий стадию получения несущего индолин полимерного носителя путем
(i) обработки соединения аминоиндолина формулы
где R1 означает C1-C18-алкил, каждый из R2 и R3 независимо означает C1-C4-алкил, янтарным ангидридом;
(ii) добавления впоследствии к смеси гидроксисмолы, диизопропилкарбодиимида и диметиламинопиридина с образованием суспензии из гранул полимера и
(iii) встряхивание суспензии из гранул полимера с получением несущего индолин полимерного носителя.
6. Способ по п.1, дополнительно включающий получение несущего индолин полимерного носителя путем
(i) встряхивания избытка гидроксисмолы с избытком янтарного ангидрида при температуре порядка 60-120°С в течение приблизительно 24-48 часов для соединения смолы и янтарной кислоты;
(ii) последующего отмывания избытка янтарного ангидрида и
(iii) обработки смолы, соединенной с янтарной кислотой, 1-гидроксибензотриазолом и ДИК приблизительно при 0-60°С и в инертной атмосфере и аминоиндолином формулы IV
где R1 означает C1-C18-алкил, каждый из R2 и R3 независимо означает С1-С4-алкил.
7. Способ по п.5, дополнительно включающий стадии получения соединения аминоиндолина путем восстановления производного нитроиндолина формулы
где R1 означает C1-C18-алкил, каждый из R2 и R3 независимо означает C1-C4-алкил.
8. Способ по п.6, дополнительно включающий стадии получения соединения аминоиндолина путем восстановления производного нитроиндолина формулы
где R1 означает С1-С18-алкил, каждый из R2 и R3 независимо означает C1-C4-алкил.