Стероидное соединение, его применение и способ лечения
Иллюстрации
Показать всеИзобретение относится к стероидным соединениям общей формулы I, где R1-O, R2 и R независимо - Н, СН3, С2Н5 и по меньшей мере один из R2 и R3-СН3 и С2Н5; R4-H. Соединения полезны при лечении, связанном с андрогенами, таком, как недостаточность андрогенов и контрацепции для мужчин и женщин. 3 н. и 2 з.п.ф-лы, 1 табл.
Реферат
Изобретение относится к новым 17α-гидрокси-14β-стероидным соединениям и их применению для лечения, связанного с андрогенами.
Известны стероидные соединения для применения в лечении, связанном с андрогенами, например, из патента США №3338925 и Jacqnesy et al. Bull Soc Chim France, Vol. 5; 1975: pp. 2281-2288. В данных публикациях раскрыты производные 19-нор-андростана с 17α-гидрокси-14β-стереоконфигурацией. Такие соединения можно использовать для получения гормональных эффектов, конкретнее некоторые из них для получения андрогенных эффектов. Последние эффекты направлены на лечение, приводящее к восстановлению недостаточности тестостерона или получению стерильности у мужчин в целях контрацепции. Важно, что данные соединения можно использовать при пероральном введении и, что продолжительность действия является достаточно высокой, чтобы отпала необходимость введения активного соединения в больших количествах в стандартных лекарственных формах.
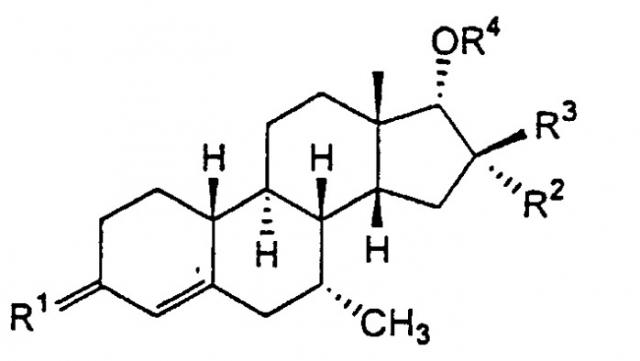
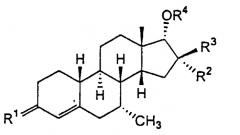
Данное изобретение относится к стероидам формулы I
,
в которой
R1 представляет О, (Н,Н), (Н,ОН), NOH, где ОН необязательно этерифицирована или эстерифицирована;
R2 и R3 независимо представляют водород или (С1-4)алкил и, по меньшей мере, один из R2 и R3 представляет (С1-4)алкил;
R4 представляет водород или (С1-15)ацил.
Установлено, что данные соединения обладают не только высокой андрогенной активностью, но также очень устойчивы к метаболизму в печени. Низкое воздействие на активное соединение важно для снижения риска появления побочных эффектов. Полезность соединений явилась неожиданной также в свете публикации Heusser et al., Helv Chim Acta, Vol. 22, 1949, pp. 1245-1251, в которой сообщалось, что 17α-гидрокси-14β-тестостерон не обладает андрогенной активностью.
Особенно подходящий профиль для применения в качестве лекарственного средства для перорального введения для лечения, связанного с андрогенами, проявляет соединение формулы I, в которой R1 представляет оксо, и, по меньшей мере, один из R2 и R3 является метилом, и другой представляет водород или метил. Особенно предпочтительным соединением по изобретению является (7α,14β,16β,17α)-17-гидрокси-7,16-диметилэстр-4-ен-3-он.
Термин (С1-4)алкил, как он используется при определении формулы I, означает разветвленный или неразветвленный алкил, имеющий 1-4 атомов углерода, такой как метил, этил, пропил, изопропил, бутил, изобутил и трет-бутил. Предпочтительными алкильными группами являются метил и этил.
Термин (С1-15)ацил означает ацил, полученный из карбоновой кислоты, имеющий 1-15 атомов углерода, такой как формил, ацетил, пропаноил, бутирил, 2-метилпропаноил, пентаноил, пивалоил, гексаноил и подобные. Также в определение (С1-15)ацил входят ацильные группы, полученные из дикарбоновых кислот, такие как полумалоил, полусукциноил, полуглутароил и т.д. Предпочтительным является полусукциноил.
Изобретение также относится к соединениям, описанным выше, как к лекарственным средствам. Соединения можно использовать для, помимо прочего, контрацепции у мужчин или заместительной гормональной терапии у мужчин или женщин. В общем целью данного лечения является получение андрогенного эффекта в организме, таком как животное или человек. Следовательно, подобное лечение относится в данном описании к лечению, связанному с андрогенами. Таким образом, изобретение также относится к способу лечения животного или человека при необходимости андрогенной стимуляции для получения андрогенного эффекта введением эффективного количества любого из вышеуказанных соединений животному или человеку. Конкретнее, изобретение относится к способу лечения недостаточности андрогена введением мужчине или женщине эффективного количества любого из вышеуказанных соединений. Изобретение также относится к применению любого из вышеуказанных соединений для получения лекарственного средства для лечения недостаточности андрогена. В контексте изобретения термин «недостаточность андрогена» относится ко всем видам заболеваний, нарушений и симптомов, при которых мужчина или женщина страдают в результате слишком низкого уровня тестостерона, например, что имеет место у мужчин с гипогонадизмом. В частности, недостаток андрогенов, подвергающийся лечению соединением по изобретению, представляет снижение уровня тестостерона, что происходит у мужчин с возрастом (тогда соединение по изобретению используют для заместительной терапии мужскими гормонами), или когда он подвергается мужской контрацепции. В отношении мужской контрацепции, соединение особенно пригодно для нейтрализации действия схем гормональной контрацепции у мужчин, в которых стерилизующее средство такое, как прогестаген или ЛГВГ (высвобождающий гормон лютеинизирующего гормона) вводят регулярно, например ежедневно, или оно используется в качестве единственного контрацептивного средства для мужчин.
В принципе андрогены можно вводить любым подходящим путем, доступным специалисту в данной области. Как уже указывалось выше, пероральное введение является предпочтительным, наиболее предпочтительно в виде твердой дозированной единицы, такой как таблетка или капсула. Изобретение также относится к фармацевтическим композициям, содержащим соединение, описанное выше, и фармацевтически приемлемый носитель. Так, носитель может быть в твердой форме или жидкой форме, и композиция может быть дозированной единицей для перорального введения, такой как таблетка или раствор для перорального введения, например, в капсуле. Способы и композиции для получения таких дозированных единиц хорошо известны специалистам в данной области. Например, общепринятые способы получения таблеток и пилюль, содержащих активные ингредиенты, описаны в общепризнанной ссылке, Gennaro et al., Remington's Pharmaceutical Sciences (18th ed., Mack Publishing Company, 1990, особо смотри Part 8: Pharmaceutical Preparations and Their Manufacture). Соединение можно также вводить в виде имплантанта, пластыря или с помощью любого другого подходящего устройства для замедленного высвобождения композиции с андрогенами.
Доза и схема введения соединений по изобретению или их фармацевтической композиции, которую вводят, очевидно будет зависить от терапевтического эффекта, которого следует достичь, и будет изменяться в зависимости от пути введения, возраста и состояния субъекта, которому вводят лекарственное средство, и/или конкретной схемы для контрацепции или заместительной гормональной терапии, по которой они используются. Как правило, дозы составляют 0,001-5 мг на кг массы тела.
Соединения по изобретению можно получить различными способами, известными в области органической химии, в общем, и в области химии стероидов, в частности (смотри, например, Fried J. et al., Organic Reactions in Steroid Chemistry, Volumes I and II, Van Nostrand Reinhold Company, New York, 1972).
Например, подходящим исходным соединением для получения соединений формулы I, в которой R1 представляет оксо, R2 и R3 имеют значения, определенные выше, и R4 представляет водород, является соединение общей формулы II, синтез которого описан в WO 00/53619.
Возможный путь синтеза соединений по изобретению начинается с алкилирования соединений формулы II в положении С-16, что обычно приводит к преобладающему или специфическому получению 16β-изомера (реакции алкилирования смотри, например, в Carey F.A., Sundberg R.J. «Advanced Organic Chemistry», Part B: Reactions and Synthesis, Chapter 1, Plenum Press, NY, 1990). Необязательно стереохимия положения С-16 может быть обращена депротонированием с последующим гидролизом. Если желательно, после алкилирования в положении С-16 можно провести вторую реакцию алкилирования в том же положении с использованием того же или другого алкилирующего агента с получением 16,16-диалкилированных соединений.
Карбонильную группу в положении С-17 восстанавливают с использованием NaBH4, LiAlH4 или других реагентов - доноров водорода, что приводит к преобладающему или специфическому получению 17α-гидроксисоединений.
Восстановление по Берчу [Caine D., in Org. Reactions 23, p. 1, Wiley, New York, 1976] 16-замещенного (14β,17α)-3-метоксиэстра-1,3,5(10)-триен-17-ола и в конце гидролиз 2,5(10)-диена дают производное 16-замещенного (14β,17α)-17-гидроксиэстр-4-ен-3-она по изобретению.
Соединения по изобретению, в которых R1 представляет (Н,Н), (Н,ОН) или NOH, где ОН необязательно этерифицирована или эстерифицирована, получают с использованием способов, известных в данной области, из соединений формулы I, в которой R1 представляет оксо.
Изобретение далее проиллюстрировано следующими примерами.
Пример 1
(7α,14β,16β,17α)-17-Гидрокси-7,16-диметилэстр-4-ен-3-он
i) Раствор бис(триметилсилил)амида лития (55,5 ммоль) в тетрагидрофуране (96 мл) охлаждали до -40°С. Добавляли по каплям раствор (7α,14β)-3-метокси-7-метилэстра-1,3,5(10)-триен-17-она (WO 00/53619; 15,0 г) в сухом тетрагидрофуране (66 мл), и реакционную смесь перемешивали в течение 45 мин. Затем при -30°С добавляли йодметан (6,3 мл) и перемешивание продолжали в течение 1 часа (-30°С <T -20°С). Смесь выливали в насыщенный водный раствор хлорида аммония, и продукт экстрагировали этилацетатом. Объединенные органические фазы промывали водой и насыщенным раствором соли, сушили над сульфатом натрия и концентрировали при пониженном давлении с получением (7α,14β,16β)-3-метокси-7,16-диметилэстра-1,3,5(10)-триен-17-она (17,33 г). Продукт использовали на последующей стадии без дополнительной очистки.
ii) Раствор продукта, полученного на предшествующей стадии (1,0 г), в тетрагидрофуране (19 мл), метаноле (9,5 мл) и воде (5,6 мл), охлажденный до -7°С, обрабатывали боргидридом натрия (0,35 г). После перемешивания в течение 1 часа при 0°С добавляли еще порцию боргидрида натрия (0,35 г) и перемешивание продолжали в течение 1 часа. Реакционную смесь выливали в воду и продукт экстрагировали этилацетатом. Объединенные органические фазы промывали насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли, сушили над сульфатом натрия и концентрировали при пониженном давлении. Проведение колоночной хроматографии давало (7α,14β,16β,17α)-3-метокси-7,16-диметилэстра-1,3,5(10)-триен-17-ол (1,06 г).
iii) Продукт, полученный на предшествующей стадии (0,98 г), в сухом тетрагидрофуране (34 мл) добавляли к раствору лития (2,15 г) в жидком аммиаке (244 мл), охлажденном до -50°С. Реакционную смесь перемешивали при температуре от -50°С до -40°С в течение 5 час. Добавляли этанол и аммиак выпаривали. Добавляли воду и продукт экстрагировали этилацетатом. Объединенные органические фазы промывали водой и насыщенным раствором соли, сушили над сульфатом натрия и концентрировали при пониженном давлении с получением (7α,14β,16β,17α)-3-метокси-7,16-диметилэстра-2,5(10)-диен-17-ола (1,03 г). Продукт использовали на последующей стадии без дополнительной очистки.
iv) Раствор продукта, полученного на предшествующей стадии (1,03 г), в ацетоне (57 мл) обрабатывали концентрированной соляной кислотой (2,9 мл). После перемешивания в течение 2 ч при комнатной температуре реакционную смесь выливали в воду. Продукт экстрагировали этилацетатом, объединенные органические фазы промывали насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли, сушили над сульфатом натрия и концентрировали при пониженном давлении. Проведение колоночной хроматографии давало (7α,14β,16β,17α)-17-гидрокси-7,16-диметилэстр-4-ен-3-он (0,54 г), [α]D 20=+98,0° (c=0,50, диоксан).
Пример 2
(7α,14β,16α,17α)-17-Гидрокси-7,16-диметилэстр-4-ен-3-он
i) Раствор бис(триметилсилил)амида лития (29 ммоль) в тетрагидрофуране (45 мл) охлаждали до -40°С. Добавляли по каплям раствор (7α,14β,16β)-3-метокси-7,16-диметилэстра-1,3,5(10)-триен-17-она (пример 1, стадия i; 6,0 г) в сухом тетрагидрофуране (24 мл), и реакционную смесь перемешивали в течение 1 часа. Затем реакцию останавливали добавлением насыщенного водного раствора хлорида аммония и продукт экстрагировали этилацетатом. Объединенные органические фазы промывали насыщенным водным раствором хлорида аммония, водой и насыщенным раствором соли, сушили над сульфатом натрия и концентрировали при пониженном давлении с получением (7α,14β,16α)-3-метокси-7,16-диметилэстра-1,3,5(10)-триен-17-она (6,82 г). Продукт использовали на последующей стадии без дополнительной очистки.
ii) После проведения способа, аналогичного описанному в п.ii примера 1, продукт, полученный на предшествующей стадии (1,0 г), превращали в (7α,14β,16α,17α)-3-метокси-7,16-диметилэстра-1,3,5(10)-триен-17-ол (0,62 г).
iii) После проведения способа, аналогичного описанному в п.iii примера 1, продукт, полученный на предшествующей стадии (0,58 г), превращали в (7α,14β,16α,17α)-3-метокси-7,16-диметилэстра-2,5(10)-диен-17-ол (0,59 г).
iv) После проведения способа, аналогичного описанному в п.iv примера 1, продукт, полученный на предшествующей стадии (0,59 г), превращали в (7α,14β,16α,17α)-17-гидрокси-7,16-диметилэстр-4-ен-3-он (0,20 г), [α]D 20=+91,3° (c=0,48, диоксан).
Пример 3
(7α,14β,17α)-17-Гидрокси-7,16,16-триметилэстр-4-ен-3-он
i) После проведения способа, аналогичного описанному в п.i примера 1, (7α,14β,16β)-3-метокси-7,16-диметилэстра-1,3,5(10)-три-ен-17-он (пример 1, стадия i; 6,0 г) превращали в (7α,14β)-3-метокси-7,16,16-диметилэстра-1,3,5(10)-триен-17-он (5,99 г).
ii) После проведения способа, аналогичного описанному в п.ii примера 1, продукт, полученный на предшествующей стадии (1,0 г), превращали в (7α,14β,17α)-3-метокси-7,16,16-триметилэстра-1,3,5(10)-триен-17-ол (0,39 г).
iii) После проведения способа, аналогичного описанному в п.iii примера 1, продукт, полученный на предшествующей стадии (0,32 г), превращали в (7α,14β,17α)-3-метокси-7,16,16-триметилэстра-2,5(10)-диен-17-ол (0,38 г).
iv) После проведения способа, аналогичного описанному в п.iv примера 1, продукт, полученный на предшествующей стадии (0,38 г), превращали в (7α,14β,17α)-17-метокси-7,16,16-триметилэстр-4-ен-3-он (0,10 г), [α]D 20=+81,1° (c=0,55, диоксан).
Пример 4
Способом, аналогичным способам, описанным в примерах 1 и 3, и с использованием (7α,14β)-3-метокси-7-метилэстра-1,3,5(10)-триен-17-она (WO 00/53619) в качестве исходного вещества получали следующие продукты:
(а) (7α,14β,16β,17α)-16-этил-17-гидрокси-7-метилэстр-4-ен-3-он, [α]D 20=+109° (c=1,00, диоксан);
(b) (7α,14β,16β,17α)-16-этил-17-гидрокси-7,16-диметилэстр-4-ен-3-он, [α]D 20=+89° (c=1,00, диоксан)[посредством алкилирования исходного вещества йодметаном с последующим алкилированием йодэтаном].
Пример 5
(7α,14β,17α)-17-Гидрокси-7-метилэстр-4-ен-3-он
(смотри соединение 2)
i) Раствор (7α,14β)-3-метокси-7-метилэстра-1,3,5(10)-триен-17-она (WO 00/53619; 2,8 г) в сухом этаноле (100 мл), охлажденном до 4°С, обрабатывали боргидридом натрия (0,70 г). После перемешивания в течение 1 часа добавляли еще порцию боргидрида натрия (0,35 г), и перемешивание продолжали еще в течение 3 час. Добавляли по каплям водный раствор уксусной кислоты (50%, 10 мл) и реакционную смесь выливали в воду. Продукт экстрагировали дихлорметаном; объединенные органические фазы промывали насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли, сушили над сульфатом натрия и концентрировали при пониженном давлении с получением (7α,14β,17α)-3-метокси-7-метилэстра-1,3,5(10)-триен-17-ола (2,93 г). Продукт использовали на последующей стадии без дополнительной очистки.
ii) После проведения способа, аналогичного описанному в п.iii примера 1, продукт, полученный на предшествующей стадии (3,40 г), превращали в (7α,14β,17α)-3-метокси-7-метилэстра-2,5(10)-диен-17-ол (3,50 г).
iii) После проведения способа, аналогичного описанному в п.iv примера 1, продукт, полученный на предшествующей стадии (3,30 г), превращали в (7α,14β,17α)-17-гидрокси-7-метилэстр-4-ен-3-он (1,50 г), т. пл. 148,5-149,3°С, [α]D 20=+102° (c=1,00, диоксан).
Пример 6
Андрогенная активность
Трансактивирующую андрогенную активность соединений по изобретению оценивали на клетках яичника китайского хомячка (СНО), трансфектированных человеческим андрогенным рецептором (hAR) в комбинации с вирусом мышиной опухоли молочной железы (MMTV) и геном рецептора люциферазы (время инкубации 16 ч, температура 37°С) и сравнивали с активностью 5α-дигидротестостерона [Schoonen W.G.E.J.; de Ries, R.J.H.; Joosten J.W.H.; Mathijssen-Mommers G.J.W.; Kloosterboer H.J., Analyt. Biochem. 261, 222-224 (1998)]. Результаты приведены в таблице 1.
Пример 7
Определение t1/2 андрогенов по изобретению после инкубации с человеческими гепатоцитами
Период полураспада соединения в результате контакта с человеческими гепатоцитами представляет надежный показатель метаболической стабильности. Хорошо известно, что соединения данной группы стероидов хорошо всасываются, данный тест обеспечивает модель in vitro активности при пероральном введении людям. Следует понимать, что более короткий период полураспада указывает на то, что соединение будет метаболизироваться быстрее или, наоборот, чем длиннее период полураспада, тем лучше соединение может проявлять свое действие на организм человека при пероральном введении.
Гепатоциты, взятые от здоровых молодых мужчин (25-45 лет), доноров органов, консервировали замораживанием в жидком азоте и хранили до использования. Клетки размораживали при 37°С на водяной бане, немедленно помещали на лед, дважды промывали одним объемом холодной (4°С) среды для инкубации [среда Вильямса Е (без фенолового красного) с глутамаксом I®, гентамицином 50 мкг/мл, инсулином 1 мкМ, фетальной телячьей сывороткой 0%(об./об.)], подсчитывали и проверяли жизнеспособность окрашиванием трипановым синим. Клетки инкубировали в виде суспензий в 96-луночных (непокрытых) планшетах при номинальной плотности 3·104 клеток/лунку в 300 мкл среды при 37°С в атмосфере воздух/СО2 (95/5).
Гепатоциты инкубировали с тестируемым соединением при конечной концентрации 100 нМ. Инкубацию останавливали через 0,5, 1 и 2 ч. центрифугированием при 200 g. Собирали супернатант для проведения жидкостной хроматографии в сочетании с масс-спектрометрией (анализ ЖХ-МС/МС) и для биоанализа. Для проведения последнего 10 мкл использовали для определения андрогенной активности. Андрогенную активность определяли, как описано в примере 6. Конечная концентрация соединения для определения андрогенной активности составляла 1 нмоль/л.
Результаты
Метаболическую стабильность (t1/2) соединений по изобретению классифицировали по следующей схеме:
(+++) метаболическая стабильность > 17α-метилтестостерона (МТ);
(++) 17α-метилтестостерон > метаболической стабильности > 80% 17α-метилтестостерона;
(+) 80% 17α-метилтестостерона > метаболической активности > тестостерона;
(-) метаболическая стабильность < тестостерона.
Результаты приведены в таблице 1.
| Таблица 1Андрогенная активность и метаболическая стабильность (t1/2) соединений по изобретению | |||
| Пример | Андрогенная активность | t1/2 ЖХ-МС/МС | Биоанализ |
| 1 | 99,0 | (++) | (++) |
| 2 | 38,7 | (+) | (++) |
| 3 | 78,5 | *а) | (+) |
| 4а | 20,0 | * | (-) |
| 4b | 24,0 | * | (+) |
| а)* означает, что данные или достоверные данные отсутствуют | |||
| Ссыл. соед. 1b | 0,5 | (-) | |
| Ссыл. соед. 1с | 60,5 | (-) | |
| b (14β,17α)-17-гидроксиэстр-4-ен-3-он (патент США №3338925) | |||
| с (7α,14β,17α)-17 гидрокси-7-метилэстр-4-ен-3-он | |||
| (пример 5) |
1. Стероидное соединение формулы I
в которой R1 представляет О;
R2 и R3 независимо представляют водород, метил или этил и, по меньшей мере, один из R2 и R3 представляет метил или этил;
R4 представляет водород.
2. Производное стероидного соединения по п.1, где R1 представляет О и, по меньшей мере, один из R2 и R3 представляет метил, и другой является водородом или метилом.
3. Производное стероидного соединения по п.2, которое представляет собой (7α,14β,16β,17α)-17-гидрокси-7,16-диметилэстр-4-ен-3-он.
4. Применение стероидного соединения по любому из пп.1-3 для производства лекарственного средства для применения в лечении, связанном с андрогенами.
5. Способ лечения животного или человека при необходимости андрогенной стимуляции для получения андрогенного эффекта, отличающийся тем, что эффективную дозу стероидного соединения по любому из пп.1-3 вводят животному или человеку.