Способ лечения коров с персистентным желтым телом яичника при хламидиозе генитальной формы
Иллюстрации
Показать всеИзобретение относится к ветеринарной гинекологии. Коровам вводят плаценту денатурированную суспендированную (ПДС) человека, подкожно в дозе 20 мл/гол/сут не более 10 суток. Способ позволяет повысить качество лечения коров с хламидиозом генитальной формы и способствует улучшению воспроизводительной способности животных за счет ингибирующе-лютеолитического воздействия на персистентное желтое тело яичника. 3 табл., 18 ил.
Реферат
Предлагаемое изобретение относится к области животноводства, в частности к ветеринарии, и может быть применено при ликвидации бесплодия и яловости у коров.
Известны способы лечения животных при хламидиозе путем применения антибиотиков: тетрациклинов, оксамицинов, макролидов и фторхинолонов (Молочков В.А. Хронический урогенитальный простатит (В.А.Молочков, И.И.Ильин. - М.: Медицина, 1998. - 304 с. Позняк А.Л. Генерализованные формы хламидийной инфекции: оценка эффективности новых схем антибактериальной терапии // А.Л. Позняк, Ю.В. Лобзин // Клин. медицина и патофизиология. - 2000. - №1. - С.35-38. Ремизов А.П. Хламидийные инфекции / А.П.Ремизов, В.А.Неверов, Н.В.Семенов. - СПб., 1995. - С.28-37. Савичева А.М. Урогенитальный хламидиоз у женщин и его последствия / А.М.Савичева, М.А.Башлакова. - Н.Новгород: Изд-во НГМА, 1998. - 182 с. Совершенствование мер борьбы и специфической профилактики хламидиозов сельскохозяйственных животных / Р.Х.Хамадеев, Ф.М.Хусаинов, В.В.Евстифеев и др. // Биол.-экол. пробл. зараз. болезней диких животных и их роль в патологии с-х животных и людей. - Покров, 2002. - С.227-230). Однако выбор осуществляют в пользу макролидов, так как у них нет таких недостатков, как вызывание дисбиотических нарушений в желудочно-кишечном и мочеполовом трактах, а также формирование персистирующей формы хламидийной инфекции (Чеботарев В.В. Урогенитальный хламидиоз: современные проблемы диагностики, патогенеза, лечение / В.В.Чеботарев // Журн. Дермато-венерологии и косметологии. - 1997. - №2. - С.5-10. Сидоренко С.В. Антибактериальная терапия инфекций, вызываемых Chlamydia trachomatis / С.В.Сидоренко // Антибиотики и химиотерапия. - 2001. - Т.46. - №2. - С.1-8). Кроме того, тетрациклины не устраняют полностью хламидионосительство (Герилович П.П. Меры борьбы с хламидиозом овец / П.П.Герилович // Ветеринария. - 1985. - №60. - С.27-28. Диагностика и лечение генерализованных форм хламидиозов у молодых людей: Учебное пособие / Ю.В.Лобзин, А.Л.Позяк, К.К.Раевский. - СПб, 2000. - 92 с. Лобзин Ю.В.Хламидийные инфекции / Ю.В.Лобзин, Ю.И.Ляшенко, А.Л.Позняк. - СПб.: ООО «Издательство ФОЛИАНТ», 2003. - 400 с. Dawson M. Ovine enzootic abortion: experimental studies of immune responses/ M. Dawson, A.I.Wilsmore, A.Zaghloul // Res. In veter. Sc. - 1986. - 40, №1. - P.59-64. Seawell Albert C. Methods of using chlamydia vaccine for preventing and treating bovine diseases / Seawell Albert C. - кл. США. 424/88 US 4267170, 3 А 61 К 39/118, 12.05.1981).
Известен также способ лечения животных при хламидиозе путем применения макролидового антибиотика - тилозина (Ballarini G. La tilosind in clinica bovina e suina / G. Ballarini // ODV Olieffivi Doc. Veter. - 1987. - 8, №6. - P.15-18), использование которого предусматривает не только антимикробное, но и противовоспалительное действие (Отечественные препараты на основе тилозина при бактериальных болезнях птиц / А.Н.Борисенкова, Т.Н.Рождественская, О.Б.Новикова и др. // Ветеринария. - 2003. - №8. - С.12-14.).
Недостатками данного способа являются: снижение интенсивности окислительно-восстановительных процессов в организме, которые сохраняются до трех месяцев с момента их применения (Субботин В.М. Влияние антибиотиков на окислительно-восстановительные процессы животных / В.М.Субботин // Проблемы патологии обмена веществ в современном животноводстве. - 1981. - С.11-16); применение антибактериальных препаратов сопровождается неблагоприятным действием на иммунологическую реактивность организма (Кашкин К.П. Иммунная реактивность организма и антибиотическая терапия / К.П.Кашкин, З.О.Караев. - Л.: Медицина, - 1984. - 200 с.); отсутствие стимулирующего эффекта нейро-эндокринной регуляции по индукции половой цикличности.
Применение при хламидиозе иммуномодуляторов тимогена, тималина, Т-активина (Дьяков И.А. Микробиология и иммунология урогенитального хламидиоза у мужчин и эффективность иммуннокоррекции в его комплексной терапии / И.А.Дьяков // Автореф. дисс. на соиск. уч. степ. канд. мед. наук. - Владивосток, 2000. - 24 с.) приводит к развитию трудноконтролируемых аутоиммунных процессов, к перегрузке макрофагов и затрудненному выходу из организма циркулирующих иммунных комплексов.
Задача изобретения - повышение качества лечения коров с хламидиозом за счет повышения неспецифической иммунореактивности и активизации запуска нейроэндокринной регуляции половой цикличности.
Это достигается тем, что в качестве лечебного средства применяют препарат ПДС (плацента денатурированная суспендированная) человека, который вводят подкожно, в области шеи в дозе 20 мл/гол/сут в течение 10 суток (RU 2036651; 6 А 61 К 35/50, 06.02.2002 г.).
ПДС - бионормализатор с выраженным иммуномодулирующим эффектом за счет наличия в его составе полипептидов, аминокислот, нуклеиновых и оксикислот в определенном соотношении.
Пример. Известно, что выделяемый персистентным желтым телом прогестерон тормозит функцию гипоталамуса, а значит, и гипофиза в отношении выработки фолликулостимулирующего и лютеинизирующего гормонов, от которого зависит наступление овуляции (Грига. Э.Н. Детерминированность функции яичников структурой желтых тел / Э.Н.Грига // Вестник ветеринарии. - 1999. - №13. - С.18-22.), а защита от действия возбудителя хламидиоза в организме в основном осуществляется за счет макрофагальной системы (Кашкин К.П. Иммунная реактивность организма и антибиотическая терапия / К.П.Кашкин, З.О.Караев. - Л.: Медицина, - 1984. - 200 с.) путем действия бактерицидного фермента лизоцима (Герберт У.Дж. Ветеринарная иммунология / У.Дж.Герберт.- М.: Колос, 1974. - 311 с.).
Функциональная активность половых желез коров находится в определенной зависимости от уровня неспецифической реактивности и, прежде всего, от фагоцитарной активности нейтрофилов и индекса фагоцитоза (Грига. Э.Н. Детерминированность функции яичников структурой желтых тел / Э.Н.Грига // Вестник ветеринарии. - 1999. - №13. - С.18-22.), а фагоцитарная активность лейкоцитов, в свою очередь усиливается эстрогенными гормонами Vliv estrogenû na fagocy târni aktivitu Krevnich leukocytû jalavic a krav / Z. // Vet. med. - 1992. - 37, №2. - S.65-74).
Кроме того, на моноциты, предшественники макрофагов, существенное влияние оказывают глюкокортикоиды, которые стимулируют в них секрецию липокортина, полипептида предотвращающего избыточную воспалительную реакцию (Руководство по иммунофармакологии: Пер с англ. / Под ред. М.М.Дейла, Дж.К.Формена. - М.: Медицина, 1998. - 332 с).
Учитывая это, иммунобиологические исследования тканевых реакций организма после применения ПДС проводили на группах коров с персистентным желтым телом яичника при наличии хламидиоза генитальной формы.
1-я группа (n=8) - обработка ПДС в дозе 20 мл/гол/сут подкожно в течение 10 суток.
2-я группа (n=4) - применение ПДС в той же дозе и кратности и тилозина-200 - 10 мл/гол/сут в/мышечно в течение 5 суток.
3-я группа (n=4) - введение тилозина-200 в той же дозе.
4-я группа (n=4) - контрольная (без обработки).
Тилозин-200 применяли как базисный (контрольный) вариант лечения коров с хламидиозом (Кленов И.Ф. Ветеринарные препараты в России: справочник / И.Ф.Кленов, Н.А.Яременко. - М.: Сельхозиздат, 2000. - 544 с.).
Кровь для исследований брали из яремной вены до и после применения препаратов промежутком в 10 и 25 суток. Отбор влагалищных смывов для выявления хламидийной инфекции производили в те же сроки.
Диагноз на наличие персистентного желтого тела яичников ставили по результатам двукратных ректальных исследований с интервалом 15 суток и данным техника-осеменатора.
Предварительный диагноз на хламидиоз устанавливали по обнаружению специфических антител хламидийной инфекции методом серологического исследования - РДСК, а окончательный диагноз - после выделения хламидий из влагалищных смывов методом постановки биопробы на белых мышах или куриных эмбрионах с последующим обнаружением хламидий в мазках-отпечатках из паренхиматозных органов (селезенка, печень, легкие) или желточных мешков, окрашенных по Стемпу и флуоресцирующими хламидийными иммуноглобулинами (Селеверстов В.В. Методические указания по лабораторной диагностике хламидийных инфекций у животных / В.В.Селеверстов. - Департамент ветеринарии, 30 июня 1999 г. - №13-7-2/643).
Количественное содержание в сыворотке крови гормонов прогестерона, кортизола и эстрадиола-17β определяли методом твердофазного иммуноферментного анализа по общепринятым методикам.
Суммарную концентрацию иммуноглобулинов в сыворотке крови определяли нефелометрическим методом.
Лизоцимную и бактерицидную активности сыворотки крови определяли фотоэлектроколориметрическим методом с использованием культур Micrococcus Lysodeicticus и E.Coli. Фагоцитарную активность лейкоцитов учитывали согласно методике с внесением в пробы крови суточной культуры E.Coli.
Для установления гистоструктурных изменений в преддверии влагалища от животных всех групп, до и после применения препаратов производили отбор биоптата со слизистой оболочки преддверия влагалища. Исследовали также яичники, матку, печень, селезенку, лимфоузлы у обработанных коров после их забоя. Консервацию и приготовление гистопрепаратов осуществляли согласно методам классической гитотехники с использованием компьютерной программы «Видео Тест-Мастер-Морфология» на микроскопе Lomo Микмед-2.
Эффективность применения бионормализатора из плаценты ПДС с целью восстановления половой цикличности проводили на коровах с дисфункцией яичников в виде персистентного желтого тела на фоне хламидиоза генитальной формы.
Были подобраны четыре группы коров.
1-я группа (n=60) - обработка ПДС в дозе 20 мл/гол/сут подкожно в течение 10 суток.
2-я группа (n=30) - введение эстрофана в дозе 2 мл (500 мкг) в/мышечно однократно.
3-я группа (n=20) - применение макролидового антибиотика тилозин-200 в дозе 10 мл/гол/сут в/мышечно в течение 5 суток.
4-я группа (n=8) - совместное применение ПДС и тилозина-200 по схемам 1-ой и 3-ей групп.
5-я группа (n=17) - контроль (без обработки).
Эстрофан применяли как базисный (контрольный) вариант лечения коров с персистентным желтым телом яичника (Справочник ветеринарного врача / А.В.Аганин, Г.П.Делекин, И.И.Калужный и др. - Ростов на Дону: Из-во «Феникс», 1999. - 608 с.).
Исследования на хламидиоз проводили до и после применения препаратов через 10 суток.
Проведенные исследования показали следующие результаты.
1. Динамика стероидных гормонов (табл.1) характеризовалась снижением прогестерона в 2,3 раза, что указывает на развитие лютеолитических процессов в персистентном желтом теле яичника (очевидно, за счет эндогенной выработки простагландина F2 альфа). В других группах животных уровень прогестерона остается без изменений, а после введения тилозина-200, наоборот, происходит его увеличение в 6,2 раза.
На фоне снижения прогестерона после обработки ПДС отмечено возрастание эстрадиола в 1,5 раза. В остальных исследуемых группах происходит снижение уровня эстрадиола после введения тилозина-200 самостоятельно или в комплексе с ПДС.
Уровень кортизола после обработки ПДС увеличивается в 1,4 раза, а после применения тилозина-200, наоборот, снижается в 1,9 раза.
| Таблица 1Гормональные изменения в крови коров после применения ПДС и тилозина 200 | |||||||||
| Показатели | 1-я группа | 2-я группа | 3-я группа | 4-я группа | |||||
| Обработка ПДС | Обработка ПДС + тилозин 200 | Обработка тилозин 200 | (Контроль) | ||||||
| до | после | через 25 сут | до | после | до | после | до | после | |
| Прогестерон нмоль/л | 13,68±6,03 | 5,95±3,29 | 15,86±9,91 | 0,83±0,016 | 0,80±0,015 | 2,57±1,02 | 15,95±1,32 | 13,6±4,82 | 13,35±2,99 |
| Эстрадиол нмоль/л | 1,85±0,36 | 2,8±0,56 | 2,38±0,35 | 2,79±1,66 | 2,09±1,25 | 2,78±0,95 | 1,54±0,61 | 0,41±0,10 | 0,63±0,13 |
| Кортизол нмоль/л | 26,52±4,56 | 38,12±10,06 | 23,42±3,24 | 32,38±1,62 | 67,26±6,94 | 50,88±15,17 | 27,35±7,14 | 39,35±5,60 | 22,75±1,69 |
| Подчеркнутые значения достоверны при p<0,05. |
2. Иммунобиологическая реактивность организма коров характеризовалась после введения ПДС снижением сегментарных нейтрофилов и возрастанием их фагоцитарной активности на фоне увеличения эстрадиола (табл.2). Возрастанию фагоцитарной активности лейкоцитов крови сопутствует увеличение лизоцимной активности сыворотки крови в 2,4 раза. На фоне применения ПДС увеличивается и бактерицидная активность сыворотки крови в 2 раза.
Комплексное использование ПДС с тилозином-200 вызывает увеличение бактерицидной активности сыворотки крови и фагоцитарной активности нейтрофилов крови в 1,8 раза при одновременном снижении лизоцимной активности сыворотки крови в 1,1 раза. Полученные результаты подтверждают данные о снижении активности лизоцима в сыворотке крови при введении антибиотиков (16). Наиболее отчетливо это наблюдается при использовании одного тилозина-200, где лизоцимная активность снижается в 1,8 раза.
| Таблица 2Показатели иммунного ответа после обработки ПДС и тилозином 200 | |||||
| Группа | Вводимые препараты | Время исследования крови | Исследуемые показатели | ||
| Лизоцимная активность сыворотки крови, % | Бактерицидная активность сыворотки крови, % | Фагоцитарная активность полиморфноядерных нейтрофилов крови, % | |||
| 1 (n=8) | ПДС | до обработки | 13,0±2,04 | 37,25±3,77 | 52,75±1,89 |
| через 10 сут | 31,25±1,25 | 75,5±8,45 | 71,0±1,29 | ||
| 2 (n=4) | ПДС + тилозин 200 | до обработки | 15,50±1,19 | 36,25±3,17 | 33,0±3,39 |
| через 10 сут | 14,0±0,91 | 63,75±3,30 | 58,75±1,10 | ||
| 3 (n=4) | Тилозин 200 | до обработки | 14,0±3,03 | 32,50±4,29 | 38,75±2,66 |
| через 10 сут | 8,0±0,82 | 37,0±3,24 | 43,75±1,93 | ||
| 4 (n=4) | Без обработки | до начала исследования | 8,75±2,17 | 38,50±2,66 | 44,0±3,56 |
| через 10 сут | 8,75±1,25 | 38,75±2,87 | 43,75±1,65 | ||
| Подчеркнутые значения достоверны при p<0,05. |
3. Эффективность применения ПДС у бесплодных коров характеризовалась восстановлением половой цикличности и оплодотворяемости у 85% животных с индексом осеменения 1,47 и в 100% случаев отсутствием хламидий во влагалищных смывах (табл.3).
| Таблица 3Результаты применения ПДС | ||||||
| № П/п | Показатели | Группы | ||||
| 1-я | 2-я | 3-я | 4-я | 5-я | ||
| Обработка ПДС | Обработка эстрофаном | Обработка тилозином 200 | Обработка ПДС и тилозином 200 | Контроль | ||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 1 | Количество животных в группе | 60 | 30 | 20 | 8 | 17 |
| 2 | Животные, реагировавшие в РДСК до обработки: | |||||
| положительно | 14 | 3 | - | - | - | |
| сомнительно | 6 | 1 | - | - | - | |
| отрицательно | 40 | 26 | 20 | 8 | 17 | |
| 3 | Хламидии во влагалищных смывах до обработки | обнаружены у всех животных | обнаружены у всех животных | обнаружены у всех животных | обнаружены у всех животных | обнаружены у всех животных |
| 4 | Животные, реагировавшие в РДСК после обработки: | |||||
| положительно | - | - | - | - | - | |
| сомнительно | - | - | - | - | - | |
| отрицательно | 60 | 30 | 20 | 8 | 17 | |
| 5 | Хламидии во влагалищных смывах после обработки | отсутствуют у всех животных | обнаружены у всех животных | отсутствуют у 4-х животных | отсутствуют у всех животных | обнаружены у всех животных |
| 6 | Время наступления половой охоты с момента последней обработки препаратом (сут) | 19-25 | 2-5 | 44-49 | 32-33 | - |
| 7 | Время плодотворного осеменения после применения препарата (сут) | 36 | 27 | - | 33 | - |
| 8 | Количество коров при 1-ом осеменении | 54 | 23 | 3 | 4 | - |
| 9 | Количество коров при 2-ом осеменении | 21 | 17 | - | - | - |
| 10 | Количество оплодотворенных животных после 1-го осеменения | 32 | 6 | - | 3 | - |
| 11 | Количество оплодотворенных животных после 2-го осеменения | 19 | 12 | - | - | - |
| 12 | Индекс осеменения | 1,47 | 2,22 | - | 1,33 | - |
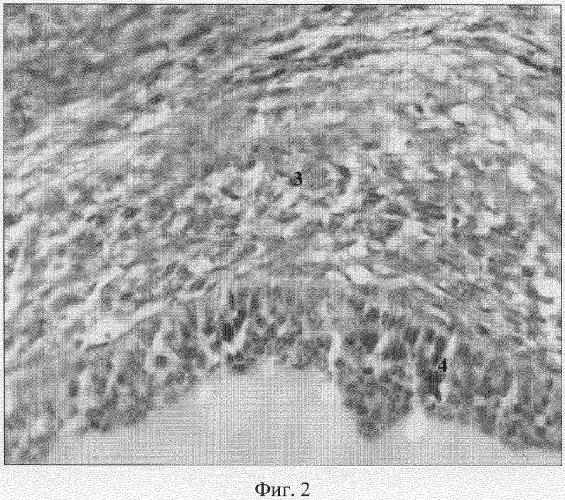
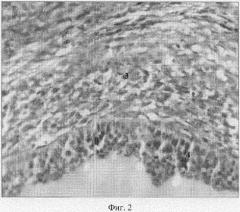
4. Индукцию фолликулогенеза после применения ПДС подтверждают гистострукткрные изменения в яичниках. В корковом веществе находится большое количество как примордиальных фолликулов (1), так и фолликулов на разных стадиях роста и развития с характерным строением (Фиг.1 и 2: 2, 3, 4). Обнаруживается также функционирующие персистентное желтое тело, но с дегенеративными явлениями в железистых клетках. В мозговом веществе располагаются хорошо развитые сосуды разного калибра.
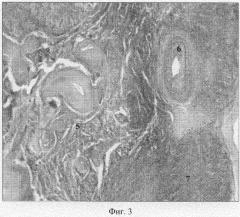
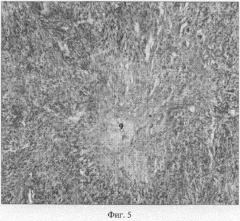
При гистоморфологическом исследовании яичников коров контрольной группы в корковом веществе обнаруживаются фолликулы на стадии роста, часто подвергнутые атрезии, с активизацией текальных клеток (Фиг 3: 5, 6, 7). В центре атретических фолликулов встречаются островки зернистого слоя с явлениями деструкции и дегенерации эпителиальных клеток (Фиг.4: 8). Иногда, непосредственно под белой оболочкой, обнаруживаются примордиальные фолликулы. В корковом веществе встречаются соединительнотканные рубцы, как результат предыдущих инволюций желтых тел. (Фиг.5: 9).
Хотя и происходит снижение содержания альбуминов в сыворотке крови животных после обработки ПДС, на гистопрепаратах наблюдается функциональная активность клеток печени. Паренхима печени представлена крупными гепатоцитами с широкой вариабельностью размера ядер, часто встречаются двуядерные клетки. Многие гепатоциты имеют мелко вакуолизированную цитоплазму. Хорошо заметны тинкториальные особенности клеток в зависимости от зоны долек. На периферии долек и вокруг центральных вен гепатоциты имеют плотную оксифильную цитоплазму. В других участках долек эти явления менее выражены.Синусы широкие, без выраженного кровенаполнения. (Фиг.6: 10,11,12).
Несмотря на увеличение альбуминов в контрольной группе клетки печени в функциональном отношении остаются менее активными, чем после применения ПДС. Гепатоциты более мелкие, большинство из них имеет мелкопенистую цитоплазму и крупные ядра, часто встречаются двуядерные клетки. В некоторых центральных венах обнаруживаются десквамированные гепатоциты, иногда с пикнотически измененными ядрами. В паренхиме встречаются скопления лимфоидной ткани. Обнаруживаются в паренхиме печени микроочаги некрозов или гепатоциты с явлениями кареолеза. Рядом с такими участками цитоплазма гепатоцитов приобретает крупновакуолизированный вид (Фиг.7: 13, 14).
На фоне изменений в лейкоцитарной формуле после применения ПДС меняется и функциональное состояние органов периферической иммунной системы. Так, при гистоморфологическом исследовании селезенки обнаруживается хорошо развитая белая пульпа в виде ограниченных крупных селезеночных телец с выраженной зональностью и герминативным центром. В красной пульпе наблюдается некоторая активизация ретикулярных клеток (Фиг 8: 15, 16, 17), тогда как в селезенке контрольной группы устанавливается слабо выраженная белая пульпа. Границы селезеночных телец размыты. Герминативные центры не выражены, что можно классифицировать, как иммунодепрессивное состояние 1-2 степени. По всей площади селезеночных телец обнаруживаются в малом количестве бластные формы лимфоидной ткани без заметной митотической активности. В красной пульпе заметны скопления макрофагов. (Фиг 9: 18, 19, 20).
Существенные изменения выявляются и в периферических лимфатических узлах. При гистоморфологической диагностике лимфатических узлов коленной складки, взятых от животных после применения ПДС, обнаруживаются в корковом веществе крупные фолликулы с хорошо выраженными герминативными центрами и фигурами митоза в бластных клетках. Мякотные тяжи мозгового вещества представлены, главным образом, зрелыми лимфоцитами. (Фиг 10: 21, 22).
В корковом веществе лимфатических узлов контрольной группы лимфоциты расположены диффузно, очень редко встречаются небольшие фолликулы со слабо выраженными герминативными центрами. Мякотные шнуры мозгового вещества составляют бластные формы клеток, которые превалируют над зрелыми лимфоцитами. (Фиг 11: 23, 24).
У животных, которые не подвергались обработке препаратами, при исследовании гистологических срезов матки обнаруживается, что слизистая оболочка выстлана призматическим 2-3-рядным мерцательным эпителием, среди клеток которого преобладают реснитчатые формы. Собственный слой слизистой оболочки богат клеточными элементами, в основном представленными специфическими децидуальными клетками. Между ними хорошо развиты капиллярная сеть и маточные железы. В просвете большинства концевых отделов желез обнаруживается оксифильное пенистое содержимое (Фиг.12: 25, 26, 27).
При микроскопическом исследовании срезов влагалища установлено, что слизистая оболочка покрыта многослойным эпителием без заметной кератинизации. Функциональный слой представлен оксифильными клетками с овальными ядрами. В среднем состоит из 4-5 слоев клеток. Наблюдается слущивание поверхностных клеток, цитоплазма которых приобретает сетчатый вид. Гранулезный слой представлен мелкими клетками (Фиг.14: 30, 31, 32).
В сравнении с контролем у животных после обработки ПДС при гистоструктурном анализе строения матки устанавливается, что эпителий эндометрия имеет меньшую толщину. Клетки эпителия уплощены, с овальными ядрами. Концевые отделы трубчатых желез характеризуются узкими просветами и малой активностью эпителия, но встречаются и с активной апокриновой секрецией. Просвет их более широкий (Фиг 13: 28,29).
Слизистая оболочка влагалища покрыта многослойным плоским эпителием, который в 1,5-2 раза тоньше, чем в контроле. Функциональный слой состоит из 2-3 слоев клеток, имеющих более плотную цитоплазму. Явления десквамации отсутствуют. Гранулезный слой представлен 1-2 рядами клеток (Фиг.15: 33, 34).
При гистоморфологическом исследовании биоптата слизистой оболочки преддверия влагалища у животных всех групп в подэпителиальной зоне обнаруживаются крупные очаги воспаления с большим скоплением лимфоидной ткани. Резко выражены процессы миграции лимфоцитов в эпителиальный пласт. Над очагом воспаления практически все клетки эпителия расплавлены. В пограничной зоне еще сохраняется поверхностный слой клеток с характерным строением. Наблюдается лизис эпителиального пласта, а очаг воспаления приобретает крупную округлую форму и окружается лимфоцитарным валом, от которого и наблюдается миграция лимфоцитов в эпителиальный пласт (Фиг.16: 35, 36, 37).
У животных после обработки ПДС в подэпителиальной зоне слизистой оболочки преддверия влагалища очаги воспаления отсутствуют. Слизистая оболочка выстлана мощным эпителиальным пластом. Поверхностный слой клеток толщиной в 4-5 клеток, в большинстве случаев имеет пикнотически измененные ядра и светлую цитоплазму. Клетки шиповатого слоя эпителия имеют мелковакуолизированную цитоплазму. В основе слизистой оболочки уменьшается количество клеток фибробластического ряда (Фиг.17: 38, 39, 40, 41).
Комплексное применение ПДС и тилозина 200 вызывает образование каверн в слизистой оболочке преддверия влагалища как следствие воспалительного процесса. Они располагаются на всю толщину слизистой оболочки, донная часть их состоит из коллагеновых волокон и фибробластов. Лимфацитарная инфильтрация отсутствует. Эпителиальный пласт раздражен. Базальный слой эпителия не выражен. Идет рубцевание каверн. (Фиг.18: 42, 43).
Использование тилозина 200 ведет к сохранению в основе слизистой оболочки преддверия влагалища, очагов воспаления с лимфоцитарной инфильтрацией.
Строение слизистой оболочки преддверия влагалища у животных контрольной группы соответствует структуре, имеющейся до начала проводимых исследований.
Источники информации
1. Лобзин Ю.В. Хламидийные инфекции / Ю.В.Лобзин, Ю.И.Ляшенко, А.Л.Позняк. - СПб.: ООО «Издательство ФОЛИАНТ», 2003. - 400 с.
2. Seawell Albert C. Methods of using chlamydia vaccine for preventing and treating bovine diseases / Seawell Albert C. - кл. США. 424/88 US №4267170, 3 А 61 К 39/118, 12.05.1981.
3. Кашкин К.П. Иммунная реактивность организма и антибиотическая терапия / К.П.Кашкин, З.О.Караев. - Л.: Медицина, - 1984. - 200 с.
ДОПОЛНИТЕЛЬНЫЕ ИСТОЧНИКИ ИНФОРМАЦИИ
4. Молочков В.А. Хронический урогенитальный простатит / В.А.Молочков, И.И.Ильин. - М.: Медицина, 1998. - 304 с.
5. Позняк А.Л. Генерализованные формы хламидийной инфекции: оценка эффективности новых схем антибактериальной терапии // А.Л.Позняк, Ю.В.Лобзин // Клин. медицина и патофизиология. - 2000. - №1. - С.35-38.
6. Ремизов А.П. Хламидийные инфекции / А.П.Ремизов, В.А.Неверов, Н.В.Семенов. - СПб., 1995. - С.28-37.
7. Савичева А.М. Урогенитальный хламидиоз у женщин и его последствия / А.М.Савичева, М.А.Башлакова. - Н.Новгород: Изд-во НГМА, 1998. - 182 с.
8. Совершенствование мер борьбы и специфической профилактики хламидиозов сельскохозяйственных животных / Р.Х.Хамадеев, Ф.М.Хусаинов, В.В.Евстифеев и др. // Биол.-экол. пробл. зараз. болезней диких животных и их роль в патологии с-х животных и людей. - Покров, 2002. - С.227-230.
9. Чеботарев В.В. Урогенитальный хламидиоз: современные проблемы диагностики, патогенеза, лечение / В.В.Чеботарев // Журн. Дермато-венерологии и косметологии. - 1997. - №2. - С.5-10.
10. Сидоренко С.В. Антибактериальная терапия инфекций, вызываемых Chlamydia trachomatis / С.В.Сидоренко // Антибиотики и химиотерапия. - 2001. - Т.46. - №2. - С.1-8.
11. Герилович П.П. Меры борьбы с хламидиозом овец / П.П.Герилович // Ветеринария. - 1985. - №60. - С.27-28.
12. Диагностика и лечение генерализованных форм хламидиозов у молодых людей: Учебное пособие / Ю.В.Лобзин, А.Л.Позяк, К.К.Раевский. - СПб., 2000. - 92 с.
13. Dawson M. Ovine enzootic abortion: experimental studies of immune responses / M. Dawson, A.I.Wilsmore, A.Zaghloul // Res. In veter. Sc. - 1986. - 40, №1. - P.59-64.
14. Ballarini G. La tilosind in clinica bovina e suina / G. Ballarini // ODV Olieffivi Doc. Veter. - 1987. - 8, №6. - P.15-18.
15. Отечественные препараты на основе тилозина при бактериальных болезнях птиц / А.Н.Борисенкова, Т.Н.Рождественская, О.Б.Новикова и др. // Ветеринария. - 2003. - №8. - С.12-14.
16. Субботин В.М. Влияние антибиотиков на окислительно-восстановительные процессы животных / В.М.Субботин // Проблемы патологии обмена веществ в современном животноводстве. - 1981. - С.11-
17. Герберт У. Дж. Ветеринарная иммунология/ У.Дж. Герберт. - М.: Колос, 1974. - 311 с.
18. Vliv estrogenû na fagocy târni aktivitu Krevnich leukocytû jalavic a krav/ Z. // Vet. med. - 1992. - 37, №2. - S.65-74.
19. Руководство по иммунофармакологии: Пер с англ. / Под ред. М.М.Дейла, Дж.К.Формена. - М.: Медицина, 1998. - 332 с.
20. Кленов И.Ф. Ветеринарные препараты в России: справочник / И.Ф.Кленов, Н.А.Яременко. - М.: Сельхозиздат, 2000. - 544 с.
21. Селеверстов В.В. Методические указания по лабораторной диагностике хламидийных инфекций у животных / В.В.Селеверстов. - Департамент ветеринарии, 30 июня 1999 г. - №13-7-2/643.
22. Справочник ветеринарного врача / А.В.Аганин, Г.П.Делекин, И.И.Калужный и др. - Ростов на Дону: Из-во «Феникс», 1999. - 608 с.
23. Дьяков И.А. Микробиология и иммунология урогенитального хламидиоза у мужчин и эффективность иммуннокоррекции в его комплексной терапии / И.А.Дьяков // Автореф. дисс. на соиск. уч. степ. канд. мед. наук. - Владивосток, 2000. - 24 с.
24. Грига. Э.Н. Детерминированность функции яичников структурой желтых тел / Э.Н.Грига // Вестник ветеринарии. - 1999. - №13. - С.18-22.
Способ лечения коров с персистентным желтым телом яичника при хламидиозе генитальной формы путем введения бионормализатора, отличающийся тем, что коровам вводят иммуномодулятор ПДС (плацента денатурированная суспендированная) подкожно в дозе 20 мл/гол/сут не более 10 суток.