Новое противогрибковое соединение 2-(3,4-диметил-2,5-дигидро-1h-пиррол-2-ил)-1-метилэтила пентаноат
Иллюстрации
Показать всеИзобретение относится к новому противогрибковому соединению 2-(3,4-диметил-2,5-дигидро-1Н-пиррол-2-ил)-1-метилэтила пентаноату формулы I
которое получают из растения Datura metel. Соединение проявляет противогрибковую активность, что позволяет использовать его в фармацевтической композиции. 3 н. и 13 з.п. ф-лы, 13 ил., 3 табл.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к новому противогрибковому соединению 2-(3,4-диметил-2,5-дигидро-1Н-пиррол-2-ил)-1-метилэтила пентаноату формулы (I). Более конкретно, изобретение относится к новому противогрибковому соединению, выделенному из растения Datura metel.
Основная цель настоящего изобретения состоит в создании нового соединения для разработки новых лекарственных средств лечения заболеваний, вызванных действием патогенных грибков.
Описание уровня техники
В течение нескольких последних десятилетий отмечается рост заболеваемости и смертности от грибковых инфекций (Saral R., 1991, Rev. Inf. Dis., 13, 487-492, Koll B.S and Brown A.E., 1993, Clin. Inf. Dis., 17, S-322-S-326). Все в большей степени признается, что инфекции, индуцируемые указанными разновидностями, представляют угрозу общественному здравоохранению. В организме человека с ослабленной иммунной системой инфекции, вызываемые действием Aspergillus, Candida, Histoplasma и др., становятся инвазивными и распространяются от первичного очага инфекции в другие части организма, включающие кишки, почки, мозг и т.п. Сообщается, что инвазивный аспергиллез является причиной смертности в 55% случаев (Denning D.W. and Stevens D.A., 1990, Rev. Inf. Dis., 12, 1147-1201). Несмотря на соответствующее химиотерапевтическое лечение, смертность реципиентов, перенесших трансплантацию костного мозга, от инфицирования Aspergillus достигает 80% (Meyer J.D., 1990, Semin. Oncol., 17 (suppl. 6) 10-13). Церебральный аспергиллез дает симптомы острого менингита и всегда имеет фатальные последствия. Вид Candida относится к коменсальным микроорганизмам слизистых поверхностей кожи человека. Однако в организме человека с ослабленной иммунной системой Candida способна прогрессировать, превращаясь при благоприятных условиях в потенциальный патоген. Эта разновидность может передаваться путем контакта другим пациентам с ослабленной иммунной системой в виде нозокомиального патогена.
В связи со сказанным выше, для предотвращения необратимого поражения, важно диагностировать и начинать лечение рассматриваемых грибковых инфекций на ранней стадии заболевания. В литературе описано применение некоторых соединений, принадлежащих к азолам, полиенам и другим группам химических веществ, для лечения микозов. Однако все указанные вещества имеют ограничения, касающиеся их применения.
Полиены относятся к давно известным и наиболее часто назначаемым противогрибковым агентам. Амфотерицин В является важным полиеновым лекарственным средством, обладающим широким спектром противогрибковой активности, однако его применение в терапии часто связано с таким побочным действием, как тяжелые лихорадочные состояния, жар, рвота, гипотензия с угрозой жизни и расстройство дыхания. Амфотерицин В вызывает нарушение функции почек (Allende M.C., Lee J.W., Francis P., Garrett K., Dollenberg H., Berenguer J., Lyman C.A., Pizzo P.A. and Walsh T.J. 1994, Antimicrob. Agents and Chemother. 38, 518-522) и возможность его внутривенного применения крайне ограничена (Stevens D.A. and Lee J.Y., 1997, Arch. Int. Med., 57, 1857-1862). Помимо наличия побочных эффектов, сообщается о резистентности некоторых видов грибков к амфотерицину В (Gokhale P.C., Kshirsagar N.A. and Pandya S.K., 1993, Current Science 65(6), 448-454, Forthergill A.W. and McGough D.A., 1995, Clin. Microbiol. Procedure Handbook, In vitro susceptibility Testing of Yeast, 5.15.1-5.15.15).
Другим важным лекарственным средством является нистатин, однако, развитие резистентности и токсичность, ограничивающая дозу, снижают полезное действие этого препарата (Forthergill A.W. and McGough A.W.,1995, Clin. Microbiol. Procedure Handbook, In Vitro susceptibility Testing of Yeasts 5.15.1-5.15.15).
Создание таких новых противогрибковых препаратов, как кетоконазол, флюконазол и итраконозол, позволило надеяться, что эти лекарственные средства окажутся полезными для профилактики и лечения грибковых инфекций. Однако эти надежды не оправдались из-за токсического действия на печень, гипогликемической природы таких препаратов и развития устойчивых грибковых штаммов (Denning D.W., Tucker R.M., Hanson L.H., Hamilton J.R. and Stevens D.A., 1989, Arch. Int. Med., 149, 2301-2308). Сообщается о том, что азолы уменьшают секрецию желудочного сока и вследствие этого понижают всасываемость как самого лекарства, так и других важных биомолекул. Эти эффекты могут столь сильно понижать уровень содержания глюкозы, что возникает угроза жизни. Также имеются сообщения о резистентности некоторых грибков к действию производных азола (Forthergill A.W. and McGough A.W., 1995, Clin. Microbiol. Procedure Handbook, In Vitro susceptibility Testing of Yeasts 5.15.1-5.15.14).
Выпускаемые в настоящее время противогрибковые лекарственные средства не обладают достаточно широким спектром действия и, соответственно, недостаточно эффективны в отношении различных грибков, включая вид Aspergilli. Эти лекарственные средства по своей природе обладают токсичным или иммуносупрессорным действием. Имеются также сообщения о том, что у грибков развивается устойчивость к действию большинства доступных лекарственных препаратов.
Из сказанного выше следует, что необходима разработка новых противогрибковых лекарственных средств, которым не присущи перечисленные выше недостатки. Новизна настоящего изобретения состоит в разработке способа выделения и идентификации нового противогрибкового лидирующего соединения из Datura metel, во много раз менее цитотоксичного, чем такие стандартные противогрибковые лекарства, как амфотерицин В.
Цель изобретения
Основная цель настоящего изобретения заключается в разработке нового противогрибкового соединения 2-(3,4-диметил-2,5-дигидро-1Н-пиррол-2-ил)-1'-метилэтила пентаноата с целью создания новых лекарственных средств против патогенных грибков.
Другая цель настоящего изобретения состоит в разработке способа выделения нового противогрибкового соединения 2-(3,4-диметил-2,5-дигидро-1Н-пиррол-2-ил)-1'-метилэтила пентаноата из Datura metel.
Еще одна цель настоящего изобретения заключается в разработке способа тестирования нового соединения, 2-(3,4-диметил-2,5-дигидро-1Н-пиррол-2-ил)-1'-метилэтила пентаноата, на противогрибковую активность.
Другая цель изобретения состоит в разработке способов применения нового соединения, 2-(3,4-диметил-2,5-дигидро-1Н-пиррол-2-ил)-1'-метилэтила пентаноата, в качестве противогрибкового агента.
Еще одна цель настоящего изобретения состоит в создании нового противогрибкового соединения, 2-(3,4-диметил-2,5-дигидро-1Н-пиррол-2-ил)-1'-метилэтила пентаноата, которое в 57,8 раз менее цитотоксично, чем такой стандартный противогрибковый препарат, как амфотерицин В.
Краткое изложение сущности изобретения
Настоящее изобретение относится к новому противогрибковому соединению, 2-(3,4-диметил-2,5-дигидро-1Н-пиррол-2-ил)-1'-метилэтила пентаноату, имеющему приведенную ниже формулу (I).
Это соединение обладает противогрибковыми свойствами и в несколько раз менее цитотоксично, чем стандартные противогрибковые лекарственные средства. Рассматриваемое соединение может применяться для борьбы с системными и поверхностными грибковыми инфекционными заболеваниями людей, оказывая при этом минимальное токсическое действие. Такое соединение выделено из легкодоступного растения Datura metel.
Краткое описание чертежей
Фиг.1: фотография пластины с результатами ТСХ активных колоночных субфракций и очищенного соединения.
Фиг.2: профиль ВЭЖХ соединения, очищенного методом ТСХ.
Фиг.3: Фотография результатов ТСХ соединения, очищенного методом ВЭЖХ.
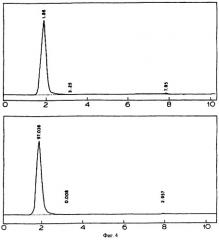
Фиг.4: профиль ВЭЖХ очищенного соединения.
Фиг.5: ингибирование роста А. fumigatus действием очищенного соединения.
Фиг.6: график, отражающий процент ингибирования прорастания спор при действии соединения на вид Aspergillus.
Фиг.7: УФ-спектр соединения.
Фиг.8: ИК-спектр соединения.
Фиг.9: масс-спектр соединения.
Фиг.10: ЯМР-спектр соединения.
Фиг.11: COSY-спектр соединения.
Фиг.12: процент цитотоксичности соединения.
Фиг.13: Доза, требующаяся для защиты 50% животных (ED50) после лечения РС-1.
Подробное описание изобретения
В соответствии с настоящим изобретением представлено новое противогрибковое соединение 2-(3,4-диметил-2,5-дигидро-1Н-пиррол-2-ил)-1'-метилэтила пентаноат формулы I:
В соответствии с одним из воплощений изобретения идентификацию активного противогрибкового соединения осуществляли такими известными аналитическими методами, как ТСХ, окрашивание реагентами, специфическими в отношении определенных групп, УФ, ИК, масс и ЯМР спектроскопия, а также с помощью таких биологических анализов, как анализ на противогрибковую активность и анализ на цитотоксичность.
В соответствии с другим воплощением настоящего изобретения новое противогрибковое соединение 2-(3,4-диметил-2,5-дигидро-1Н-пиррол-2-ил)-1'-метилэтила пентаноат представляет собой гетероциклический алкалоид, о чем свидетельствуют данные окрашивания реагентами, специфическими в отношении определенных групп, с использованием реагента Драгендорфа, имеющий следующие характеристики:
значение Rf в анализе методом ТСХ, равное 0,22 (фиг.3),
максимумы поглощения в УФ-спектре при длинах волн 300 нм и 206 нм (фиг.7),
ИК-спектр νmax: 3434 (NH), 3024, 1711 (сложный эфир), 1646 (С=С), 1524, 1426, 1230, 938, 760 см-1 (фиг.8).
+ve FABMS: m/z 239 [M]+ (C14H25O2N) (16,3), 212 (13,2), 174 (16,2), 122 (34,2), 102 (96,4), 58 (100) и 57 (19,2) (фиг.9).
1Н ЯМР (CDCl3):δ 4,15 (1Н, м, С1'-H), 3,75 (1Н, м, С2-Н), 3,17 (2Н, дд, J=7,44 Гц, 7,44 Гц, C5-Нa и C5-Hb), 2,31 (1H, т, J=6,48 Гц, C2"-Ha), 1,95 (1H, м, C2"-Hb), 1,62 (6H, шир., C6-CH3 и C7-CH3), 1,42 (1H, д, J=6,96 Гц, C2'-Ha), 1,35 (1H, д, J=7,28 Гц, C2'-Hb), 1,25 (7H, шир., C1'-CH3, C3"-Ha, C3-Hb, C4"-Ha и C4"-Hb), 0,87 (3H, т, J=5,96 Гц, C5"-CH3) и COSY спектр (фиг.11).
Минимальная ингибирующая концентрация (МИК) указанного нового противогрибкового соединения составляет 5,0 мкг/диск согласно данным анализа диффузии на диске (фиг.5) и 87,5 мкг/мл по данным ингибирования прорастания спор (фиг.6), соответственно.
Цитотоксичная доза для 50% клеток (СТ50) указанного противогрибкового соединения составляет 889,2 мкг/мл (фиг.12).
ED50 указанного противогрибкового соединения составляет 167,0 мг/кг веса тела (фиг.13).
Эффективная противогрибковая доза рассматриваемого вещества составляет 100-400 мг/кг веса тела (таблица 3).
В соответствии с другим воплощением новое противогрибковое соединение в 57,8 раз менее цитотоксично, чем стандартные противогрибковые лекарственные препараты.
Согласно еще одному воплощению предусматривается способ лечения, в котором доза 2-(3,4-диметил-2,5-дигидро-1Н-пиррол-2-ил)-1-метилэтила пентаноата, эффективная для выживания 50% (ED50) указанных объектов, составляет 167,0 мг/кг веса тела (фиг.13).
В соответствии с другим воплощением защитная in vivo эффективная доза противогрибкового соединения, 2-(3,4-диметил-2,5-дигидро-1Н-пиррол-2-ил)-1'-метилэтила пентаноата, для указанного объекта составляет 100-400 мг/кг веса тела (таблица 3).
Другое воплощение настоящего изобретения предусматривает фармацевтическую композицию, содержащую приемлемое количество указанного выше 2-(3,4-диметил-2,5-дигидро-1Н-пиррол-2-ил)-1'-метилэтила пентаноата, а также фармацевтически приемлемые добавки и адъюванты.
В соответствии с другим воплощением приемлемые добавки выбирают из группы пищевых добавок, представляющих собой фармацевтически приемлемый носитель.
Согласно еще одному воплощению новое противогрибковое соединение можно применять в виде таблеток, капсул, сиропа, порошка, геля, мази и путем инъекции.
Еще одно воплощение изобретения предусматривает фармацевтически приемлемую композицию, содержащую эффективное количество нового соединения с концентрацией в интервале 100-400 мг/мл.
В соответствии с другим воплощением предусматривается способ лечения грибковых инфекций у указанного объекта, включающий стадии введения эффективного количества 2-(3,4-диметил-2,5-дигидро-1Н-пиррол-2-ил)-1'-метилэтила пентаноата пероральным, назальным, внутривенным, внутрибрюшинным, внутримышечным и другими путями.
В другом воплощении эффективная доза 2-(3,4-диметил-2,5-дигидро-1Н-пиррол-2-ил)-1'-метилэтила пентаноата может составлять 100-400 мг/кг веса тела.
Еще одно воплощение изобретения относится к способу выделения нового противогрибкового соединения, 2-(3,4-диметил-2,5-дигидро-1Н-пиррол-2-ил)-1'-метилэтила пентаноата, из растения, Datura metel, включающему (i) экстракцию измельченного в порошок растения Datura metel органическим растворителем при температуре в интервале 15-45°С, (ii) удаление растворителя с образованием остатка, (iii) экстракцию остатка со стадии (ii) алифатическим углеводородным растворителем с последующей экстракцией хлороформом, (iv) удаление хлороформа из хлороформной фракции со стадии (iii), (v) скрининг остатка со стадии (iv), полученного из хлороформной фракции, на противогрибковую активность, (vi) выделение и очистку нового противогрибкового соединения из активной фунгицидной хлороформной фракции с использованием традиционных методов хроматографии и (vii) анализ указанного очищенного соединения на противогрибковую активность и цитотоксичность.
Еще одно воплощение настоящего изобретения отличается тем, что растворитель, используемый для экстракции, выбирают из группы, состоящей из спиртового растворителя, кетонного растворителя и/или галогенированного углеводорода.
В соответствии с другим воплощением изобретения, растворитель для экстракции предпочтительно выбирать из группы, состоящей из метанола, этанола, ацетона и хлороформа.
Другое воплощение изобретение отличается тем, что используемый алифатический углеводородный растворитель выбирают из гексана, петролейного эфира.
Согласно еще одному воплощению соединение очищают методом колоночной или тонкослойной хроматографии (ТСХ), а также высокоэффективной жидкостной хроматографии (ВЭЖХ).
В соответствии с еще одним воплощением изобретения очистку нового соединения можно проводить методом тонкослойной хроматографии с использованием систем растворителей, выбранных из смеси хлороформ : ацетон : диэтиламин (5,0:4,0:1,0), хлороформ : метанол : диэтиламин (8,5:1,5:0,1) и хлороформ : метанол : муравьиная кислота (8,0:2,0:0,1) или различных комбинаций из указанных выше органических растворителей.
В соответствии с другим воплощением изобретения очистку нового соединения можно проводить методом ВЭЖХ с использованием системы растворителей, состоящей из ацетонитрила и воды в соотношении 70:30 и хроматографической колонки RP-8 с обращенной фазой.
Согласно другому воплощению изобретения идентификацию активного противогрибкового соединения проводят такими известными аналитическими методами, как ТСХ, групповое окрашивание, УФ-, ИК-, масс- и ядерно-магнитная резонансная спектроскопия, а также с помощью таких биологических анализов, как анализ на противогрибковую активность и цитотоксичность.
В соответствии с другим воплощением изобретения предусматривается способ тестирования нового соединения, 2-(3,4-диметил-2,5-дигидро-1Н-пиррол-2-ил)-1'-метилэтила пентаноата, на противогрибковую активность.
Согласно другому воплощению настоящего изобретения тест на фунгицидную активность может проводиться после каждой стадии очистки с помощью таких известных способов, как разбавление в микробульоне (MD), диффузия на диске (DD) ингибирование прорастания спор (SGI).
Очистка соединения
Настоящее изобретение предусматривает новое противогрибковое соединение, 2-(3,4-диметил-2,5-дигидро-1Н-пиррол-2-ил)-1'-метилэтила пентаноат, и способ его выделения. Главным образом, изобретение относится к выделению нового противогрибкового соединения из природных источников.
(i) Приготовление метанольного экстракта
Растительный материал Datura metel (Solanaceae) собирали в течение месяца в период апреля/мая вблизи железнодорожной станции Kishanganj, Delhi, India. Достоверность идентификации растительного материала подтверждена в Hamdard College of Pharmacy, New Delhi, где хранится контрольный образец. Свежесобранный растительный материал, находящийся в хорошо проветриваемой упаковке, сушили в тени. Высушенный материал измельчали в порошок и экстрагировали метанолом. Все экстракты, полученные в ходе четырех циклов экстракции метанолом, сливали и выпаривали досуха при пониженном давлении и температуре 45°С в роторном испарителе Rotavapor R-114 (Buchi), соединенном с водяной баней Waterbath B-480 (Buchi). Полученный остаток хранили при 4°С до применения. Метанольный экстракт исследовали на наличие противогрибковой активности против вида Aspergillus. Экстракт с противогрибковой активностью подвергали дополнительному фракционированию с целью выделения активного противогрибкового компонента.
(ii) Фракционирование метанольного экстракта Datura metel
Компоненты сырого метанольного препарата фракционировали по модифицированному способу Harbourne (Harbourne J.B., 1997, Phytochemical Methods, Chapman and Hall, London, pp.1-5). Метанольный экстракт последовательно экстрагировали гексаном, хлороформом и ацетоном. Вначале метанольный экстракт четырежды экстрагировали гексаном. Все четыре гексановых экстракта сливали и растворитель выпаривали с помощью Rotavapor R-114 (Buchi). Сухие фракции собирали и хранили при 4°С до последующего применения. Остаток после экстракции гексаном подвергали ступенчатой четырехкратной экстракции хлороформом и ацетоном с получением хлороформной и ацетоновой фракций. Оставшийся материал растворяли в метаноле. Растворители выпаривали и собирали сухие фракции. Все фракции соответствующим образом помечали и исследовали их противогрибковую активность по отношению к патогенным микроорганизмам Aspergillus. Было установлено, что хлороформная фракция обладает активностью, в связи с чем ее дополнительно субфракционировали методами колоночной и тонкослойной хроматографии.
(iii) Колоночная хроматография
Хлороформную фракцию субфракционировали методом модифицированной колоночной хроматографии на колонке с силикагелем. Силикагель суспендировали в гексане и помещали в колонку размером 1,25×35 см. Готовили суспензию хлороформного экстракта и пропускали ее через предварительно уравновешенную силикагелевую (60-120 мкм) колонку. Компоненты хлороформной фракции элюировали 100 мл хлороформа с объемной скоростью 1,0 мл/мин, затем смесями хлороформ : метанол с содержанием компонентов в интервале 100:0-0:100. Все субфракции анализировали методом ТСХ. Субфракции с аналогичным профилем значений Rf сливали и сушили в вакууме. Каждую субфракцию тестировали на противогрибковую активность с использованием патогенных штаммов Aspergilli. Субфракции с противогрибковым потенциалом дополнительно подвергали очистке методом тонкослойной хроматографии с целью идентификации и выделения чистого активного компонента.
(iv) Тонкослойная хроматография (ТСХ)
Активные противогрибковые фракции с колонки наносили пятнами на пластины с силикагелем (E. Merck Cat №1.05554, F254) и проводили обработку методом ТСХ, используя три различные системы из следующих растворителей, хлороформ : ацетон : диэтиламин (5,0:4,0:1,0), хлороформ : метанол : диэтиламин (8,5:1,5:0,1) и хлороформ : метанол : муравьиная кислота (8,0:2,0:0,1). Полосы на пластинах подвергали УФ-визуализации при длине волны 254 и 366 нм, проводя распыление хлорпалатината, реагента Драгендорфа и иода. Компоненты различных полос соскабливали и исследовали на противогрибковую активность. Для получения интересующего активного соединения использовали метод препаративной ТСХ.
(v) Высокоэффективная жидкостная хроматография (ВЭЖХ)
Чистоту соединения РС-1, полученного методом препаративной ТСХ, анализировали методом ВЭЖХ с использованием колонки RP-8 (Merck). Обработку методом ВЭЖХ с обращенной фазой проводили изократно с использованием системы растворителей из 70 частей ацетонитрила и 30 частей воды. Перед загрузкой испытуемые образцы пропускали через пористую мембрану. 5,0 мкл 0,22 мкм фильтрованного образца загружали в предварительно уравновешенную ВЭЖХ колонку при комнатной температуре. Объемная скорость составляла 1,0 мл/мин.
Идентификация
(i) Определение структуры
Идентификацию полученного соединения осуществляли с использованием таких различных методов, как идентификация по классу с помощью химических методов, дериватизация соединения, определение температуры плавления очищенного соединения, с помощью УФ-спектров (фиг.7), ИК-спектров (фиг.8), масс-спектров (фиг.9), спектра ЯМР (фиг.10) и COSY (фиг.11). Подробности, касающиеся спектральных данных нового соединения, приведены выше.
Анализ на противогрибковую активность
Противогрибковую активность таких различных препаратов, как неочищенное соединение, метанольный экстракт, субфракции и очищенное соединение, исследовали методом разведения в микробульоне, диффузии на диске и с помощью анализа на ингибирование прорастания спор с применением патогенных грибковых штаммов.
(i) Патоген
Патогенные штаммы грибков получали из Микологического департамента Vallabhbhai Patel Chest Institute, Delhi. Все штаммы выращивали на Sabouraud декстрозном агаре при 37°С. Собирали конидиевую форму указанных культур и ее суспендировали в Sabouraud мальтозном бульоне. Число конидий подсчитывали с помощью гемоцитометра, и их численность поддерживали в соответствии с экспериментальными потребностями.
(ii) Анализ разведением в микробульоне
Фунгицидную чувствительность грибков к действию различных фракций очищенного компонента анализировали методом разведения в микробульоне (Forthergill A.W. and McGough A.W. 1995, Clin. Microbiol. Procedure Handbook. In vitro susceptibility Testing of Yeast, 5.15.1-5.15.15). Грибковые споры собирали с 96-часовых культур и их количество поддерживали на уровне 1×106 на 1 мл. Sabouraud декстрозную среду растворяли в дважды дистиллированной воде и в течение 15 минут обрабатывали в автоклаве при давлении 10 фунт/дюйм2. В лунки микропланшета для анализа клеточных культур добавляли по 90 мкл среды. Различные концентрации экстракта, фракций или очищенного соединения готовили в дублированных лунках, после чего их инокулировали 10 мкл споровой суспензии. Планшеты инкубировали при 37°С и через 48 часов подвергали макроскопическому исследованию для определения роста грибкового мицелия. Активность обозначали индексом -ve, если наблюдался рост, и индексом +ve, если среда оказывалась чистой без каких-либо признаков грибкового роста.
(iii) Анализ методом диффузии на диске
Тест диффузией на диске проводили на стерилизованных облучением чашках Петри диаметром 10 см (Tarsons) в соответствии со способом, описанным в Indian Pharmacopoeia (Indian Pharmacopoeia, 1996, Appendix 9, p. A101-A110). Sabouraud декстрозную агаровую среду растворяли в бидистилированной воде и помещали на 15 минут в автоклав под давлением 10 фунт/дюйм2. Раствор охлаждали до 45°С и в каждую чашку Петри помещали по 20,0 мл раствора. В Sabouraud мальтозном бульоне готовили конидиальную суспензию, 1,0 мл которой содержал 1х106 конидий, и полученный препарат выкладывали на поверхность агаровой пластины. Стерильные диски диаметром 5,0 мм из ватмановской фильтровальной бумаги пропитывали различными концентрациями образца. Такие диски помещали на поверхность агаровых пластин, инокулированных грибковыми спорами. Пластины инкубировали при 37°С и через 48 часов исследовали зону ингибирования, если она имелась, вокруг диска. Диаметр зоны ингибирования измеряли с помощью масштабной линейки. Концентрацию, обеспечивающую зону ингибирования диаметром 6,0 мм, считали минимальной ингибирующей концентрацией. В качестве стандартного контрольного лекарственного препарата в анализе использовали амфотерицин В. Также использовали дополнительный контрольный диск без тестируемого образца, но пропитанный эквивалентным количеством растворителя. Тест для определения активности различных испытуемых препаратов повторяли 3-5 раз.
(iv) Построение стандартной кривой
Стандартную кривую строили в соответствии со способом, описанным в Indian Pharmacopoeia (Indian Pharmacopoeia, 1996, Appendix 9, p. A101-A110).
(v) Анализ на ингибирование прорастания спор
Модифицированный анализ на ингибирование прорастания спор проводили по ранее описанной методике (Sureder P. and Janaiah C., 1987, Ind. J. Expt. Biol., 25, 233-234). Различные виды грибков выращивали в течение 96 часов на пластинах с Sabouraud десктрозным агаром при 37°С. С пластин собирали образовавшиеся конидии и готовили их гомогенную суспензию в Sabouraud декстрозном бульоне. Подсчитывали число конидий и их численность устанавливали равной 1×104 на 1 мл. Стандартный лекарственный препарат амфотерицин В и испытуемые образцы вначале растворяли в минимальном количестве диметилсульфоксида (ДМСО) и затем разбавляли Sabouraud декстрозной средой. Различные концентрации испытуемых образцов в 90 мкл культуральной среды готовили методом двойного разбавления в 96-луночных плоскодонных микрокультуральных планшетах (Nunc). Для каждой концентрации использовали по три лунки микропланшета. После этого каждую лунку инокулировали 10 мкл споровой суспензии, содержащей 100±5 спор. Пластины инкубировали в течение 10 часов при 37°С и прорастание спор исследовали с помощью инверсионного микроскопа (Nickon Diphot). Подсчитывали число проросших и непроросших спор. Процент ингибирования прорастания спор (PSGI) рассчитывали с использованием следующей формулы:
Оценка in vitro токсичности
In vitro токсичность активного соединения исследовали с применением МТТ анализа, используя RAW клетки (Mossman T., 1983, J. Immunol. Methods, 65, 55-63).
Клеточная культура
Исходную культуру RAW клеток получали от National Facility for Cell and Tissue Culture, Pune. Клетки выдерживали при 37°С в RPMI-1640 среде, дополненной глутамином (2,3 мг/л), фетальной телячьей сывороткой (10% об/об) и гентамицином (50,0 мг/л), в углекислотном инкубаторе Nuair IR Autoflow с водным охлаждением.
Приготовление образца
Исходный раствор соединения получали путем растворения 2,5 мг очищенного соединения в минимальном количестве ДМСО с последующим разбавлением двукратным количеством дистиллированной воды, доводя систему до конечного объема 1,0 мл. Анализ на цитотоксичность проводили с использованием различных концентраций в интервале 1250,0-19,5 мкг/мл.
Анализ на клеточную цитотоксичность
Клетки собирали в фазе лог-роста при выливании системы из колбы. Гомогенную суспензию клеток готовили в 2,0 мл культуральной среды. Число клеток в суспензии подсчитывали с использованием гемоцитометра и клеточную суспензию разбавляли таким образом, чтобы оставить 5×107 жизнеспособных клеток на 1 мл. Жизнеспособность клеток проверяли с помощью теста на эксклюзию с трипаном голубым. Анализ на цитотоксичность проводили в 96-луночных плоскодонных планшетах для культивирования ткани (Nunc Nunclon). Каждую лунку засевали 5×106 клеток в 100,0 мкл объема. Планшет инкубировали при 37°С в течение 8 часов в атмосфере, содержащей 5% СО2 (об/об). Проводили микроскопическое изучение лунок на предмет образования монослоя клеток. К монослою клеток добавляли различные концентрации в интервале от 1250,0 мкг/мл до 19,5 мкг/мл соединения РС-1 (метелатропиниловый эфир). В +ve контрольных лунках использовали известный цитотоксичный белок, полученный из A.fumigatus. В другой серии лунок в качестве другого +ve токсичного материала использовали ZnSO4 (8,0 мг/л). В отрицательных контрольных лунках применяли эквивалентное количество растворителя. Для каждой концентрации испытуемого соединения использовали по две лунки. Планшеты инкубировали в течение ночи при 37°С в инкубаторе, содержащем 5% СО2 (об/об). Среду вместе со всплывшими мертвыми клетками выливали из лунок, переворачивая планшет. В результате в лунках оставались лишь живые клетки, прилипшие к поверхности планшета. Эти клетки окрашивали 40,0 мкл 2,5% красителя МТТ. После добавления в лунки красителя планшет выдерживали в течение 1 часа при 37°С в атмосфере, содержащей 5% СО2. Планшет для культивации ткани вынимали из инкубатора и весь краситель удаляли аспирацией. Окрашивались лишь живые клетки. Клетки подвергали лизису путем добавления в лунки 100,0 мкл смеси изопропанол-HCl. После проведения лизиса планшеты прочитывали при длине волны 540 нм с использованием планшет-ридера (Spectra Max 190, Molecular Device).
Интерпретация результатов
Токсичность соединения выражали в процентах к токсичности в - ve контрольном образце. Процент цитотоксичности рассчитывали с использованием формулы, приведенной ниже:
In vivo эффективность РС-1
In vivo эффективность соединения против заражения A.fumigatus изучали на мышах разновидности Balb/C обоих полов в возрасте 6-8 недель весом 15-20 г. Мышиная модель аспергиллеза, описанная Dixon с сотр. (1989), использовалась для исследования действия соединения на in vivo заражение A.fumigatus.
Животные содержались в клетках с микробарьерами со стерильной подстилкой в условиях предоставления ad libitum воды и пищи. Мышей подразделяли на 6 групп, каждая из которых включала по 8-10 животных. Мышей экспериментально инфицировали A.fumigatus. За три дня до инфицирования конидиями мышам делали подкожные инъекции 3 доз (250,0 мг/кг/день) ацетата кортизона в 400,0 мкл PBS. В день инфицирования каждой мыши назально вводили по одной капле конидиальной суспензии. У животных в такой модели развивался инвазивный аспергиллез, и все инфицированные животные погибали в течение 4-6 дней.
Приготовление инокулята для A.fumigatus в опытах по экспериментальному заражению мышей.
Изолят A.fumigatus (190/96) выращивали в течение 4 дней на планшетах с Sabouraud декстрозным агаром при 37°С. Конидии собирали с культуральных планшетов с использованием PBS (pH 7,2), содержащего 0,05% Tween 80 (Sigma Chemicals), и полученные суспензии фильтровали через стерильную стекловату. Конидии переводили в осадок путем центрифугирования со скоростью 2000 об/мин и ресуспендировали в PBS, pH 7,2. Определяли численность конидий и поддерживали их концентрацию 1×108 конидий/мл. Жизнеспособность конидий определяли высеванием разбавлений суспензий на Sabouraud декстрозном агаре.
Очищенное соединение (метелатропиниловый эфир), выделенный из D. metel, перорально применяли с концентрацией 0,0, 25,0, 50,0, 100,0, 200,0 и 400,0 мг/кг веса тела на мышах, экспериментально инфицированных A.fumigatus.
Лечение
Дозирование 6 различным группам животных (обработанных кортизоном и зараженных) испытуемыго соединения начинали через 30 минут после заражения конидиями A.fumigatus.
Группа I: мыши получали перорально 7 доз по 25,0 мг/кг/день испытуемого соединения.
Группа II: животные, инфицированные конидиями A.fumigatus, в течение 7 дней получали перорально по 50 мг/кг/день испытуемого соединения.
Группа III: животные этой группы получали 7 пероральных дозировок соединения по 100,0 мг/кг/день каждая.
Группа IV: в этой группе животные получали 7 пероральных доз испытуемого соединения (200 мг/кг/день).
Группа V: животные этой группы получали 7 пероральных доз по 400 мг/кг/день в течение 7 дней.
Группа VI: животные этой группы использовались в качестве контрольных и получали перорально 7 доз растворителя, содержащего 400 мкл PBS.
Выживаемость
Животных содержали в соответствующим образом отмеченных клетках и внимательно следили за их весовыми потерями и смертностью. Подсчитывали выживаемость за 10 дней и определяли грибковую нагрузку на выживших особях (Clemons and Stevens, 1994). Среди животных, получивших дозы 25,0, 50,0, 100,0, 200,0 и 400,0 мг/кг веса тела, к 10-му дню выжили, соответственно, 1 из 10 (10%), 1 из 8 (12,5%), 3 из 9 (33,3%), 4 из 9 (44,4%) и 8 из 10 (80%) животных.
Количественное определение колониеобразующих единиц
Животные находились под постоянным наблюдением и к 10 дню испытания умерщвляли умирающих и выживших животных. На умерших мышах производили аутопсию с целью изъятия внутренних органов для количественного определения колониеобразующих единиц (CFU). Легкие, печень и почки мышей удаляли в асептических условиях, помещали в стерильный PBS (pH 7,2) и гомогенизировали с помощью тефлонового пестика со ступкой. Значения CFU для испытуемых животных определяли высеванием 10-кратных разбавлений гомогенатов внутренних органов на Sabouraud декстрозном агаре, содержащем 0,05% тритона Х-100. Тритон Х-100 ограничивает размер колоний и существенно облегчает их подсчет (Frosco, 1992). После инкубации в течение 48 часов при 37°С полученные колонии подсчитывали и результаты выражали числом CFU в расчете на орган.
Длительность выживания и значение CFU, указывающее на грибковую нагрузку на различные органы, использовались для оценки защитной эффективности испытуемого соединения in vivo.
Следующие ниже примеры представлены для иллюстрации настоящего изобретения и не ограничивают его область.
Пример 1
Экстракция и фракционирование
Воздушные части растения Datura metel (Solanaceae) собирали в апреле в течение месяца на территории, близлежащей к городу Дели, Индия. В Hamdard College of Pharmacy, New Delhi, зарегистрирована аутентичность идентификации растительного материала и там хранится его контрольный образец. Свежесобранный растительный материал, помещенный в хорошо проветриваемую упаковку, сушили в тени. 400 г высушенного материала измельчали в порошок и экстрагировали в каждом цикле 500 мл метанола. Все экстракты, полученные после четырех циклов экстракции, сливали и выпаривали досуха при пониженном давлении. Остаток в количестве 25 г хранили при 4°С до использования.
Метанольный экстракт последовательно экстрагировали гексаном, хлороформом и ацетоном. Вначале метанольный экстракт четырежды экстрагировали гексаном. Все четыре гексановых экстракта сливали и выпаривали растворитель. Сухую гексановую фракцию собирали и хранили при 4°С до дальнейшего использования. Остаток после экстракции гексаном по 4 раза экстрагировали хлороформом и ацетоном с получением хлороформной и ацетоновой фракций, соответственно. Окончательный остаток растворяли в метаноле. Высушенные фракции исследовали на противогрибковую активность. Фракции, не ингибирующие рост Aspergillus до концентраций 1500 мкг/мл и 50 мкг/диск, соответственно, в ингибировании прорастания пор и анализе диффузии на диске, считались неактивными. Было установлено, что хлороформная фракция Datura metel проявляет активность, поскольку концентрация в 1250 мкг/мл ингибирует прорастание 100% спор согласно анализу на ингибирование прорастания спор, а концентрация в 25 мкг/диск приводит к образованию значимой зоны ингибирования активности. В связи с этим рассматриваемую фракцию использовали в дальнейших исследованиях для идентификации и очистки активного компонента, с использованием различных хроматографических методов.
Пример 2
Очистка активного соединения
Хлороформную фракцию подвергали субфракционированию с помощью модифицированной колоночной хроматографии, как описано выше. Указанные выше фракции анализировали методом ТСХ и образцы, дающие аналогичные пятна, объединяли и сушили в вакууме с получением субфракций. Всего было получено 15 субфракций. Каждую из полученных субфракций тестировали на противогрибковую активность с использованием патогенных штаммов Aspergillus. Субфракции под номерами 10 и 11 демонстрировали потенциальную противогрибковую активность, и их дополнительно подвергали очистке методом препаративной тонкослойной хроматографии с целью выделения чистого активного компонента.
Для проведения ТСХ использовали силикагелевые пластины (каталожный номер 1.05554, F254), приобретенные у Merck. Активные фракции, полученные методом колоночной хроматографии, наносили пятнами на пластины и подвергали обработке тремя различными системами растворителей: хлороформ : ацетон : диэтиламин (5,0:4,0:1,0), хлороформ : метанол : диэтиламин (8,5:1,5:0,1) и хлороформ : метанол : муравьиная кислота (8,0: 2,0:0,1). Полосы на пластинах визуализировали с помощью УФ-облучения с длиной волны 254 нм и 366 нм и опрыскиванием хлорпалатинатом, реагентом Драгендорфа и иодом. Компоненты в трех различных основных полосах, которые расщеплялись под воздействием системы растворителей хлороформ : метанол : муравьиная кислота (8,0:2,0:0,1) (фиг.1) и имели значения Rf 0,14, 0,22 и 0,37, соответственно, соскабливали с пластины и исследовали их противогрибковую активность. Соединение, обладающее эффективностью по отношению к Aspergillus, восстанавливали с полосы с Rf 0,22. Это соединение очищали повторной обработкой методом ТСХ и тестировали на его противогрибковую активность. Активное соединение дает положительную реакцию с реагентом Драгендорфа, что свидетельствует о его алкалоидной природе.
Чистоту соединения, полученного после препаративной ТСХ, анализировали методом ВЭЖХ с использованием колонк