Гибридный ген pcupl - a sup35mc для анализа факторов, регулирующих продукцию, агрегацию и дисагрегацию пептида амилоид (a ) человека в дрожжевой системе
Иллюстрации
Показать всеИзобретение относится к области биотехнологии и может быть использовано в медицине. Гибридный ген Pcupl-Aβ-SUP35MC получен на основе промотора CUP1, последовательности, кодирующей полноразмерный амилоидный пептид бета (Аβ-пептид) человека, последовательности, кодирующей М и С домены белка Sup35 дрожжей Saccharomyces cerevisiae, и последовательности, терминирующей трансляцию. Применение изобретения позволяет проводить масштабный скрининг агентов, регулирующих агрегацию Аβ-пептида. 2 ил.
Реферат
Изобретение относится к генной инженерии и биомедицинской промышленности и представляет собой последовательность нуклеотидов ДНК, кодирующих гибридный ген Aβ-SUP35MC.
Изобретение имеет большой практический, медицинский и нравственный аспект, поскольку касается, в частности, не только проблемы увеличения средней продолжительности жизни человека, но и его психического здоровья. С увеличением средней продолжительности жизни в развитых странах закономерно увеличивается число людей, страдающих нейродегенеративными заболеваниями. В связи с этим исследование механизмов нейродегенеративных заболеваний и поиски пути их лечения являются одним из приоритетных направлений современной биомедицины. Наибольший практический интерес представляют исследования болезни Альцгеймера (одной из широко распространенных форм старческого маразма), связанной с формированием в тканях центральной нервной системы так называемых амилоидных бляшек, основным компонентом которых является пептид Аβ. Аβ-пептид представляет собой продукт одного из двух путей протеолиза белка АРР (Amiloid Precusor Protein) (1) - Wisniewski Т., Ghiso J., Frangione В. Bilology of Aβ amyloid in Alzheimer's desease. // Neurobiology of desease. 1997. 4: 313-328. Есть основания полагать, что формирование амилоидных бляшек является результатом нарушения процессинга, что может приводить к увеличению продукции Аβ-пептида (2) - Citron M., Westaway D., Xia W., Carlson G. et al. Mutant presenilins of Alzheimer' s disease increase production of 42-residue amyloid beta-protein in both transfected cells and transgenic mice. // Nat Med. 199 V3. P.67-72; (3) - Suzuki N., Cheung T.T., Cai X.D., Odaka A. et al. An increased percentage of long amyloid beta protein secreted by familial amyloid beta protein precursor (beta APP717) mutants. // Science. 1994. 264. P.1336-1340; (4) - Tamaoka A., Odaka A., Ishibashi Y., Usami M. et al. APP717 missense mutation affects the ratio of amyloid beta protein species (A beta 1-42/43 and a beta 1-40) in familial Alzheimer's disease brain. J Biol Chem. 1994. 269(52). P. 32721-32724. В олигомерной изоформе Аβ-пептид представлен в виде β-слоев и вызывает нейротоксический эффект (5) - Price D.L., Sisodia S.S. Mutant genes in familial Alzheimer' s disease and transgenic models. Annu Rev Neurosci. 1998. V21. P.479-505. У людей среднего возраста это заболевание встречается достаточно редко, однако после 85 лет болезнью Альцгеймера страдает каждый третий. Так, по прогнозам нобелевского лауреата Стенли Прусинера к 2025-му году число американцев, страдающих этим заболеванием, составит 10 миллионов, а к 2050-му 50 миллионов (6) - Prusiner S.B. Shattuck lecture - neurodegenerative deseases and prions. // N Eng J Med. 2001. V.344. No.20. P.1516-1526. Болезнь Альцгеймера неизбежно приводит к нарушению психической и физической активности и, в конечном итоге, имеет летальный исход. До настоящего времени не существует способов борьбы с этим неизлечимым недугом. В связи с этим исследование биологических аспектов этого заболевания и поиски лекарственных средств против болезни Альцгеймера чрезвычайно актуальны.
Характеристика гибридного гена.
Гибридный ген Pcupl-Aβ-SUP35MC для анализа факторов, регулирующих продукцию, агрегацию и дисагрегацию пептида амилоид β (Аβ) человека в дрожжевой системе, имеющий размер 2493 пар оснований, состоит из следующих элементов:
фрагмента Xhol-BamHl размером 477 п.о., представляющего последовательность, индуцибельного CUPl-промотора для экспрессии последовательностей в дрожжевой клетке. Уровень экспрессии последовательностей под контролем CUPl-промотора зависит от концентрации ионов меди в питательной среде. С увеличением концентрации ионов меди увеличивается уровень экспрессии последовательностей, контролируемых CUPl-промотором;
BamHI-BamHl фрагмента размером 135 пар оснований, представляющего собой последовательность, кодирующую амилоидный пептид бета (Аβ-пептид) человека, размером 40 аминокислот, фланкированную ТАТА-боксом и старт-кодоном (АТО) с 5'-конца;
BamHl-Sacl фрагмента размером 1879 пар оснований, представляющего собой последовательность, кодирующую М и С домены белка Sup35 дрожжей Saccharomyces cereviceae, фланкированную сайтом рестрикции BamHl с 5', а также последовательностями, терминирующими транскрипцию и трансляцию, и сайтом Sad с 3'-конца. Функции М домена неизвестны. С домен является вспомогательным фактором терминации трансляции eRF3 (7) - Zhouravleva G., Frolova L., Le Goff X., Le Guellec R., hige-Vechtomov S., Kisselev L., Philippe М. Termination of translation in eukaryotes is governed by two interacting polypeptide chain release factors, eRFl and eRF3. // EMBO J. 1995. 14:4065-4072. Инактивация С домена приводит к снижению точности терминации трансляции и индукции нонсенс-супрессии.
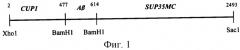
Взаимное расположение элементов гибридного гена PCUPl-Aβ-SUP35MC представлено на фиг.1.
На фиг.1 указаны сайты рестрикции (Xhol, BamHl, BamHl и Sad), фланкирующие элементы гибридного гена (CUPl-промотор, последовательность, кодирующая Аβ-пептид человека и фрагмент, кодирующий М и С домены дрожжевого гена SUP35). Цифрами указаны номера нуклеотидов кодирующей цепи, вслед за которыми соответствующая рестриктаза гидролизует последовательность.
Элементы (последовательности, кодирующие Аβ-пептид и Sup35MC) находятся под контролем CUPl-промотора, фланкированы сайтами рестрикции и представляют собой одну открытую рамку считывания.
В конкретном примере ген встроен в центромерную плазмиду [PCUPl-Aβ-SUP35MC(UBA3)], которая содержит бактериальный и дрожжевой орижины репликации, ген устойчивости к ампицилину - AmpR и ген URE3.
Нуклеотидная последовательность гибридного гена Pcupl-Aβ-SUP35MC:
Получение гибридного гена Pcupl-Aβ-SUP35MC и пример реализации.
Последовательность, кодирующая Аβ-пептид, была получена при помощи стандартного метода «RT-PCR» из тотальной РНК мозга абортуса (протокол приведен ниже). Праймеры содержат регуляторные последовательности (ТАТА-бокс и кодон ATG, инициирующий транскрипцию), сайты рестрикции BamHl и Sad и последовательности комплиментарные 5' и 3' концам Аβ, кодирующего 40 аминокислот.
Нуклеотидная последовательность праймеров:
F-primer: 5' GGGTCCAC GGATCC TAT ATG TCT GATGCAGAATTCCGACAT 3'
R-primer: 5' GTTATAAA GGATCC GACAACACCGCCCACCAT 3'
Для получения однонитевой копиии сДНК была проведена реакция обратной транскрипции:
Тотальная РНК из мозга абортуса - 1 μl (1 μg/μl)
Праймер F - 1 μl (100 ng)
Добавить:
5 × буфер - 4 μl
dNTP - 3 μl (2mM)
Полимеразная цепная реакция:
кДНК - 2 μl
10 × буфер - 5
dNTP - 2 μl (2mM)
праймер F -1 μl (100 ng)
праймер R - 1 μl (100 ng)
H2O - 38 μl
- полимераза "Vent" - 1 μl
Полимеразная цепная реакция:
Фаза 1 94° 1 мин
Фаза 2 94° 1 мин
41° 1 мин 1 цикл
72° 1 мин
Фаза 3 94° 1 мин
63° 1 мин 40 циклов
72° 1 мин
Плазмида [Psup35-SUP35MC(URA3)] (Werzyn et al., 2001) была гидролизована с помощью рестриктаз Xhol и BamHl, что позволило заместить промотор SUP35 на последовательность, кодирующую промотор CUP1 (нуклеотидная последовательность промотора CUPl представлена). Реакция лигирования проводилась по стандартному протоколу фирмы "Promega". Таким образом, была сконструирована плазмида [РCUPl SUP35MC(URA3)].
Амплифицированная последовательность, кодирующая Аβ-пептид, была проверена секвенированием (фирма «Хеликс») и, затем, с помощью лигирования, встроена в плазмиду [Рcupl-SUP35MC(URA3)] по сайтам BamHl и Sad, расположенными вслед за CUPl-промотором. Полученная нами центромерная плазмида [Рcupl-Aβ-SUP35MC(URA3)] содержит последовательность гибридного гена Aβ-SUP35MC под контролем индуцибельного CUPl-промотора, бактериальный и дрожжевой орижины репликации, ген устойчивости к ампилицилину - AmpR и ген URE3.
Пример использования гибридного гена Рcupl-Aβ-SUP35MC
Поиск агентов, блокирующих агрегацию Аβ-пептида, планируется проводить с использованием дрожжевой тест-системы, которая позволит вести масштабный скрининг белков, пептидов и химических агентов, блокирующих и (или) предотвращающих агрегацию Aβ-пептида. Ключевым элементом такой тест-системы является заявляемый гибридный ген Рcupl-Aβ-SUP35MC. Данный гибридный ген экспрессируется в дрожжевом штамме и кодирует гибридный белок Aβ-Sup35MC. Последовательность, соответствующая М и С доменам дрожжевого белка Sup35, выполняет функцию фактора терминации трансляции. Аминокислотные последовательности Aβ-пептида человека способны агрегировать друг с другом, что приводит к агрегации и частичной инактивации гибридного белка Ap-Sup35MC. Используемый дрожжевой штамм имеет делецию хромосомной копии гена SUP35 и маркирован нонсенс-мутацией adel-14. Агрегация и инактивация Aβ-Sup35MCp приводит к снижению точности терминации трансляции, что приводит к супрессии нонсенс-мутации adel-14 и детектируется по критерию «рост - отсутствие роста на селективной среде без аденина». Таким образом, использование гибридного гена Рcupl-Aβ-SUP35MC позволяет выявлять агрегацию Аβ-пептида человека на фенотипическом уровне. Это дает возможность быстро и дешево проводить первичный масштабный поиск белков, пептидов и химических соединений, блокирующих и предотвращающих болезнетворную агрегацию Аβ-пептида. В частности, планируется провести полный скрининг кДНК библиотеки из мозга человека и выявить белки, контролирующие олигомеризацию Аβ-пептида. Такие белки можно рассматривать в качестве потенциальных терапевтических средств против болезни Альцгеймера.
Другие тест-системы
Заявителю неизвестны из патентной и научной литературы аналогичные тест-системы, позволяющие вести указанный выше масштабный скрининг агентов, блокирующих агрегацию Аβ-пептида. Поиск факторов, контролирующих агрегацию Аβ,проводится в экспериментах на млекопитающих, в культуре клеток, или в системе in vitro.
В частности, получена трансгенная линия мышей, которые несут ген АРР человека и предрасположены к развитию нейродегенеративного заболевания в результате отщепления Аβ-пептида (8) - Sturchler-Pierrat Ch., Abramowski D., Duke М., Wiederhold K. et al. Two amyloid precursor protein transgenic mouse models with Alzheimer disease-like pathology. // Proceeding of National Academy of Sciences of USA. 1997. Vol.94, P.13287-13292). Тестирование каждого потенциального лекарственного средства требует эксперимента с целой группой группой животных и длится не менее года.
Эксперименты с культурами клеток и в системе in vitro требуют использования биохимических методов (9) - Pike C.J., Walencewicz A.J., Glabe C.G., Cotman C.W. In vitro aging of beta-amyloid protein causes peptide aggregation and neurotoxicity. Brain Research. 1991 Nov 1; 563(1-2), P.311-314); (10) - Lorenzo A., Yankner B.A. Beta-amyloid neurotoxicity requires fibril formation and is inhibited by congo red. Proc Nati Acad Sci USA. 1994 Dec 6; 91(25), P.12243-12247). Совершенно очевидно, что данные подходы не позволяют осуществлять масштабный скрининг агентов, блокирующих формирование амилоидов.
Анализ проводился при помощи стандартного метода дифференциального центрифугирования с последующей Вестерн-блот гибридизацией (Ма and Lindquist, 1999, Nature Cell Biol, 1(6): 358-361).
Тотальный белок был выделен из штамма Saccharomyces cerevisiae, содержащего гибридный ген Pcupl-Aβ-SUP35MC, и разделен с помощью ультрацентрифугирования в градиенте сахарозы на различные фракции. Верхняя (самая легкая) фракция содержит белок в мономерной изоформе. Во всех других фракциях (осадочных) белок может выявляться только в том случае, если он формирует в клетках высокомолекулярные агрегаты за счет агрегации. После этого белок из всех полученных фракций денатурировали до мономерного состояния и наносили на полиакриламидный гель для проведения белкового электрофореза. Белки переносили с геля на нитроцеллюлозную мембрану и проводили Вестерн-блот гибридизацию с моноклональными антителами (4F "Sigma") к Аβ-пептиду. Во всех проанализированных фракциях выявляется специфичный сигнал гибридизации в районе 80-90 kDa, что соответствует размеру белка Аβ-Sup35MC. На второй дорожке специфический сигнал соответствует мономерной фракции белка Aβ-Sup35MC. Наличие специфического сигнала на 2-й, 3-й, 4-й и 5-й дорожках свидетельствует о наличии в клетках дрожжей агрегатов Aβ-Sup35MC различного размера (фиг.2).
Поскольку значительная доля белка выявляется в осадочных фракциях, можно утверждать, что белок Aβ-Sup35MC агрегирует в дрожжевой клетке. Поскольку укороченный белок Sup35MC не способен к агрегации (Ter-Avanesyan et al., 1994, Genetics, 137:671-676), то можно утверждать, что агрегация обусловлена наличием в составе гибридного белка последовательности Aβ-пептида.
Список использованной литературы
1. Wisniewski Т., Ghiso J., Frangione В. Bilology of Ар amyloid in Alzheimer's desease. // Neurobiology of desease. 1997. 4: 313-328.
2. Citron M., Westaway D., Xia W., Carlson G. et al. Mutant presenilins of Alzheimer' s disease increase production of 42-residue amyloid beta-protein in both transfected cells and transgenic mice. // Nat Med. 199 V3. P.67-72.
3. Suzuki N., Cheung T.T., Cai X.D., Odaka A. et al. An increased percentage of long amyloid beta protein secreted by familial amyloid beta protein precursor (beta APP717) mutants. // Science. 1994. 264. P.1336-1340.
4. Tamaoka A., Odaka A., Ishibashi Y., Usami M. et al. APP717 missense mutation affects the ratio of amyloid beta protein species (A beta 1-42/43 and a beta 1-40) in familial Alzheimer's disease brain. J Biol Chem. 1994. 269(52). P.32721-32724.
5. Price D.L., Sisodia S.S. Mutant genes in familial Alzheimer' s disease and transgenic models. Annu Rev Neurosci. 1998. V21. P.479-505.
6. Prusiner S.B. Shattuck lecture - neurodegenerative deseases and prions. // N Eng J Med. 2001. V.344. No.20. P.1516-1526].
7. Zhouravleva G., Frolova L., Le Goff X., Le Guellec R., Inge-Vechtomov S., Kisselev L., Philippe M. Termination of translation in eukaryotes is governed by two interacting polypeptide chain release factors, eRF1 and eRF3. // EMBO J. 1995. 14:4065-4072.
8. Sturchler-Pierrat Ch., Abramowski D., Duke M., Wiederhold K. et al. Iwo amyloid precursor protein transgenic mouse models with Alzheimer disease-like pathology. // Proceeding of National Academy of Sciences of USA. 1997. Vol.94, P.13287-13292.
9. Pike C.J., Walencewicz A.J., Glabe C.G., Cotman CW. In vitro aging of beta-amyloid protein causes peptide aggregation and neurotoxicity. Brain Research. 1991 Nov 1; 563(1-2), P.311-314.
10. Lorenzo A., Yankner B.A. Beta-amyloid neurotoxicity requires fibril formation and is inhibited by congo red. Proc Nati Acad Sci USA. 1994 Dec 6; 91(25), P.12243-12247.
Гибридный ген Pcupl-Aβ-SUP35MC для анализа факторов, регулирующих продукцию, агрегацию и дисагрегацию пептида амилоид β (Аβ) человека в дрожжевой системе, состоящий из фрагмента Xhol-BamHl размером 477 пар оснований, представляющего собой последовательность CUPl-промотора, BamHl-BamHl фрагмента размером 135 пар оснований, представляющего собой последовательность, кодирующую полноразмерный амилоидный пептид бета (Аβ-пептид) человека, размером 40 аминокислот (см. нуклеотидную последовательность, представленную в перечне последовательностей под цифрой «2»), фланкированную ТАТА-боксом и старт-кодоном (ATG) с 5'-конца, BamHl-Sacl фрагмента размером 1879 пар оснований, представляющего собой последовательность, кодирующую М и С домены белка Sup35 дрожжей Saccharomyces cerevisiae, фланкированную сайтом рестрикции BamHl с 5', а также последовательностью, терминирующей трансляцию и сайтом Sad с 3'-конца.