Извлечение меди из халькопирита
Иллюстрации
Показать всеИзобретение относится к способам извлечения меди из халькопирита. Способ включает (а) окисление серы в халькопирите раствором при определенных условиях взаимодействия и высвобождение, по меньшей мере, части присутствующей в халькопирите меди в раствор, последующую стадию восстановления серы в твердом продукте со стадии (а) до сульфида при определенных условиях взаимодействия и окисление серы в твердом продукте со стадии (b) раствором в определенных условиях взаимодействия и высвобождение, по меньшей мере, части остаточной меди в твердом продукте в раствор в виде ионов меди на стадии (с). Способ дополнительно включает извлечение меди из одного или более растворов со стадии (а) и (с), обеспечивается повышение скорости выщелачивания и извлечения меди в раствор. 2 н. и 21 з.п. ф-лы, 2 ил.
Реферат
Настоящее изобретение относится к извлечению меди из халькопирита (CuFeS2).
Предметом настоящего изобретения является способ извлечения меди из халькопирита, который основан на выщелачивании меди в раствор и последующем извлечении меди из упомянутого раствора.
Существует ряд предложений по использованию конкретных интервалов окислительно-восстановительного потенциала для выщелачивания халькопирита.
Международная заявка PCT/GB97/00585 (WO 98/39491) на имя Энтони Пинчеза (Anthony Pinches) раскрывает один такой предложенный интервал окислительно-восстановительного потенциала.
Упомянутая Международная заявка раскрывает способ выщелачивания меди из халькопирита с использованием раствора, содержащего ионы трехвалентного железа и растворенный кислород, для окисления меди в халькопирите до растворимой формы.
Способ, раскрытый в упомянутой Международной заявке, характеризуется регулированием поверхностного потенциала халькопирита во время стадии выщелачивания в интервале от 350 до 450 мВ, измеренного относительно стандартного каломельного электрода сравнения.
Упомянутая Международная заявка раскрывает тот факт, что регулирование поверхностного потенциала в интервале от 350 до 450 мВ делает возможным достижение приемлемых скоростей выщелачивания.
Настоящее изобретение основано на исследовательской работе, которая позволяет заявителю считать установленным, что вышеупомянутый интервал от 350 до 450 мВ является границей между окислительными и восстановительными условиями.
С учетом результатов этой экспериментальной работы заявитель считает, что возможно получить лучшие результаты (в смысле общего извлечения меди из халькопирита и скоростей выщелачивания), чем результаты, достигнутые с помощью раскрытого в упомянутой Международной заявке способа.
Более конкретно, заявитель считает, что лучшие результаты могут быть получены с помощью способа согласно настоящему изобретению, который включает в себя обработку халькопирита сначала в окислительных условиях, а затем в восстановительных условиях.
В данном способе, так же, как и в способе, раскрытом в упомянутой Международной заявке, присутствующая в халькопирите медь высвобождается в раствор на стадии окисления.
Целью стадии восстановления, как в данный момент понимается заявителем, является восстановление серы (Sn 2-) в остающемся твердом продукте до степени окисления минус два, т.е. сульфида (S2-). Заявитель считает, что упомянутое восстановление ионов серы до валентного состояния сульфида необходимо для достижения затем по существу полного удаления меди, присутствующей в остающемся твердом продукте, на последующей стадии окисления или цикле стадий окисление/восстановление.
В широком смысле согласно настоящему изобретению предусматривается способ извлечения меди из халькопирита, включающий в себя стадии:
(а) взаимодействия халькопирита (приведения его в контакт) с раствором при определенных условиях взаимодействия, причем раствор и условия взаимодействия выбирают для окисления серы в халькопирите и тем самым высвобождения по меньшей мере части присутствующей в халькопирите меди в раствор в виде ионов меди;
(b) взаимодействия твердого продукта со стадии (а) с раствором при определенных условиях взаимодействия, причем раствор и условия взаимодействия выбирают для восстановления серы в твердом продукте до минус двух, т.е. сульфида, и тем самым восстановления серы в твердом продукте до сульфидных ионов;
(с) взаимодействия твердого продукта со стадии (b) с раствором при определенных условиях взаимодействия, причем раствор и условия взаимодействия выбирают для окисления серы в твердом продукте и тем самым высвобождения по меньшей мере части оставшейся в твердом продукте меди в раствор в виде ионов меди; и
(d) извлечения меди из одного или более растворов со стадий (а) и (с).
Вышеупомянутый способ выщелачивания может быть осуществлен как способ кучного выщелачивания, способ выщелачивания из отвалов, реакторная система выщелачивания или способ выщелачивания in situ (т.е. на месте).
Предпочтительно, стадия (а) окисления включает в себя взаимодействие халькопирита с раствором, содержащим ионы трехвалентного железа.
Предпочтительно, стадия (а) окисления включает в себя взаимодействие халькопирита с раствором, содержащим ионы трехвалентного железа и растворенный кислород.
Окисление халькопирита ионами трехвалентного железа и растворенным кислородом потребляет ионы трехвалентного железа и превращает их в ионы двухвалентного железа.
Соответственно, является предпочтительным, когда стадия (а) окисления включает в себя взаимодействие халькопирита с раствором, содержащим ионы трехвалентного железа и растворенный кислород, в присутствии окисляющих железо бактерий, которые окисляют ионы двухвалентного железа до ионов трехвалентного железа в аэробных условиях.
Предпочтительно, упомянутый раствор, содержащий ионы трехвалентного железа и растворенный кислород, находится при рН менее 2,5, более предпочтительно - в интервале 0,5-2, еще более предпочтительно - в интервале 0,5-1,5.
Предпочтительно, упомянутый раствор, содержащий ионы трехвалентного железа и растворенный кислород, находится при температуре 30-80°C, более предпочтительно - 50-80°C.
Обычно раствор содержит сульфатные ионы при кислотности раствора, обеспечиваемой серной кислотой.
Раствор может подаваться из внешнего источника и/или генерироваться путем окисления серы до сульфата с использованием бактерий.
В альтернативном варианте раствор содержит хлоридные ионы при кислотности раствора, обеспечиваемой хлористоводородной кислотой.
В раствор могут вводиться (добавляться) выбранные добавки для облегчения реакций выщелачивания.
Заявитель считает, что в некоторых ситуациях улучшение стабильности ионов одновалентной меди в растворе может быть благоприятным.
Когда раствор содержит сульфатные ионы, упомянутые добавки предпочтительно включают в себя хлоридные ионы и/или другие частицы, которые образуют комплекс с ионами меди.
Предпочтительно, стадия (b) восстановления включает в себя взаимодействие твердого продукта со стадии (а) с раствором, содержащим сульфатные ионы, в присутствии бактерий, которые потребляют сульфатные ионы и генерируют реагенты, которые восстанавливают ионы серы в твердом продукте до сульфидных ионов в анаэробных условиях.
Предпочтительно, упомянутый раствор содержит некоторое количество железа, присутствующего в виде ионов двухвалентного железа, и соответствующие бактерии, так что в анаэробных условиях ионы трехвалентного железа, присутствующие в растворе или образовавшиеся во время данной стадии, восстанавливаются до ионов двухвалентного железа.
Предпочтительно, бактерии являются совместимыми с бактериями, используемыми на стадии (а) окисления, для минимизации результатов конкуренции при изменении (замене) растворов.
Более предпочтительно, бактерии относятся к типу, который может изменять поведение от окисления ионов двухвалентного железа в присутствии кислорода до восстановления ионов трехвалентного железа в отсутствие кислорода, и могут быть, таким образом, использованы для обеих стадий (а) и (b).
Предпочтительно, стадия (с) окисления включает в себя взаимодействие твердого продукта со стадии (b) с раствором, содержащим ионы трехвалентного железа и растворенный кислород.
Предпочтительно, стадия (с) окисления включает в себя взаимодействие твердого продукта со стадии (b) с раствором, содержащим ионы трехвалентного железа и растворенный кислород, в присутствии окисляющих железо бактерий, которые окисляют ионы двухвалентного железа до ионов трехвалентного железа в аэробных условиях.
В одном варианте осуществления стадия (d) извлечения включает в себя стадию экстракции растворителем, на которой выделяют ионы меди из растворов, содержащих ионы меди, и получают медьсодержащие растворители и обедненные медью рафинаты.
В данном варианте осуществления является предпочтительным, когда стадия (d) извлечения дополнительно включает в себя стадию электрохимического выделения, на которой извлекают медь из растворителей.
Предпочтительно также, стадия (d) извлечения включает в себя обработку обедненных медью рафинатов и риформинг желаемого щелока от выщелачивания либо путем регенерирования любых остаточных ионов двухвалентного железа до ионов трехвалентного железа в рафинатах, либо альтернативно путем восстановления присутствующих ионов трехвалентного железа до ионов двухвалентного железа для рециклирования на стадию восстановительного выщелачивания.
Обработанные рафинаты могут быть поданы в качестве растворов на стадию (а) и/или стадию (b) и/или стадию (с).
В другом, хотя и не в единственном другом, варианте осуществления стадия (d) извлечения включает в себя обработку растворов, содержащих ионы меди, и получение медьсодержащего промежуточного продукта.
Сульфид меди и оксид меди являются примерами такого промежуточного продукта.
Согласно настоящему изобретению предусмотрен также способ, такой как способ кучного выщелачивания, для извлечения меди из халькопирита, включающий в себя стадии:
(а) взаимодействия халькопирита с раствором, содержащим ионы трехвалентного железа, при аэробных условиях в присутствии окисляющих железо бактерий и окисления серы в халькопирите и окисления ионов двухвалентного железа, полученных при окислении серы, до ионов трехвалентного железа и посредством этого высвобождения по меньшей мере части меди в халькопирите в раствор в виде ионов меди;
(b) взаимодействия твердого продукта со стадии (а) с раствором, содержащим сульфатные ионы, в присутствии бактерий, которые потребляют сульфатные ионы в анаэробных условиях и генерируют реагенты, которые восстанавливают серу в твердом продукте до валентного состояния минус два, т.е. сульфида, и тем самым восстановления серы в твердом продукте до сульфидных ионов;
(с) повторения стадии (а) на твердом продукте со стадии (b) и окисления серы в твердом продукте и окисления ионов двухвалентного железа, полученных при окислении серы, до ионов трехвалентного железа, и тем самым высвобождения по меньшей мере части меди в твердом продукте в раствор в виде ионов меди; и
(d) извлечения меди из одного или более растворов со стадий (а) и (с).
Предпочтительно, способ включает в себя повторение последовательности стадий (a), (b) и (с) из предыдущего абзаца и извлечение меди из любого одного или более растворов со стадий (а) и (с), как требуется для извлечения существенной части меди в халькопирите.
Предпочтительно, стадия (b) включает в себя взаимодействие твердого продукта со стадии (а) с раствором, содержащим сульфатные ионы, путем введения раствора, полученного ex situ из кучи, и замещения окислительного раствора со стадии (а), либо путем изменения условий в куче, так что присутствующий раствор превращается в требуемый восстановительный раствор, за счет ограничения количества присутствующего кислорода и обеспечения последующего бактериального воздействия, с превращением ионов трехвалентного железа в ионы двухвалентного железа и потреблением части или всех сульфатных ионов, либо обоими путями замены и превращения.
Настоящее изобретение основано на исследовательской работе, результатом которой стало заключение заявителя о том, что механизм реакции выщелачивания меди из халькопирита требует стадии восстановления после начальной стадии окисления для того, чтобы кондиционировать халькопирит (т.е. придать ему необходимое состояние) и, в частности, серу в халькопирите, так что последующая стадия окисления может удалить по существу всю оставшуюся медь из халькопирита.
Следующие моменты суммируют исследовательскую работу, выполненную заявителем и для него, и некоторые результаты этой работы, которая привела в итоге к разработке упомянутого механизма реакции.
- Были выполнены исследования растворения при рН 1 и 2 в HClO4 и H2SO4 при 85°C и 40°C (время приведенное).
- Исследования растворения были выполнены в воздухе, кислороде или азоте для контроля степени возможного окисления.
- Введение ионов трехвалентного железа было исследовано в воздухе и в азоте.
- Было исследовано введение ионов двухвалентного железа вместе с продувкой азотом; эта работа показала, что в случае, если восстановитель присутствует сначала, то может быть инициировано растворение при действии полученных ионов трехвалентного железа, в свою очередь, в качестве окислителя.
- Был выполнен рентгеновский фотоэлектронный спектроскопический (от англ. XPS, т.е. X-ray photoelectron spectroscopy) поверхностный анализ поверхностей, экстрагированных при выбранном времени растворения; эта работа показала образование полисульфида на поверхностях и повторное появление сульфидного пика.
- Были выполнены специальные расчеты раствора и квантово-химическое моделирование механизма поверхностного выщелачивания.
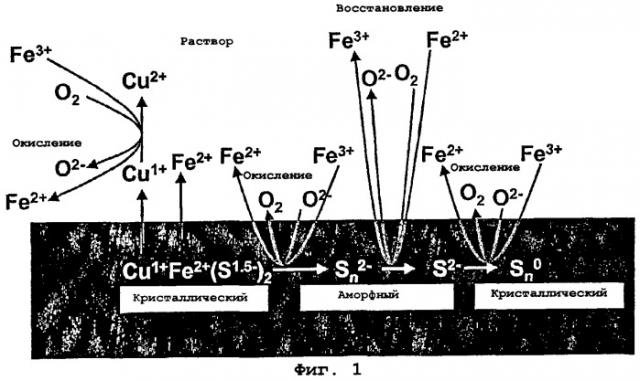
Механизм реакции выщелачивания халькопирита (насыпного, т.е. в куче) показан схематически на фиг.1 и стехиометрически описан в приведенных ниже уравнениях 1-4.
Обращаясь к фиг.1, начальная реакция в реакционном механизме представляет собой реакцию окисления серы в халькопирите. Уравнения 1 и 2 описывают такую начальную реакцию окисления. В последующих уравнениях "n" представляет собой целое число больше 1.
Реакция окисления показана как на фиг.1.
Уравнения 1 и 2 показывают начальное частичное выщелачивание Cu2+ и Fe2+ и образование полисульфидов (Sn 2-).
Степени окисления Cu и Fe в халькопирите представляют собой Cu1+ и Fe2+ (как было показано с помощью квантово-химического моделирования), и эти степени окисления сохраняются при образовании полисульфида (как было показано с помощью рентгеновских фотоэлектронных спектроскопических исследований). Таким образом, окисление серы в халькопирите обусловлено восстановлением частиц в растворе.
Двумя видами частиц в растворе, которые наиболее вероятно ответственны за упомянутый процесс, являются Fe3+ (уравнение 1) или О2 (уравнение 2).
Из экспериментальных данных видно, что Fe3+ является более эффективным окислителем, чем О2, поскольку скорость окисления увеличивается при добавлении Fe3+, однако при увеличенной подаче О2 подача Fe3+ может быть обеспечена вначале (при отсутствии добавления Fe3+) за счет растворения поверхностного слоя халькопирита из оксида/гидроксида Fe(III). Предполагается, что данная реакция окисления является скоростьопределяющей (лимитирующей скорость) при рН=2 (из-за более низкого значения Eh и, следовательно, более низкого отношения Fe3+ к Fe2+).
Из уравнений 1 и 2 можно видеть, что процент (%) Cu и Fe, выщелоченных из халькопирита, является функцией длины образованных полисульфидных цепей, т.е. величины n. Если n=2, то выщелачивается 1/3 Cu и Fe. Однако, если n=10, тогда во время упомянутой стадии будет выщелачиваться приблизительно 87% Cu и Fe. На основе упомянутых уравнений можно постулировать, что в случае, если достаточно сильный окислитель (такой как Fe3+) присутствует в достаточных количествах, выщелачивание может проходить почти до конца, т.е. почти полностью.
При дальнейшем обращении к фиг.1 видно, что следующей реакцией в реакционном механизме является реакция восстановления, которая превращает полисульфиды (Sn 2-) в моносульфиды (S2-). Эта реакция показана в уравнении 3.
и/или
Данное уравнение описывает восстановительный разрыв длинноцепочечных полисульфидов на полисульфиды с более короткими цепями. Моносульфид S2- был выбран в уравнении для представления упомянутого процесса, т.к. он является тем сульфидом, который показывает наибольшее повторное появление при выщелачивании. Упомянутая реакция протекает при окислении Fe2+ до Fe3+ или окислении Cu+ до Cu2+.
Окисление Fe2+ до Fe3+ происходит только в том случае, если Fe2+ находится в растворе в сравнительно значительном избытке. Н+ адсорбируется из раствора для того, чтобы уравновесить получаемый в результате поверхностный заряд. В уравнении 3 даны два альтернативных варианта получаемой в результате структуры выщелоченного халькопирита с показом возможного образования смеси моносульфидного продукта и H2S.
Восстановление полисульфидного слоя не позволяет высвободить Cu и Fe из твердого вещества, однако делает возможным конечную реакцию окисления в реакционном механизме (как показано на фиг.1), согласно которой образуется кристаллическая элементарная сера.
Уравнение 4 является такой реакцией окисления.
Эта реакция окисления приводит к массовой структурной перестройке поверхности от аморфного полисульфидного слоя (состоящего, как можно мысленно представить, из пучков «лапшинок» различной длины) до кристаллитов элементарной серы (аналогичных огромным сотам).
Оставшиеся медь и железо могут быть выщелочены из халькопирита по вышеупомянутому механизму окислительной реакции. Если n=2, то в ходе упомянутого процесса будут выщелочены оставшиеся 2/3 Cu и Fe. Если n=10, то остается только 13% Cu и Fe, подлежащих выщелачиванию. Предполагается, что весь Н+ возвращается в раствор. Однако, это будет иметь место только в том случае, если вся S превращается в кристаллическую элементарную S, и поэтому это, вероятнее всего, не происходит. Упомянутая стадия не проявляет себя как скоростьопределяющая для рН=1, и не видно, что она имеет место (пока что) для рН=2.
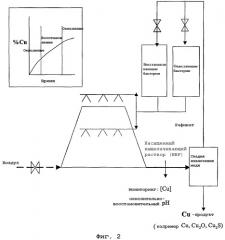
Способ согласно настоящему изобретению дополнительно описан с помощью примера со ссылкой на фиг.2.
Фиг.2 иллюстрирует один вариант осуществления способа согласно данному изобретению.
Способ, показанный на фиг.2, является способом кучного выщелачивания, в котором покрытая куча халькопирита последовательно выщелачивается:
(а) раствором, содержащим ионы трехвалентного железа при рН в интервале 1-2 и температуре 60-80°C и окисляющие железо бактерии, для окисления серы в халькопирите и превращения ионов двухвалентного железа, полученных при окислении серы, в ионы трехвалентного железа в аэробных условиях; и
(b) раствором, содержащим сульфатные ионы и железо, преимущественно в двухвалентном состоянии, с присутствующими бактериями, которые восстанавливают ионы трехвалентного железа до ионов двухвалентного железа и потребляют сульфатные ионы и генерируют реагенты, которые восстанавливают ионы серы в халькопирите в анаэробных условиях.
Вышеупомянутые стадии выщелачивания повторяют согласно требованиям по удалению меди из халькопирита. В данном контексте, как указано выше, восстановительная стадия (b) выщелачивания делает возможным удаление из халькопирита на последующей окислительной стадии выщелачивания той меди, которая не была удалена на предыдущей окислительной стадии выщелачивания.
Воздух подают в кучу селективно в процессе упомянутой выше стадии (а) выщелачивания с помощью линии с регулировочным клапаном или с помощью любого другого подходящего средства.
Выщелачивающие растворы подают в кучу из емкостей хранения, и они распределяются по куче с помощью набора распылительных сопел или с помощью любого другого подходящего средства.
Жидкость удаляют от нижней части кучи и транспортируют на стадию обработки упомянутого способа для извлечения меди.
Медь удаляют из жидкости, и обедненную медью жидкость рециркулируют в емкости хранения и повторно используют в упомянутом способе.
В зависимости от используемой обработки по извлечению меди ее извлекают в виде ряда форм, таких как медь, оксид одновалентной меди и сульфид меди.
Может оказаться полезным облегчить регулирование потока и температуры выщелачивающих растворов.
В наипростейшем виде, как описано выше (и как в настоящее время используется на практике для выщелачивания оксида меди и халькоцита), на верхнюю поверхность кучи распыляют щелок, а собирают его внизу. Однако это обеспечивает только ограниченное регулирование условий внутри кучи, и во многих случаях желательны более сложные системы внутри кучи для регулирования потока щелока и поступления воздуха.
Одна из таких более сложных систем включает в себя введение проницаемых и барьерных зон внутри кучи. Введение проницаемых зон внутри кучи, обычно путем создания секций из материала с близкими, в разумных пределах крупными размерами частиц, обеспечивает достижение внутри кучи намного более однородных условий. Упомянутые зоны обеспечивают перераспределение щелока внутри, а также, когда это желательно, могут обеспечить впрыск щелока и/или вдувание воздуха и удаление щелока тангенциально из кучи в одной или большем количестве точек вниз по боковым сторонам. Это может позволить избежать результатов нехватки реакционной способности в нижних секциях кучи и нежелательного/неконтролируемого выпадения осадков, особенно соединений железа, в упомянутых нижних секциях вследствие градиентов концентрации и температуры.
Другая более сложная система включает в себя образование барьера на наружной стороне кучи либо путем использования непроницаемого кожуха, либо путем введения материала, который взаимодействует с кислотным щелоком и становится непроницаемым. В обоих случаях цель заключается в том, чтобы предотвратить нежелательный доступ воздуха и сделать возможным затопление кучи щелоком для облегчения стадии анаэробного восстановления. Кроме того, упомянутые системы могут также сделать возможным периодическое промывание (орошение) дна для реверсирования нормальных градиентов концентрации, образующихся в процессе традиционного верхнего распыления.
В настоящем изобретении, описанном выше, может быть выполнено множество модификаций без отхода от сути и объема изобретения.
В качестве примера, хотя вариант осуществления способа согласно данному изобретению, описанный выше по отношению к фиг.2, является способом кучного выщелачивания, изобретение не ограничивается этим и распространяется на другие типы выщелачивания, включая выщелачивание из отвалов, выщелачивание in situ и реакторное выщелачивание.
1. Способ извлечения меди из халькопирита, включающий в себя стадии
(a) взаимодействия халькопирита с раствором при определенных условиях взаимодействия, причем раствор и условия взаимодействия выбирают для окисления серы в халькопирите и тем самым высвобождения по меньшей мере части присутствующей в халькопирите меди в раствор в виде ионов меди;
(b) взаимодействия твердого продукта со стадии (а) с раствором при определенных условиях взаимодействия, причем раствор и условия взаимодействия выбирают для восстановления серы в твердом продукте до минус двух, т.е. сульфида, и тем самым восстановления серы в твердом продукте до сульфидных ионов;
(c) взаимодействия твердого продукта со стадии (b) с раствором при определенных условиях взаимодействия, причем раствор и условия взаимодействия выбирают для окисления серы в твердом продукте и тем самым высвобождения по меньшей мере части оставшейся в твердом продукте меди в раствор в виде ионов меди; и
(d) извлечения меди из одного или более растворов со стадий (а) и (с).
2. Способ по п.1, в котором стадия (а) окисления включает в себя взаимодействие халькопирита с раствором, содержащим ионы трехвалентного железа.
3. Способ по п.1, в котором стадия (а) окисления включает в себя взаимодействие халькопирита с раствором, содержащим ионы трехвалентного железа и растворенный кислород.
4. Способ по п.3, в котором стадия (а) окисления включает в себя взаимодействие халькопирита с раствором, содержащим ионы трехвалентного железа и растворенный кислород, в присутствии окисляющих железо бактерий, которые окисляют ионы двухвалентного железа до ионов трехвалентного железа в аэробных условиях.
5. Способ по п.3 или 4, в котором раствор, содержащий ионы трехвалентного железа и растворенный кислород, находится при рН менее 2,5.
6. Способ по п.5, в котором рН раствора, содержащего ионы трехвалентного железа и растворенный кислород, составляет 0,5-2.
7. Способ по п.3, в котором раствор, содержащий ионы трехвалентного железа и растворенный кислород, находится при температуре 30-80°С, более предпочтительно 50-80°С.
8. Способ по п.3, в котором раствор, содержащий ионы трехвалентного железа и растворенный кислород, также содержит сульфатные ионы при кислотности раствора, обеспечиваемой серной кислотой.
9. Способ по п.3, в котором раствор, содержащий ионы трехвалентного железа и растворенный кислород, содержит также хлоридные ионы при кислотности раствора, обеспечиваемой хлористоводородной кислотой.
10. Способ по п.1, в котором стадия (b) восстановления включает в себя взаимодействие твердого продукта со стадии (а) с раствором, содержащим сульфатные ионы, в присутствии бактерий, которые потребляют сульфатные ионы и генерируют реагенты, которые восстанавливают серу в твердом продукте до сульфидных ионов в анаэробных условиях.
11. Способ по п.10, в котором упомянутый раствор содержит некоторое количество железа, присутствующее в виде ионов двухвалентного железа, и соответствующие бактерии, так что при анаэробных условиях ионы трехвалентного железа, присутствующие в растворе или образованные в процессе данной стадии, восстанавливаются до ионов двухвалентного железа.
12. Способ по п.11, в котором бактерии являются совместимыми с используемыми на стадии окисления (а) для минимизации результатов конкуренции при изменении растворов.
13. Способ по п.12, в котором бактерии относятся к типу, который может изменять поведение от окисления ионов двухвалентного железа в присутствии кислорода до восстановления ионов трехвалентного железа в отсутствие кислорода и могут, таким образом, использоваться для обеих стадий.
14. Способ по п.1, в котором стадия (с) окисления включает в себя взаимодействие твердого продукта со стадии (b) с раствором, содержащим ионы трехвалентного железа и растворенный кислород.
15. Способ по п.14, в котором стадия (с) окисления включает в себя взаимодействие твердого продукта со стадии (b) с раствором, содержащим ионы трехвалентного железа и растворенный кислород, в присутствии окисляющих железо бактерий, которые окисляют ионы двухвалентного железа до ионов трехвалентного железа в аэробных условиях.
16. Способ по п.1, в котором стадия (d) извлечения включает в себя стадию экстракции растворителем, на которой выделяют ионы меди из растворов, содержащих ионы меди, и получают медьсодержащие растворители и обедненные медью рафинаты.
17. Способ по п.16, в котором стадия (d) извлечения дополнительно включает в себя стадию электрохимического выделения, на которой извлекают медь из растворителей.
18. Способ по п.16, в котором стадия (d) извлечения включает в себя обработку обедненных медью рафинатов и риформинг желаемого щелока от выщелачивания либо путем регенерирования любых остаточных ионов двухвалентного железа до ионов трехвалентного железа в рафинатах, либо альтернативно путем восстановления присутствующих ионов трехвалентного железа до ионов двухвалентного железа для рециклирования на восстановительную стадию выщелачивания.
19. Способ по п.1, в котором стадия (d) извлечения включает в себя обработку растворов, содержащих ионы меди, и получение медьсодержащего промежуточного продукта.
20. Способ по п.19, в котором промежуточным продуктом является один или более из оксида одновалентной меди, сульфида меди и оксида меди.
21. Способ кучного выщелачивания для извлечения меди из халькопирита, включающий в себя стадии
(а) взаимодействия халькопирита с раствором, содержащим ионы трехвалентного железа, при аэробных условиях в присутствии окисляющих железо бактерий, окисления серы в халькопирите и окисления ионов двухвалентного железа, полученных при окислении серы, до ионов трехвалентного железа и тем самым высвобождения по меньшей мере части присутствующей в халькопирите меди в раствор в виде ионов меди;
(b) взаимодействия твердого продукта со стадии (а) с раствором, содержащим сульфатные ионы, при анаэробных условиях в присутствии бактерий, которые потребляют сульфатные ионы и генерируют реагенты, которые восстанавливают серу в твердом продукте до минус двух, т.е. сульфида, и тем самым восстанавливают серу в твердом продукте до сульфидных ионов;
(c) повторения стадии (а) для твердого продукта со стадии (b) и окисления серы в твердом продукте и окисления ионов двухвалентного железа, полученных при окислении серы, до ионов трехвалентного железа и тем самым высвобождения по меньшей мере части меди в твердом продукте в раствор в виде ионов меди и
(d) извлечения меди из одного или более растворов со стадий (а) и (с).
22. Способ по п.21, который включает в себя повторение последовательности стадий (а), (b) и (с) и извлечение меди из одного или более растворов со стадий (а) и (с) согласно требованиям по извлечению существенной части присутствующей в халькопирите меди.
23. Способ по п.21 или 22, в котором стадия (b) включает в себя взаимодействие твердого продукта со стадии (а) с раствором, содержащим сульфатные ионы, путем введения подходящего раствора, полученного ех situ из кучи, и замещения окисляющего раствора со стадии (а), либо путем изменения условий в куче, так что присутствующий раствор превращается в требуемый восстанавливающий раствор, за счет ограничения количества присутствующего кислорода и обеспечения подходящего бактериального воздействия, с превращением ионов трехвалентного железа в ионы двухвалентного железа и потреблением части или всех сульфатных ионов, либо обоими путями замещения и превращения.